Высокомолекулярные соединения (серия А), 2020, T. 62, № 6, стр. 413-419
ПОЛИЭЛЕКТРОЛИТНЫЕ КОМПЛЕКСЫ ХИТОЗАНА С НАТРИЕВОЙ СОЛЬЮ КАРБОКСИМЕТИЛЦЕЛЛЮЛОЗЫ В ВОДНО-СПИРТОВЫХ СРЕДАХ И МИКРОКАПСУЛЫ НА ИХ ОСНОВЕ
С. В. Шилова a, *, Г. М. Миргалеев a, А. Я. Третьякова a, В. П. Барабанов a
a Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
* E-mail: s_shilova74@mail.ru
Поступила в редакцию 03.12.2019
После доработки 20.01.2020
Принята к публикации 28.02.2020
Аннотация
Изучено формирование полиэлектролитных комплексов природных полисахаридов хитозана и натриевой соли карбоксиметилцеллюлозы в водно-этанольных средах. Установлено, что с ростом содержания спирта в растворителе до 50 об. % наблюдается постепенное ослабление интенсивности электростатических взаимодействий противоположно заряженных групп полиэлектролитов и, как следствие, снижение комплексообразующей способности полимеров. Методом послойной адсорбции полиэлектролитов на микрочастицы карбоната кальция получены микрокапсулы с разным количеством слоев. Предложен способ контроля проницаемости стенок полиэлектролитных микрокапсул, основанный на изменении полярности растворителя путем введения в водный раствор 50 об. % этанола. С использованием данного подхода получены микрокапсулы с высокой эффективностью включения модельного лекарственного вещества – ацетилсалициловой кислоты.
ВВЕДЕНИЕ
Актуальным направлением современной биомедицины является разработка новых лекарственных форм, способных усиливать эффективность действия и биодоступность имеющихся лекарственных веществ [1–4]. Значительное внимание здесь проявляется к полиэлектролитным комплексам (ПЭК), которые могут выполнять функции полимерных носителей, обеспечивая адресную доставку, защиту и контролируемое высвобождение лекарственных и биологически активных соединений [5–7].
Важнейшие требования, предъявляемые к полимерным носителям лекарственных средств, – биосовместимость, биодеградируемость и низкая токсичность. Этим требованиям отвечают природные полисахариды, в частности хитозан. Полиэлектролитная природа хитозана, обусловленная наличием протонированных аминогрупп, обеспечивает его способность к комплексообразованию с противоположно заряженными синтетическими и природными полиэлектролитами [8–12]. Положительным моментом в использовании хитозана в качестве полимера медико-биологического назначения является также и то, что данный полисахарид обладает собственной биологической активностью, проявляя антимикробное действие, способность активировать макрофаги, усиливать пролиферацию фибробластов и т.д. [13–15].
ПЭК имеют высокую стабильность, которая достигается за счет кооперативного характера межмолекулярных связей, возникающих между комплементарными макромолекулами (электростатические, ван-дер-ваальсовые и гидрофобные взаимодействия) [8, 16, 17]. В то же время эти полимерные системы восприимчивы к незначительным изменениям внешних факторов. Формирование ПЭК и фазовое состояние комплексов можно регулировать, варьируя природу полиэлектролитов, ионную силу раствора, pH, температуру, состав растворителя и т.д.
В литературе имеются сведения о влиянии природы и состава растворителя на направление конкурентных реакций в системе полианион–поликатион–анионное ПАВ [18, 19], образование ПЭК с участием сополимеров простых виниловых эфиров [20] и формирование комплексов полиэлектролитов различной природы с противоположно заряженными ПАВ [21–26].
Одним из способов получения полимерных микрочастиц с инкапсулированными лекарственными веществами является послойная адсорбция положительно и отрицательно заряженных полимерных цепей на частицах капсулируемого вещества, либо частицах вспомогательного темплата (метод “слой-за-слоем” – “layer-by-layer”) [27–29]. Наряду с совершенствованием методики синтеза “layer-by-layer” в настоящее время активно изучаются также способы получения полиэлектролитных капсул с контролируемой проницаемостью стенок и высвобождения инкапсулируемых веществ. Одним из подходов к управлению проницаемости стенок капсул может быть использование растворителей различной полярности, которые оказывают влияние на структуру ПЭК [30].
Однако получению ПЭК на основе природных ионогенных полисахаридов в водно-органических средах уделяется недостаточное внимание. Цель данного исследования – изучение влияния состава водно-этанольных растворителей на формирование ПЭК хитозана и натриевой соли карбоксиметилцеллюлозы (Na-КМЦ), а также анализ возможности регулирования проницаемости стенок полиэлектролитных капсул путем изменения состава водно-спиртового растворителя.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе применяли хитозан с М = 3.8 × 104 и степенью деацетилирования 80% (Закрытое акционерное общество “Биопрогресс”, Щелково), а также высокомолекулярную Na-КМЦ с М = = 1.2 × 106 и степенью замещения 0.8%, (“Panreac”, E.U., Barcelona). Модельным лекарственным средством служила ацетилсалициловая кислота (АСК) (>95%, “Sigma-Aldrich”).
При приготовлении растворов использовали смеси бидистиллированной воды с этанолом (сп. ч., “Компонент-Реактив”, Москва) с варьируемым соотношением компонентов. Чистоту воды контролировали по удельной электропроводности, которая составляла 1.0–3.0 мкСм/см.
Синтез ПЭК проводили путем смешивания эквимолярных растворов хитозана с концентрацией 0.01 осново-моль/л в 0.1 М растворе HCl с водным раствором Na-КМЦ с концентрацией 0.01 осново-моль/л. Объемное соотношение хитозан : Na-КМЦ = 9 : 1, 8 : 2, 7 : 3, 6 : 4, 5 : 5, 4 : 6, 3 : 7, 2 : 8, 1 : 9, 0.8 : 9.2, 0.4 : 9.6 и 0.2 : 9.8. Полученные смеси интенсивно перемешивали на магнитной мешалке 1 ч и выдерживали в течение 1 суток при комнатной температуре. Состав смесей полиэлектролитов выражали в виде отношения мольных концентраций Na-КМЦ и хитозана.
Закономерности образования ПЭК устанавливали кондуктометрическим методом с помощью комбинированного иономера-кондуктометра “АНИОН-410А” (Россия) с диапазоном измерений 10–9–10–4 См/см.
ИК-спектры снимали на фурье-спектрометре ALPHA-Т S/N 102706 (“Bruker”) со спектральным диапазоном 400–4000 см–1, разрешением 4 см–1. Образцы представляли собой таблетки с KBr.
Размер и ζ-потенциал частиц ПЭК и полиэлектролитных капсул определяли методом динамического светорассеяния на анализаторе размера частиц и дзета-потенциала серии “Zetasizer Nano ZS” (“Malvern Instruments Ltd”, Великобритания) с применением технологии M3-PALS. Анализатор оснащен He-Ne-лазером с мощностью 4 мВт и длиной волны 633 нм. Угол светорассеяния составлял 173°. Графическую интерпретацию результатов измерения получали с помощью программного обеспечения “DTS Application Software” компании Malvern Instruments. Перед выполнением измерений образцы фильтровали через фильтры “Millipore” с мембраной Durapore PVDF и диаметром пор 0.45 мкм.
Спектры флуоресценции зонда в растворах ПЭК регистрировали на люминесцентном спектрофлуориметре “Cary Eclips” (“Varian”) для щелей возбуждения и эмиссии 5 нм. Возбуждение производили при длине волны 335 нм. Флуоресцентным зондом служил пирен (p.a. for fluorescence, “Aldrich”). Использовали растворы зонда с концентрацией 1 × 10–6 моль/л в этаноле. По спектрам поглощения находили интенсивность флуоресценции при 373 (I1) и 384 нм (I3).
Полиэлектролитные капсулы получали методом послойной адсорбции хитозана и Na-КМЦ на микрочастицы карбоната кальция. Микрочастицы СаСО3 приготавливали путем смешивания растворов 0.33 М Na2CO3 и 0.33 М СаСl2. Смесь перемешивали на магнитной мешалке в течение 60 с, затем образовавшуюся суспензию выдерживали 5 мин до полной кристаллизации СаСО3. Полученный осадок отделяли центрифугированием (3000 об/мин) в течение 5 мин, промывали деионизированной водой, затем повторяли процедуру центрифугирования при тех же условиях. Высушенные микрочастицы СаСО3 хранили в закрытой пробирке при комнатной температуре.
Микрочастицы СаСО3 (20 мг) суспендировали в 1 мл водного раствора хитозана (2 мг/мл), содержащем 0.5 М NaCl. Микрочастицы инкубировали при интенсивном перемешивании на магнитной мешалке в течение 15 мин. Несвязавшийся полимер удаляли центрифугированием в течение 5 мин при 3000 об/мин. Осадок промывали 1 мл раствора NaCl с концентрацией 0.5 моль/л и повторно центрифугировали. Далее проводили адсорбцию противоположно заряженного полиэлектролита Na-КМЦ из раствора с концентрацией 1 мг/мл. Для предотвращения агрегации микрочастиц в процессе адсорбции полиэлектролитов суспензию подвергали ультразвуковой обработке в ультразвуковой ванне “Ya Xun YX-9050” с мощностью 50 В (Китай) в течение 3–5 с.
После необходимого числа стадий адсорбции хитозана и Na-КМЦ карбонат кальция удаляли из “ядра” микрочастиц обработкой раствором Трилона Б (0.2 М). Процедуру выполняли до полного растворения карбонатной матрицы. Далее капсулы отделяли центрифугированием в течение 5 мин при 3000 об/мин.
Процесс инкапсулирования АСК контролировали спектрофотометрическим методом в УФ-диапазоне на сканирующем двухлучевом спектрофотометре “Lambda 35” (“Perkin Elmer”). Измерения проводили в кварцевых кюветах объемом 3 см3. Графическую интерпретацию получали при помощи программного обеспечения UV WinLab. Оптическую плотность растворов определяли в максимуме поглощения АСК (228 ± 2 нм). Концентрацию АСК рассчитывали по предварительно построенному калибровочному графику. Эффективность инкапсулирования кислоты оценивали по разности исходного количества АСК, взятого для включения в капсулы, и равновесного количества АСК в растворе. Все измерения выполняли при температуре 25° С.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Образование ПЭК хитозан–Na-КМЦ в водных растворах происходит за счет электростатического взаимодействия протонированных аминогрупп хитозана и метилкарбоксильных групп Na-КМЦ. Оно может быть описано следующей реакцией обмена:
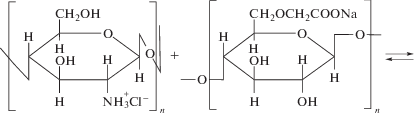
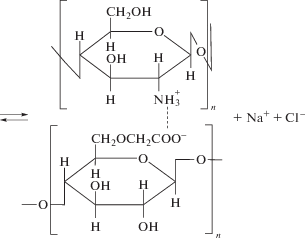
С целью изучения особенностей межмолекулярного взаимодействия хитозана с Na-КМЦ в водно-спиртовых средах, а также фазового состояния систем были приготовлены смеси полиэлектролитов различного состава. Смешение эквимольных растворов хитозана с Na-КМЦ приводило к фазовому разделению – появлению опалесценции или осадка вследствие образования нерастворимых ПЭК. Осадки ПЭК представляли собой гелеобразную массу белого цвета, без запаха. ПЭК в виде геля формировался в смесях, характеризующихся избытком натриевой соли карбоксиметилцеллюлозы, при [Na-КМЦ] : [хитозан] = 7 и выше. Максимальную массу осадок имел при [Na-КМЦ] : [хитозан] = 7.
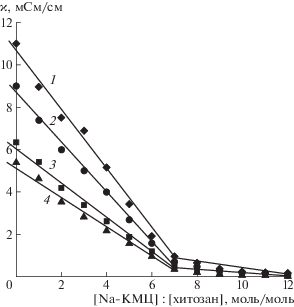
На рис. 1 приведены зависимости удельной электропроводности от состава смеси Na-КМЦ и хитозана. На зависимости удельной электропроводимости в водном растворе (кривая 1) наблюдается ярко выраженный перегиб при составе смеси [Na-КМЦ] : [хитозан] = 7, что свидетельствует об образовании индивидуального соединения – ПЭК. Данный состав смеси указывает на формирование в системе нестехиометрического комплекса, содержащего одновременно как связанные, так и не связанные между собой функциональные группы полиэлектролитов.
Рис. 1.
Зависимость удельной электропроводности смешанных растворов хитозана и Na-КМЦ от соотношения [Na-КМЦ] : [хитозан] при содержании этанола в растворителе 0 (1), 10 (2), 25 (3) и 50 об. % (4).
При переходе от водных сред к водно-спиртовым уменьшается полярность среды, что вызывает снижение степени диссоциации полиэлектролитов. Введение в воду короткоцепочечных алифатических спиртов также ослабляет гидрофобные взаимодействия и повышает растворимость неполярных фрагментов полимерной цепи [31, 32]. Совокупность данных факторов должна приводить к уменьшению интенсивности взаимодействия противоположно заряженных полиэлектролитов при увеличении концентрации спирта в системе.
Для изучения характера влияния состава растворителя на формирование ПЭК хитозан–Na-КМЦ были получены смеси полиэлектролитов в водно-спиртовых средах. Был выбран следующий состав смешанных растворителей: 10 об. % этанола + 90 об. % воды; 25 об. % этанола + 75 об. % воды; 50 об. % этанола + 50 об. % воды. Визуальным проявлением влияния добавок этанола являлось снижение мутности и вязкости смесей, а также сдвиг начала образования ПЭК в виде геля в сторону меньших концентраций Na-КМЦ.
На зависимостях удельной электропроводности от состава смеси Na-КМЦ и хитозана в водно-этанольных растворах (рис. 1, кривые 2–4) также наблюдается излом, соответствующий образованию ПЭК. При переходе от водного раствора к смешанным средам для смесей с соотношением [Na-КМЦ] : [хитозан] от 1 до 6 происходит значительное уменьшение начального угла наклона на кривой электропроводности, что подтверждает снижение степени диссоциации противоположно заряженных полиэлектролитов и, следовательно, интенсивности их электростатического взаимодействия с увеличением содержания этанола в растворителе от 10 до 50 об. %.
Методом динамического светорассеяния был установлен характер изменения электрокинетического потенциала ПЭК в водно-этанольных средах разного состава (рис. 2). Как видно из рисунка, ζ-потенциал макромолекул хитозана имеет положительное значение, что обусловлено зарядом протонированных аминогрупп. С увеличением содержания этанола ζ-потенциал макроиона хитозана уменьшается от +26 до +12 мВ. Введение Na-КМЦ в водный раствор хитозана (кривая 1) способствует снижению электрокинетического потенциала. При [Na-КМЦ] : [хитозан] = 7 наблюдается полная нейтрализация положительно заряженных аминогрупп хитозана отрицательно заряженными метилкарбоксильными группами Na-КМЦ. Дальнейший рост концентрации Na-КМЦ в смеси с хитозаном приводит к перезарядке комплекса.
Рис. 2.
Зависимость ζ-потенциала ПЭК от соотношения [Na-КМЦ] : [хитозан] при содержании этанола в растворителе 0 (1), 10 (2), 25 (3) и 50 об. % (4).
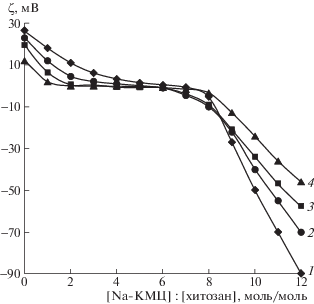
При образовании ПЭК в водно-этанольных средах (кривые 2–4) характер изменения электрокинетического потенциала комплекса сохраняется. Вместе с тем с увеличением концентрации спирта инверсия знака ζ-потенциала ПЭК хитозан–Na-КМЦ наблюдается при меньшем содержании Na-КМЦ по сравнению с водным раствором ([Na-КМЦ] : [хитозан] = 6, 4 и 3 при содержании этанола 10, 25 и 50 об. % соответственно).
Формирование ПЭК подтверждали методом ИК-фурье-спектроскопии. С этой целью были получены ИК-спектры хитозана, Na-КМЦ и комплекса на их основе с [Na-КМЦ] : [хитозан] = 7, образованного в водном растворе. На спектрах исходных полиэлектролитов присутствуют характерные для полисахаридов полосы поглощения: νO–H (3700–3000 см–1), νC–H (3000–2800 см–1), νC–С, νC–О пиранозных колец (1200–1000 см–1). Для хитозана отмечается наличие полос поглощения в интервале, характерном для амидных групп ${{\delta }_{{{\text{N}}{{{\text{H}}}_{2}}}}}$ (1650–1300 см–1). Присутствие полос поглощения 1521 и 1318 см–1 подтверждает высокую степень деацетилирования исходного образца хитозана и его катионную форму, обусловленную присутствием групп ${\text{NH}}_{3}^{ + }$. Для Na-КМЦ наблюдаются интенсивные полосы поглощения в областях 1650–1550 и 1400–1300 см–1, соответствующие асимметричным и симметричным валентным колебаниям карбоксилат-аниона. В спектре комплекса основные изменения происходят в области полос поглощения аминогрупп хитозана и карбоксилат-анионов Na-КМЦ, что подтверждает их электростатическое взаимодействие.
Высокая стабильность ПЭК может достигаться за счет гидрофобных взаимодействий неполярных фрагментов макромолекул, что должно приводить к возникновению в растворе локальных гидрофобных областей. Данный вопрос изучали методом зондовой флуоресцентной спектроскопии с использованием в качестве зонда пирена С16H10, структурные и динамические свойства которого чувствительны к локальному микроокружению [33]. Так, отношение интенсивностей первого и третьего пиков I1/I3 в спектре флуоресценции пирена чрезвычайно чувствительно к диэлектрической проницаемости среды в микроокружении его молекул. В полярной среде (в воде) отношение I1/I3 (“параметр полярности”) равно 1.4–1.6, в неполярной среде (например, в гексане) – 0.6 [34]. Анализ спектров флуоресценции пирена показал, что в растворах индивидуальных полиэлектролитов хитозана и Na-КМЦ отношение I1/I3 ≈ 1, что существенно меньше, чем значение I1/I3 в случае водного окружения молекул пирена. Такая величина параметра полярности характерна для мицеллярных систем на основе ПАВ [35] и указывает на формирование локальных гидрофобных областей, в которых пирен, являясь гидрофобным веществом, солюбилизируется. Однако в процессе образования ПЭК во всех изученных водно-этанольных растворителях значение параметра полярности не изменяется и остается близким к единице. Это может свидетельствовать о том, что в процессе комплексообразования хитозана с Na-КМЦ доминируют электростатические взаимодействия, а дополнительные межмолекулярные гидрофобные взаимодействия не играют большой роли.
Таким образом, с увеличением концентрации этанола в растворителе до 50 об. % постепенно ослабляются электростатические взаимодействия противоположно заряженных функциональных групп хитозана и Na-КМЦ в процессе образования ПЭК, что обусловлено уменьшением полярности среды.
Использование биосовместимых биодеградируемых полиэлектролитов в технологии послойной адсорбции открывает новые возможности для создания систем пролонгированного действия с контролируемым высвобождением лекарственных и биологически активных соединений.
Полиэлектролитные капсулы получали методом послойной адсорбции хитозана и Na-КМЦ на микрочастицы СаСО3. После необходимого числа стадий адсорбции полиэлектролитов карбонатное “ядро” частиц удаляли. В результате были получены одно-, двух-, трех-, четырех- и пятислойные капсулы. В качестве модельного лекарственного средства использовали ацетилсалициловую кислоту. Заключением кислоты в капсулы можно добиться снижения раздражающего действия на слизистую оболочку желудочно-кишечного тракта и обеспечить пролонгированное действие лекарства при сохранении терапевтического эффекта.
Образование многослойной оболочки на поверхности микрочастиц СаСО3 контролировали путем измерения ζ-потенциала частиц после каждого этапа адсорбции полиэлектролитов (табл. 1). Смена знака заряда ζ-потенциала после очередной стадии адсорбции противоположно заряженных полиэлектролитов свидетельствовала об их сверхэквивалентном связывании. Увеличение размера капсул с ростом количества нанесенных слоев полиэлектролитов (табл. 1) также подтверждает факт последовательной адсорбции полимеров.
Формирование многослойной оболочки капсул происходит в результате электростатического взаимодействия противоположно заряженных групп полиэлектролитов. Следовательно, процесс образования и проницаемость стенок капсул можно регулировать, варьируя природу и полярность растворителя.
Нами разработан следующий способ регулирования состояния полиэлектролитной оболочки капсул, который позволяет контролировать степень инкапсулирования АСК. В водно-этанольный раствор (50 об. % этанола + 50 об. % воды) АСК помещали полые микрокапсулы (эксперименты проводили для пятислойных капсул). АСК проникала внутрь полиэлектролитных капсул, поскольку при снижении диэлектрической проницаемости среды ε до 36 [31] происходит значительное ослабление электростатического взаимодействия между хитозаном Na-КМЦ и в полиэлектролитных стенках капсул появляются дефекты. Далее добавляли избыток воды, и взаимодействие противоположно заряженных полиэлектролитов в стенках капсул усиливалось. Полиэлектролитная оболочка восстанавливалась, кислота оставалась во внутренней полости капсул. Идея об “открывающихся” и “закрывающихся” стенках многослойных полиэлектролитных капсул основана на том, что изменение рН или полярности растворителя может приводить к появлению в стенках капсул пор диаметром около 100 нм вследствие нарушения строения ПЭК в слоях стенок [36]. Схожая методика была применена для эффективного инкапсулирования уреазы в полиэлектролитные микрокапсулы, полученные методом послойной адсорбции полиаллиламина и полистиролсульфоната [30].
Процесс инкапсулирования АСК контролировали методом УФ-спектроскопии. Капсулирование характеризуется очень высокой эффективностью. Эффективность включения зависит от продолжительности процедуры инкапсулирования (табл. 2). Самая высокая степень включения отмечается при времени инкапсулирования 30–60 мин. Причиной столь высокой эффективности включения АСК в микрокапсулы может быть взаимодействие карбоксильных групп АСК с аминогруппами хитозана в многослойной оболочке. Формирование комплексов стехиометрического состава обнаружено также при взаимодействии хитозана с антибиотиком цефотаксимом [37].
ЗАКЛЮЧЕНИЕ
Проведенное исследование показало, что процесс комплексообразования хитозана с Na-КМЦ в водно-этанольных средах характеризуется постепенным ослаблением взаимодействия противоположно заряженных полиэлектролитов при увеличении содержания спирта до 50 об. % вследствие уменьшения полярности среды. Предложен способ контроля проницаемости стенок полиэлектролитных микрокапсул, основанный на изменении полярности растворителя путем введения этанола. Использование данного метода позволило получить микрокапсулы с высокой эффективностью включения модельного лекарственного вещества – ацетилсалициловой кислоты. Таким образом, изменение полярности растворителя можно рассматривать как средство управления процессом комплексообразования биосовместимых биодеградируемых полиэлектролитов хитозана и Na-КМЦ и контроля проницаемости многослойных стенок микрокапсул на их основе.
С.В. Шилова благодарит за финансовую поддержку Российский фонд фундаментальных исследований (код проекта 18-03-00099).
Список литературы
Sinha V.R., Singla A.K., Wadhawan S., Kaushik R., Kumria R., Bansal K., Dhawan S. // Int. J. Pharmaceut. 2014. V. 274. № 1. P. 1.
Demetzos C., Pippa N. // Drug Deliv. 2014. V. 21. № 4. P. 250.
Severin E.S. // Russ. Chem. Rev. 2015. V. 84. № 1. P. 43.
Kumar M.N.V.R., Muzzarelli R.A.A., Muzzarelli C., Sashiwa H., Domb A.J. // Chem. Rev. 2004. V. 104. № 1. P. 6017.
Grigor’ev D., Musabekov K.B., Musabekov N.K., Kusainova Z.Z. // Polymer Science A. 2017. V. 59. № 4. P. 506.
Zakharova L.Ya., Vasilieva E.A., Gaynanova G.A., Mirgorodskaya A.B., Ibragimova A.R., Salnikov V.V., Uchegbu I.F., Konovalov A.I., Zuev Yu.F. // Colloids Surf. A. 2015. V. 471. P. 93.
Shurshina A.S., Galina A.R., Kulish E.I. // Polymer Science A. 2018. V. 60. № 3. P. 303.
Krajukhina M.A., Samoilova N.A., Yamskov I.A. // Russ. Chem. Rev. 2008. V. 77. № 9. P. 799.
Kawazoe1 N., Narita Y., Chen G., Satomi T., Tateishi T. // Biotechnol. J. 2008. № 2. P. 148.
Maciel V.B.V., Yoshida C.M.P., Franco T.T. // Carbohydr. Polym. 2015. V. 132. P. 537.
Aranaz I., Harris R., Navarro-Garcia F., Heras A., Acosta N. // Carbohydr. Polym. 2016. V. 146. P. 402.
Izumrudov V.A., Volkova I.F., Grigoryan E.S., Gorshkova M.Y. // Polymer Science A. 2011. V. 53. № 4. P. 281.
Azimov Z.T., Oksengendler B.L., Turaeva N.N., Rashidova S.S. // Polymer Science A. 2013. V. 55. № 2. P. 98.
Lunkov A.P., Ilyina A.V., Varlamov V.P. // Appl. Biochem. Microbiol. 2018. V. 54. № 5. P. 449.
Sazhnev N.A., Kil’deeva N.R., Drozdova M.G., Balabanova T.V., Markvicheva E.A., Rodionov I.A., Lozinsky V.I. // Appl. Biochem. Microbiol. 2018. V. 54. № 5. P. 459.
Izumrudov V.A., Zezin A.V., Kabanov V.A. // Russ. Chem. Rev. 1991. V. 60. № 7. P. 792.
Kabanov V.A. // Russ. Chem. Rev. 2005. V. 74. № 1. P. 3.
Изумрудов В.А., Коробко Т.А. // Вестн. МГУ. Сер. 2. Химия. 1997. Т. 38. № 3. С. 188.
Кабанов В.А., Зезин А.Б., Рогачева В.Б., Новоскольцева О.А., Крупенина Т.В. // Докл. АН СССР. 1998. Т. 358. № 6. С. 786.
Кудайбергенов С.Е., Нуркеева З.С., Мун Г.А., Хуторянский В.В. // Высокомолек. соед. А. 1998. Т. 40. № 10. С. 1541.
Machaeva E.E., Starodubzev S.G. // Polym. Bull. 1993. V. 30. P. 327.
Хандурина Ю.В., Рогачева В.Б., Зезин А.Б., Кабанов В.А. // Высокомолек. соед. A. 1994. Т. 36. № 2. С. 241.
Fukui H., Satake I., Hayakawa K. // Langmuir. 2002. V. 18. № 11. P. 4465.
Vasserman A.M., Aliev I.I., Motyakin M.V., Zakharova Yu.A., Otdel’nova M.V. // Colloid J. 2006. V. 68. № 6. P. 679.
Shilova S.V., Tret’yakova A.Ya., Barabanov V.P. // Polymer Science A. 2010. V. 52. № 12. P. 1283.
Shilova S.V., Tret’yakova A.Ya., Barabanov V.P. // Polymer Science A. 2019. V. 61. № 1. P. 39.
Wang Q., Hauser P.J. // Carbohydr. Polym. 2010. V. 81. № 2. P. 491.
Del Mercato L.L., Rivera-Gil P., Abbasi A.Z., Ochs M., Ganas C., Zins I., Soennichsen C., Parak W.J. // Nanoscale. 2010. V. 2. P. 458.
Volodkin D. // Adv. Colloid Interface Sci. 2014. V. 207. P. 306.
Lvov Y., Antipov A.A., Mamedov A., Möhwald H., Sukhorukov G.B. // Nanoletters. 2001. V. 1. № 3. P. 125.
Райхардт К. Растворители и эффекты среды в органической химии. М. : Мир, 1991.
Крестов Г.А. Термодинамика ионных процессов в растворах Л.: Химия, 1984.
Lakowicz J. Principles of Fluorescence Spectroscopy. New York: Plenum Press, 1983.
Ortona O., D'Errico G., Mangiapia G., Ciccarelli D. // Carbohydr. Polym. 2008. V. 74. № 1. P. 16.
Aguiar J., Carpena P., Molina-Bolívar J.A., Carnero R.C. // J. Colloid Interface Sci. 2003. V. 258. P. 116.
Mendelson J., Barrett C., Chan V., Pal A., Mayes A., Rubner M. // Langmuir. 2000. V. 16. P. 5017.
Mudarisova R.Kh., Kulish E.I., Zinatullin R.M., Tamindarova N.E., Kolesov S.V., Khunafin S.N., Monakova Yu.B. // Russ. J. Appl. Chem. 2006. V. 79. № 7. P. 1210.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


