Высокомолекулярные соединения (серия А), 2021, T. 63, № 1, стр. 10-16
К ВОПРОСУ О МЕТОДИКЕ ОПРЕДЕЛЕНИЯ КРИТИЧЕСКОГО ЗНАЧЕНИЯ рН ПРИ ФОРМИРОВАНИИ КОМПЛЕКСОВ МЕЖДУ НЕИОННЫМИ ПОЛИМЕРАМИ И ПОЛИКИСЛОТОЙ В ВОДНЫХ РАСТВОРАХ
Б. Б. Ермухамбетова a, И. Э. Сулейменов b, А. Ж. Аликулов a, И. Молдахан b, С. Т. Байпакбаева b, Г. А. Мун a, *
a Казахский национальный университет им. аль-Фараби
050040 Алматы, пр. аль-Фараби, 71, Казахстан
b Алматинский университет энергетики и связи им. Г. Даукеева
050013 Алматы, ул. Байтурсынова, 126/1, Казахстан
* E-mail: mungrig@yandex.ru
Поступила в редакцию 14.04.2020
После доработки 02.06.2020
Принята к публикации 17.06.2020
Аннотация
Предложена новая методика количественного определения критических значений рН при формировании комплексов между неионными полимерами и поликислотой в водных растворах. За показатель, отражающий значение рН, где имеет место переход от раствора, содержащего невзаимодействующие макромолекулы, к раствору, в котором протекает формирование интерполимерного комплекса, следует принять значение рН с выходом реакции образования комплекса 1/2 от максимального. Целесообразность использования именно такого показателя связана с тем, что имеется достаточно протяженная граничная область по рН с сосуществованием в ней невзаимодействующих макромолекул и продукта реакции между ними. Показано, что определяемый таким образом показатель удобно рассчитывать при помощи метода фазовых портретов. Осуществлено тестирование данной методики на примере анализа семейств экспериментально полученных кривых, описывающих влияние добавок хлорида калия на процесс комплексообразования между сополимером 2-гидроксиэтилакрилата и бутилакрилата и полиакриловой кислотой в водном растворе. Установлено, что для данной системы характер зависимости влияния ионной силы на формирование поликомплекса существенно зависит от состава сополимера, при этом увеличение содержания гидрофобных звеньев бутилакрилата в составе сополимера всего на 4.9 мол. % сопровождается переходом данной системы от слабо комплексующей к сильно комплексующей.
ВВЕДЕНИЕ
Интерполимерные реакции поликарбоновых кислот с неионогенными полимерами в водных растворах на протяжении нескольких десятилетий выступают предметом интенсивных исследований, результаты которых отражены в целом ряде статей обзорного характера [1–7]. В значительной степени это обусловлено тем, что продукты таких взаимодействий – интерполимерные комплексы, образованные системой кооперативных водородных связей, по существу, представляют собой новый класс высокомолекулярных соединений, обладающих ценными в научном и практическом отношении свойствами, заметно отличающимися от свойств исходных полимерных компонентов. Интерес к изучению интерполимерных комплексов наряду с широким спектром возможного эффективного применения продиктован, в том числе, возможностями их использования в системах с контролируемым выделением лекарственных веществ, а также при моделировании поведения биологических макромолекул [5, 8, 9].
Механизм формирования интерполимерных комплексов является достаточно сложным и зависит от множества внешних и внутренних факторов, определяющих стабильность и структуру поликомплексов. Так, кислотность среды оказывает весьма существенное влияние на характер формирования комплекса между неионными полимерами и слабыми поликислотами. При этом, как показано рядом авторов [5, 6, 10, 11], появление интерполимерных комплексов в водных растворах возможно лишь ниже определенной критической величины рНкрит, вследствие того, что в структуре поликарбоновых кислот к участию в образовании водородных связей способны только неионизированные карбоксильные группы, количество которых в макромолекуле поликарбоновой кислоты устанавливается кислотностью среды.
Кроме того, как было показано в работах [4, 6], механизм, раскрывающий влияние различных факторов на формирование интерполимерных комплексов, во многом связан с заметными различиями в степенях набухания заряженных и незаряженных макромолекулярных клубков. Если степень ионизации одной из рассматриваемых компонент считается достаточно высокой, то характерные размеры клубка, сформированного этой компонентой, существенно превышают размеры клубка неионного полимера. В этих условиях комплекс, стабилизируемый водородными связями, образоваться не сможет, потому что для его формирования требуется совершение работы против сил полиэлектролитного растяжения [6], в то время как энергия формирования водородных связей является относительно низкой.
Впервые существование критической величины рН комплексообразования в системе неионный полимер–поликислота было продемонстрировано Е. Tsuchida с соавторами в работе [10], в которой величина рНкрит определена гравиметрическим методом. Позже оценка значений рНкрит была проведена В. Барановским с соавторами в работе [11] методом вискозиметрии. Авторы настоящей работы в своих исследованиях [12] для оценки рНкрит использовали метод турбидиметрии, поскольку кривые зависимости мутности (оптической плотности) водных растворов смесей поликарбоновая кислота–неионогенный полимер от рН характеризуются резким повышением мутности системы, которое можно объяснить фазовым разделением при достижении кислотности, соответствующей рНкрит. Это обусловливает возможность достаточно простого метода определения величины рНкрит. Как было продемонстрировано в работах [5, 12], эта величина несет в себе важную информацию о специфике образования комплексов в водных растворах между неионными протоноакцепторными полимерами и слабыми поликислотами, стабилизированными водородными связями. В частности, в ряде работ [5, 12, 13] показано, что бόльшему значению рНкрит соответствует более высокая комплексообразующая способность системы.
Однако несмотря на многочисленные исследования в этой области [5, 12, 13], до настоящего времени отсутствует достаточно адекватная методика определения рНкрит на основании экспериментальных данных. Главным образом, это связано с тем, что переход от области pH, в которой интерполимерный комплекс не формируется, к области кислотности, где имеет место его образование, носит диффузный характер. Следовательно, методики, построенные на основе эвристических подходов (например, определение рНкрит по точке пересечения оси абсцисс и касательной к кривой зависимости оптической плотности раствора от pH) могут приводить к заметным ошибкам, в том числе и систематическим [5, 12, 13].
Приемлемой альтернативой является подход, основанный на использовании теоретических кривых, описывающих рассматриваемый фазовый переход, обусловленный формированием интерполимерных комплексов, обладающих значительно более высокой гидрофобностью по сравнению с исходными взаимодействующими полимерами. В настоящей работе показано, что использование метода фазовых портретов, предложенного ранее [14], позволяет развить методику определения pHкрит, обеспечивающую точность до 0.02 по шкале pH. Осуществлено тестирование данной методики на примере анализа семейств экспериментально полученных кривых, описывающих влияние добавок хлорида калия на процесс комплексообразования термочувствительного сополимера 2-гидроксиэтил-акрилата и бутилакрилата с полиакриловой кислотой в водном растворе. Такая система уже исследована ранее в работе [15], в частности, было показано, что взаимодействие сополимера 2-гидроксиэтил-акрилат–бутилакрилат с полиакриловой кислотой сопровождается существенным изменением его термочувствительного поведения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали 2-гидроксиэтилакрилат (ГЭА) производства фирмы “Aldrich Chemical Co.” (США) с содержанием основного продукта 98%, который отмывали от ингибитора 10%-ным водным раствором КОН, после чего сушили над поташом и очищали двукратной вакуумной перегонкой в токе аргона (Ткип = 61 град/3 мм рт.ст., $n_{{\text{D}}}^{{{\text{20}}}}$ = 1.4500).
Бутилакрилат фирмы “Fluka Chemika” (Швеция) с содержанием основного продукта 99% также отмывали от ингибитора 10%-ным водным раствором КОН, сушили над поташом и очищали двукратной вакуумной перегонкой (Ткип = 59 град/15 мм рт.ст., $n_{{\text{D}}}^{{{\text{20}}}}$ = 1.4180).
Полиакриловую кислоту с молекулярной массой М = 7.5 × 105 фирмы “Aldrich Chemical Co.” (США) применяли без дополнительной очистки.
Сополимеры ГЭА–бутилакрилат синтезировали методом радикальной сополимеризации. Состав полученных сополимеров устанавливали методом спектроскопии ЯМР 1Н с использованием спектрометра “Bruker Avance 250 DPX” (Германия). Методика синтеза и определения состава сополимеров описана в работе [15].
Методы
Турбидиметрические измерения растворов полимеров и их поликомплексов проводили с использованием УФ-спектрофотометра “UV-2401 PC Shimadzu” (Япония) при длине волны λ = 400 нм.
рН водных растворов полимеров и их смесей определяли при постоянной температуре 20 ± 0.1°С на цифровом иономере “Ion Meter 3345” (“Jenway Ltd.”, Великобритания) с точностью ±0.01 единиц рН, регулировали его добавлением малого количества 0.1 н растворов HCl или NaOH.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
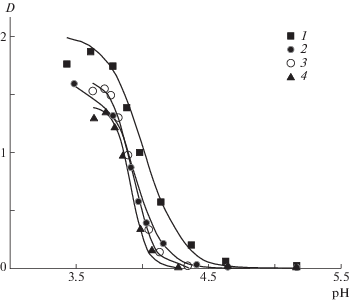
На рис. 1 и 2 представлены данные по турбидиметрическому исследованию влияния добавок низкомолекулярной соли на комплексообразование в водных растворах эквимольных смесей сополимеров ГЭА–бутилакрилат и ПАК. Видно, что при достижении определенного диапазона кислотности среды, соответствующего значению рНкрит, наблюдается резкое повышение мутности системы, что свидетельствует о кооперативном процессе формирования гидрофобного ИПК, сопровождающимся фазовым разделением.
Рис. 1.
Зависимость оптической плотности водного раствора эквимольной смеси сополимера [ГЭА] : [бутилакрилат] = = 95.2 : 4.8 мол. % и [ГЭА–бутилакрилат] = [ПАК] = 0.01 осново-моль/л от рН среды при концентрации хлорида калия 0 (1), 0.001 (2), 0.005 (3), 0.010 (4) и 0.030 моль/л (5); МПАК = 7.5 × 105; сплошные линии – теоретический расчет.
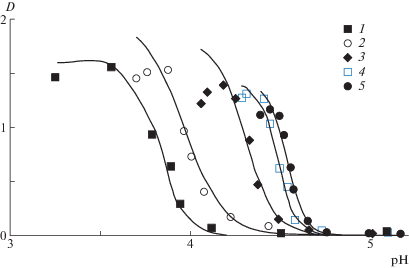
Рис. 2.
Зависимость оптической плотности водного раствора эквимольной смеси сополимера [ГЭА] : [бутилакрилат] = = 90.3 : 9.7 мол. % и [ГЭА–бутилакрилат] = [ПАК] = 0.01 осново-моль от рН среды при концентрации хлорида калия 0 (1), 0.005 (2), 0.010 (3) и 0.030 моль/л (4); МПАК = 7.5 × 105; сплошные линии – теоретический расчет.
Как было показано ранее, способность к комплексообразованию в системе неионный полимер–поликарбоновая кислота существенно зависит от ионной силы водного раствора [4, 5, 10, 11]. При этом значения рНкрит могут значительно изменяться при добавлении низкомолекулярной соли в раствор реагирующих полимеров, причем увеличение ионной силы в общем случае может приводить как к уменьшению, так и к увеличению значения рНкрит. В соответствии с классификацией, предложенной авторами работы [13], если добавление соли сдвигает рНкрит в область более высоких значений рН, то пара “неионный полимер–карбоновая поликислота” относится к группе слабо комплексующих систем, в противном случае – к группе сильно комплексующих. То есть, в одном случае низкомолекулярная соль препятствует образованию комплекса, а в другом – является фактором, способствующим комплексообразованию.
Из сравнения представленных данных видно, что для системы сополимер ГЭА–бутилакрилат и ПАК характер зависимости влияния ионной силы на формирование интерполимерных комплексов существенно зависит от состава сополимера, а именно от содержания гидрофобных звеньев бутилакрилата. Действительно, на рис. 1 и 2 показано, что для системы ПАК с сополимером ГЭА–бутилакрилат, содержащего 4.8 мол. % бутилакрилата (состав сополимера [ГЭА] : [бутил-акрилат] = 95.2 : 4.8 мол. %), повышение концентрации низкомолекулярной соли хлорида калия сопровождается увеличением значения рНкрит, т.е. является фактором благоприятным для комплексообразования. И наоборот, для системы ПАК с сополимером ГЭА–бутилакрилат с более высоким содержанием бутилакрилата, равным 9.7 мол. % (состав сополимера [ГЭА] : [бутил-акрилат] = 90.3 : 9.7 мол. %), наблюдается обратная зависимость, а именно, повышение концентрации KCl в растворе сопровождается сдвигом рНкрит в область более низких значений рН, т.е. в данном случае ионная сила является фактором, неблагоприятно влияющим на комплексообразование. Следовательно, увеличение содержания звеньев бутилакрилата в составе сополимера ГЭА–бутилакрилат всего на 4.9 мол. % сопровождается переходом системы сополимер ГЭА–бутил-акрилат и ПАК от слабо комплексующей к сильно комплексующей, в соответствии с классификацией [13].
Полученные результаты хорошо согласуются с представлениями о существенном вкладе гидрофобных взаимодействий в дополнительную стабилизацию интерполимерных комплексов, образованных водородными связями [5]. В частности, в ряде работ было продемонстрировано, что увеличение содержания гидрофобных звеньев в составе сополимеров способствует повышению их комплексообразующей способности при взаимодействии с ПАК в водных растворах [5, 12].
Для системы сополимер ГЭА–бутилакрилат и ПАК наряду с экспериментально полученными данными по зависимости оптической плотности (мутности) водного раствора эквимольной смеси сополимеров и ПАК от рН (точки) на рис. 1 и 2 представлены теоретические кривые, построенные по методике, рассматриваемой ниже (сплошные линии).
В работе [14] был предложен вид зависимости оптической плотности раствора полимера от рН, испытывающего фазовый переход при изменениях кислотности среды:
(1)
$D = \frac{{{{D}_{0}}}}{{1 + \exp \left( {\left( {{\text{pH}} - {\text{p}}{{{\text{H}}}_{0}}} \right){\text{/}}{{{\tau }}_{0}}} \right)}},$Вид кривой (1) может быть получен, в том числе, на основе полуфеноменологической теории [14], параметры D0, pH0 и τ0 вычисляются на основе экспериментальных данных.
Однако, можно видеть, что вид данной зависимости совпадает с логистической кривой, которая часто используется, например, в теории нейронных сетей.
Кривая зависимости оптической плотности раствора полимера от рН, описываемая уравнением (1), удовлетворяет дифференциальному уравнению первого порядка:
(2)
$\frac{{dD}}{{d{\text{pH}}}} = \frac{{{{D}^{2}}}}{{{{D}_{0}}{{{\tau }}_{0}}}} - \frac{D}{{{{{\tau }}_{0}}}}$Это означает, что зависимость производной dD/dpH оптической плотности D по pH от значения D, должна иметь параболический вид. Такие зависимости могут трактоваться в качестве фазовых портретов и их можно построить непосредственно на основе экспериментальных данных, численно дифференцируя анализируемую кривую [14].
Фазовые портреты для кривых 1–4 на рис. 2, приведены на рис. 3а–3г соответственно: точки отвечают значениям, рассчитанным численным дифференцированием экспериментально полученных зависимостей, а пунктирные линии – параболической аппроксимации, причем аппроксимирующая кривая проходит через начало координат.
Рис. 3.
а–г: Зависимости производной dD/dpH оптической плотности D по pH от значения D: точки – результат численного дифференцирования экспериментальной кривой; пунктирные линии – параболическая аппроксимация для кривых 1–4, представленных на рис. 2, соответственно.
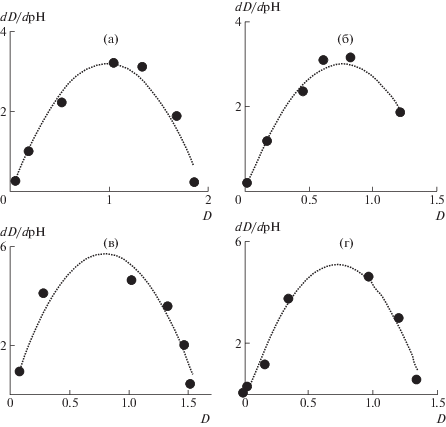
Видно, что точки, полученные численным дифференцированием экспериментальных зависимостей, показанные на рис. 3, с удовлетворительной точностью описываются параболической кривой, проходящей через начало координат.
Это означает, что рассматриваемые зависимости удовлетворяют дифференциальному уравнению (2), а значит, сами зависимости D(pH) характеризуются его решением вида (1). При этом значения параметров D0 и τ0 вычисляются по кривым рис. 3 непосредственно методом наименьших квадратов. Такой же результат получен и для фазовых портретов кривых, представленных на рис. 1.
Решение уравнения (2) предполагает использование одной константы интегрирования – величины pH0, входящей в формулу (1), значение которой определялось минимизацией суммарного отклонения экспериментальных кривых от заданного формулой (1).
Величину pH0 целесообразно использовать как количественную характеристику для границы области, где формируется комплекс. Действительно, образование продукта любой химической реакции носит статистический характер. По традиции, в физической химии в качестве пороговых значений для управляющих параметров часто выбираются такие, которые отвечают протеканию реакции с выходом 50% (т.е. половина веществ прореагировала). С учетом характера рассматриваемой кривой (1) на рис. 3, 50 %-ный выход реакции образования комплекса в точности соответствует значению pH равному pH0.
Значения управляющих параметров, полученные на основе параболической аппроксимации фазовых портретов, были использованы для построения теоретических зависимостей D по pH. Эти зависимости показаны на рис. 1 и 2 сплошными линиями. Видно, что теоретическая кривая (1) описывает экспериментальные данные с хорошей точностью. Исключение составляет область вблизи максимума кривой, что и следовало ожидать, так как образующийся комплекс выпадает в осадок.
Следовательно, величину pH0 действительно можно применять для количественного описания области, где имеет место образование комплекса.
Зависимости pH0 и τ0 от концентрации низкомолекулярной соли в растворе для систем, которым соответствуют данные рис. 1 и 2, представлены на рис. 4 и 5.
Рис. 4.
Зависимость pH0 (1) и τ0 (2) от концентрации низкомолекулярной соли при образовании комплекса в системе сополимер ГЭА–бутилакрилат с ПАК. Сополимер [ГЭА] : [бутилакрилат] = 95.2 : 4.8 мол. %, [ГЭА–бутилакрилат] = = [ПАК] = 0.01 осново-моль/л; МПАК = 7.5 × 105.
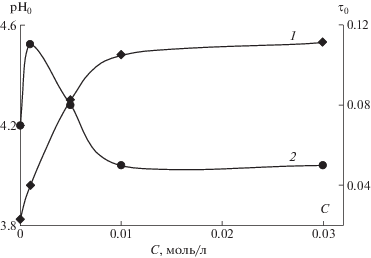
Рис. 5.
Зависимость pH0 (1) и τ0 (2) от концентрации низкомолекулярной соли при образовании комплекса в системе сополимер ГЭА–бутилакрилат с ПАК. Сополимер [ГЭА] : [бутилакрилат] = 90.3 : 9.7 мол. %, [ГЭА–бутилакрилат] = = [ПАК] = 0.01 осново-моль/л; МПАК = 7.5 × 105.
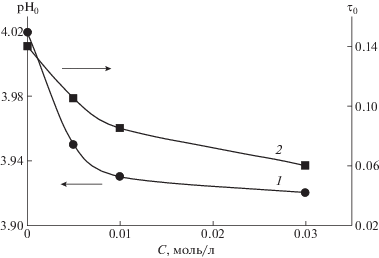
Предлагаемый подход позволяет выявлять достаточно тонкие эффекты, связанные с влиянием низкомолекулярной соли на образование комплекса. Это обеспечивается тем, что показатель pH0 может быть определен с высокой точностью. В частности, сопоставление данных рис. 4 и 5 демонстрирует, что даже весьма малые вариации состава рассматриваемого сополимера могут существенным образом изменить характер формирующегося интерполимерного комплекса. Так, на рис. 4 видно, что добавление низкомолекулярной соли приводит к сдвигу pH0 в щелочную область, а на рис. 3 – в кислую. Отметим, что речь идет об одном и том же комплексе, отличающемся только относительно небольшим изменением содержания бутилакрилата в составе сополимера.
Также на формирование интерполимерных комплексов заметное влияние оказывают даже сравнительно небольшие значения концентрации низкомолекулярной соли. При дальнейшем увеличении этого показателя кривые (рис. 4 и 5, оси ординат слева) достаточно быстро выходят на насыщение, т.е. дальнейшее увеличение концентрации низкомолекулярной соли перестает оказывать влияние на формирование комплекса.
Таким образом, применение метода фазовых портретов [14] позволяет выделить еще один параметр τ0, отражающий резкость фазового перехода, – чем этот параметр больше, тем более широким является диапазон значений рН, в котором осуществляется постепенный переход от раствора, содержащего невзаимодействующие макромолекулы, к раствору, в котором сформировался интерполимерный комплекс. Так, рис. 4 и 5 демонстрируют, что добавление низкомолекулярной соли в раствор макромолекул, способных формировать интерполимерный комплекс, существенным образом влияет на данный показатель: он может изменяться в 2 и более раза. При этом достаточно высокие значения концентрации низкомолекулярной соли приводят к тому, что ширина переходной области по рН становится все более и более узкой. Иначе, добавление низкомолекулярной соли усиливает кооперативные эффекты, сопровождающие формирование интерполимерных комплексов.
ЗАКЛЮЧЕНИЕ
Характер интерполимерного комплекса, формируемого сополимером ГЭА–бутилакрилат и ПАК, весьма чувствителен к вариациям содержания бутилакрилата в составе сополимера. Изменение содержания бутилакрилата от 4.8 до 9.7 мол. % приводит к тому, что пара рассматриваемого типа конвертируется из слабо комплексующей в сильно комплексующую.
Для выявления тонких эффектов подобного типа целесообразно использовать показатель pH0 – значение рН, при котором реакция формирования интерполимерного комплекса протекает наполовину (образуется 1/2 от его максимального количества). Такой показатель, как продемонстрировано в настоящей работе, может быть установлен при помощи метода фазовых портретов, который гарантирует также высокую точность определения pH0, что существенно для выявления тонких эффектов влияния низкомолекулярной соли на характер комплексообразования.
Метод фазовых портретов позволяет ввести в употребление еще один параметр, характеризующий процессы формирования интерполимерного комплекса, – ширину переходной области по рН; данный параметр является новым и ранее не использовался. Он дает возможность получать дополнительные сведения о характере реакции между неионными полимерами и поликислотами.
Работа выполнена при поддержке Министерства образования и науки Республики Казахстан (грант № BR05236446).
Список литературы
Кабанов В.А., Паписов И.М. // Высокомолек. соед. А. 1979. Т. 21. № 2. С. 244.
Bekturov E.A., Bimendina L.A. // Adv. Polym. Sci. 1981. V. 41. P. 99.
Tsuchida E., Abe K. // Adv. Polym. Sci. 1982. V. 45. P. 1.
Jiang M., Li M., Xiang M., Zhou H. // Adv. Polym. Sci. 1999. V. 146. P. 121.
Hydrogen-Bonded Interpolymer Complexes. Formation, Structure and Applications / Eds. by V.V. Khutoryanskiy, G. Staikos. Singapore: World Scientific, 2009.
Mun G.A., Suleimenov I.E., Ermukhambetova B.B., Vorob’eva N.A., Irmukhametova G.S. // Polymer Science A. 2016. V. 58. № 6. P. 944.
Khutoryanskiy V.V., Smyslov R.Yu., Yakimansky A.V. // Polymer Science A. 2018. V. 60. № 5. P. 553.
Khutoryanskaya O.V., Morrison P.W.J., Seilkhanov S.K., Mussin M.N., Ozhmukhametova E.K., Rakhypbekov T.K., Khutoryanskiy V.V. // Macromol. Biosci. 2014. V. 14. № 2. P. 225.
Moustafine R.I., Victorova A.S., Khutoryanskiy V.V. // Int. J. Pharm. 2019. № 558. P. 53.
Ikawa T., Abe K., Honda K., Tsuchida E. // J. Polym. Sci., Polym. Chem. Ed. 1975. V. 13. № 7. P. 1505.
Baranovsky V., Petrova T., Rashkov I. // Eur. Polym. J. 1991. V. 27. P. 1045.
Nurkeeva Z.S., Mun G.A., Khutoryanskiy V.V. // Polymer Science B. 2001. V. 43. № 5–6. P. 148.
Khutoryanskiy V.V., Mun G.A., Nurkeeva Z.S., Dubolazov A.V. // Polym. Int. 2004.V. 53. P. 1382.
Suleimenov I.E., Budtova T., Adil’Bekov S.A., Pereladov I.Y., Bekturov, E.A. // Polymer Science A. 2004. V. 46. № 7–8. P. 797.
Mun G.A., Nurkeeva Z.S., Beissegul A.B., Dubolazov A.V., Urkimbaeva P.I., Park K., Khutoryanskiy V.V. // Macromol. Chem. Phys. 2007. V. 208. № 9. P. 979.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


