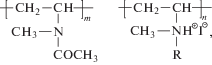Высокомолекулярные соединения (серия А), 2021, T. 63, № 1, стр. 3-9
ДЕТЕКТИРОВАНИЕ ГИДРОФОБНЫХ ВЗАИМОДЕЙСТВИЙ В АМФИФИЛЬНЫХ СОПОЛИМЕРАХ ГРЕБНЕОБРАЗНОГО СТРОЕНИЯ ВИСКОЗИМЕТРИЧЕСКИМ МЕТОДОМ
Г. М. Павлов a, *, А. А. Гостева a, О. А. Доммес a, О. В. Окатова a, И. И. Гаврилова a, Е. Ф. Панарин a, b
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
b Санкт-Петербургский государственный политехнический университет Петра Великого
195251 Санкт-Петербург, Политехническая ул., 29, Россия
* E-mail: georges.pavlov@mail.ru
Поступила в редакцию 22.06.2020
После доработки 12.08.2020
Принята к публикации 26.08.2020
Аннотация
Изучены амфифильные сополимеры N-метил-N-винилацетамида и алкилированного N-метил-N-виниламина, сочетающие в себе гидрофильную основу и гидрофобные боковые цепи различной длины, несущие заряд. Сопоставлены результаты и рассмотрены особенности применения известных методик определения характеристической вязкости в водных и органических растворителях. Сделаны выводы о внутримолекулярной организации в молекулярных цепях исследованных сополимеров и проявлении гидрофобных взаимодействий в макромолекулах с разной длиной алкильных радикалов. Выявлены условия, при которых амфифильный характер сополимеров не проявляется. Предложено в качестве меры гидрофобности цепей сополимеров рассматривать знак и величину второй производной зависимости lnηr = f(c[η]).
ВВЕДЕНИЕ
Изучение внутримолекулярной организации сополимеров, сочетающих гидрофильную основу и гидрофобные боковые цепи, а также несущих заряд, представляет фундаментальный интерес, заключающийся в рассмотрении конкуренции трех типов взаимодействий и их влияния на размеры цепей, помещенных в различные растворители. Внимание к амфифильным сополимерам определяется тем, что в макромолекулярных клубках возможно формирование гидрофобных внутренних доменов, т.е. образование в объеме макромолекулы мицеллярных областей в водном растворе. Мицеллярные структуры способны нести гидрофобные биологически активные вещества, инкапсулированные в гидрофобном ядре, и удерживать их в водном растворе за счет гидрофильной оболочки [1, 2]. В настоящее время интенсивно ведутся работы по синтезу и исследованию свойств амфифильных полимеров [3–7].
Подобные системы могут быть изучены различными методами, например, ЯМР- и УФ-спектроскопией, нейтронным рассеянием, динамическим светорассеянием, а также методами молекулярной гидродинамики [8–11]. Значительную роль играют теоретические работы, моделирующие процессы самоорганизации амфифильных полимеров [12–14]. Мониторинг молекулярных свойств таких полимеров методами молекулярной гидродинамики и оптики является одним из основных инструментов для получения информации о размерах и конформационном статусе растворенных макромолекул.
В ряде работ [15–19] комплексно изучены гидродинамические и оптические свойства макромолекул линейных полимеров на основе N-виниламидов в разбавленных растворах, которые относятся к малоизученной группе водорастворимых полимеров. Исследование внутримолекулярной организации сополимеров N-метил-N-винилацетамида и алкилированного N-метил-N-виниламина, сочетающих гидрофильную основу и гидрофобные боковые цепи, несущие заряд, вызывает интерес в плане изучения нескольких типов взаимодействий в макромолекулах при различных условиях:
где R = –C6H13, –C8H17, –C10H21, –C12H25.
В настоящей работе на примере указанных выше амфифильных сополимеров рассмотрены особенности определения и интерпретации такой фундаментальной величины, как характеристическая вязкость.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Изучали статистические сополимеры N-метил-N-винилацетамида и алкилированного N-метил-N-виниламина с алкильными заместителями разной длины в боковых цепях: R = C6H13, C8H17, C10H21 и C12H25. Состав сополимеров устанавливали по содержанию йода, определяемого кондуктометрическим титрованием.
Сополимеры N-метил-N-винилацетамида и гидрохлорида N-метил-N-виниламина мольного состава 85 : 15 получали в лаборатории гидрофильных полимеров Института высокомолекулярных соединений РАН путем частичного гидролиза поли(N-метил-N-винилацетамида) [20]:
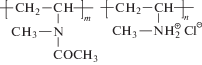
Подтверждали их структуру с помощью ИК-спектроскопии на спектрометре “Vertek70” (“Brucker”). Содержание заряженных групп определяли при помощи аргентометрического титрования. Алкилирование сополимеров соответствующими йодистыми алкилами проводили по процедуре, изложенной в работе [21].
Вискозиметрические исследования растворов сополимеров осуществляли в капиллярном вискозиметре Оствальда. Скоростную седиментацию изучали на аналитической ультрацентрифуге “BeckmanXLI” в двухсекторной кювете с оптическим путем 12 мм при скорости вращения ротора 40000 об/мин. Седиментационные интерференционные сканы обрабатывали в программе Sedfit [22]. Поступательную диффузию исследовали на поляризационном диффузометре Цветкова [23] в металлической кювете с тефлоновым вкладышем толщиной 3 см по ходу луча [24]. Фактор плавучести образцов рассчитывали по плотности растворов сополимеров, измеренных на денситометре Kyoto “Electronics DA-640”. Детально протоколы седиментационно-диффузионного анализа представлены в работах [15, 17, 25, 26]. Молекулярные массы рассчитывали по формуле Сведберга:
Здесь R – универсальная газовая постоянная, T – абсолютная температура, $\nu $ – парциальный удельный объем, ρ0– плотность растворителя, s0 – коэффициент седиментации, D0– коэффициент поступательной диффузии.
Полный комплекс исследований осуществляли при 25°C в 0.1 моль/л NaCl в условиях подавления полиэлектролитных эффектов. Характеристики образцов 1–7 приведены в табл. 1; значения характеристической вязкости алкилированного сополимера с R = C12H25 и сополимеров N-метил-N-винилацетамида и гидрохлорида N-метил-N-виниламина представлены в табл. 2.
Таблица 1.
Гидродинамические и молекулярные характеристики образцов сополимеров N-метил-N-винилацет-амида и N-метил-N-виниламина в 0.1 моль/л NaCl при 25°С
| Образец, № | R | [η], см3/г | s0 × 1013, с | D0 × 107, см2/с | MsD × 10 ̶ 3 | L × 108, см | lphil/lphob |
|---|---|---|---|---|---|---|---|
| 1 | C12H25 | 75 | 1.72 | 2.80 | 150 | 3200 | 1.03 |
| 2 | C10H21 | 94 | 2.20 | 1.86 | 130 | 2880 | 1.21 |
| 3 | C8H17 | 103 | 2.28 | 2.0 | 120 | 2760 | 1.48 |
| 4 | C6H13 | 103 | 2.0 | 2.0 | 100 | 2390 | 1.90 |
| 5 | H | 103 | – | – | 130** | 3530 | – |
| 6 | H | 129 | – | – | 180** | 4890 | – |
| 7 | H | 167 | 2.19* | 1.66* | 200 | 5450 | – |
Примечания. R – алкильный заместитель в N-метил-N-виниламине, L – контурная длина макромолекулы. Образец 1 получен в результате алкилирования образца 6; образцы 2–4 – алкилированием образца 5; образец 7 имеет состав 84 : 16 мол. %; образцы 5–7 – сополимеры N-метил-N-винилацетамида и гидрохлорида N-метил-N-виниламина.
** MM рассчитаны по характеристической вязкости [27].
Таблица 2.
Значения характеристической вязкости [η] образцов сополимеров
| Образец, № | Растворитель | [η]*, cм3/г | kH | [η]**, cм3/г | [η]***, cм3/г | kK | [η]****, cм3/г | [η]ср, cм3/г |
|---|---|---|---|---|---|---|---|---|
| 1 | H2O + NaCl 0.1 моль/л | 74.0 ± 1.0 | 0.97 | 74.0 ± 1.0 | 76.0 ± 1.0 | +0.18 | 77 ± 1 | 75 ± 1 |
| ДМФА + LiBr 0.1 моль/л | 57.0 ± 0.1 | 0.39 | 54.9 ± 0.6 | 57.2 ± 0.3 | –0.13 | 56 ± 1 | 56 ± 1 | |
| ДМФА + LiCl 0.1 моль/л | 49.2 ± 0.5 | 0.47 | 49.0 ± 3.0 | 49.7 ± 0.4 | –0.10 | 51 ± 2 | 50 ± 1 | |
| 5 | H2O + NaCl 0.1 моль/л | 105.0 ± 1.0 | 0.32 | 100.0 ± 6.0 | 105.0 ± 1.0 | –0.16 | 100 ± 4 | 103 ± 3 |
| 6 | H2O + NaCl 0.1 моль/л | 130.0 ± 1.0 | 0.30 | 129.0 | 129.0 ± 1.0 | –0.17 | 126 | 129 ± 2 |
| 7 | H2O + NaCl 0.1 моль/л | 166.0 ± 1.0 | 0.35 | 170.0 ± 1.0 | 165.4 ± 0.7 | –0.14 | 167 ± 1 | 167 ± 2 |
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Амфифильные сополимеры в водных растворах
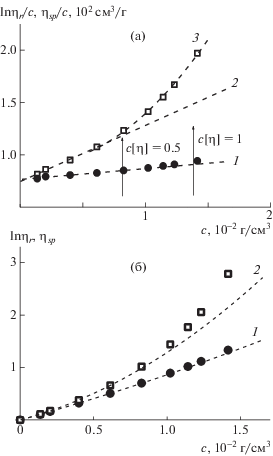
Задачей настоящей работы было изучение гидрофобных взаимодействий в цепях алкилированных сополимеров, что осуществимо только при подавленных полиэлектролитных эффектах. В бессолевых водных растворах гидродинамическое поведение алкилированных цепей целиком определяется наличием зарядов и практически не зависит от длины алкильного радикала. Результаты вискозиметрических измерений алкилированного статистического сополимера (образец 1) представлены на рис. 1а в координатах, соответствующих уравнениям Хаггинса и Крэмера:
(2)
${\text{ln}}{{\eta }_{r}}{\text{/}}с = [\eta ] + {{k}_{{\text{K}}}}{{[\eta ]}^{2}}с + ...{\text{ }},~$Рис. 1.
а – Зависимость lnηr/с (1) и ηsp/с (2, 3) от концентрации для образца 1 в 0.1 моль/л NaCl, кривая 2 – экстраполяция начального участка зависимости 3; б – те же данные, представленные в виде зависимости lnηr (1) и ηsp (2) от концентрации.
На рис. 1б приведена обработка вискозиметрических результатов в исходных координатах, предложенных Штаудингером и Крэмером [28, 29]:
где ηsp = ηr – 1 – удельная вязкость раствора, ηr = = (η/η0) – относительная вязкость, η0 и η – динамические вязкости растворителя и раствора соответственно, с – концентрация полимера в растворе.Соотношения (3) и (4) исторически считаются исходными определениями характеристической вязкости [η]. Важнейшим результатом работы Штаудингера стал постулат: [η] = KM, т.е. величина [η] является мерой молекулярной массы растворенного полимера. С этого момента вискозиметрия разбавленных растворов высокомолекулярных соединений получила широкое распространение, а [η] – одна из основных гидродинамических характеристик макромолекул. Следует отметить, что соотношение [η] = KM, предложенное Штаудингером, является предтечей известного теперь скейлингового соотношения Марка–Куна–Хаувинка–Сакурады [η] = KMbη и совпадает с последним при bη = 1. Молекулярно-физический смысл величины [η] задается формулой Флори–Фокса: [η] = Φ 〈h2〉3/2/M, где 〈h2〉 – среднеквадратичное расстояние между концами макромолекулярной цепи, Φ – гидродинамический параметр Флори.
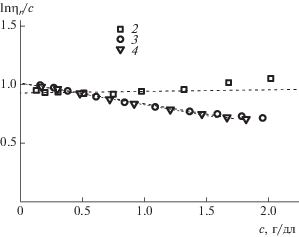
Результаты, полученные для образца 1, целесообразно сравнить на рис. 2 с аналогичными измерениями в 0.1 моль/л NaCl неалкилированного сополимера (образец 7).
Рис. 2.
а – Зависимость lnηr/с (1) и ηsp/с (2) от концентрации для образца 7 в 0.1 моль/л NaCl (а); б – те же данные, представленные в виде зависимости lnηr (1) и ηsp (2) от концентрации.
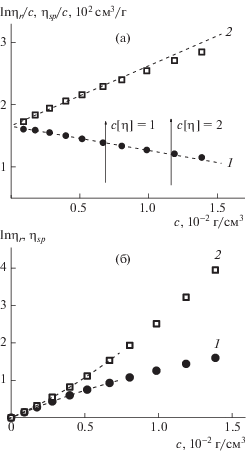
На рис. 1а и 2а стрелками отмечены степени разбавления растворов, характеризующиеся параметром Дебая с [η].
При сравнении рис. 1 и 2 обращают на себя внимание два обстоятельства. Во-первых, наклон зависимости lnηr/с на рис. 1а или вторая производная зависимости lnηr на рис. 1б меняют знаки с обычного для гибкоцепных полимеров отрицательного, наблюдаемого для неалкилированного сополимера (рис. 2), на положительный для алкилированного (рис. 1). Во-вторых, линейная зависимость ηsp/с (рис. 1а) в области малых значений концентрации наблюдается в меньшем интервале концентрации, чем на рис. 2а, а именно в области с[η] < 0.5. В интервале 0.5 < с[η] <1.0 зависимость ηsp/с (рис. 1а) хорошо описывается восходящим полиномом второй степени. Подобное отклонение от линейной зависимости величины ηsp/с обычно наблюдают для линейных гомополимеров в термодинамически хороших растворителях, но в области значительно бóльших значений концентрации, что связывают с возникновением и нарастанием в растворах межцепных взаимодействий, начиная с определенных значений. Для растворов сополимера 1 нелинейное возрастание величины ηsp/с наблюдается в области разбавленных растворов. В то же время, зависимость lnηr/с остается линейной вплоть до с[η] ≈ 1. Важно, что существенно разная протяженность начальных линейных участков зависимостей ηsp/с и lnηr/с делает предпочтительным использование построения lnηr/с для надежной экстраполяции этой величины к условию бесконечного разбавления и получению надежного значения [η].
Смена знака второй производной зависимости lnηr от с (или параметра Кремера), а также отклонение от линейности зависимости ηsp/с, на наш взгляд, связано с внутримолекулярной самоорганизацией макромолекул сополимера за счет взаимодействия алкильных радикалов. Это можно назвать проявлением внутримолекулярных гидрофобных взаимодействий типа полимер–полимер на фоне взаимодействий полимер–растворитель. В макромолекулярных клубках сополимеров, содержащих боковые алкильные радикалы, в водной среде возможно формирование гидрофобных внутренних доменов, т.е. образование в объеме отдельной макромолекулы мицеллярных петель.
Отметим, что поскольку для таких систем (kH – kK) ≫ 0.5, то уравнения (2) и (3) перестают быть математически эквивалентными при с → 0.
Проанализируем, как длина бокового радикала в цепях амфифильных алкилированных сополимеров влияет на характер экспериментальных зависимостей. На рис. 3 представлены данные измерений характеристической вязкости для сополимеров 2–4 в 0.1 моль/л NaCl.
Результаты вискозиметрических измерений растворов алкилированных сополимеров в 0.1 моль/л NaCl обобщены на рис. 4. Координаты lnηr – c[η] позволяют сравнивать вискозиметрические данные полимеров различной молекулярной массы и широко используются в реологии полимеров [30–32].
Рис. 4.
Зависимость lnηr от степени разбавления раствора с[η] для сополимеров N-метил-N-винилацет-амида и N-метил-N-виниламина в 0.1 моль/л NaCl.
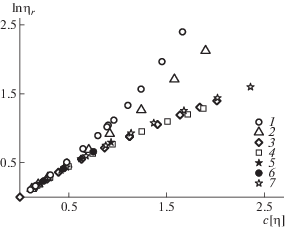
Так, на рис. 4 видно, что гидрофобные взаимодействия проявляются в растворах сополимеров 1 и 2, содержащих десять и двенадцать атомов углерода в боковых цепях. Для них вторая производная зависимости имеет положительный знак. Однако гидрофобные взаимодействия не детектируются в растворах сополимеров 3 и 4, содержащих шесть и восемь атомов углерода: вторая производная зависимости отрицательная, как и для неалкилированного сополимера (образцы 5–7).
Важным параметром здесь может выступать отношение среднего отрезка между двумя ближайшими по цепи алкильными радикалами (lphil) к их контурной длине (lphob), характеризующего соотношение гидрофильной и гидрофобной частей сополимера, которое в исследуемом ряду изменяется в пределах 1.03 < lphil/lphob < 1.90. Степень гидрофобности можно варьировать, изменяя один из параметров или оба. Таким образом, для изученной системы при значениях параметра lphil/lphob < 1.3 полимер проявляет внутримолекулярные гидрофобные взаимодействия, а при lphil/lphob > 1.5 нет. Удивительно, что данные для образцов 3 и 4 укладываются на единую зависимость с сополимером, не содержащим алифатических групп (образцы 5–7). Таким образом, амфифильный характер указанных сополимеров не прослеживается в их вязком течении в водных растворах.
Амфифильные сополимеры в растворах органических растворителей
Можно “выключить” гидрофобные взаимодействия в цепях сополимера 1, поместив его в органический растворитель, например ДМФА, в котором растворяются оба компонента. Результаты определения характеристик вязкого течения сополимера 1 в среде ДМФА с добавлением низкомолекулярных солей представлены на рис. 5. В среде ДМФА характер вискозиметрических зависимостей lnηr/c алкилкированного сополимера (рис. 5а) такой же, как для неалкилированного сополимера в водно-солевой среде (см. рис. 2а), т.е. они имеют отрицательный наклон. Это позволяет утверждать, что именно взаимодействия гидрофобных боковых радикалов в водной среде являются причиной изменения характера зависимостей на рис. 1 и 2. Отметим, что гидродинамический объем макромолекул сополимера 1 в среде ДМФА, т.е. величины [η], в 1.3–1.5 раза меньше, чем в 0.1 моль/л NaCl в водном растворе. Самоорганизация макромолекул сополимера с двенадцатью атомами углерода в боковой цепи в водном растворе не приводит к минимальным размерам их клубков.
Рис. 5.
а – Зависимость lnηr/с от концентрации для алкилированного сополимера 1 в 0.1 моль/л NaCl + + H2O (1), в ДМФА + 0.1 моль/л LiBr (2), в ДМФА + + 0.1 моль/л LiCl (3); б – зависимость lnηr от степени разбавления с[η] для сополимера 1 в 0.1 моль/л NaCl + + H2O (1), ДМФА + 0.1 моль/л LiCl (2 ') и ДМФА + + 0.1 моль/л LiBr (2 '') и для сополимера 7 в 0.1 моль/л NaCl + H2O (2 ''').
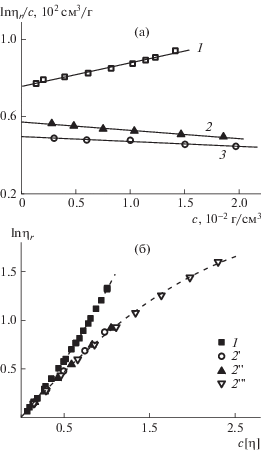
На рис. 5б представлены зависимости lnηr от степени разбавления раствора c[η] для алкилированного сополимера в 0.1 моль/л NaCl + H2O, а также в ДМФА + 0.1 моль/л LiCl, ДМФА + 0.1 моль/л LiBr и неалкилированного сополимера в 0.1 моль/л NaCl + H2O (см. табл. 2). Так, данные для алкилированного образца 1 в ДМФА + 0.1 моль/л LiCl и ДМФА + 0.1 моль/л LiBr и неалкилированного образца сополимера 7 в водно-cолевом растворе описываются одним полиномом второй степени: lnηr = c[η] – (0.135 ± 0.007)(c[η])2, а результаты для образца 1 в растворе 0.1 моль/л NaCl + H2O хорошо аппроксимируются уравнением lnηr = = c[η] + (0.31 ± 0.02)(c[η])2.
Экспериментальные данные по поведению линейных гибкоцепных макромолекул в термодинамически хороших растворителях [33–36] и теоретический анализ [37–39] показывают, что их размеры уменьшаются с ростом концентрации. Такому поведению отвечают сополимеры 1 в органическом растворителе и 7 в водно-солевой среде. Однако для алкилированного сополимера 1 в водной среде уже при c < 1/[η] (см. рис. 1а, 5б) эффекты как внутримолекулярного, так, возможно, и межмолекулярного взаимодействия между протяженными алифатическими боковыми группами вносят дополнительный вклад в трение макромолекул, т.е. приводят к росту их эффективного гидродинамического объема. Это можно проиллюстрировать в терминах так называемой “текущей характеристической вязкости” [40, 41] [η]* = ∂lnηr/∂c при c ≠ 0, которая будет убывать по мере увеличения концентрации для сополимера 1 в органическом растворителе и возрастать для него же в водной среде.
ЗАКЛЮЧЕНИЕ
Исследования ряда алкилированных сополимеров показали, что, во-первых, в водных растворах алкилированных сополимеров по сравнению с неалкилированным гомологом происходит изменение знака наклона зависимости lnηr/c от концентрации с отрицательного на положительный, это можно назвать проявлением гидрофобных взаимодействий в цепях сополимеров; во-вторых, для получения надежного невозмущенного значения величины [η] предпочтительно использовать построения Крэмера (lnηr/c от c); в-третьих, обобщенными координатами при анализе вязкого течения разбавленных растворов полимеров являются lnηr от степени разбавления раствора c[η], позволяющие сопоставлять полимеры разных структур и ММ в разных растворителях; в-четвертых, гидрофобные эффекты наблюдаются в цепях изученных гребнеобразных алкилированных сополимеров (состав сополимера 85 : 15 мол. %) при числе атомов углерода в боковых алифатических цепях ≥10; в-пятых, мерой гидрофобных взаимодействий может служить величина положительной второй производной зависимостей lnηr от c[η]; и, наконец, алкилированные сополимеры не демонстрируют специфики в вязком течении их разбавленных растворов в некоторых органических растворителях. В этом случае амфифильный характер сополимеров не проявляется.
Работа выполнена при финансовой поддержке Российского научного фонда в рамках гранта РНФ (№ 18-13-00324).
Список литературы
Tian L., Yam L., Zhou N., Tat H., Uhrich K.E. // Macromolecules. 2004. V. 37. № 2. P. 538.
Torchilin V.P. // J. Controll. Release. 2001. V. 73. № 2−3. P. 137.
Vilar G., Tulla-Puche J., Albericio F. // Curr. Drug Deliv. 2012. V. 9. № 4. P. 367.
Ma L., Zhou C.J., Yang Q.Z., Yang X.G., Zhang C., Liao L.Q. // Curr. Organic Chem. 2014. V. 18. № 15. P. 1937.
Панарин Е.Ф., Лавров Н.А., Соловский М.В., Шальнова Л.И. Полимеры – носители биологически активных веществ. СПб.: Профессия, 2014.
Lipinski C.A. // J. Pharmacol. Toxicol. Methods. 2000. V. 44. № 1. P. 235.
Schramm O.G., Pavlov G.M., van Erp H.P., Meier M.A.R., Hoogenboom R., Schubert U.S. // Macromolecules. 2009. V. 42. № 6. P. 1808.
Kidd B.E., Li X.L., Piemonte R.C., Cooksey T.J., Singh A., Robertson M.L., Madsen L.A. // Macromolecules. 2017. V. 50. № 11. P. 4335.
Zinn T., Willner L., Knudsen K.D., Lund R. // Macromolecules. 2017. V. 50. № 18. P. 7321.
Abdelhamid D., Arslan H., Zhang Y.Y., Uhrich K.E. // Polym. Chem. 2014. V. 5. № 4. P. 1457.
Pavlov G.M., Knop K., Okatova O.V., Schubert U.S. // Macromolecules. 2013. V. 46. № 21. P. 8671.
Larin D.E., Lazutin A.A., Govorun E.N., Vasilev-skaya V.V. // Langmuir. 2016. V. 32. № 27. P. 7000.
Vasilevskaya V.V., Markov V.A., ten Brinke G., Khokhlov A.R. // Macromolecules. 2008. V. 41. № 20. P. 7722.
Glagolev M.K., Vasilevskaya V.V., Khokhlov A.R. // Polymer. 2017. V. 125. P. 234.
Pavlov G.M., Okatova O.V., Michailova A.V., Ulianova N.N., Gavrilova I.I., Panarin E.F. // Macromol. Bioscience. 2010. V. 10. P. 790.
Pavlov G.M., Okatova O.V., Gavrilova I.I., Ulianova N.N., Panarin E.F. // Polymer Science A. 2013. V. 55. № 12. P. 699.
Pavlov G.M., Okatova O.V., Gubarev A.S., Gavrilova I.I., Panarin E.F. // Macromolecules. 2014. V. 47. № 8. P. 2748.
Pavlov G.M., Kolbina G.F., Okatova O.V., Gavrilova I.I., Panarin E.F. // Dokl. Chem. 2015. V. 463. № 1. P. 181.
Pavlov G.M., Dommes O.A., Okatova O.V., Gavrilova I.I., Panarin E.F. // Phys. Chem. Chem. Phys. RSC. 2018. V. 20. P. 9975.
Okatova O.V., Gavrilova I.I., Ulianova N.N., Panarin E.F. Pavlov G.M. // Russ. J. Appl. Chem. 2012. V. 85. № 8. P. 1239.
Панарин Е.Ф., Гаврилова И.И. // Высокомолек. соед. Б. 1977. Т. 19. С. 251.
Schuck P. // Biophys. J. 2000. V. 78. P. 1606.
Tsvetkov V.N. Rigid–Chain Polymers: Hydrodynamic and Optical Properties in Solution. New York: Plenum Press, 1989.
Лавренко П.Н., Окатова O.В. // Высокомолек. соед. А. 1977. Т. 19. № 11. С. 2640.
Pavlov G.M., Perevyazko I., Okatova O.V., Schubert U.S. // Methods. 2011. V. 54. P. 124.
Pavlov G.M. // Analytical Ultracentrifugation: Instrumentation, Software, and Applications / Eds. by S. Uchiyama, F. Arisaka, W.F. Stafford, T. Laue. Tokyo: Springer, 2016. P. 269.
Dommes O.A., Okatova O.V., Kostina A.A., Gavrilova I.I., Panarrin E.F., Pavlov G.M. // Polymer Science C. 2017. V. 59. № 1. P. 125.
Staudinger H. // Nobel Lecture (1953): Macromolecular Chemistry, in Nobel Lectures, Chemistry 1942–1962. Amsterdam: Elsevier, 1964. P. 397.
Kraemer E.O. // Ind. Eng. Chem. 1938. V. 30. № 10. P. 1200.
Malkin A.Ya. // Rheol. Acta. 1973. V. 12. P. 486.
Vinogradov G.V., Malkin A.Y. Rheology of Polymers: Viscoelasticity and Flow of Polymers. Berlin; Heidelberg: Springer-Verlag, 1980.
Будтов В.П. Физическая химия полимеров. СПб.: Химия, 1992.
Cotton J.P., Decker D., Benoit H., Farnoux B., Higgins J., Jannink G., Ober R., Picot C., des Cloizeaux J. // Macromolecules. 1974. V. 7. № 6. P. 863.
Kirste R.G., Kruse W.A., Schelten J. // Makromol. Chem. 1973. V. 162. P. 299.
Ballard D.G.H., Wignall G.D., Schelten J. // Eur. Polym. J. 1973. V. 9. P. 965.
Hayashi H., Hamada F., Nakajima A. // Macromolecules. 1974. V. 7. № 6. P. 959.
Freed K.F., Edwards S.F., Warner M. // J. Chem. Phys. 1976. V. 64. P. 5132.
Бирштейн T.M., Скворцов A.M., Sariban A.A. // Высокомолек. соед. Б. 1977. № 2. Т. 19. С. 74.
Birshtein T.M., Skvortsov A.M., Sariban A.A. // Polymer. 1983. V. 24. P. 1145.
Баранов В.Г., Агранова С.А., Бресткин Ю.В. // Высокомолек. соед. Б. 1987. № 3. С. 206.
Pavlov G.M., Gubarev A.S., Zaitseva I.I., Sibileva M.A. // Russ. J. Appl. Chem. 2006. V. 79. № 9. P. 1407.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)