Высокомолекулярные соединения (серия А), 2021, T. 63, № 6, стр. 413-421
МИКРОСТРУКТУРА И МЕХАНИКО-ПРОЧНОСТНЫЕ СВОЙСТВА ГУБОК НА ОСНОВЕ ХИТОЗАНА, ПОЛУЧЕННЫХ ИЗ РАСТВОРОВ ПОЛИМЕРА В УГОЛЬНОЙ КИСЛОТЕ
И. С. Чащин a, *, М. С. Рубина a, Н. А. Архарова b, М. А. Пигалева c
a Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
b Институт кристаллографии им. А.В. Шубникова, Федеральный научно-исследовательский центр “Кристаллография и фотоника” Российской академии наук
119333 Москва, Ленинский пр., 59, Россия
c Московский государственный университет имени М.В. Ломоносова. Физический факультет
119991 Москва, Ленинские горы, Россия
* E-mail: chaschin@polly.phys.msu.ru
Поступила в редакцию 13.05.2021
После доработки 30.06.2021
Принята к публикации 14.07.2021
Аннотация
Впервые полимерные губки на основе хитозана получены из растворов хитозана в угольной кислоте, а также из гелей на основе таких растворов, сшитых нецитотоксичным агентом природного происхождения – генипином. Проведен сравнительный анализ структуры и механико-прочностных свойств губок, приготовленных из растворов хитозана в угольной кислоте и растворов в уксусной кислоте. Показано, что добавление генипина в количестве ~2 мас. % к раствору хитозана в угольной кислоте приводит к уменьшению среднего размера пор в ~2.5 раза и значительному повышению прочностных характеристик материала по сравнению с губкой, приготовленной без генипина.
ВВЕДЕНИЕ
В настоящее время большое внимание научного сообщества направлено на материалы, получаемые из возобновляемых ресурсов, в частности из природных полимеров и их производных, таких как хитозан, коллаген, альгинат и другие. В особенности это касается материалов, используемых в биомедицине, где необходимо соблюдение биосовместимости и антимикробности, например, в пористых каркасах для задач тканевой инженерии или матрицах с инкапсулированными активными веществами [1, 2]. Так, одним из перспективных направлений является создание пластырей для трансдермальной доставки лекарств (ТДЛ), которые в течение времени нахождения материала на коже пациента способны диффундировать в кровоток [3].
Деацетилированное производное хитина – хитозан представляет собой полисахарид, широко применяемый для изготовления материалов биомедицинского назначения, в том числе материалов для ТДЛ в форме пористых губок, микрогранул, гидрогелей, пленок и т.д. [4]. Полимерная пористая губка из хитозана – особенно удобная форма материала для контакта с кожными покровами. В качестве растворителей для переработки данного полимера в новые формы биоматериалов используют минеральные неорганические и некоторые органические кислоты. “Классический рецепт” получения пористых губок хитозана включает в себя стадии растворения хитозана (1–2 мас. %) в разбавленном (1–2 об. %) растворе уксусной кислоты, замораживания и лиофильной сушки [5]. Несмотря на низкое содержание кислоты в таких материалах, при контакте с ними на кожных покровах могут развиваться аллергические реакции. В связи с этим, становится крайне важной разработка новых способов переработки данного полимера и поиск новых сред для растворения.
Альтернативным способом получения растворов хитозана можно назвать растворение полисахарида в воде, насыщенной СО2 под высоким давлением [6]. В воде, насыщенной диоксидом углерода, формируется угольная кислота, причем под давлением можно достичь кислотности вплоть до рН 2.8 при температуре 25°С и давлении 30 МПа [7]. Важная особенность данного метода состоит в том, что он позволяет получать биоматериал минуя стадию химической нейтрализации. Действительно, кислота, образующаяся при контакте воды с СО2 под высоким давлением, самонейтрализуется простым сбросом давления до атмосферного. Кроме того, данный биоматериал параллельно проходит и стадию стерилизации, поскольку угольная кислота оказывает инактивирующее действие на микроорганизмы [8]. Такие особенности выгодно отличают этот растворитель в качестве среды для получения хитозановых губок для использования там, где требуется применение материалов высокой чистоты.
Важно отметить, что пористые губки, изготовленные исключительно из хитозана без каких-либо низко- или высокомолекулярных добавок, не обладают необходимыми для ряда медицинских задач механическими свойствами, в частности, имеют низкую эластичность и прочность [5, 6]. Между тем, механическая стабильность материалов для ТДЛ особенно важна при их эксплуатации.
Для улучшения механических свойств полимерных губок на основе хитозана полимерные цепи сшивают с помощью альдегидов (например, глицеринового и глутарового), карбодиимидов, ионных сшивателей [9–12]. На сегодняшний день существуют спорные данные о токсичности широко используемых синтетических сшивающих агентов. В особенности это касается альдегидов. В любом случае, при их применении следует контролировать остаточное содержание несвязанного сшивателя и появление возможных побочных продуктов, образующихся в результате протекающих при сшивании побочных реакций [13, 14].
Генипин – химическое соединение, обнаруженное в экстракте плодов гардении. Его получают путем гидролиза генипозида, β-D-глюкопиранозида генипина, экстрагированного из плодов гардении, с помощью β-глюкозидазы [15]. Генипин является нетоксичным бифункциональным сшивающим агентом с цитотоксичностью во много раз меньше, чем у распространенного сшивателя глутарового альдегида [16]. Генипин сшивает первичные аминогруппы. Он был широко исследован при сшивании как 2D-гелей, так и 3D-скаффолдов на основе аминосодержащих полимеров, таких как хитозан, коллаген и желатин [17]. Использование данного сшивающего агента для получения биосовместимых механически прочных материалов для ТДЛ крайне оправдано [18–20]. Однако для изготовления патчей или конденсированных полимерных пленок с соответствующими той или иной прикладной задаче механическими свойствами необходимо подбирать оптимальное соотношение генипина и полимера, а также время сшивания [21].
Цель настоящей работы состояла в демонстрации принципиальной возможности получения хитозановых губок из растворов полимера в угольной кислоте – воде, насыщенной диоксидом углерода под высоким давлением, исследование их внутренней микроструктуры, пористости, механико-прочностных свойств, а также сопоставление этих данных с параметрами полимерных губок, полученных из традиционного растворителя – уксусной кислоты.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали хитозановый порошок (номер по каталогу 448877) и генипин (номер по каталогу 4796) производства “Sigma-Aldrich”, СО2 высокой чистоты (99.995%; Московский газоперерабатывающий завод), очищенную перед каждым экспериментом на установке “Millipore” Milli-Q воду, химически чистые ледяную уксусную кислоту и гидроксид натрия.
Очистка хитозана
Очистку хитозана проводили путем переосаждения полимера в его основной форме. Хитозан (1 мас. %) растворяли в 0.5 моль/л растворе соляной кислоты. Осадок, не растворившийся в кислоте, отделяли с помощью центрифугирования на скорости 10 000 об/мин. На следующем этапе pH раствора доводили до значения 5.4, добавляя по каплям 0.5 моль/л раствор гидроксида натрия. Готовый раствор хитозана при интенсивном перемешивании осаждали 0.05 моль/л раствором гидроксида натрия. Осадок центрифугировали, многократно промывали дистиллированной и деионизованной водой (финишное промывание) и лиофильно высушивали при остаточном давлении 12 Па.
Молекулярную массу хитозана после переосаждения определяли вискозиметрическим методом. Полимер растворяли в ацетатном буфере, состоящем из 0.3 моль/л уксусной кислоты и 0.2 моль/л ацетата натрия. Время истечения буфера и растворов полимера разной концентрации измеряли на вискозиметре Уббелоде с диаметром капилляра 0.54 мм. Средневязкостную молекулярную массу рассчитывали по уравнению Марка–Хаувинка при K = 0.074 и a = 0.76 [22]. Степень деацетилирования переосажденного хитозана находили методом линейного потенциометрического титрования по методике, подробно описанной в работе [23].
Получение полимерных губок поливом из растворов хитозана в уксусной кислоте
Переосажденный хитозан (100 мг) растворяли в водном растворе 0.2 моль/л уксусной кислоты (10 мл) при перемешивании в течение суток. Полученный раствор хитозана наливали в чашки Петри диаметром 5.6 см и замораживали при температуре –25°C в течение двух суток. Далее образцы лиофильно высушивали на установке “Alpha 1-2 LD” (“Christ”, Германия) при температуре –50°С и остаточном давлении 12 Па.
Получение полимерных губок поливом из растворов хитозана в угольной кислоте
В автоклав объемом 30 мл добавляли 10 мл деионизованной воды и 100 мг переосажденного хитозана. При температуре 25°С реактор заполняли СО2, создавая внутри давление 30 МПа. Содержимое реактора перемешивали на магнитной мешалке в течение семи суток при комнатной температуре. После этого проводили медленную декомпрессию автоклава со скоростью 0.5 МПа/мин. В результате описанной процедуры получали раствор хитозана в угольной кислоте. Полимерные губки готовили путем полива раствора в чашки Петри, замораживания и лиофильной сушки.
Получение хитозановых губок, сшитых генипином
Для приготовления хитозановой губки, сшитой генипином, в раствор хитозана в угольной кислоте при перемешивании по каплям добавляли 500 мкл 0.32 мас. % раствора генипина (1.6% от массы хитозана). Согласно данным работы [21], такое соотношение генипина и полимера, должно обеспечить максимальную прочность губок. Раствор оставляли перемешиваться на магнитной мешалке в течение 10 мин. Далее раствор выливали в чашки Петри, замораживали и высушивали лиофильно.
Методы исследования структуры хитозановых губок
ИК-спектры хитозановых губок получали на спектрометре “ThermoNicolet IS5 FT-IR” (“Nexus FT-IR”, США). Спектры регистрировали на приставке многократного нарушенного полного внутреннего отражения с использованием кристалла селенида цинка.
Морфологию поперечных сколов лиофильно высушенных хитозановых губок изучали методом низковольтной растровой электронной микроскопии на микроскопе “Scios” (“FEI”, США) при ускоряющем напряжении 1 кВ в режиме вторичных электронов. Образцы скалывали после замораживания в жидком азоте непосредственно перед съемкой. Исследовали поверхность скола, перпендикулярного плоскости образца. Долю пор на поверхности сколов и пористость оценивали по электронно-микроскопическим изображениям с помощью программы Image J.
Исследование механико-прочностных свойств хитозановых губок
Механико-прочностные свойства полимерных губок исследовали на анализаторе текстуры “TA.XT Рlus” (“Texture Technologies”, США). Для испытаний использовали образец губки длиной 40 мм, шириной 10 мм и толщиной 0.3 мм. Кривую напряжение–деформация определяли для трех образцов, и из полученных данных рассчитывали средние значения прочностных характеристик. Предел прочности губки на растяжение σ, т.е. максимальное напряжение, которое материал может выдержать при растяжении, оценивали из соотношения
где F – нагрузка в момент разрушения, S – площадь сечения губки.Относительное удлинение губки при разрыве ε устанавливали с помощью уравнения
Здесь ∆l – абсолютное удлинение образца перед разрывом, l – исходная длина образца.
Модуль Юнга E находили из соотношения
Пористость хитозановых губок
Пористость губок определяли путем заполнения свободного пространства губки 95% этиловым спиртом. Образец полимерной губки с известными геометрическими параметрами и массой погружали в виалу со спиртом. Через 5 минут образец вынимали из виалы, с помощью фильтровальной бумаги удаляли избыток этанола и взвешивали. Пористость φ рассчитывали по формуле
где mf – масса губки после экспозиции в спирте; mi – масса исходной губки; V – объем губки, рассчитанный из геометрических параметров образца; ρ – плотность 95% этилового спирта.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе работы коммерческий препарат хитозана был очищен с помощью переосаждения и охарактеризован. Молекулярная масса хитозана, определенная вискозиметрическим методом, составила 283 × 103. Согласно результатам потенциометрического титрования, степень деацетилирования, т.е. мольная доля D-глюкозоаминных звеньев равна 0.73 ± 0.04.
В результате растворения хитозана, последующего полива, замораживания раствора и лиофильного высушивания были получены полимерные губки (рис. 1; табл. 1). В качестве растворителей для хитозана выступали уксусная и угольная кислоты.
Рис. 1.
Схема получения хитозановых губок из раствора полимера в угольной кислоте. Цветные рисунки можно посмотреть в электронной версии.
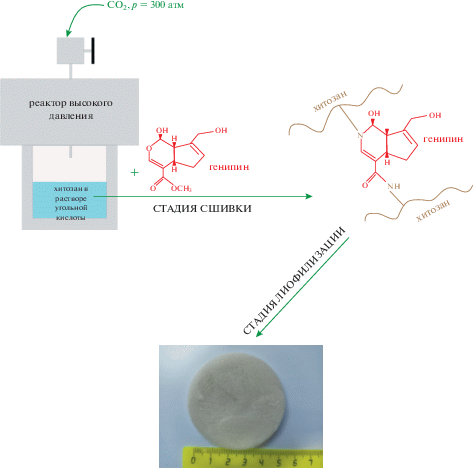
Таблица 1.
Образцы хитозановых губок, полученные в работе
| Шифр образца | Исходная система |
|---|---|
| ХТЗ_УК | раствор хитозана в 0.2 моль/л уксусной кислоте |
| ХТЗ+Ген_УК | раствор хитозана в 0.2 моль/л уксусной кислоте с добавлением генипина (1.6% от массы хитозана) |
| ХТЗ_УГ | раствор хитозана в угольной кислоте |
| ХТЗ+Ген_УГ | раствор хитозана в угольной кислоте с добавлением генипина (1.6% от массы хитозана) |
Для объекта медицинского назначения (например, для патча, используемого в качестве биосовместимой матрицы для внедрения биоактивных веществ через кожу, или для материала для тканевой инженерии) очень важна структурная стабильность, т.е. способность выдерживать различные механические воздействия, неизбежно возникающие при жизнедеятельности пациента. Чтобы исследовать механические свойства полимерных губок, для них были сняты деформационные кривые (рис. 2).
Рис. 2.
Кривые напряжения–деформации для хитозановых губок, полученных из растворов полимера в угольной и уксусной кислотах: 1 – ХТЗ_УГ, 2 – ХТЗ+Ген_УГ, 3 – ХТЗ_УК, 4 – ХТЗ+Ген_УК.
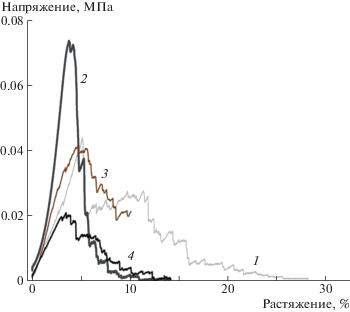
Обнаружено, что прочность при растяжении для губки, полученной из 1 мас. % раствора хитозана в уксусной кислоте (0.05 ± 0.01 МПа), совпадает с таковой для губки, приготовленной из раствора такой же концентрации в угольной кислоте (0.05 ± 0.02 МПа).
Полученные значения σ согласуются с имеющимися в литературе данными по пределу прочности хитозановых губок – 0.01–0.07 МПа [24–26]. Для повышения прочности хитозановых губок проводили сшивание полимера в растворе сшивающим агентом природного происхождения генипином.
Небольшая добавка генипина (1.6% от массы хитозана) в раствор хитозана в угольной кислоте дает возможность получать значительно более прочный и жесткий материал (возрастание величины предельного напряжения на Δσ = 40 ± 15%, снижение величины деформации разрыва на Δε = 150 ± 20%) с характерной для эластичных материалов кривой напряжение–деформация (рис. 2, табл. 3). Напротив, сшивка генипином хитозана в растворе уксусной кислоты при тех же условиях приводит к двукратному снижению прочности губки.
Методом ИК НПВО, позволяющим зондировать состав приповерхностного слоя образца, было доказано наличие генипина в хитозановой матрице, а также исследован характер взаимодействия макромолекул и сшивателя. Глубина проникновения падающего излучения составляет порядка нескольких микрон и позволяет анализировать состав вещества в объеме губок.
ИК-спектры хитозановых губок, полученных из растворов в угольной кислоте без сшивателя (ХТЗ_УГ) и с добавлением генипина (ХТЗ+Ген_УГ), показаны на рис. 3а. В спектрах губок присутствуют абсорбционные полосы, характерные для основной формы хитозана: 3350 см–1 – валентные колебания N–H и O–H, 1645 см–1 – деформационные колебания C=O (амид I), 1551 см–1 – деформационные колебания N–H (амид II), 1159 см–1 – валентные колебания С–О–С в гликозидной связи [27]. Уменьшение интенсивности полосы с волновым числом 1551 см–1, которая соответствует колебаниям N–H в аминогруппе, и сдвиг в область больших волновых чисел полосы амид I указывают на появление ковалентной связи между аминогруппой хитозана и олефиновым атомом углерода молекулы генипина с образованием гетероциклического амина [28]. На спектрах губок, полученных из растворов в уксусной кислоте, (ХТЗ_УК + Ген) отсутствуют пики и сдвиги, свидетельствующие об образовании ковалентной связи между аминогруппой хитозана и олефиновым атомом углерода молекулы генипина (рис. 3б).
Рис. 3.
ИК-спектры хитозановых губок, получаемых из угольной кислоты (а) и приготавливаемых из уксусной кислоты (б): 1 – губки без сшивателя, 2 – губки с добавления 1.6 мас. % генипина.
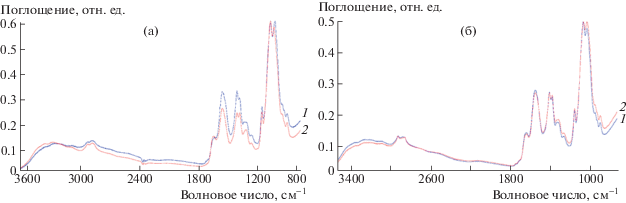
Такая разница в спектрах губок с генипином, приготовленных из растворов хитозана в угольной и уксусной кислотах, связана с различием в степени сшивания полимерных цепей молекулами генипина. Действительно, из литературы известно, что скорость и эффективность сшивания хитозановых гелей генипином зависит от рН раствора [29]. У раствора хитозана в уксусной кислоте рН составил 3.86 ± 0.05. В отличие от этого, рН раствора хитозана в угольной кислоте после сброса давления быстро увеличивается и в условиях данного эксперимента был равен 5.70 ± 0.05. С уменьшением кислотности среды возрастает доля свободных непротонированных аминогрупп, которые способны вступать в реакцию образования сшивок с молекулами генипина.
Существенную разницу в прочности губок, получаемых из растворителей двух типов, в частности аномальное двукратное снижение прочности при добавлении сшивателя в растворе уксусной кислоты, можно объяснить влиянием конформационных особенностей полимерных цепей в растворе, а также различием в плотности сшивания цепей генипином. Действительно, без сшивателя прочность губок примерно одинаковая и определяется физическими сшивками за счет взаимного переплетения макромолекул в растворе (рис. 4а). При добавлении генипина происходит образование химических сшивок – ковалентных меж- и внутримолекулярных связей между аминогруппами хитозана и генипином. Вследствие внутримолекулярного сшивания изменяется конформация макромолекул и образуются домены.
Рис. 4.
Конформации макромолекул хитозана в водном растворе без сшивателя (а), с генипином при низкой плотности сшивания (случай сшивания хитозана в уксусной кислоте) (б), с генипином при высокой плотности сшивания (случай сшивания хитозана в угольной кислоте) (в).
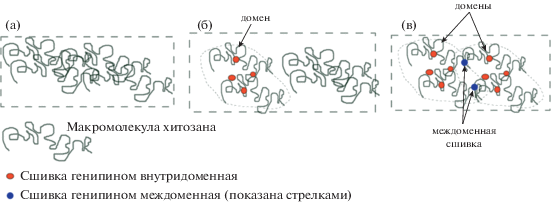
В растворе угольной кислоты, где реализуется высокая плотность сшивки полимерных цепей, междоменное связывание намного сильнее, чем в растворе уксусной кислоты (рис. 4б, 4в). В случае образования многочисленных междоменных сшивок, как это происходит в растворе угольной кислоты (рис. 4в), интегральное (общее) связывание всех макромолекул в системе выше, чем в растворе без сшивателя. Напротив, при добавлении генипина в раствор хитозана в уксусной кислоте интегральное связывание макромолекул в системе снижается (рис. 4б) вследствие уменьшения общего количества межмолекулярных сшивок. Действительно, в отсутствие сшивателя макромолекулы хитозана в растворе и при дальнейшем замораживании имеют равновесную конформацию (рис. 4а), количество физических сшивок при этом значительно выше, чем в случае слабой сшивки генипином, где домены с цепями с неравновесной (сжатой) конформацией слабо связаны между собой и свободными макромолекулами (рис. 4б).
Для анализа особенностей деформационного поведения полученных губок была исследована внутренняя микроструктура образцов. Электронно-микроскопические изображения поверхности поперечного скола лиофильно высушенных губок, полученных из растворов полимера в уксусной и угольной кислоте, представлены на рис. 5. Для микроструктуры хитозановой губки, приготовленной из раствора в уксусной кислоте, характерно наличие как крупных пор размерами до 100 мкм, так и пор с размерами порядка единиц мкм, что существенно отличается от микроструктуры губки, полученной из раствора в угольной кислоте (рис. 5б, 5д), в которой имеются поры гораздо большего размера (при сохранении мелких пор диаметром в несколько мкм). Средний размер пор в губке, приготовленной из раствора хитозана в угольной кислоте, составляет 67 ± 3 мкм, что почти в 3 раза превышает средний размер пор в губке, полученной из раствора в уксусной кислоте (табл. 2). При этом площадь пор на поверхности у губки ХТЗ_УГ в 2 раза выше, чем у губки ХТЗ_УК. Такая макропористая архитектура полимерной губки может быть особенно полезна для приложений тканевой инженерии [30]. Поры в объеме материала после сшивания губки генипином несколько уменьшаются, что косвенно свидетельствует о потере подвижности макромолекул вследствие химической сшивки, что проявляется также в небольшом снижении предельного растяжения губок (Δ = 10 ± 3%; табл. 3).
Рис. 5.
Электронно-микроскопические изображения поверхности сколов хитозановых губок, полученных из растворов полимера в угольной и уксусной кислотах: а – ХТЗ_УК, б – ХТЗ+Ген_УК, в – ХТЗ_УГ, г – ХТЗ+Ген_УГ.

Таблица 2.
Средний размер пор и доля площади пор на поверхности поперечных сколов полимерных губок
| Образец | Средний размер пор, мкм | Доля пор на поверхности скола площадью 3 мм2, % |
|---|---|---|
| ХТЗ_УК | 25 ± 1 | 4.5 ± 0.3 |
| ХТЗ+Ген_УК | 20 ± 1 | 4.1 ± 0.3 |
| ХТЗ_УГ | 67 ± 3 | 9.4 ± 0.3 |
| ХТЗ+Ген_УГ | 25 ± 1 | 5.0 ± 0.3 |
Таблица 3.
Механико-прочностные характеристики и пористость хитозановых губок, полученных лиофильной сушкой растворов полимера в угольной и уксусной кислоте
| Образец | σ, МПа | Деформация при начале разрыва, % | Деформация при окончании разрыва, % | ϕ, % | E, МПа |
|---|---|---|---|---|---|
| ХТЗ_УК | 0.05 ± 0.02 | 4.5 ± 0.5 | 15 ± 1 | 78 ± 5 | 1.2 ± 0.4 |
| ХТЗ+Ген_УК | 0.021 ± 0.001 | 3.7 ± 0.4 | 19 ± 2 | 80 ± 5 | 0.6 ± 0.1 |
| ХТЗ_УГ | 0.05 ± 0.01 | 5.0 ± 1.0 | 15 ± 5 | 85 ± 5 | 1.0 ± 0.1 |
| ХТЗ+Ген_УГ | 0.07 ± 0.01 | 4.5 ± 1.0 | 8 ± 4 | 85 ± 5 | 2.5 ± 0.2 |
На рис. 5 видно, что микроструктура хитозановой губки, полученной из раствора в угольной кислоте и сшитой генипином, близка к структуре хитозановой губки, сшитой генипином, но приготовленной из раствора в уксусной кислоте при нормальных атмосферных условиях. Таким образом, сшивая генипином губку, полученную из раствора хитозана в угольной кислоте, можно добиться стандартного распределения пор по размерам, для которого доказана эффективность при загрузке и пролонгированной доставке лекарственных средств (известно, что хитозановые губки, полученные из растворов в уксусной кислоте, с успехом применяются при доставке лекарственных средств благодаря наличию развитой пористой микроструктуры [31]). При этом губки, полученные из растворов в воде, насыщенной СО2 под высоким давлением, обладают неоспоримыми преимуществами: применяемый растворитель абсолютно биосовместим, экологичен и не требует пост-обработки в виде, например, нейтрализации кислоты, использующейся при создании материала.
ЗАКЛЮЧЕНИЕ
В работе впервые показано, что хитозановые губки с хорошими механико-прочностными свойствами можно получать из растворов полимера в биосовместимом, самонейтрализующемся растворителе – угольной кислоте. Проведено сравнительное исследование морфологии и механико-прочностных характеристик губок, полученных из раствора в угольной кислоте и в традиционном для хитозана растворителе – уксусной кислоте. Показано, что для губок хитозана, приготовленных из раствора полимера в угольной кислоте, характерно наличие крупных пор с размерами до 300 мкм, что вдвое больше, чем для губок, полученных из уксусной кислоты. Обнаружено, что сшивание губок генипином приводит к уменьшению среднего размера пор для обеих губок, при этом для губки, полученной из угольной кислоты, средний размер пор уменьшается в 2.5 раза. Продемонстрировано, что механико-прочностные характеристики у полимерных губок, полученных из растворов в угольной кислоте и дополнительно сшитых генипином, значительно лучше, чем у традиционных композитов, приготовленных из растворов в уксусной кислоте при нормальном атмосферном давлении. В частности, их модуль Юнга в 2–4 раза выше. Такие механико-прочностные характеристики позволят применять новые пористые хитозановые материалы даже при сложных условиях эксплуатации, например, в качестве составной части патча с биоактивными веществами на коже человека.
Работа выполнена при поддержке Российского научного фонда (грант № 20-73-10180). Полученные материалы были охарактеризованы при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования ИНЭОС РАН (ИК НПВО спектроскопия), СЭМ-исследования осуществлены при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию с использованием оборудования ЦКП ФНИЦ “Кристаллография и фотоника” РАН (проект RFMEFI62119X0035).
Список литературы
Dash M., Chiellini F., Ottenbrite R.M., Chiellini E. // Prog. Polym. Sci. 2011. V. 36. P. 981.
Wei S., Ching Y.C., Chuah C.H. // Carbohydr. Polym. 2020. V. 231. P. 115744.
Shariatinia Z., Azam Barzegari A. // Polysaccharide Carriers for Drug Delivery, Sawston. Cambridge: Woodhead Publ., 2019.
Bakshi P.S., Selvakumar D., Kadirvelu K., Kumar N.S. // Int. J. Biol. Macromol. 2020. V. 150. P. 1072.
Pallela R., Venkatesan J., Janapala V.R., Kim S.K. // J. Biomed. Mater. Res. 2012. V. 100. № 2. P. 486.
Pigaleva M.A., Portnov I.V., Rudov A.A., Blagodatskikh I.V., Grigoriev T.E., Gallyamov M.O., Potemkin I.I. // Macromolecules. 2014. V. 47. P. 5749.
Toews K.L., Shroll R.M., Wai C.M., Smart N.G. // Anal. Chem. 1995. V. 67. P. 4040.
Garcia-Gonzalez L., Geeraerd A.H., Spilimbergo S., Elst K., Van Ginneken L., Debevere J., Van Impe J.F., Devlieghere F. // Int. J. Food Microbiol. 2007. V. 117. № 1. P. 1.
Ornoff D.M., Wang Y., Proctor A., Shah A.S., Allbritton N.L. // Biomaterials. 2016. V. 74. P. 77.
Xu L., Huang Y.-A., Zhu Q.-J., Ye C. // Int. J. Mol. Sci. 2015. V. 16. № 8. P. 18328.
Ghosh P., Rameshbabu A.P., Das D., Francis N.K., Pawar H.S., Subramanian B., Pal S., Dhara S. // Colloids Surf. B. 2015. V. 125. P. 160.
Shu X., Zhu K. // Int. J. Pharm. 2002. V. 233. № 1–2. P. 217.
Lai J.Y., Li Y.T., Wang T.P. // Int. J. Mol. Sci. 2010. V. 11. P. 5256.
Gallyamov M.O., Chaschin I.S., Khokhlova M.A., Grigorev T.E., Bakuleva N.P., Lyutova I.G., Kondratenko J.E., Badun G.A., Chernysheva M.G., Khokhlov A.R. // Mater. Sci. Engineer. C. 2014. V. 37. P. 127.
Fujikawa S., Fukui Y., Koga K., Iwashita T., Komura H., Nomoto K. // Tetrahedron Lett. 1987. V. 28. P. 1.
Dimida S., Demitri C., De Benedictis V.M., Scalera F., Gervaso F., Sannino A. // J. Appl. Polym. Sci. 2015. V. 132. № 28. Article ID 42256.
Muzzarelli R.A.A. // Carbohydr. Polym. 2009. V. 77. № 1. P. 2009.
Chiono V., Pulieri E., Vozzi G., Ciardelli G., Ahluwalia A., Giusti P. // J. Mater. Sci., Mater. Med. 2008. V. 19. P. 889.
Subrata Deb Nath S.D., Abueva C., Kima B., Lee B.T. // Carbohydr. Polym. 2015. V. 115. P. 160.
Gorczyca G., Tylingo R., Szweda P., Augustin E., Sadowska M., Milewski S. // Carbohydr. Polym. 2014. V. 102. P. 901.
Kildeeva N., Chalykh A., Belokon M., Petrova T., Matveev V., Svidchenko E., Surin N., Sazhnev N. // Polymers. 2020. V. 12. P. 1.
Rinaudo M., Milas M., Le Dung P. // Int. J. Biol. Macromol. 1993. V. 15. P. 281.
Tan S.C., Khor E., Tan T.K., Wong S.M. // Talanta. 1998. V. 45. P. 713.
Madihally S.V., Matthew H.W.T. // Biomaterials. 1999. V. 20. № 12. P. 1133.
Suh J.K.F., Matthew H.W.T. // Biomaterials. 2000. V. 21. № 24. P. 2589.
Ikeda T., Ikeda K., Yamamoto K., Ishizaki H., Yoshizawa Y., Yanagiguchi K., Yamada S., Hayashi Y. // Biomed. Res. Int. 2014. Article ID 786892.
Van de Velde K., Kiekens P. // Carbohydr. Polym. 2004. V. 58. P. 409.
Butler M.F., Ng Y.-F., Pudney P.D.A. // J. Polym. Sci., Polym. Chem. 2003. V. 41. P. 3941.
Delmara K., Bianco-Peled H. // Carbohydr. Polym. 2015. V. 127. P. 28.
Griffon D.J., Sedighi M.R., Schaeffer D.V., Eurell J.A., Johnson A.L. // Acta Biomaterialia. 2006. V. 2. № 3. P. 313.
Anitha A., Sowmya S., Sudheesh Kumar P.T., Deepthi S., Chennazhi K.P., Ehrlich H., Tsurkan M., Jayakumar R. // Progr. Polym. Sci. 2014. V. 39. P. 1644.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


