Высокомолекулярные соединения (серия А), 2021, T. 63, № 6, стр. 430-442
НОВЫЕ БИОРАЗЛАГАЕМЫЕ АБСОРБЕНТЫ НА ОСНОВЕ ПОЛИЛАКТИДА, ПОЛИ(3-ГИДРОКСИБУТИРАТА) И ХИТОЗАНА ДЛЯ СОРБЦИИ ИОНОВ ЖЕЛЕЗА И ХРОМА
С. З. Роговина a, *, Л. А. Жорина a, А. Л. Иорданский a, Э. В. Прут a, А. Р. Яхина a, А. В. Грачев a, А. В. Шапагин b, О. П. Кузнецова a, А. А. Берлин a
a Федеральный исследовательский центр химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
b Институт физической химии и электрохимии им. А.Н. Фрумкина Российской академии наук
119071 Москва, Ленинский пр., 31, Россия
* E-mail: s.rogovina@mail.ru
Поступила в редакцию 15.03.2021
После доработки 05.07.2021
Принята к публикации 19.07.2021
Аннотация
Получены пленочные биоразлагаемые тройные композиции полилактида и поли(3-гидроксибутирата) с хитозаном различного состава. Исследованы термические свойства и абсорбционная способность композиций по отношению к ионам железа и хрома. Показано, что сорбционная активность зависит как от соотношения компонентов в композициях, так и от природы ионов металлов и их концентрации в растворе. С использованием модели Ленгмюра рассчитаны кинетические и сорбционные характеристики процесса. При изучении морфологической структуры композиций, содержащих абсорбированные ионы металлов, методом сканирующей электронной микроскопии обнаружено значительное изменение их поверхности, а также появление новой фазы в виде дисперсных частиц, форма и распределение которых зависят от природы металла.
ВВЕДЕНИЕ
Очистка водной среды от промышленных отходов – важная экологическая проблема, успешное решение которой связано как с необходимостью больших финансовых вложений, так и с поиском эффективных методов осуществления процесса.
Среди прочих загрязнений ионы тяжелых металлов, в том числе железа и хрома, будучи токсичными, занимают особое место, неся угрозу человеческому организму [1].
Железо и его химические соединения являются одними из наиболее распространенных веществ земной коры. При попадании в искусственные и природные водоемы в виде промышленных отходов ионы железа резко ухудшают экологию водных ресурсов. Нерастворимые оксиды, сульфаты и сульфиты железа, накапливаясь в организмах водных обитателей, оказывают негативное воздействие на их жизнедеятельность [2]. В этой связи, в Евросоюзе установлены нормы на предельное общее содержание железа, не превышающее 1.0–1.5 мг/л, а для его растворимых форм этот предел еще ниже и составляет 0.10–0.35 мг/л [3].
Cоединения хрома представляют серьезную опасность для здоровья человека, поражая, главным образом, печень, легкие и желудок [4]. Учитывая высокую токсичность ионов хрома для питьевой воды, европейские и североамериканские нормативы строго регламентируют общее содержание в ней Cr (3+) и Cr (6+). Так, например, Всемирная Организация Здравоохранения (ВОЗ) ограничивает верхний предел концентрации этих ионов величиной 5 × 10–2 [5], тогда как в США, cогласно разработанным американским Агентством по охране окружающей среды критериям, эта величина несколько выше и составляет 0.1 мг/л [6]. Значительно более высокие значения концентрации хрома содержатся в сточных водах после попадания в них отходов электронной промышленности, где применяется хром, а также при производстве различных изделий с его использованием, например при дублении кожи. Разработка эффективных методов удаления хрома из водных сред является важной задачей.
Существует ряд традиционных методов очистки воды, таких как осаждение, флокуляция, ионный обмен, разделение с помощью мембран, однако они малоэффективны и в настоящее время активно замещаются абсорбционными технологиями, где в качестве абсорбентов используются неорганические частицы, а также полимерные селективные мембраны и волокна.
Абсорбция считается наиболее эффективным и распространенным способом удаления металлов из сточных вод, о чем свидетельствует большое количество работ, посвященных этой проблеме. Преимуществами данной технологии являются низкий расход энергии, высокая производительность и относительно невысокая цена. При этом возникает проблема выбора эффективного селективного абсорбента, отвечающего этим требованиям. Такими абсорбентами могут быть активированный уголь, обладающий хорошо развитой поверхностью, неорганические частицы различной природы, некоторые магнитные нанокомпозиционные материалы, продемонстрировавшие высокую абсорбционную способность, а также полимерные селективные мембраны и волокна. Среди многочисленных абсорбентов особый интерес представляет природный полисахарид хитозан, получаемый путем дезацетирования полисахарида хитина, содержащегося в панцирях ракообразных. Благодаря наличию функциональных аминогрупп, хитозан помимо прочих многочисленных областей применения также хорошо зарекомендовал себя в качестве селективного абсорбента ионов металлов из сточных вод. Хорошо известна его способность образовывать комплексы и хелаты с поливалентными тяжелыми металлами, включая железо [7] и хром [8], что позволяет успешно применять хитозан для удаления токсичных веществ из водной среды. Однако серьезным недостатком хитозана как экологически безопасного абсорбента считается его значительное набухание в водных средах и, как следствие, невысокие механические характеристики.
В этой связи, целесообразным представляется использование хитозана в составе композиций, компоненты которых обладают хорошими механическими характеристиками наряду со способностью к биоразложению. Таким требованиям, в частности, соответствуют получаемые из природного сырья полиэфиры – полилактид (ПЛА) и поли(3-гидроксибутират) (ПГБ), композиции которых были изучены в работе [9]. ПЛА является продуктом полимеризации молочной кислоты, образующейся при брожении сельскохозяйственных отходов, в то время как ПГБ синтезируется микробиологическим путем. Несмотря на свое природное происхождение, ПЛА активно деструктирует лишь в активных средах (компост, морская вода) [10], он относительно дешевый, в то время как стоимость полностью биоразлагаемого ПГБ достаточно высокая. Присутствие ПГБ улучшает биоразлагемость композиций, в то время как наличие ПЛА позволяет их удешевить. Ранее в работе [11] была продемонстрирована возможность использования таких композиций в качестве биоразлагаемых сорбентов нефти из сточных вод.
Двойные композиции хитозана с ПЛА и ПГБ для разделительных мембран были исследованы в работах [12, 13]. В таких композициях полиэфиры выполняли армирующую функцию, улучшая механические характеристики мембран, и регулировали их гидрофильно-гидрофобный баланс, определяющий интенсивность и механизм набухания и диффузии. Подробно композиции ПЛА с хитозаном описаны также в работах [14, 15].
Использование биоразлагаемых полимерных композиций в качестве инновационных абсорбентов является в настоящее время активно развивающимся направлением работ, проводимых в этой области [16]. Комбинация ПЛА и ПГБ с хитозаном позволяет создавать новые недорогие биоразлагаемые композиции, устойчивые в водных средах с хорошими механическими параметрами и обладающие сорбционной способностью по отношению к ионам металлов, которые могут быть утилизированы после окончания срока эксплуатации.
Цель настоящей работы – получение и изучение термических и сорбционных свойств биоразлагаемых тройных композиций на основе биополиэфиров ПЛА, ПГБ и хитозана, предназначенных для абсорбции ионов железа и хрома из сточных вод и способных разлагаться после окончания срока эксплуатации под действием окружающей среды на безвредные для природы вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования выступали полилактид марки “4034D” производства “Nature Works”, США (Mw = 2.2 × 105, Тпл = 155°С, прозрачность 2.1%); ПГБ производства “Biomer”, Германия (Мw = 2.05 × 105, Тпл = 175°С); хитозан производства “Биопрогресс”, Россия (M = 4.4 × 105, степень дезацетилирования 0.87); безводный хлорид железа (“Fluka Chemie”, Швейцария); хром сернокислый водный квалификации ч.д.а. (“ХимПэк”, Россия).
Пленки готовили путем смешивания растворов ПЛА и ПГБ в хлороформе. В полученный раствор при механическом перемешивании вводили хитозан в виде порошка. Сформированные пленки, толщина которых составляла 0.2–0.3 мм, высушивали при комнатной температуре. Пленки, помещали в водные растворы солей металлов различной концентрации и выдерживали в растворах в течение определенного времени, после чего их высушивали при температуре 50–60°С.
Теплофизические характеристики исходных полимеров и их смесей исследовали методом ДСК и ТГА на дифференциально сканирующем калориметре “Netzch”, модель “DSC-F1” (Германия) при скорости нагревания 10 град/мин в диапазоне температуры 40–250°С. Навески образцов составляли ~10 мг. Точность измерения температуры 0.1°С.
Процентное содержание сорбированных ионов железа и хрома в пленочных композициях определяли методом рентгено-флуоресцентного анализа на рентгено-флуоресцентном волнодисперсионном спектрометре “ARL PERFORM’X X-ray Fluorescene Spectrometer” (“Thermo Fisher Scientific”, США). Регистрацию спектров и все дальнейшие манипуляции с ними проводили с помощью метода “SIALMO.UQ”.
Морфологию поверхности тройных композиционных пленок ПГБ–ПЛА–хитозан до и после абсорбции ионов железа и хрома исследовали методом сканирующей электронной микроскопии (СЭМ) с использованием сканирующего электронного микроскопа “Philips SEM-500” (Нидерланды) во вторичных электронах при ускоряющем напряжении 15 кэВ. Подготовка образцов заключалась в термонапылении в вакууме углерода на поверхность пленок с использованием вакуумного универсального поста “ВУП-5” (Россия). Для получения сплошного токопроводящего углеродного покрытия образцы в процессе термораспыления вращали в одной плоскости.
Информацию об элементном составе исследуемых образцов получали методом рентгеноспектрального микроанализа (РСМА) с использованием рентгеновского спектрометра с дисперсией по энергии “Eumex” (Германия) при ускоряющем напряжении 15 кэВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Tермическое поведение ПГБ, ПЛА, хитозана и их композиций различного состава было изучено методами ДСК и ТГА (рис. 1–4; табл. 1). На рис. 1 и 2 представлены ДСК-кривые исходных полимеров и их композиций в температурном интервале 40–250°С, а на рис. 3 и 4 полученные ТГА соответствующие кривые потери массы в температурном интервале 40–600°С.
Рис. 1.
ДСК-кривые хитозана (1), ПЛА (2), ПГБ (3) и композиции ПЛА–ПГБ–хитозан c соотношением компонентов 70 : 20 : 10 мас. % (4).
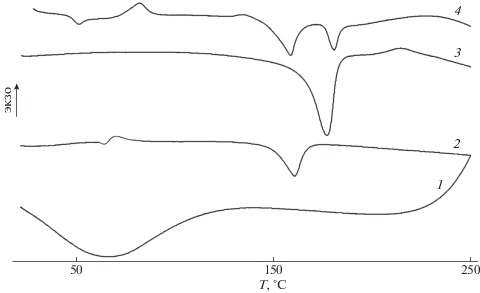
Рис. 2.
ДСК-кривые композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. % (1) и той же композиции, содержащей сорбированные ионы железа (2) и хрома (3).
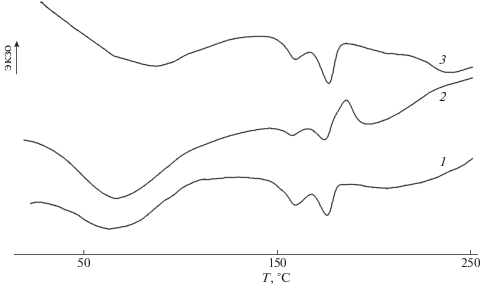
Рис. 3.
ТГА-кривые хитозана (1), ПЛА (2), ПГБ (3) и композиции ПЛА–ПГБ–хитозан c соотношением компонентов 70 : 20 : 10 мас. % (4).
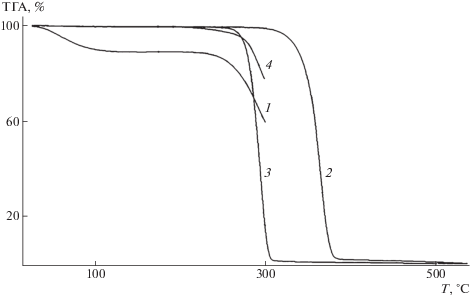
Рис. 4.
ТГА-кривые композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. % (1) и этой же композиции, содержащей сорбированные ионы железа (2) и хрома (3).
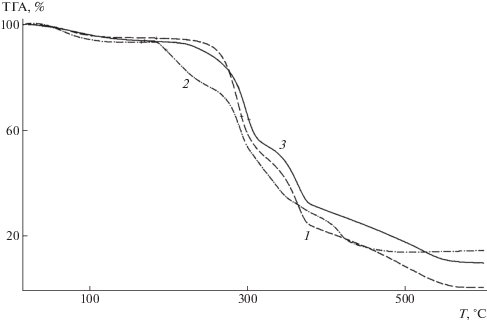
Таблица 1.
Термические характеристики хитозана, ПЛА, ПГБ и их композиций различного состава
| Состав композиций, мас. % | Пик выделения воды, °С | Тс, °С ПЛА | Тх.к, °С ПЛА | Тпл, °С | ПЛА/ПГБ | Т0, °С | ||
|---|---|---|---|---|---|---|---|---|
| ПЛА | ПГБ | ΔНпл, Дж/г | χ, % | |||||
| Хитозан | 67.0 | − | − | − | − | − | − | 261 |
| ПЛА | − | 66 | 75.0 | 161 | − | 28 | 30 | 346 |
| ПГБ | − | − | − | 177 | 80 | 55 | 280 | |
| ПЛА–ПГБ–хитозан (70 : 20 : 10) | 54.0 | − | 82.5 | 159 | 181 | 41/11 | 62/38 | 270 |
| ПЛА–ПГБ–хитозан (25 : 25 : 50) | 63.0 | − | − | 159 | 176 | 6/7 | 25/19 | 268 |
| ПЛА–ПГБ–хитозан (25 : 25 : 50) + Fe(3+) | 66.5 | − | − | 158 | 174 | 3/11 | 12/30 | 186 |
| ПЛА–ПГБ–хитозан (25 : 25 : 50) + Cr(3+) | 87.0 | – | – | 159 | 177 | 3/8 | 12/22 | 273 |
Как видно на рис. 1, на ДСК-кривых исследуемых полимеров присутствуют несколько пиков, определяемых их температурными переходами. У хитозана (кривая 1) наблюдается широкий эндотермический пик с максимумом при 67°С, связанный с разрушением водородных связей, образованных молекулами воды и функциональными группами хитозана, при десорбции воды в процессе нагревания.
На ДСК-кривой ПЛА (кривая 2) наблюдаются три термических перехода. Пик при 66°С обусловлен релаксационным переходом из стеклообразного в высокоэластичное состояние, экзотермический максимум в области 75.4°С соответствует холодной кристаллизации Тх.к и пик при 161°С – температуре плавления, при этом удельная энтальпия плавления ∆H, определяемая из площади пика, равняется 28 Дж/г (табл. 1).
У хорошо кристаллизующегося ПГБ на ДСК-кривой (кривая 3) присутствует лишь один эндотермический пик плавления при 177°С, а соответствующая удельная теплота плавления составляет 80 Дж/г (кривая 2), что выше, чем у ПЛА.
Из рассмотрения ДСК-кривой тройной композиции ПЛА–ПГБ–хитозан с соотношением компонентов (70 : 20 : 10 мас. %) (кривая 4) видно, что в результате существующего различия в значениях температуры плавления ПЛА и ПГБ их высокотемпературные эндотермические максимумы хорошо разделены. Для этой композиции наблюдаются все описанные выше термические переходы за исключением перехода при температуре стеклования Тс и некоторые изменения температурных значений. Так, у пика выделения воды из хитозана максимум смещается на 13°С, а холодная кристаллизация ПЛА протекает при более высокой температуре (82.5°С) по сравнению с исходным ПЛА (75.4°С).
На рис. 2 представлены термические переходы полимеров в исходной тройной композиции с преобладающим содержанием хитозана и одинаковым содержанием ПЛА и ПГБ (ПЛА : ПГБ : хитозан = 25 : 25 : 50, мас. %) (кривая 1) и этой же композиции, содержащей абсорбированные ионы железа (кривая 2) и хрома (кривая 3). Видно, что у тройной композиции ПЛА–ПГБ–хитозан с указанным соотношением компонентов максимумы эндотерм плавления по сравнению с исходными полиэфирами практически не смещены, однако пик холодной кристаллизации ПЛА, в отличие от композиции ПЛА–ПГБ–хитозан с соотношением компонентов 70 : 20 : 10 (мас. %) отсутствует. По-видимому, для композиции с соотношением компонентов 25 : 25 : 50 (мас. %), 50%-ное содержание хитозана препятствует холодной кристаллизации ПЛА, или же пик холодной кристаллизации ПЛА перекрывается широким эндотермическим пиком хитозана.
Сравнение ДСК-кривых тройных композиций ПЛА–ПГБ–хитозан различного состава (рис. 1, кривая 4 и рис. 2, кривая 1) показывает, что наиболее заметные изменения термических переходов наблюдаются, когда концентрация ПЛА в смеси максимальна. В этом случае происходит также значительное возрастание степени кристалличности ПЛА, как полиэфира с более низкой температурой кристаллизации, чем ПГБ, за счет того, что 10%-ное содержание хитозана не мешает процессу кристаллизации. При 50% содержании хитозана в композиции процесс кристаллизации затруднен, вследствие чего происходит снижение кристалличности обоих полиэфиров (табл. 1).
При рассмотрении кривых ДСК композиций, содержащих абсорбированные ионы железа и хрома, отчетливо видно изменение формы пика хитозана, что, очевидно, связано с сорбцией функциональными группами хитозана ионов железа и хрома. Действительно, если в тройных композициях, в отсутствие ионов металлов форма характеристического пика определяется количеством связанной воды, то в присутствие ионов металлов в результате их сорбции функциональными группами хитозана, по-видимому, устанавливается равновесие между сорбированной водой и ионами металлов, влияющими на конечную форму пика хитозана.
Важно отметить, что при этом одновременно происходит значительное снижение кристалличности обоих полиэфиров ПЛА и ПГБ (табл. 1), т.е., по-видимому, присутствие ионов железа и хрома в растворе затрудняет процесс кристаллизации полиэфиров.
Таким образом, композиции, содержащие абсорбированные ионы металлов, менее кристалличны, чем исходные, что облегчает последующую сорбцию.
Начальная температура разложения Т0 исходных полимеров и их композиций на кривых потери массы, полученных методом ТГА (рис. 3, 4), была определена по пересечению касательных к этим кривым.
Из данных ТГА (рис. 3) видно, что в температурной области до 200°С у полиэфиров ПГБ и ПЛА потери массы не наблюдается, и следовательно, при этих значениях температуры они являются термостабильными полимерами. Однако для хитозана в температурном интервале 50–75°С происходит ~11% потеря массы относительно исходного образца. Более отчетливо данный переход виден на кривой ДСК (рис. 1, кривая 1), где он присутствует в виде широкого эндотермического пика с максимумом при 67°С.
Совокупность данных, представленных методами ТГА и ДСК при исследовании термического поведения хитозана, позволяет предположить, что указанные переходы связаны с перераспределением водородных связей и испарением воды из образца. Являясь гидрофильным полимером, полисахарид хитозан имеет высокое сродство к молекулам воды и прочно удерживает их путем образования системы водородных связей с участием групп –OH и –NH2. В процессе нагревания образца водородные связи разрушаются, и происходит выделение воды с соответствующей потерей массы и изменением энтальпии полимерной системы в результате отрицательного вклада энтальпии испарения. Ширина и положение максимума определяются соотношением групп –ОН и –NH2 в хитозане, т.е. зависят от степени дезацетилирования.
Значения температуры разложения хитозана, ПГБ и ПЛА составляют 261, 280 и 346°С соответственно (рис. 3). Начальная температура разложения композиции ПЛА–ПГБ–хитозан (70 : 20 : 10, мас. %) равняется ⁓273°С, т.е. ниже, чем температура разложения ПГБ и ПЛА. Аналогичный эффект прослеживается и для композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : : 25 : 50 (мас. %), начальная температура разложения которой составляет ⁓268°С, т.е. в композициях с большим содержанием хитозана изменение начальной температуры разложения проявляется более заметно.
Как видно на рис. 4, присутствие абсорбированных ионов железа в отличие от ионов хрома приводит к дополнительному снижению начальных значений температуры разложения композиций, что, по-видимому, объясняется различным влиянием этих металлов на протекание процессов термодеструкции.
В табл. 1 приведены определенные из кривых ДСК и ТГА, а также рассчитанные теплофизические характеристики исходных полимеров и в композициях, где Тс – температура стеклования; Тх.к – температура холодной кристаллизации (°С); Тпл – температура плавления (°С); ΔНпл – энтальпия плавления; χ – степень кристалличности; Т0 – температура начала разложения. Также представлены характеристики композиций, содержащих абсорбированные ионы Fe(3+) и Cr(3+) из 0.3 моль/л растворов FeCl3 и Cr2(SO4)3 соответственно.
Степень кристалличности ПЛА и ПГБ была вычислена по известной формуле [17]:
(1)
${{\chi }} = \frac{{{{\Delta }}{{H}_{{{\text{пл}}}}}}}{{{{\Delta }}H_{{{\text{пл}}}}^{0}}} \times 100\% ,$Кристалличность ПЛА в смесях рассчитывали по формуле
(2)
${{\chi }} = \frac{{{{\Delta }}{{H}_{{{\text{ПЛА}}}}} - {{\Delta }}{{H}_{{{\text{х}}{\text{.к}}}}}}}{{{{W}_{{{\text{ПЛА}}}}}~\Delta H_{{{\text{пл}}}}^{0}}} \times 100\% $Здесь WПЛА – массовая доля ПЛА в смеси.
Степень кристалличности ПГБ в композициях была рассчитана согласно формуле:
(3)
${{\chi }} = \frac{{{{\Delta }}{{H}_{{{\text{пл}}}}}}}{{{{W}_{{{\text{ПГБ}}}}}~\Delta H_{{{\text{пл}}}}^{0}}} \times 100\% ,$Анализ приведенных на рис. 1–4 и в табл. 1 данных ДСК и ТГА подтверждает полученные ранее результаты, кратко представленные в работе [20].
Поиск эффективных абсорбентов для извлечения металлов из сточных вод требует тщательного изучения равновесных изотерм абсорбции. Существует большое число моделей, используемых для анализа изотерм абсорбции природными абсорбентами – полипептидами, коллагеном, хитозаном и другими. Эти модели могут быть подразделены на двухпараметрические модели типа Ленгмюра, Фрейндлиха, Дубинина–Радушкевича, Темкина и трех-параметрические модели, такие как модели Редлиха–Петерсона, Сипса, Тота, основанные на наличии одного центра абсорбции. Третья группа моделей, описывающая многоцентровую абсорбцию, основывается на мультипараметрических моделях: Бранауэр–Эмметт–Теллера, Френкеля–Халси–Хилла и Макмиллана–Теллера. Для всех этих моделей характерна простота математической обработки уравнений, описывающих абсорбционные процессы и однозначном представлении о природе абсорбционных центров.
В общем случае многостадийный механизм абсорбции ионов включает в себя их транспорт к поверхности абсорбента во внешней диффузионной области, последующую диффузию в объем полимерной системы и непосредственно физико-химическое взаимодействие ионов с функциональными группами полимера [21, 22].
Для неорганических и органических молекул большого диаметра вклад внешней диффузии может быть достаточно значителен, тогда как для ионов металлов малого диаметра в условиях интенсивного перемешивания диффузией во внешнем растворе и частично в объеме полимерного набухающего абсорбента можно пренебречь. Более надежно определить соотношение диффузии и кинетики абсорбции возможно, анализируя зависимости концентрации поглощенного полимером вещества от времени абсорбции (t). В случае преобладания диффузионных процессов эти зависимости описываются соотношением CМе(t) ~ t 0.5, где CМе – концентрация абсорбированных ионов, зависящая от времени. В том случае, когда скорость извлечения ионов из водной среды определяется кинетикой их взаимодействия с функциональными группами полимера, т.е. собственно абсорбцией, характер кинетических кривых поглощения ионов металлов полимером меняется и часто приближенно описывается дифференциальным уравнением первого порядка [23]:
Здесь C∞ – предельное значение абсорбции ионов при t → ∞, т.е. при достижении максимального равновесия; ka – константа скорости абсорбции, и dCМе/dt – производная концентрации по времени, которая соответствует скорости накопления абсорбированных ионов в полимере.
Решение уравнения (4) при начальном условии, когда t = 0, CМе= 0, позволяет легко перейти к его более удобному для обработки результатов логарифмическому виду:
На рис. 5 приведены кинетические кривые абсорбции ионов Fe(3+) из 1 × 10–2 моль/л и 5 × 10–3 моль/л растворов FeCl3 и Cr(3+) из 1 × × 10–2 моль/л раствора Cr2(SO4)3 пленочной композицией ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 (мас. %). Концентрация абсорбированных ионов в пленках (СМе) была определена методом ренгено-флуоресцентного анализа. Видно, что абсорбция ионов монотонно возрастает до предельных значений, при этом для ионов Fe(3+) максимальная величина абсорбции зависит от их содержания в растворе (1 × 10–2 и 5 × 10–3 моль/л) и возрастает с увеличением концентрации соли. Полученные результаты хорошо аппроксимируются полулогарифмической анаморфозой в координатах уравнения (5) (рис. 6).
Рис. 5.
Кинетические кривые абсорбции ионов Fe(3+) и Cr(3+) композицией ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. %. Концентрация солей Cr2(SO4)3 (1) и FeCl3 (2, 3) в водных растворах 1 × 10–2 (1, 2) и 5 × 10–3 моль/л (3) соответственно.
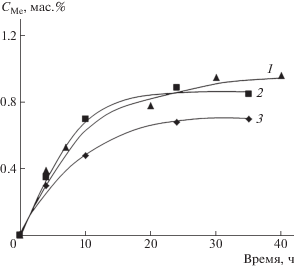
Рис. 6.
Кинетические кривые абсорбции ионов Fe(3+) и Сr(3+) в полулогарифмических координатах уравнения (5) первого порядка. Концентрация солей Cr2(SO4)3 (1) и FeCl3 (2, 3) в водных растворах 1 × 10–2 (1, 2) и 5 × 10–3 моль/л (3) соответственно.
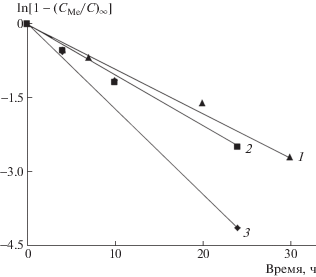
Результаты расчета параметров уравнения (5) по специальной программе линейной аппроксимации экспериментальных точек “Origin 2018” представлены в табл. 2. Приведенный в таблице коэффициент корреляции R2 линейной регрессии уравнения (5) имеет высокие значения, что подтверждает хорошее соответствие между кинетической моделью и экспериментальными данными. Слабая зависимость предельных величин абсорбции от времени, вероятно, объясняется высокой степенью их гидратации.
Таблица 2.
Кинетические характеристики абсорбции ионов Fe(3+) и Сr(3+) композицией ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 (мас. %)
| Концентрация ионов в растворе, моль/л | C∞, мас. % | ka × 103, ч–1 | R2 |
|---|---|---|---|
| 1 × 10–2 Cr(3+) | 0.98 | 2.97 ± 0.25 | 0.948 |
| 1 × 10–2 Fe(3+) | 1.0 | 3.20 ± 0.47 | 0.960 |
| 5 × 10–3 Fe(3+) | 0.71 | 6.08 ± 0.39 | 0.993 |
Как видно из приведенных в табл. 2 данных, равновесная концентрация C∞ и константа скорости абсорбции ka определяются природой иона и его концентрацией в растворе. В динамических условиях абсорбционного процесса скорость образования комплекса “ион металла–полимер” зависит как от степени гидратации иона, так и от его электронного строения. Поэтому константа скорости абсорбции ka ионов хрома ниже, чем ионов железа. Наблюдаемое при этом двукратное уменьшение константы скорости с ростом концентрации железа в растворе может быть связано с изменением гидратной оболочки ионов.
Таким образом, характер кинетических кривых абсорбции ионов Сr(3+) и Fe(3+) тройной композицией ПЛА–ПГБ–хитозан позволяет сделать вывод о механизме процесса, согласно которому абсорбция ионов функциональными группами хитозана протекает в кинетическом, а не в диффузионном режиме. Абсорбция хорошо описывается уравнением первого порядка, что позволяет рассчитать ее кинетические (ka) и равновесные (С∞) параметры.
Для определения эффективности использования тройной композиции ПЛА–ПГБ–хитозан с соотношением 25 : 25 : 50 (мас. %) в качестве абсорбента было проведено сравнительное изучение ее абсорбционной способности по отношению к 3-валентным ионам железа и хрома.
Описание абсорбции тяжелых металлов хитозаном, который является компонентом исследуемых в данной работе композиций, наиболее часто проводится с использованием модели типа Ленгмюра или Фрейндлиха [24, 25]. В нейтральной или слабокислой среде взаимодействие между абсорбируемыми ионами железа и хрома и молекулами хитозана может включать в себя электростатическое взаимодействие, комплексообразование и хелатную иммобилизацию поливалентного иона функциональными группами хитозана.
Экспериментальные значения были получены для растворов с умеренными показателями концентрации ионов железа и хрома (0.05, 0.1 и 0.3 моль/л), соответствующими их концентрации в сточных водах, и значениями pH ⁓6, предотвращающими растворение хитозана.
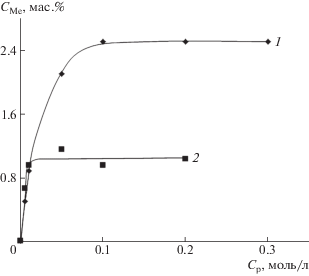
На рис. 7 приведены изотермы абсорбции ионов Fe(3+) и Сr(3+) при 25°С. Как видно на рисунке, с увеличением концентрации солей в растворе происходит монотонный рост концентрации абсорбированных ионов, однако при одной и той же концентрации ионов металлов в исходных растворах более активно абсорбируются ионы железа. Таким образом, предельные значения ионной абсорбции зависят от природы электролита и для исследуемых ионов различаются примерно в 2.5 раза.
Рис. 7.
Изотермы равновесной абсорбции ионов Fe(3+) (1) и Cr(3+) (2) композицией ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. %.
Полученные зависимости имеют типичный вид кривых ленгмюровского типа и описываются формулой:
(6)
${{C}_{{{\text{Мe}}}}} = C_{{{\text{Me}}}}^{0}{{K}_{{\text{Л}}}}{{C}_{{\text{р}}}}{\text{/}}(1 + {{K}_{{\text{Л}}}}{{C}_{{\text{р}}}}),$Преобразованное уравнение Ленгмюра имеет вид, удобный для расчета абсорбционных характеристик (рис. 8):
(7)
$1{\text{/}}{{C}_{{{\text{Ме}}}}} = 1{\text{/}}C_{{{\text{Me}}}}^{0} + 1{\text{/}}(C_{{{\text{Me}}}}^{0}{{K}_{{\text{Л}}}}{{C}_{{\text{р}}}})~~~~~$Рис. 8.
Изотермы абсорбции ионов Fe(3+) (1) и Cr(3+) (2) композицией ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. % в обратных координатах уравнения Ленгмюра.
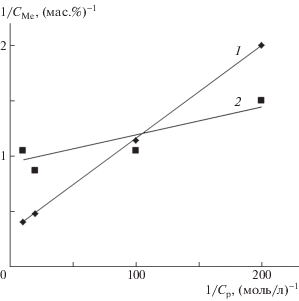
Использование линейной регрессии позволяет рассчитать характеристические параметры абсорбции ионов Fe(3+) and Cr(3+) тройной композицией ПЛА–ПГБ–хитозан (табл. 3).
Таблица 3.
Характеристики равновесной абсорбции ионов Fe(3+) и Сr(3+) композицией ПГБ–ПЛА–хитозан с соотношением компонентов 25 : 25 : 50 (мас. %)
| Абсорбируе-мый ион | $C_{{{\text{Me}}}}^{0}$, мас. % | 1/($C_{{{\text{Me}}}}^{0}$KЛ) × 103, моль/л | KЛ, л/моль |
|---|---|---|---|
| Fe(3+) | 3.05 ± 0.22 | 8.41 ± 0.52 | 39 ± 4.3 |
| Сr(3+) | 1.12 ± 0.16 | 2.83 ± 0.37 | 315 ± 27 |
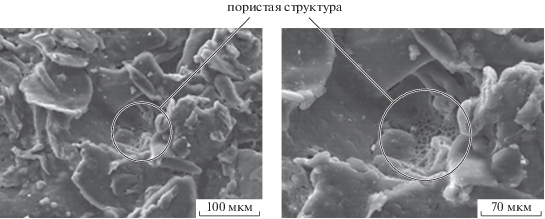
Морфология полученных композиций была исследована с использованием метода СЭМ. На рис. 9 представлены микрофотографии поверхности исходной пленочной композиции ПГБ–ПЛА–хитозан (25 : 25 : 50, мас. %) при различных увеличениях. При больших увеличениях отчетливо видны волокна ПЛА и ПГБ и мелкопористая структура хитозана, представляющие собой отдельные фазы. Именно благодаря пористой структуре хитозана происходит абсорбция металлов из водных растворов, полиэфиры же обеспечивают механическую прочность абсорбентов.
Рис. 9.
Микрофотографии поверхности пленок композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : : 25 : 50 мас. %, полученные методом СЭМ.
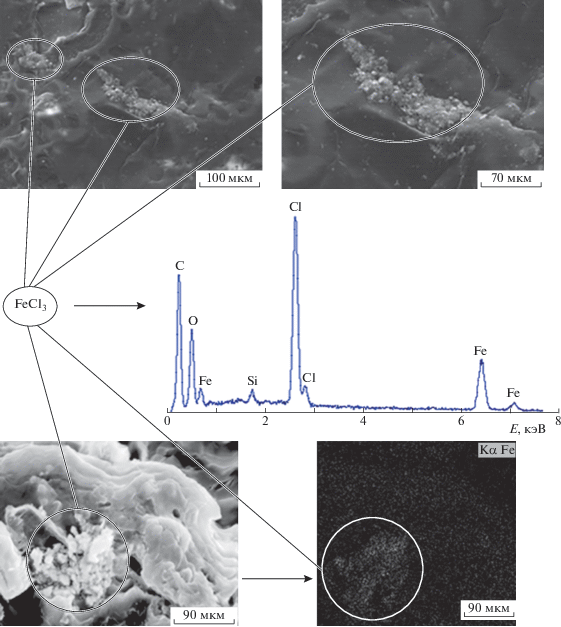
На рис. 10 представлены микрофотографии композиций ПЛА–ПГБ–хитозан, содержащие соли железа, абсорбированные из 0.3 моль/л раствора FeCl3 при различных увеличениях. Видно, что абсорбция приводит к сглаживанию поверхности и исчезновению пористости хитозана, которая отчетливо наблюдалась у исходной композиции. Вместе с тем, в области высокой концентрации соли Fe(3+), превышающей их термодинамическую растворимость, образуется самостоятельная фаза хлорного железа, имеющая вид мелкодисперсных частиц.
Рис. 10.
Микрофотографии поверхности пленок композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. % после абсорбции из 0.3 моль/л раствора FeCl3, полученные методом СЭМ. Пояснения в тексте.
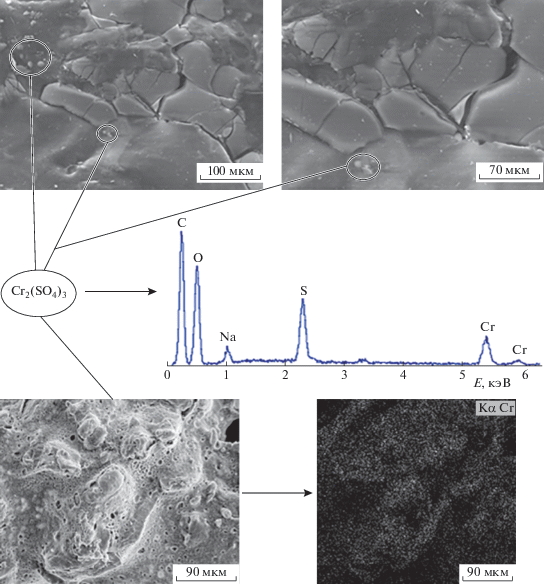
При небольшом увеличении подобная картина снижения рельефности наблюдается и для поверхности смесевых пленок после их экспозиции в 0.3 моль/л растворе сернокислого хрома (рис. 11). Однако, как и в случае соли железа, в области высокой концентрации соли Сr(3+), превышающей их термодинамическую растворимость, образуется фаза Cr2(SO4)3, имеющая вид отдельных сферических частиц с широким распределением по размеру и максимальным диаметром ⁓10 мкм.
Рис. 11.
Микрофотографии поверхности пленок композиции ПЛА–ПГБ–хитозан с соотношением компонентов 25 : 25 : 50 мас. % после абсорбции из 0.3 моль/л раствора Cr2(SO4)3, полученные методом СЭМ. Пояснения в тексте.
Таким образом, абсорбция ионов металлов, происходящая при экспонировании тройной смеси ПЛА–ПГБ–хитозан в концентрированных водных растворах исследуемых электролитов, приводит к заметным морфологическим изменениям полимерной поверхности, а также в области высоких значений концентрации к формированию фазы электролитов в виде дисперсных частиц, чья форма и распределение зависят от природы электролита. Так, для соли хрома (3+) эти частицы имеют сфероподобный вид и пространственно отделены друг от друга, тогда как соли Fe(3+) образуют мелкодисперсный слой, где все частицы контактируют друг с другом. В целом же следует отметить, что абсорбция ионов тяжелых металлов композицией ПЛА–ПГБ–хитозан вследствие ее неоднородной структуры представляет собой сложный процесс, сопровождающийся структурной перестройкой полимерной матрицы, связанный с набуханием гидрофильного компонента хитозана в водной среде и гетерогенным распределением адсорбируемых ионов Fe(3+) и Cr(3+) в матрице и на поверхности композита.
ЗАКЛЮЧЕНИЕ
Композиции ПЛА–ПГБ–хитозан являются термостабильными материалами и, благодаря присутствию хитозана, могут использоваться в качестве экологически безопасных промышленных абсорбентов с последующей утилизацией после окончания срока эксплуатации. С использованием модели Ленгмюра проведена оценка абсорбционной способности тройных композиций по отношению к ионам Fe(3+) и Сr(3+), наиболее часто встречающимся в индустриальных сточных водах. При одинаковой концентрации ионов железа и хрома в растворе количество абсорбированного железа выше, чем хрома, что, очевидно, связано с различиями электронного строения ионов, определяющих их взаимодействие с функциональными группами хитозана.
Абсорбция ионов тяжелых металлов тройной композицией ПЛА–ПГБ–хитозан представляет собой сложный процесс, сопровождающийся структурной перестройкой полимерной матрицы, обусловленной набуханием ее гидрофильного компонента хитозана в водной среде и специфическим распределением в ней адсорбируемых ионов Fe(3+) и Cr(3+).
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проект 18-29-05017).
Список литературы
Rene P., Schwarzenbach T., Hofstettter T., Gunteb U., Wehrli B. // Soc. Sci. Electronic Publ. 2019. V. 35. P. 109.
Briff J., Sinagra E., Blundell R. // Helion. 2020. V. 6. e04691. P. 1.
Haldar D., Duarah P., Purkait M.K. // Chemosphere. 2020. V. 251. P. 126388.
Flora S.D., Camoriano A., Bagnasco M., Bennicelli C., Corbett G.E., Kerger B.D. // Carcinogenesis. 1997. V. 18. P. 531.
Vaiopoulou E., Glikas P. // Chemosphere. 2020. V. 254. P. 126876.
Huang J., Zhang X., Bai L., Yuan S. // J. Env. Sci. 2012. V. 24. P. 1433.
Zhung L., Zeng Y., Cheng Z. // J. Molecul. Liq. 2016. V. 214. P. 175.
Qian S., Huang G., Jiang J., He F., Wang Y. // J. Appl. Polym. Sci. 2015. V. 77. P. 3216.
Zhorina L.A., Rogovina S.Z., Prut E.V., Kuznetsova O.P., Grachev A.V., Ivanuskina N.E., Iordanskii L.A., Berlin A.A. // Polymer Sci. A. 2020. V. 62. № 4. P. 361.
Luo Y., Lin Z., Guo G. // Nanoscale. Res. Lett. 2019. V. 14. P. 156.
Iordanskii A.L., Samoylov N.A., Olkhov A.A., Markin V.S., Rogovina S.Z., Kildeeva N.R., Berlin A.A. // Dokl. Phys. Chem. 2019. V. 487. № 2. P. 106.
Rogovina S.Z., Aleksanyan K.V., Grachev A.V., Berlin A.A., Prut. E.V. // Mendeleev Commun. 2015. V. 25. P. 361.
Ivantsova E.L., Iordanskii A.L., Kosenko R.Yu., Rogovina S.Z., Grachev A.V., Prut E.V. // Pharm. Chem. J. 2011. V. 45. P. 51.
Claro P.I.C., Neto A.R.S., Bibbo A.C.C., Mattoso L.H.C., Bastos M.S.R., Marconcini J.M.J. // J. Polym. Environ. 2016. V. 24. P. 363.
Marudova M., Yorov T. // Int. J. Polym. Mater. 2019. V. 68. P. 99.
Luttenberger L.R.J. // Clean Prod. 2020. V. 256. P. 120495.
Handbook of Thermal Analysis and Calorimetry / Ed. by S.Z.D. Cheng. Amsterdam: Elsiever, 2002. V. 3.
Suksut B., Deeprasertkul C. // J. Polym. Ennviron 2011. V. 19. P. 288.
Kizilitas A., Gardner D.J., Han Y., Yang H. // Thermochim Acta. 2011. V. 519. P. 38.
Zhorina L.A., Iordanskii A.L., Rogovina S.Z., Grachev A.V., Yakhina A.R., Prut E.A., Berlin A.A. // Mendeleev Commun. 2021. V. 31. P. 104.
Gao X., Guo C., Hao J., Zhao Z., Long H., Li M. // Int. J. Biological Macromol. 2020. V. 164. P. 4423.
Wang R., Liang R., Dai T., Chen J., Shual X., Liu C. // Trends Food Sci. Technol. 2019. V. 91. P. 319.
Beni A.A., Esmaeli A. // Enviromental Technol. Innovat. 2020. V. 17. P. 100503.
Moberly J.G., Bernards M.T., Waynant K.V. // J. Cheminform. 2018. V. 10. P. 5.
Zhang L., Zeng Y., Cheng Z. // J. Mol. Liq. 2016. V. 214. P. 175.
Kumar M., Tripathi B.P., Shahi V.K. // J. Hazard. Mater. 2009. V. 172. P. 1041.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


