Высокомолекулярные соединения (серия А), 2022, T. 64, № 1, стр. 24-44
НЕКОТОРЫЕ ТЕНДЕНЦИИ КРИОТРОПНОГО ГЕЛЕОБРАЗОВАНИЯ ПОЛУРАЗБАВЛЕННЫХ ВОДНЫХ РАСТВОРОВ ПОЛИВИНИЛОВОГО СПИРТА С РАЗЛИЧНОЙ ТЕРМИЧЕСКОЙ ПРЕДЫСТОРИЕЙ
Е. А. Курская a, *, Е. А. Подорожко a, Е. С. Афанасьев a, Е. Г. Кононова a, А. А. Аскадский a, b
a Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
b Московский государственный строительный университет
129337 Москва, Ярославское ш., 26, Россия
* E-mail: kurskaya_e@mail.ru
Поступила в редакцию 06.07.2021
После доработки 08.09.2021
Принята к публикации 01.11.2021
- EDN: PHXFQB
- DOI: 10.31857/S2308112022010060
Аннотация
Рассмотрены некоторые тенденции, наблюдающиеся при криотропном гелеобразовании 8%-х водных растворов поливинилового спирта, предварительно прогретых до 25, 55 и 85°С, при быстром охлаждении и замораживании системы. Методами реологии, термомеханического анализа, нарушенного полного внутреннего отражения и сканирующей электронной микроскопии установлено, что образующиеся в данных условиях макропористые криогели поливинилового спирта различаются упругопластическими свойствами, способностью к набуханию в воде, степенью микрокристалличности и размерами пор. Полученные результаты подтверждены исследованием диффузионного высвобождения из криогелей стабилизированных наночастиц серебра. Показано, что стенки макропор в сетке криогеля состоят из сферических образований, по-видимому, представляющих собой контактирующие друг с другом микрогелевые частицы, появляющиеся при жидкофазном расслоении растворов полимера перед стадией криотропного гелеобразования.
ВВЕДЕНИЕ
Гелеобразующая способность некоторых природных и синтетических водорастворимых полимеров, обладающих биосовместимостью, биоразлагаемостью и нетоксичностью, представляет большой интерес для изучения и практического применения гелей в разных областях. Одним из таких полимеров является поливиниловый спирт [1]. Физические гидрогели поливинилового спирта и их разновидность макропористые криогели [2] представляют собой термообратимые сетки аморфно-кристаллической структуры с верхней критической температурой растворения [3–6]. Гели ПВС часто используются в пищевой промышленности [7], в медицине в качестве носителей для доставки лекарств [8], покрытий на раны [9, 10], для лечения травм сухожилий [11, 12], для восстановления кожного покрова [13], в офтальмологии [14] и биоинженерии [15, 16].
Для успешного использования материалы на основе гелей ПВС должны иметь определенный комплекс свойств: устойчивость в физиологических условиях, регулируемые структурно-механические показатели, степень гидратации и уровень диффузии лекарственных средств. Эти качества во многом зависят от молекулярной массы и степени дезацетилитрования макромолекул [17], их концентрации в растворе, а также от температурно-кинетического режима формирования гелей и криогелей [8, 18, 19].
Гибкоцепные макромолекулы ПВС с боковыми гидроксильными функциональными группами в мономерных звеньях имеют высокую гидрофильность и способность к образованию внутри- и межмолекулярных водородных связей как по донорному, так и по акцепторному механизму [20]. Присущая ПВС микрокристалличность не препятствует набуханию, но ограничивает растворение полимера в холодной и теплой воде. Повышение растворимости ПВС наблюдается в области температур выше 65°С – температуры начала плавления микрокристаллитов [21, 22]. Для полного разрушения кристаллитов ПВС растворение производят при 120°С в условиях автоклавирования [23]. В таких условиях реализуется максимальная диссоциация надмолекулярных образований при достаточно высокой степени гидратации макромолекул, замедляющей процесс кристаллизации при охлаждении. Для начала кристаллизации полимера необходимо наличие в системе центров (зародышей) кристаллизации и условий для упорядочения макромолекулярных сегментов (параллельная укладка [24]), соединенных внутри- или межмолекулярными Н-связями без участия молекул воды [25, 26].
Полуразбавленные водные растворы ПВС в зависимости от концентрации и температуры в результате бинодального макрофазового расслоения полимерной системы образуют слабые гидрогели, а в результате спинодального микрофазового расслоения – вязкие опалесцирующие золи [27]. Для получения прочных термоустойчивых гидрогелей используют как концентрированные полимерные растворы, так и регулируемую дегидратацию макромолекул ПВС: испарение воды [9, 28], применение смешанных водо-органических растворителей [29], введение в водную среду низкомолекулярных соединений высаливающего действия [30].
Одним из способов регулирования дегидратации макромолекул ПВС и формирования термоустойчивых нековалентных гелей является вымораживание растворителя. Метод криотропного гелеобразования включает несколько стадий: замораживание водных растворов ПВС с целью кристаллизации свободной и части слабо связанной воды; выдерживание системы в замороженном состоянии; оттаивание в условиях, благоприятных для формирования аморфных и кристаллических узлов сетки криогелей. На морфологию и физико-химические свойства криогелей, сформированных из водных растворов полимера (с концентрацией с ≥ 5%), влияют температура и продолжительность всех стадий процесса, скорость изменения этих параметров, а также количество циклов замораживания–оттаивания [31, 32]. Аморфно-кристаллический баланс криогелей ПВС оказывает влияние на их способность к набуханию, термостабильность и структурно-механические свойства [33, 34].
В работах [35, 36] показано, что при нагревании растворов ПВС происходит уменьшение толщины гидратной оболочки макромолекул. При увеличении температуры от 0 до 100°С количество Н-связей между макромолекулами ПВС и молекулами воды снижается примерно в 1.3 раза [37]. Конформационное состояние, интенсивность взаимодействия гидратированных макромолекул друг с другом [38] и физические свойства молекул свободной воды (динамическая вязкость, самодиффузия, релаксация и электропроводность) также зависят от изменения температуры [39–41]. Быстрое охлаждение прогретых водных растворов ПВС ниже температуры стеклования полимера и температуры кристаллизации льда в определенной степени позволяет зафиксировать то состояние системы, которое образовалось при предварительном прогревании [42]. Далее в процессе замораживания полимерной системы происходит образование кристаллов льда [43] и концентрирование макромолекул в межкристаллическом пространстве, а при оттаивании замороженной системы – формирование макропористых криогелей ПВС [44].
Влияние различных температурно-временных параметров криоструктурирования водных растворов ПВС на свойства образующихся криогелей изучено достаточно подробно. Однако рассмотрению влияния термической предыстории исходных растворов на морфологию и физико-химические свойства соответствующих криогелей, на наш взгляд, уделено недостаточно внимания. Исследование данного влияния является основной целью настоящей работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали поливиниловый спирт (“Aldrich” Германия) с М = (11 ± 1.5) × 104 и степенью дезацелирования около 100%, а также препарат наночастиц серебра (с d = 50–60 нм), стабилизированных амфифильными макромолекулами сополимера этилена и малеиновой кислоты (ММ звена 144), синтезированный по методике [45]. Для получения криогелей из сухого препарата и бидистиллированной воды готовили 8%-й водный раствор ПВС. Гранулы полимера подвергали набуханию при комнатной температуре в течение 18–20 ч и нагревали при 90–95°С при перемешивании в течение 2 ч до полного растворения; в конце растворения компенсировали потерю воды. Раствор и образующийся из него гидрогель хранили при температуре 8–10°С в течение не более двух недель для предотвращения макросинерезиса гидрогеля.
Зависимость мутности (светорассеяния под углом 45°) от температуры для 8%-го исходного золя ПВС изучали с помощью спектрофотометра “Specol” (Германия), снабженного фотоумножителем “PhoM3/19” и термостатируемой приставкой “TK” при длине волны 435 нм. Измерения проводили в интервале температур от 20 до 90°С через каждые 5 градусов. При каждой температуре перед измерениями раствор ПВС прогревали в течение 15 мин.
Для изучения влияния предварительного прогревания 8%-х золей ПВС на свойства образующихся криогелей, 1.8 г исходного золя полимера в закрытом металлическом контейнере объемом 2 мл прогревали в течение 15 мин при Т = 25, 55 или 85°С, а затем незамедлительно ставили в морозильную камеру с Т = –13 ± 2°С. Скорость потери текучести охлажденных препаратов приблизительно составляла 4.8, 5.5 и 6.2 град/мин для золей с исходной температурой 25°С и растворов с температурой 55 и 85°С.
Замораживание растворов проводили в течение 18 ч. Оттаивание замороженной системы осуществляли или при малом времени выдерживания при температуре расстекловывания системы (определенной из кривых ТМА): 1 ч при Т = 10°С и 1 ч при Т ≈ 23°С, или при большом времени выдерживания: 24 ч при Т = 10°С и 1 ч при Т ≈ 23°С. Количество циклов замораживания–оттаивания n меняли от 1 до 3. Между этими циклами оттаивание проводили в быстром режиме.
Структурно-механические свойства образцов криогелей ПВС после оттаивания и после выдерживания в течение нескольких суток во влажной атмосфере в эксикаторе при Т ≈ 23°С исследовали с помощью динамометрических весов Каргина–Соголовой [46] c использованием сферического индентора с диаметром шарика 4 мм. Условно-мгновенный модуль сдвига G0 и податливость при сдвиге через 15 мин после разгрузки образцов J15 рассчитывали по формуле из работы [47]
Для оценки изменения во времени при комнатной температуре массы криогелей при набухании mt по отношению к массе исходных образцов m0 фиксировали изменение их веса при выдерживании в 3.5 мл бидистиллированной воды. Для определения растворимости образцов методом рефрактометрии определяли концентрацию и массу растворимого криогеля в 3.5 мл воды рt по отношению к исходной массе образца р0. Калибровочную кривую, связывающую показатель преломления и концентрацию ПВС в водном растворе, строили при Т = 25°С.
Концентрацию стабилизированных сополимером этилена и малеиновой кислоты наночастиц серебра, перешедших в воду в результате диффузии из наполненных макропористых криогелей ПВС, определяли методом спектрофотометрии в видимой области длины волн [48]. Для получения нанокомпозитных криогелей ПВС в прогретые (в течение 15 мин) при выбранной температуре 8%-е растворы ПВС добавляли 1.5 мкмоль препарата наночастиц в виде водного золя, смесь перемешивали, немедленно замораживали при температуре –13°С в течение 18 ч и выдерживали при оттаивании при 10°С в течение 24 ч. Затем образцы криогелей помещали в 3.5 мл бидистиллированной воды и ежедневно определяли концентрацию наночастиц в растворе по величине поглощения D при длине волны 410 ± 5 нм. При этом использовали калибровочную кривую С(мкмоль/мл) = k · D410нм, где коэффициент k = = 0.154 был взят из работы [45]. Об отсутствии заметной агрегации наночастиц стабилизированного серебра при получении нанокомпозитных криогелей ПВС в выбранных нами условиях судили по близости положения максимумов поглощения золей серебра (в диапазоне 410 ± 5 нм) до и после замораживания–оттаивания системы в процессе диффузии наночастиц из криогелей ПВС в водную среду [48].
Термомеханический анализ криогелей проводили на приборе “Q400EM” (“TAInstruments” США) при предварительном охлаждении образцов до –40°С и последующем нагревании до 90°С со скоростью 5 град/мин при напряжении сжатия 0.6 Н с помощью индентора диаметром 6 мм.
ИК-спектры НПВО высушенных при комнатной температуре криопленок ПВС с различной термической предысторией исходных растворов были получены на ИК-фурье-спектрофотометре “Bruker Vertex 70v” (“Bruker” Германия) с алмазной призмой.
Препараты криогелей для электронно-микроскопических исследований готовили согласно методике [44]. Образцы сначала фиксировали 2.5%-м раствором глутарового диальдегида в 0.1 М HCl, затем промывали водой. Далее воду в образцах замещали на этанол, последовательно обрабатывая их растворами с повышающейся концентрацией этанола и, наконец, образцы трехкратно обрабатывали ацетоном, после чего высушивали их в критической точке. Затем каждый препарат погружали в жидкий азот и производили скалывание. Скалывание осуществляли в направлении, перпендикулярном направлению роста кристаллов льда. На поверхность сколов в среде аргона с помощью ионного распылителя “IB-3” (“Eiko Engineering” Япония) наносили слой алюминия толщиной 250 Å. Структуру образцов изучали при увеличении в 3500 и 10 000 раз на сканирующем электронном микроскопе “Camscan S-2” (“Cambridge Instruments” Великобритания) при ускоряющем напряжении 20 кВ.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выдерживание 8%-го раствора ПВС при невысоких положительных температурах приводит к образованию опалесцирующего гидрогеля, имеющего температуру плавления около 18°С [49]. Такой гель при комнатной температуре постепенно переходит в вязкий опалесцирующий золь. Рассеивающими свет центрами здесь являются неразрушенные ассоциаты макромолекул, стабилизированные в основном водородными связями между гидроксильными группами полимера. Снижение мутности системы с ростом температуры качественно характеризует уменьшение размеров ассоциатов (рис. 1). В диапазоне температур 35–60°С уменьшение опалесценции соответствует распаду слабых межмолекулярных Н-связей, в области выше 60°С разрушаются как гидрофобные взаимодействия между неполярными фрагментами амфифильных цепей ПВС, так и, по-видимому, зародыши микрокристаллитов, образующиеся при хранении исходного 8%-го гидрогеля при невысоких положительных температурах (рис. 2).
Рис. 2.
Влияние нагревания на диссоциацию межмолекулярных связей в 8%-м гидрогеле ПВС. 1 – Н-связи между гидроксильными группами макромолекул без участия воды в области микрокристаллитов, 2 – Н-связи через прослойку воды в аморфной области, 3 – гидрофобные взаимодействия между неполярными группами макромолекул.

Из фазовой диаграммы ПВС–вода [49] следует, что при температуре 25°C 8%-й раствор ПВС (с М ~ 105) является жидкой двухфазной микрогелевой системой (т.е. соответствует области диаграммы между линиями бинодали и спинодали), при 55°C раствор ПВС содержит ассоциаты макромолекул (отвечает области выше линии бинодали), а при 85°C раствор ПВС состоит преимущественно из индивидуальных макромолекул. Можно предположить, что быстрое охлаждение и замораживание водных растворов ПВС с различной термической предысторией и, следовательно, с разной степенью организации макромолекулярных структур, позволяет сформировать криогели с различной морфологией и физико-химическими свойствами. Ниже криогели, сформированные из раствора ПВС с температурой предварительного прогревания 25, 55 и 85°C, обозначаются как КГ-25, КГ-55 и КГ-85 соответственно.
Упругопластические свойства криогелей, образованных из растворов ПВС с различной термической предысторией
Криогели КГ-25, КГ-55 и КГ-85, полученные путем однократного (n = 1) замораживания–оттаивания с последующим выдерживанием системы при температуре 10°C в течение 1 (табл. 1) и 24 ч (табл. 2), были одинаково матовыми, обладали выраженными упругими свойствами и имели сильную адгезию к гидрофильным поверхностям. Поскольку процесс замораживания являлся преимущественно однонаправленным, т.е. градиент перепада температур был направлен снизу от охлаждающей поверхности к верхней части образцов, следовало ожидать некоторой неравномерности структурно-механических свойств по объему свежеполученных криогелей.
Таблица 1.
Влияние старения (при ~23°С) на условно-мгновенный модуль сдвига G0 и остаточную деформацию J15 криогелей, полученных при однократном (n = 1) замораживании и оттаивании системы при 10°С в течение 1 ч
| Температура прогревания исходного раствора, °С | Время старения, сутки | G0, кПа | ∆G0, кПа | J15, кПа–1 |
|---|---|---|---|---|
| 25 | 0 | 2.5/2.0 | 0.5 | 0.10/0.15 |
| 1 | 2.4/1.8 | 0.6 | 0.22/0.28 | |
| 5 | 1.6/1.3 | 0.4 | 0.79/0.84 | |
| 55 | 0 | 2.7/1.9 | 0.8 | 0.23/0.26 |
| 1 | 2.4/2.1 | 0.3 | 0.26/0.33 | |
| 5 | 1.6/1.3 | 0.3 | 0.44/0.60 | |
| 85 | 0 | 2.4/1.8 | 0.6 | 0.41/0.53 |
| 1 | 2.1/2.0 | 0.1 | 0.35/0.40 | |
| 5 | 1.9/1.9 | 0 | 0.48/0.50 |
Примечание. Здесь и в табл. 2 и 3 для G0 и J15 в числителе даны значения для нижней части образца, а в знаменателе – для верхней. ∆G0 – разность между величинами G0 для нижней и верхней части образца. Ошибка измерения для G0 и J15 составляет ± 0.2 кПа и ± 0.05 кПа–1 соответственно.
Таблица 2.
Влияние старения (при ~23°С) на условно-мгновенный модуль сдвига G0 и остаточную деформацию J15 для криогелей, полученных из растворов при однократном (n = 1) замораживании и выдерживании системы при 10°С в течение 24 ч
| Температура прогревания исходного раствора, °С | Время старения, сутки | G0, кПа | ∆G0, кПа | J15, кПа–1 |
|---|---|---|---|---|
| 25 | 0 | 1.4/1.2 | 0.2 | 0.50/0.56 |
| 1 | 1.6/1.5 | 0.1 | 0.33/0.36 | |
| 5 | 2.1/1.9 | 0.2 | 0.14/0.19 | |
| 55 | 0 | 1.8/1.6 | 0.2 | 0.52/0.58 |
| 1 | 1.9/1.7 | 0.2 | 0.31/0.36 | |
| 5 | 2.1/2.0 | 0.1 | 0.13/0.18 | |
| 85 | 0 | 1.4/1.3 | 0.1 | 0.43/0.46 |
| 1 | 1.6/1.5 | 0.1 | 0.23/0.26 | |
| 5 | 2.2/2.2 | 0 | 0.15/0.18 |
В табл. 1 и 2 приведены величины условно-мгновенного модуля сдвига G0 и остаточной деформации под действием напряжения сдвига через 15 мин после снятия нагрузки J15 на обеих плоскостях цилиндрических образцов. На основании полученных данных можно заключить, что на упругопластические свойства криогелей оказывает влияние не столько термическая предыстория исходных растворов ПВС, сколько время выдерживания оттаявших полимерных систем при невысокой положительной температуре. Так, значения G0 у образцов КГ-25, КГ-55 и КГ-85 после размораживания различались незначительно. Однако в процессе старения при комнатной температуре у криогелей, выдержанных при 10°С в течение 1 ч, наблюдали снижение G0 (табл. 1) в противоположность образцам, выдержанным при 10°С в течение 24 ч (табл. 2). При этом величины остаточной деформации J15, напротив, увеличивались в процессе старения при малом времени выдерживания криогелей (табл. 1) и уменьшались при более длительном времени выдерживания (табл. 2). В последнем случае также быстрее выравнивались величины G0 по объему образцов (табл. 2).
При невысоких положительных температурах в температурной области расстекловывания полимерной системы возможно образование зародышей и рост микрокристаллитов с формированием сравнительно термоустойчивых узлов сетки геля, возникающих при взаимодействии подвижных сегментов разных макромолекул. Данный процесс является медленным [75] и требует больше времени, чем формирование менее термостабильных аморфных контактов между гидратированными функциональными группами макромолекул. По этой причине, вероятно, именно длительное выдерживание образцов при 10°С оказывается благоприятным фактором для формирования более упругой и менее пластичной сетки криогелей.
При проведении двух и трех циклов (n = 2 или 3) замораживания–оттаивания образцы КГ-25, КГ-55 и КГ-85 внешне отличались от однократно замороженных более плотной белой окраской и отсутствием адгезии к гидрофильным поверхностям (липкости). Сравнивая соответствующие величины G0 и J15 (табл. 1 и 3), можно отметить, что при повышении числа циклов n до 3 у образцов КГ-25, КГ-55 и, особенно, у КГ-85 условно-мгновенный модуль упругости значительно увеличивался, а остаточная деформация J15 уменьшалась. Полученные данные не противоречат результатам других работ для криогелей ПВС [50]. Наблюдаемые изменения происходят за счет уплотнения и упрочнения стенок сеток криогеля в условиях концентрирования макромолекул в межкристаллическом пространстве льда при криогенном воздействии.
Таблица 3.
Условно-мгновенный модуль сдвига G0 и остаточная деформация J15, для криогелей ПВС, сформированных при трехкратном замораживании (n = 3) и малом (1 ч) времени выдерживания системы при 10°С между циклами
| Температура прогревания исходного раствора, °С | Время старения при ~23°С, сутки | G0, кПа | ∆G0, кПа | J15, кПа–1 |
|---|---|---|---|---|
| 25 | 1 | 6.8/5.2 | 1.6 | 0.28/0.43 |
| 5 | 6.8/5.7 | 1.1 | 0.21/0.28 | |
| 55 | 1 | 7.0/5.8 | 1.2 | 0.25/0.35 |
| 5 | 7.9/6.9 | 1.0 | 0.10/0.17 | |
| 85 | 1 | 7.0/6.8 | 0.2 | 0.13/0.18 |
| 5 | 8.2/7.8 | 0.4 | 0.13/0.23 |
Изучение способности криогелей к набуханию в воде
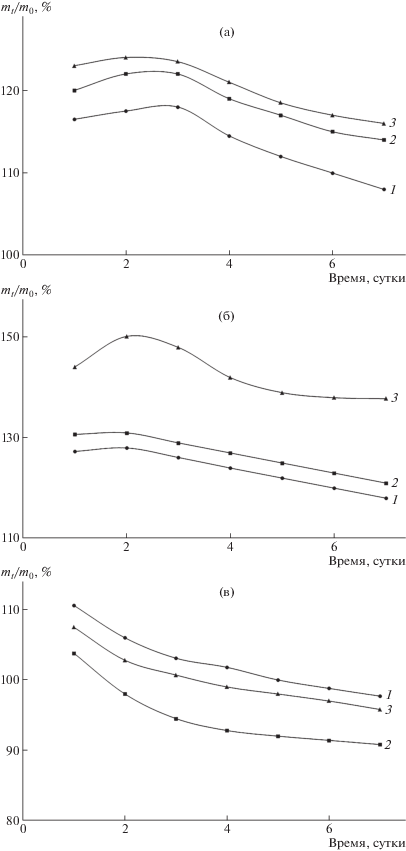
Величина набухания различных криогелей ПВС позволяет сравнить степень их гидратации в зависимости от условий формирования образцов. В процессе выдерживания криогелей ПВС в воде в течение 7 суток при комнатной температуре (при n = 1) определяли изменение их массы при набухании по отношению к исходной величине (с учетом возможного выхода в воду растворимой полимерной фракции). Для КГ-85, КГ-55 и КГ-25, сформированных при малом (1 ч) времени выдерживания оттаявших образцов при 10°С, наблюдалось увеличение отношения массы набухшего криогеля к его исходной массе mt/m0, т.е. преобладание набухания над частичным растворением (рис. 3а). Большие величины mt/m0 отмечались у криогелей, сформированных при длительном (24 ч) выдерживании при 10°С (рис. 3б). При этом максимальное относительное увеличение массы при набухании (около 140–150%) было у образцов КГ-85. Высокая температура прогревания исходных растворов перед замораживанием, сопровождающаяся частичной дегидратацией макромолекул ПВС, в совокупности с длительным выдерживанием оттаявших образцов при невысокой положительной температуре при однократном цикле замораживания–оттаивания (n = 1) являлись благоприятными факторами для формирования криогелей с высокой набухающей способностью.
Рис. 3.
Изменение во времени отношения массы mt набухшего в воде (≈ 23°С) криогеля к его исходной массе m0 для образцов КГ-25 (1), КГ-55 (2) и КГ-85 (3) при выдерживании при 10°С в процессе оттаивания 1 ч и n = 1 (а), выдерживании при 10°С в течение 24 ч и n = 1 (б) и выдерживании при 10°С в процессе оттаивания 1 ч и n = 3 (в).
При n = 1 растворимость в воде криогелей ПВС с различной термической предысторией исходных растворов не превышала 2.3–3.0% от их начальной массы (рис. 4а).
Рис. 4.
Изменение в процессе растворения в воде отношения массы криогеля pt к его исходной массе p0 в условиях выдерживания в процессе оттаивания при 10°С в течение 1 ч для криогелей КГ-25 (1), КГ-55 (2) и КГ-85 (3) при количестве циклов замораживания–оттаивания n = 1 (а) и 3 (б).

Увеличение количества циклов замораживания–оттаивания до трех (n = 3) приводило к снижению степени набухания (рис. 3в) и растворимости в воде (рис. 4б) у всех видов криогелей. Эти результаты указывают на формирование новых узлов в сетках криогелей, ограничивающих процесс их набухания и растворения.
Термомеханический анализ криогелей с разной термической предысторией исходных растворов
Метод ТМА был использован для изучения термомеханического поведения образцов КГ-25, КГ-55 и КГ-85 при постоянной величине сжатия. На рис. 5 приведены кривые ТМА в интегральном и дифференциальном видах в координатах деформация–температура для образцов КГ-25, КГ-55 и КГ-85, сформированных при однократном замораживании–оттаивании (n = 1) и малом (1 ч) времени выдерживания оттаявшей системы при 10°С. Из ТМА-кривых следует, что у всех образцов вблизи 10°С наблюдается термический переход из стеклообразного состояния в вязкоупругое (рис. 5а) с экстремумом на дифференциальной кривой около 16–17°С (рис. 5б). Второй экстремум при температуре около 36°С характеризует переход системы из вязкоупругого состояния в вязкотекучее вследствие распада водородных связей в узлах сетки криогелей. Следует отметить, что при n = 1 в более высокой температурной области (выше 60°С), характеризующей начало распада микрокристаллитов в узлах сетки криогелей, на кривых ТМА образцов КГ-25, КГ-55 и КГ-85 таких температурных переходов не наблюдалось.
Рис. 5.
Интегральные (а) и дифференциальные (б) кривые ТМА для однократно замороженных (при –13°С) криогелей КГ-25 (1), КГ-55 (2) и КГ-85 (3) при оттаивании замороженной системы 1 ч при 10°С.
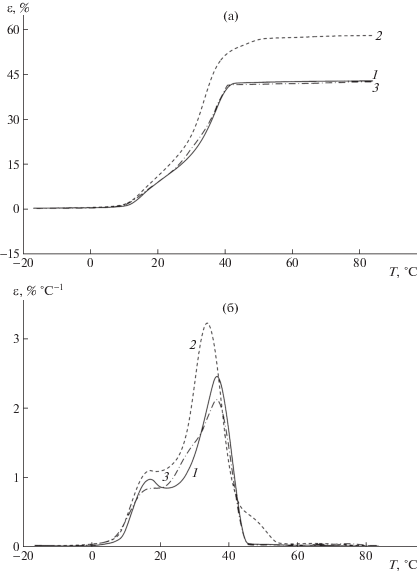
Аналогичным образом были проведены термомеханические испытания для образцов КГ-25, КГ-55 и КГ-85 при двукратном замораживании (n = 2) и при малом времени выдерживания образцов при 10°С между циклами (рис. 6). По сравнению с результатами, приведенными на рис. 5, при повторном замораживании–оттаивании для образцов КГ-25 и КГ-55 изменялся характер интегральных кривых ТМА (рис. 6а): в диапазоне температур 40–60°С появлялся участок слабой зависимости деформации от температуры, характеризующий высокоэластическое состояние образцов, а при температуре около 70°С – высокотемпературный переход к вязкотекучему состоянию, указывающему на плавление микрокристаллитов в узлах сетки КГ-25 и КГ-55. Эти особенности отсутствовали на кривых ТМА образца КГ-85.
Рис. 6.
Интегральные (а) и дифференциальные (б) кривые ТМА для двукратно замороженных (при –13°С) криогелей КГ-25 (1), КГ-55 (2) и КГ-85 (3) при оттаивании замороженной системы 1 ч при 10°С.

Следует отметить, что при n = 2 даже понижение температуры замораживания с –13 до –30°С (рис. 7) не вызывало появления микрокристаллитов в узлах сетки КГ-85 как при малом (кривая 1), так и при большом (кривая 2) времени пребывания оттаявшей системы при температуре расстекловывания 10°С. Эти данные могут косвенно свидетельствовать о важной роли повышенного давления при образовании кристаллов льда в процессе удаления слабо связанной макромолекулами воды, благоприятном для образования зародышей микрокристаллитов при криогенном воздействии на полимерную систему.
Рис. 7.
Интегральные (а) и дифференциальные (б) кривые ТМА для двукратно замороженного (при –30°С) криогеля КГ-85 при оттаивании системы при 10°С в течение 1 ч (1) и выдерживании оттаявшей системы при 10°С в течение 24 ч (2).

Отмеченная особенность кривых ТМА для КГ-85 может объясняться тем, что прогревание исходного раствора ПВС при 85°C вызывает разрушение большей части внутри- и межмолекулярных Н-связей, а также гидрофобных взаимодействий и зародышей микрокристаллитов, которые могут образовываться в исходном 8%-м гидрогеле ПВС при невысоких положительных температурах. Быстрое охлаждение горячего раствора, по-видимому, не приводит к формированию значительного количества новых зародышей – центров роста микрокристаллитов.
Аналогичная картина наблюдалась, например, при исследованиях методом ДСК 5% криогелей ПВС, подвергнутых нескольким циклам замораживания–оттаивания [51]. После первого цикла замораживания–оттаивания на кривой не определялась фракция микрокристаллитов. Исходный водный раствор ПВС не содержал зародышей микрокристаллитов, так как был приготовлен при температуре 120°С в режиме автоклавирования. В то же время методом ЯМР было установлено, что 10%-е растворы ПВС, приготовленные в более мягких условиях при 80°С и охлажденные до комнатной температуры, содержали около 5% первичных микрокристаллитов, которые способствовали дальнейшему кристаллообразованию в образцах при криогенном воздействии. По этой причине образующиеся криогели имели высокую температуру плавления (около 80°С) уже после первого цикла замораживания–оттаивания [21].
После проведения третьего цикла замораживания–оттаивания на интегральных кривых ТМА (рис. 8а) уже для всех образцов ПВС, КГ-25, КГ-55 и КГ-85, были отмечены высокотемпературные переходы от высокоэластического к вязкотекучему состоянию и соответствующие им экстремумы на дифференциальных кривых около 70°С, характеризующие плавление микрокристаллитов в узлах сетки криогелей (рис. 8б). Как было установлено ранее [54], при увеличении количества циклов замораживания–оттаивания полимерных растворов в системе увеличивается доля свободной кристаллизующейся воды за счет перехода части слабо удерживаемой (связанной) воды в разряд вымораживаемой [52]. Это может приводить к укрупнению кристаллов льда и росту давления в межкристаллическом пространстве, способствуя дальнейшему концентрированию полимерной фазы, упрочнению стенок сетки криогеля, а также появлению в благоприятных условиях зародышей микрокристаллитов [54].
Анализ ИК-спектров НПВО криопленок ПВС, сформированных из растворов с разной термической предысторией
Содержание свободной воды и степень кристалличности в криогелях ПВС и в высушенных гелях – криопленках сильно различаются [55]. Метод ИК-спектроскопии позволяет довольно точно определить наличие в системе кристалличности [56]. Однако присутствие большого количества воды (свыше 80%) во влажных образцах затрудняет проведение такой оценки. В связи с этим после удаления свободной воды путем высушивания криопленок можно только проводить сравнительный анализ количества связанной воды, а также качества водородных связей в криопленках, полученных из растворов ПВС с разной термической предысторией.
Для анализа методом НПВО использовали полосы валентных колебаний ОН в области 3700–3000 см–1, полосу деформационных колебаний ОН (область 1670–1600 см–1), а также полосу валентных колебаний С–Н (3000–2900 см–1).
Рассмотрим сначала случай однократного замораживания–оттаивания. Анализ интенсивности полос в области валентных 3700–3000 см–1 и деформационных 1670–1600 см–1 колебаний групп ОН (рис. 9а) показал, что содержание связанной воды в пленках КГ-55 и КГ-85 в ~2 раза меньше, чем в образце КГ-25. Известно, что для свободной воды деформационные колебания группы ОН имеют максимум при 1637 см–1. В то же время для криопленок полоса воды имеет более высокую частоту (1655 см–1 в КГ-25, 1670 см–1 в КГ-55 и КГ-85). Это означает, что во всех исследуемых образцах вода входит в состав гидратной оболочки макромолекул ПВС (рис. 9в).
Рис. 9.
а: Спектры НПВО образцов КГ-25 (1), КГ-55 (2) и КГ-85 (3), полученных при одном цикле замораживания–оттаивания (n = 1); б: область валентных колебаний групп ОН (3700–3000 см–1) и валентных колебаний С–Н (3000–2900 см–1); в: область деформационных колебаний ОН-групп, 1670–1600 см–1.

Анализ полуширины полосы валентных колебаний групп ОН (3700–3000 см–1) показал, что структура с наиболее плотной упаковкой макромолекул (имеющая меньшую степень дифференциации Н-связей) была присуща образцу КГ-25 (полуширина полосы ОН равна 225 см–1). Для образцов КГ-55 и КГ-85 полуширина полос групп ОН составляли соответственно 275 и 350 см–1, что указывало на меньшую упорядоченность в системе (рис. 9б). Увеличение полуширины полос валентных колебаний групп ОН для образцов КГ-85 и КГ-55 по сравнению с КГ-25 происходит за счет возникновения более сильных межмолекулярных Н-связей.
Судя по соотношению интенсивностей полос валентных колебаний С–Н (2939 и 2909 см–1), содержание различных конформеров макромолекул в пленках также зависит от температуры предварительного прогревания исходных растворов ПВС. Если в образце КГ-25 доминирует конформер, который характеризуется полосой СН при 2939 см–1, то для КГ-55 и КГ-85 наблюдается практически равное содержание двух разных конформеров, о чем свидетельствуют две полосы валентных колебаний СН одинаковой интенсивности при 2939 и 2909 см–1.
Неоднократное замораживание криогелей ПВС, как показали данные ИК-спектроскопии НПВО (рис. 10), приводит к усилению дегидратации криопленок по сравнению с образцами после однократного криогенного воздействия. Анализ полуширины полосы валентных колебаний групп ОН (3700–3000 см–1) указывает на то, что при n = 2 упорядочение структуры для образцов КГ-25 (290 см–1) и КГ-55 (325 см–1) усилилось, а для КГ-85 полуширина полосы ОН (350 см–1) не изменилась. Это соответствует поведению образцов КГ-25 и КГ-55 при ТМА для n = 2. Кроме этого было отмечено смещение максимумов полос валентных колебаний ОН в низкочастотную область (КГ-25 – 3300 см–1, КГ-55 – 3320 см–1, КГ-85 – 3270 см–1) по сравнению со спектрами для образцов первого цикла замораживания–оттаивания. Это может указывать на усиление связей в полимерных сетках. Так как содержание связанной воды в образце КГ-85 минимально, многие Н-связи в нем образуются за счет межмолекулярных взаимодействий.
Рис. 10.
Спектры НПВО образцов КГ-25 (1), КГ-55 (2) и КГ-85 (3), полученных при трех циклах замораживания–оттаивания (n = 3), в области валентных колебаний групп ОН (3700–3000 см–1) и групп С–Н (3000–2900 см–1).

В наиболее плотной структуре образца КГ-25 превалирует конформер, характеризующийся полосой СН при 2939 см–1. С повышением температуры предварительного прогревания исходного раствора у КГ-55 растет интенсивность второй полосы СН (при 2909 см–1), а в КГ-85 интенсивность этой полосы уже выше интенсивности полосы при 2939 см–1.
Увеличение циклов замораживания–оттаивания приводит к усилению наблюдаемых эффектов в отношении формирования полимерной сетки. Дифференциация водородных связей в полимерной структуре, находящаяся в соответствии с полушириной полосы групп ОН (3700–3000 см–1), для образца КГ-85 изменяется с 350 до 375 см–1. Это свидетельствует об усилении водородного связывания и, следовательно, об образовании более прочной полимерной структуры, чем в образцах, полученных при меньшем значении цикличности и более низкой температуре предварительного прогревания начальных растворов.
Таким образом, анализ данных ИК-спектроскопии НПВО позволяет заключить, что величина температуры предварительного прогревания растворов ПВС влияет как на конформационное состояние макромолекул в криоструктурах, так и на регулярность и прочность образующихся в них водородных связей. Более разупорядоченные (предварительным прогреванием при 85°С) макромолекулы в итоге формируют более регулярную сетку межмолекулярных Н-связей, которая в большей степени подвергается упрочнению при циклическом режиме криогенного воздействия.
Морфология криогелей ПВС, сформированных из растворов с различной термической предысторией
Поскольку при криотропном гелеобразовании 8%-го раствора ПВС формируются макропористые сетки, морфология криогелей преимущественно определяется температурно-временным режимом кристаллизации воды и оттаивания замороженной системы. Начальная температура полимерного раствора при быстром охлаждении также влияет на кинетику замораживания и на морфологию пористых криогелей ПВС.
На рис. 11 приведены электронные микрофотографии криогелей поливинилового спирта, полученных из растворов с начальной температурой 25, 55 и 85°С (при n = 1), а также из растворов с начальной температурой 85°С (при n = 3) при замораживании до –13°С и выдерживании при 10°С в течение 24 ч. Скол препаратов криогелей ПВС был осуществлен в направлении, перпендикулярном основному направлению роста кристаллов льда. Морфология образцов КГ-25 (рис. 11а) и КГ-55 (рис. 11в) характерна для макропористых матриц криогелей [44]. По-видимому, Н-связи макромолекул, разрушенные при прогревании исходного раствора ПВС при 55°С [27], могут частично восстанавливаться при последующем охлаждении. Это может объяснить похожую морфологию образцов КГ-25 и КГ-55. Размер крупных умеренно вытянутых пор в сетке геля меняется приблизительно от 0.5 до 3.0 мкм для КГ-25 (рис. 11а) и от 0.5 до 4.0 мкм для КГ-55 (рис. 11в). При этом стенки сетки у КГ55 в среднем более тонкие, чем у КГ-25.
Рис. 11.
Электронные микрофотографии поперечных сколов криогелей ПВС, полученных при выдерживании при 10°С в течение 24 ч и предварительном прогревании исходных растворов ПВС при 25 (а, б), 55 (в) и 85°С (г–е). Число циклов замораживание–оттаивание n = 1 (а–д) и 3 (е). Увеличение 3500 (а, в, г, е) и 10000 (б, д).

На микрофотографии КГ-25, полученной при более высоком разрешении (рис. 11б), видно, что сетка криогеля состоит из сферических наноразмерных образований разного диаметра. Сферические структуры могут образовываться при охлаждении 8%-го водного раствора ПВС (М ~ 105) в результате жидкофазного расслоения системы в интервале температур между 18 и 10°С [49]. При замораживании гетерофазной системы микрогелевые частицы концентрируются в межкристаллическом пространстве льда, формируя стенки образующейся при оттаивании пористой структуры. Сферические образования также присутствуют в образце КГ-55. Для морфологии криогеля КГ-55 характерна сравнительно равномерная толщина стенок сетки и наличие более выраженной системы сообщающихся между собой пор (рис. 11в). В образцах КГ-25 и КГ-55 помимо крупных пор в стенках сетки видны множественные мезо- и микропоры.
Совсем иную микроструктуру имеет образец КГ-85, полученный при самой высокой температуре прогревания (85°C) исходного раствора ПВС. Здесь (при n = 1) в поперечном срезе не наблюдается ячеистая морфология сетки (рис. 11г), характерная для КГ-25 и КГ-55. Структурные элементы сетки КГ-85 представляют собой обособленные волокнистые образования, собранные в пучки, между которыми видны крупные и редкие поры с размером до 3–5 мкм. В сетке криогеля также присутствуют сферические элементы, но более мелкие, чем, например, в сетке КГ-25. При изучении микрофотографии КГ-85, полученной при более высоком разрешении (рис. 11д), можно заключить, что волокнистые образования сетки криогеля также состоят из множества примыкающих друг к другу наноразмерных сферических образований разного диаметра.
Таким образом, при n = 1 сетка КГ-85 преимущественно представляет собой слабо упорядоченную слоистую структуру со сравнительно крупными порами. Макропоры образца КГ-85 образованы при таянии более крупных кристаллов льда, сформированных в большем количестве (по сравнению с образцами КГ-25 и КГ-55) свободно кристаллизующегося растворителя в системе. По-видимому, быстрое охлаждение прогретого при 85°С раствора ПВС с максимально разрушенными межмолекулярными связями и более тонкой гидратной оболочкой макромолекул способствует накоплению в системе свободной, способной к кристаллизации при замораживании, воды [52]. При невысоких отрицательных температурах замораживания это приводит к образованию более крупных кристаллов льда. Кроме того, нужно учитывать, что при замораживании горячих водных растворов система меньшее время пребывает в переохлажденном состоянии, чем в случае холодных растворов [53]. Это может снижать уровень обратного перехода части свободной воды в связанную, кристаллизующуюся в более низкотемпературной области [54].
При трехкратном замораживании–оттаивании (n = 3) криогелей, полученных из горячих растворов ПВС, стенки сетки уплотняются (рис. 11е) и представляют собой плотно прилегающие друг к другу (“спрессованные”) сферические образования. В данном случае формируется ячеистая структура сетки КГ-85 с более толстыми, чем у КГ-25 и КГ-55, стенками и большим количеством крупных открытых пор. Размер пор у КГ-85 в поперечном направлении не превышает 3 мкм, т.е. максимальный размер пор сетки криогелей, сформированных при однократном замораживании–оттаивании.
Таким образом, при быстром (~6.2 град/мин) охлаждении горячих (85°С) полуразбавленных растворов ПВС, а также при охлаждении (со скоростью ~4.8 град/мин) холодных (25°С) золей в полимерной системе при понижении температуры происходит жидкофазное расслоение [27] и в процессе замораживания формируются криогели, стенки сеток которых состоят из различных по форме, размерам и уровню контакта микрогелевых полимерных частиц. Можно предположить, что структура стенок сетки криогелей будет меняться при более высоких скоростях охлаждения исходных растворов ПВС с разной термической предысторией.
Гидродинамические свойства макропористых криогелей ПВС, сформированных из растворов с различной термической предысторией
Для оценки гидродинамических свойств макропористых криогелей в прогретые исходные растворы ПВС перед замораживанием добавляли водный золь стабилизированных сферических наночастиц серебра со средним диаметром основной фракции 50–60 нм [45]. Как следует из рис. 12, количество наночастиц, вышедших в результате диффузии в течение 7 суток из макропор в воду, для криогеля КГ-85 при n = 1 было приблизительно в 1.5 ± 0.1 раза выше, чем для КГ-55 (и для КГ-25). Причем наибольшая концентрация вышедших наночастиц устанавливалась к третьим–четвертым суткам. Одновременно достигалась и наибольшая величина набухания у образца КГ-85 (рис. 3а). Интенсивная диффузия наночастиц серебра из образца КГ-85 в водную среду может быть связана с формированием у данного криогеля более крупных макропор, чем у криогелей КГ-25 и КГ-55. Эти данные подтверждаются результатами микроскопических исследований морфологии криогелей (рис. 11г).
Рис. 12.
Спектры поглощения стабилизированных наночастиц серебра, перешедших в результате диффузии из макропор геля в воду при комнатной температуре в течение 7 суток, для КГ-55 (1) и КГ-85 (2) (n = 1).

Нужно отметить, что неоднократное циклическое замораживание–оттаивание КГ-85, наполненного наночастицами стабилизированного серебра, приводит к последовательному снижению количества наночастиц, переходящих в результате диффузии в водную среду, до 16–20% от максимального значения при n = 1. Это может быть связано как с изменением размеров пор криогеля при неоднократных циклах замораживания–оттаивания, так и с адсорбцией наночастиц в условиях повышенного давления в системе при кристаллизации растворителя.
Как следует из литературных данных, нагревание полуразбавленных водных растворов ПВС сопровождается несколькими термообратимыми процессами с участием водородных связей: изменением толщины гидратной оболочки макромолекул [37, 57], их конформационного состояния [38], характера межмолекулярных взаимодействий [58], а также энергетического и динамического состояния молекул воды, не входящих в гидратную оболочку. Эти процессы происходят одновременно и влияют друг на друга и в водном растворе, и на стадии кристаллизации льда [59–62], сопровождающейся появлением межмолекулярных контактов, способных в благоприятных условиях образовывать узлы трехмерной макропористой сетки криогелей ПВС.
Общепринятыми считаются представления о постепенном ослаблении и разрыве многих водородных связей между молекулами воды по мере роста температуры, что ведет к снижению степени упорядоченности в расположении молекул воды и уменьшению расстояния, на котором эта упорядоченность сохраняется [40]. Изменяются и динамические свойства молекул воды. Например, при изменении температуры от 273 до 300 К коэффициент самодиффузии молекул воды увеличивается приблизительно вдвое [63].
При понижении температуры ниже 4°С уменьшается плотность и увеличивается мольный объем воды, что сопровождается упорядочением Н-связей в тетраэдрической структуре [40]. Однако в температурной области, предшествующей фазовому переходу в лед, в переохлажденной воде, происходит изменение термодинамических характеристик молекул жидкой воды и трансформация тетраэдрических водородных связей в их более устойчивую форму – гексагональную структуру льда Ih. При нагревании закристаллизованной системы до температуры плавления кристаллов льда Ih (273 К) в воде появляется жидкая фракция льдоподобных гексамерных кластеров [64, 65]. Экспериментальные результаты показывают, что “талая вода” при температуре до 25°С [66] некоторое время (до 1 суток) может находиться в метастабильном состоянии.
Температура кристаллизации льда и динамические свойства молекул воды зависят от характера их водородного связывания с макромолекулами (рис. 13) [52] и друг с другом и определяются в том числе расстоянием до поверхности макромолекул [62]. Количество незамерзающей воды при замораживании растворов ПВС не зависит от тепловых режимов, предшествующих замораживанию, а количество связанной и свободной воды зависит от них [57]. Свойства воды в гидратном слое значительно отличаются от свойств свободной воды, в частности, по более низкой подвижности молекул и температуре кристаллизации.
Рис. 13.
Варианты образования водородных связей в системе поливиниловый спирт – вода: 1 – межмолекулярные Н-связи с участием молекул воды, 2 – внутримолекулярные Н-связи с участием молекул воды, 3 – связи между ОН-группой ПВС и молекулой воды, 4 – связи между ОН-группой ПВС и двумя молекулами воды.

Присутствие в растворе гидрофильных макромолекул ПВС влияет на снижение скорости движения слабо связанных молекул воды к центрам кристаллизации льда [67]. Кроме того, вследствие особенностей своего строения макромолекулы ПВС обладают эффективным антифризным действием, которое заключается в адсорбции отдельных макромолекул на центрах роста кристаллов льда [68]. Такое действие усиливается при адсорбции крупных ассоциатов макромолекул ПВС [69], блокирующих большее количество растущих центров кристаллизации. Предварительное прогревание растворов ПВС перед замораживанием оказывает влияние как на количество связанных макромолекулами воды, так и на конформацию и ассоциацию макромолекул полимера. В связи с этим единичные макромолекулы с меньшим количеством слабо связанной воды (как в случае горячих водных растворов ПВC), по-видимому, обладают менее выраженными антифризными свойствами.
Косвенным указанием на образование более крупных кристаллов льда при быстром охлаждении горячего раствора ПВС является более интенсивная диффузия наночастиц серебра из макропор у образца КГ-85 (n = 1) по сравнению с КГ-25 и КГ-55. Можно предположить, что ухудшение антифризных свойств меньших по размеру и менее гидратированных индивидуальных макромолекул ПВС при температуре 85°С по сравнению со свойствами объемных ассоциатов макромолекул в растворах при температурах 55 и 25°С, является одной из причин возможного формирования более крупных кристаллов льда при замораживании горячего раствора ПВС (рис. 11г).
Условия длительного выдерживания оттаявших образцов при невысоких положительных температурах также влияют на свойства образующихся криогелей. Однако при отсутствии в первоначальной системе зародышей даже благоприятные условия оттаивания не могут способствовать росту микрокристаллитов. Установлено, что при 300 К количество Н-связей между макромолекулами ПВС и молекулами воды в 13–14 раз превосходит число межмолекулярных Н-связей [74]. Для образования аморфных межмолекулярных контактов через прослойку молекул воды достаточно подвижности функциональных групп макромолекул, которая наблюдается при субнулевых отрицательных температурах [70]. Для формирования областей микрокристаллитов требуется подвижность параллельно расположенных сегментов макромолекул [24], соединенных Н-связями без участия гидратационной воды [25] в условиях минимальной гидратации макромолекул. При недостаточном уровне дегидратации возможность образования межмолекулярных водородных связей без участия воды ограничена.
Благоприятные условия для образования и роста зародышей микрокристаллитов создаются вблизи температуры расстекловывания замороженной полимерной системы (из кривых ТМА следует, что она равна приблизительно 10°С). В то же время определенная часть молекул воды после таяния кристаллов льда Ih все еще сохраняет Н-связи в структуре гексагональных льдоподобных кластеров [65]. Следовательно, определенное количество жидких гексагональных кластеров воды в геле при размораживании образцов при невысоких положительных температурах не имеет тетраэдрической координации, характерной для жидкой воды. На эту структурную особенность молекул воды также влияют стерические препятствия со стороны полимерных цепей [71]. Перестройку гексагональных льдоподобных кластеров в тетраэдрические, характерные для жидкой воды, в интервале 0–25°С до определенной степени можно рассматривать как продолжение плавления кристаллов Ih-льда. Нахождение части молекул свободной воды в виде малоподвижных гексагональных кластеров при невысоких положительных температурах ограничивает их возможность в образовании Н-связей с макромолекулами, т.е. гидратации [57]. Например, в гексагональном кластере (Н2О)6 из 12 водородных атомов в свободном состоянии, способном к образованию Н-связей с макромолекулами, находится только половина. Данное обстоятельство является благоприятным фактором для образования микрокристаллических узлов в сетке геля, поскольку известно, что взаимодействие молекул воды с гидроксильными группами макромолекул ПВС может приводить даже к уменьшению степени микрокристалличности [72]. При этом происходит разрушение водородных связей между гидроксильными группами макромолекул, и конфигурация кристаллического плоского зигзага переходит в аморфную конфигурацию. Как следствие, длительное выдерживание размороженных образцов при температуре расстекловывания полимерной системы при минимальной гидратации макромолекул оказывается благоприятным для формирования и роста зародышей микрокристаллитов.
Таким образом, предварительное прогревание исходных 8%-х водных растворов ПВС при температурах 25, 55 или 85°С с последующим немедленным охлаждением до температуры ниже температуры стеклования и замораживания, выдерживанием в замороженном состоянии и медленным оттаиванием при температуре около 10°С, соответствующей расстекловыванию замороженной системы, оказывает влияние на морфологию, физико-химические свойства и аморфно-кристаллический баланс криогелей ПВС.
ЗАКЛЮЧЕНИЕ
Прогревание 8%-го водного золя ПВС в диапазоне температур 20–90°С вызывает ступенчатое уменьшение мутности системы, связанное с изменением агрегационного состояния макромолекул вследствие уменьшения количества межмолекулярных Н-связей, областей микрокристалличности и ослабления гидрофобных взаимодействий.
В процессе быстрого преимущественно однонаправленного охлаждения и замораживания прогретых растворов ПВС и последующего оттаивания при невысокой положительной температуре формируются криогели с изначально неоднородными по объему упругопластическими свойствами, которые выравниваются в процессе старения при комнатной температуре.
Степень набухания криогелей ПВС в воде находится в прямой зависимости от температуры прогревания исходных растворов перед замораживанием, а также от времени выдерживания оттаявшей системы при температуре расстекловывания (около 10°С) и обратно пропорциональна количеству циклов замораживания–оттаивания.
Более высокое количество выходящих из макропор в воду в процессе диффузии стабилизированных наночастиц серебра (d = 50–60 нм) в случае наполненного КГ-85 (n = 1) указывает на большую величину размеров пор в данном геле, чем в образцах КГ-25 и КГ-55.
Методом ИК-спектроскопии НПВО установлено, что макромолекулы ПВС, находящиеся в диссоциированном состоянии при прогревании раствора до 85°С, при последующем криотропном воздействии (n = 3) образуют наиболее прочную сетку межмолекулярных водородных связей.
Методом электронной микроскопии показано, что для морфологии КГ-25 и КГ-55, полученных при n = 1, характерна тонкая сетчатая структура, в основном сформированная из микрогелевых сферических частиц, а для морфологии КГ-85 при n = 1 типичны более редкие и крупные (до 3–5 мкм) поры и широкие стенки в виде множественных полимерных волокон, состоящих из микрогелевых сферических частиц. При n = 3 у КГ-85 также формируется ячеистая структура сетки с уплотненными стенками, состоящими из “спрессованных” микрогелевых сферических частиц.
Показано, что морфология, физико-химические свойства и наличие микрокристаллических узлов в сетке криогелей ПВС определяются не только температурно-временными условиями криоструктурирования, но и величиной предварительного термического воздействия на макромолекулы ПВС в исходных водных растворах.
В ИНЭОС РАН проведены все эксперименты по получению гидрогелей поливинилового спирта, изучению их структуры, влияния режима термической обработки на свойства. В МГСУ выполнены необходимые расчеты и дана интерпретация переходов по термомеханическим кривым.
Авторы выражают благодарность А.Г. Богданову (МГУ) за помощь в получении микрофотографий сканирующей электронной микроскопии объектов исследования.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект “Теоретико-экспериментальное конструирование новых композитных материалов для обеспечения безопасности при эксплуатации зданий и сооружений в условиях техногенных и биогенных угроз” № FSWG-2020-0007 (МГСУ) и тема Госзадания ИНЭОС РАН № 0085-2019-0004).
Список литературы
Hydrogels in Medicine and Pharmacy. V. 1. Fundamentals / Ed.by N.A. Peppas. New York: CRC Press, 2019.
Hassan Ch.M., Peppas N.A. // Macromolecules. 2000. V. 33. P. 2472.
Polymeric Cryogels Macroporous Gels with Remarkable Properties / Ed. by Oguz Okay. New York: Springer, 2014.
Polymeric Gels. Characterization, Properties and Biomedical Applications / Ed. by K. Pal, I. Banerjee. Cambridge: Elsevier, 2018.
Biomedical Hydrogels Biochemistry, Manufacture and Medical Applications / Ed. by S. Rimmer. Oxford, Cambridge: Woodhead Publ. Limited, 2011.
Peppas N.A., Hilt J.Z., Khademhosseini A., Langer R. // Adv. Mater. 2006. V. 18. P. 1345.
Levine H., Slade L. Water Relationships in Food. New York: Springer, 1991.
Hassan Ch.M., Peppas N.A. // Adv. Polym. Sci. 2000. V. 153. P. 65.
Harland R.S., Peppas N.A. // J. Pharmac. Sci. 1989. V. 78. № 2. P. 146.
Slaughter B.V., Khurshid Sh.S., Fisher O.Z., Khademhosseini A., Peppas N.A. // Adv. Mater. 2009. V. 21. P. 3307.
Kobayashi M., Toguchida J., Oka M. // Biomater. 2003. V. 24. № 4. P. 639.
Baker M.I., Walsh S.P., Schwartz Z., Boyan B.D. // J. Biomed. Mater. Res. B. 2012. V. 9999. P. 1.
Biomaterials for Treating Skin Loss. / Ed. by D. Orgill, C. Blanco. Cambridge: CRC Press Woodhead Publ. Limited, 2009.
Hyon S.-H., Cha W.-I., Ikada Y., Kita M., Ogura Y., Honda Y. // J. Biomater. Sci., Polym. Ed. 1994. V. 5. № 5. P. 397.
Kumar A., Han S.S. // Int. J. Polym. Mater. Polym. Biomater. 2017. V. 66. № 4. P. 159.
Teodorescu M., Bercea M., Morariu S. // Polym. Revs. 2018. V. 58. № 2. P. 247.
Dai L., Yu Sh. // Polym. Adv. Technol. 2003. V. 14. P. 449.
Lozinsky V.I. // Russ. Chem. Revs. 1998. V. 67. P. 573.
Wan W., Bannerman A.D., Yang L., Mak H. // Adv. Polym. Sci. 2014. V. 263. P. 283.
Molyneux Ph. Water-Soluble Synthetic Polymers: Properties and Behavior. Boca Raton; London: New York: CRC Press, 1984. V. 1.
Valentın J.L., Lopez D., Hernandez R., Mijangos C., Saalwachter K. // Macromolecules. 2009. V. 42. P. 263.
Кленин В.И., Клeнина О.В., Колчанов В.А., Шварцбурд Б.И., Френкель С.Я. // Высокомолек. соед. А. 1974. Т. 16. № 10. С. 2351.
Nakaoki T., Yamashita H. // J. Molec. Struct. 2008. V. 875. P. 282.
Бартенев Г.М., Френкель С.Я. Физика полимеров. Л.: Химия, 1990.
Hodge R.M., Edward G.H., Simon G.P. // Polymer. 1996. V. 37. № 8. P. 1371.
Hatakeyama H., Hatakeyama T. // Thermochim. Acta. 1998. V. 308. P. 3.
Kawanishi K., Komatsu M., Inoue T. // Polymer. 1987. V. 28. P. 980.
Otsuka E., Sugiyama M., Suzuki A. // J. Phys.: Conference Ser. 2010. V. 247. P. 1.
Kanaya T., Takahashi N., Takeshita H., Ohkura M., Nishida K., Kaji K. // Polym. J. 2012. V. 44. P. 83.
Tretinnikov O.N., Zagorskaya S.A. // J. Appl. Spectroscopy. 2012. V. 78. № 6. P. 904.
Bhattacharya A., Ray P. // J. Appl. Polym. Sci. 2004. V. 93. P. 122.
Water Soluble Polymers / Ed. by Z. Amjad. New York: Plenum Press, 1998.
Polymeric Cryogels. Macroporous Gels with Remarkable Properties / Ed. by O. Okay. Advances in Polymer Science 263. Switzerland: Springer Int. Publ., 2014.
Peppas N.A., Merrill E.W. // J. Appl. Polym. Sci. 1977. V. 21. P. 1763.
Arai K., Okuzono M., Shikata T. // Macromolecules. 2015. V. 48. № 5. P. 1573.
Paradossi G., Finelli I., Natali F., Telling M.T.F., Chiessi E. // Polymers. 2011. V. 3. P. 1805.
Wu Ch. // Polymer. 2010. V. 51. P. 4452.
Klenin V.J., Fedusenko I.V., Klokhtina Yu.I. // Polymer Science A. 2003. V. 45. № 12. P. 1231.
Khorolskyi O.V. // Ukr. J. Phys. 2018. V. 63. № 2. P. 144.
Вода: структура, состояние, сольватация / Под ред. А.М. Кутепова. М.: Наука, 2003.
Zhao L., Ma K., Yang Z. // Int. J. Molec. Sci. 2015. V. 16. P. 8454.
Hatakeyama T., Quinn F.X., Hatakeyama H. // Carbohydr. Polym. 1996. V. 30. P. 155.
Moberg D.R., Becker D., Dierking Ch.W., Zurheide F., Bandow B., Buck U., Hudait A., Molinero V., Paesani F., Zeuch T. // Proc. Natl. Acad. Sci. USA. (PNAS). 2019. P. 1.
Lozinsky V.I., Vainerman E.S., Domotenko L.V., Mamtsis A.M., Titova E.F., Belavtseva E.M., Rogozhin S.V. // Colloid Polym. Sci. 1986. V. 264. P. 19.
Samoilova N., Kurskaya E., Krayukhina M., Askadsky A., Yamskov I. // J. Phys. Chem. B. 2009. V. 113. P. 3395.
Каргин В.А., Соголова Т.И. // Журн. физ. химии. 1949. Т. 23. С. 540.
Lee E.H., Radok J.R. // J. Appl. Mech. E. 1960. V. 27. P. 438.
Agnihotri Sh., Mukherji S., Mukherji S. // Roy. Soc. Chem. Adv. 2014. V. 4. P. 3974.
Hara C., Matsuo M. // Polymer. 1995. V. 36. № 3. P. 603.
Willcox P.J., Howie D.W., Schmidt-Rohr K., Hoagland D.A., Gido S.P., Pudjijanto S., Kleiner L.W., Venkatraman S. // J. Polym. Sci., Polym. Phys. 1999. V. 37. P. 3438.
Hatakeyema T., Uno J., Yamada Ch., Kishi A., Hatakeyama H. // Thermochim. Acta. 2005. V. 431. P. 144.
Li W., Xue F., Cheng R. // Polymer. 2005. V. 46. P. 12026.
Brownridge J.D. // Am. J. Phys. 2011. P. 1.
Hatakeyama T., Tanaka M., Hatakeyama H. // J. Biomater. Sci., Polym. Ed. 2010. P. 211865.
Hatakeyama T., Yamauchi A., Hatakeyama H. // Eur. Polym. J. 1987. V. 23. P. 361.
Peppas N.A., Merrill E.W. // J. Polym. Sci. 1976. V. 14. P. 441.
Chiessi E., Cavalieri F., Paradossi G. // J. Phys. Chem. B. 2005. V. 109. № 16. P. 8091.
Klenin V.J. Thermodynamics of Systems Containing Flexible-Chain Polymers. Amsterdam: Elsevier, 1999.
Ogawa S., Koga M., Osanai S. // Chem. Phys. Lett. 2009. V. 480. P. 86.
Inada T., Lu S.-S. // Chem. Phys. Lett. 2004. V. 394. P. 361.
Naullage P.M., Molinero V. // J. Am. Chem. Soc. 2020. V. 142. P. 4356.
Wu S., He Z., Zang J., Jin Sh., Wang Z., Wang J., Yao Y., Wang J. // Sci. Adv. 2019. V. 5. P. 1.
Reddy S.K., Straight S.C., Bajaj P., Pham C.H., Riera M., Moberg D.R., Morales M.A., Knight C., Götz A.W., Paesani F. // J. Chem. Phys. 2016. V. 145. P. 194504-1.
Khakhalin A.V., Gradoboeva O.N., Shirshov Ya.N. // Moscow Univ. Phys. Bull. 2012. V. 67. № 6. P. 537.
Liu J., He X., Zhang J.Z.H. // Phys. Chem. Chem. Phys. 2017. P. 1.
Kholmanskiy A. // J. Molec. Struct. 2015. V. 1989. P. 124.
Laage D., Strinemann G., Hynes J.T. // Science China. 2010. V. 53. № 6. P. 1068.
Naullage P.M., Molinero V. // J. Am. Chem. Soc. 2020. V. 142. P. 4356.
Weng L., Stott S.L., Toner M. // Langmuir. 2017. № 4. P. 1.
Lozinsky V.I., Damshkaln L.G. // J. Appl. Polym. Sci. 2000. V. 77. P. 2017.
Tamai Y., Tanaka H. // Phys. Rev. E. 1999. V. 59. № 5. P. 5647.
Mallapragada S.K., Peppas N.A. // J. Polym. Sci., Polym. Phys. 1996. V. 34. P. 1339.
Li W., Xue F., Cheng R. // Polymer. 2005. V. 46. P. 12026.
Shi L., Han Q. // Molec. Simul. 2018. V. 44. № 17. P. 1363.
Auriemma F., De Rosa C., Triolo R. // Macromolecules. 2006. V. 39. P. 9429.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)




