Высокомолекулярные соединения (серия А), 2022, T. 64, № 3, стр. 163-170
ТЕРМООБРАТИМОЕ ПОВЫШЕНИЕ ВЯЗКОСТИ ПРИ НАГРЕВАНИИ ВОДНЫХ РАСТВОРОВ БЛОК-СОПОЛИМЕРОВ ЭТИЛЕН- И ПРОПИЛЕНОКСИДА, НЕ СОПРОВОЖДАЮЩЕЕСЯ ОБРАЗОВАНИЕМ ГЕЛЯ
Ю. М. Домнина a, Е. С. Жаворонок a, *, В. В. Суслов a, Д. В. Решетняк a, b, С. А. Кедик a, b
a МИРЭА – Российский технологический университет
119571 Москва, пр. Вернадского, 86, Россия
b Акционерное общество “Институт фармацевтических технологий”
121353 Москва, Сколковское ш., 21, офис 1, Россия
* E-mail: zhavoronok@mirea.ru
Поступила в редакцию 20.01.2022
После доработки 15.02.2022
Принята к публикации 21.02.2022
- EDN: CDQAGJ
- DOI: 10.31857/S2308112022200019
Аннотация
Методами реовискозиметрии и динамического рассеяния света исследованы водные растворы блок-сополимеров этилен- и пропиленоксида (полоксамеров) с молекулярной массой (2.2–15.0) × 103 и относительным содержанием звеньев пропиленоксида 19.9–57.0 мол. %. Установлены температурные и концентрационные зависимости свойств растворов, а также описаны особенности их термообратимого поведения в широком диапазоне содержания полимера (4.7–47.2 об. %) и температур (15–75°С). Выделен новый, не описанный ранее для этих объектов тип термообратимого поведения, заключающийся в экстремальном изменении динамической вязкости с увеличением температуры. Это поведение проанализировано в рамках представлений о мицеллярной структуре растворов и связано с изменением гидродинамического размера мицелл полоксамеров. Количественно охарактеризовано влияние молекулярной массы, соотношения звеньев сомономеров и температуры на критические концентрации полоксамера, ограничивающие проявление нового типа термообратимого поведения растворов.
ВВЕДЕНИЕ
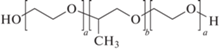
Полоксамеры или плюроники – хорошо известные неионогенные полимеры, представляющие собой блок-сополимеры этиленоксида с пропиленоксидом [1]:
Сочетание в полоксамерах блоков разной гидрофильности обусловливает их необычное поведение в водных растворах по сравнению с гомополимерами – полиэтиленоксидом и полипропиленоксидом [2]. К характерным проявлениям таких свойств относится термообратимое повышение вязкости указанных растворов при увеличении температуры. В связи с этим полоксамеры широко применяют в медицине, фармацевтике и в других областях в качестве поверхностно-активного агента, загустителя и т.д. [3].
Исследованию полоксамеров, в том числе в составе различных композиций, посвящено множество работ [4–7]. Отмечено, что при растворении полоксамера в холодной воде (5 ± 2°С) наблюдается гидратация гидрофильных этиленоксидных (ЭО) звеньев, в то время как более гидрофобные пропиленоксидные (ПО) фрагменты локализуются внутри макромолекулярного клубка [8]. При достаточной концентрации в водных растворах макромолекулы полоксамеров объединяются в мицеллы, внутри которых сосредоточены пропиленоксидные звенья, а снаружи – более гидрофильные этиленоксидные. При повышении температуры раствора происходит перестройка конформации фрагментов молекул, составляющих мицеллу, она расширяется и получает возможность контактировать с соседними мицеллами. Результатом этого является образование нетекучего геля, как это описано авторами работ [9–11].
Определяющими факторами гелеобразования можно считать молекулярную массу полоксамера, соотношение звеньев сомономеров в нем, а также концентрацию раствора [12]. В ряде работ [13, 14] указано, что гель образуется только при концентрации выше критической концентрации мицелообразования, тогда как при более низких концентрациях раствор остается текучим и термообратимое повышение вязкости с температурой отсутствует. Однако в ходе разработки составов назального спрея, содержащего налтрексона гидрохлорид [15] при концентрации полоксамера ниже ККМ мы впервые обнаружили необычное поведение его растворов, характеризующееся термообратимым повышением вязкости без образования геля. В связи с этим целью настоящей работы – подробное исследование термического поведения полоксамеров при концентрациях равных и ниже ККМ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Основными объектами исследования служили полоксамеры Kolliphor™ (“Geismar”, США) различной молекулярной массы и с разным соотношением сомономерных звеньев (табл. 1).
Таблица 1.
Основные характеристики полоксамеров
| Полоксамер | Физическая форма | Молекулярная масса М × 10–3 | Температура плавления, °С [16] | Соотношение звеньев этиленоксида и пропиленоксида | |
|---|---|---|---|---|---|
| а : b | NЭО: NПО, мол. % | ||||
| Kolliphor™ P 124 | Жидкость | 2.2 | 16 | 12 : 20 | 43 : 57 |
| Kolliphor™ P 237 | Твердое вещество | 7.7 | 49 | 61 : 40 | 66 : 34 |
| Kolliphor™ P 188 | Твердое вещество | 8.4 | 52 | 76 : 30 | 76 : 24 |
| Kolliphor™ P 407 | Твердое вещество | 12.8 | 56 | 100 : 69 | 65 : 35 |
| Kolliphor™ P 338 | Твердое вещество | 15.0 | 57 | 141 : 44 | 80 : 20 |
Растворы готовили в воде очищенной по общей методике: навеску полоксамера смешивали с половиной расчетного количества воды, предварительно охлажденной до 5 ± 2°С и термостатировали при этой температуре не менее 12 ч. По истечении данного времени раствор нагревали до комнатной температуры (23 ± 2°С) и выдерживали при ней в течение 30 мин. Затем вносили оставшуюся часть воды, перемешивали до получения оптически прозрачного гомогенного раствора и выдерживали 30 мин при той же температуре для удаления пузырьков воздуха.
Динамическую вязкость водных растворов полоксамеров измеряли на ротационном вискозиметре Брукфильда с рабочим узлом в виде коаксиальных цилиндров, снабженным термостатируемой ячейкой. Эксперимент проводили при скоростях сдвига 10–120 с–1 при постоянной температуре в диапазоне 15–75°С в широком интервале концентраций растворов 4.7–47.2 об. %.
Размер частиц в водных растворах полоксамеров оценивали методом динамического рассеяния света на анализаторе частиц “Delsa Nano C” (“Beckman Coulter”, США) при постоянной температуре 25, 35 или 50°С.
Уравнение регрессии рассчитывали в соответствии со стандартной методикой [17].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
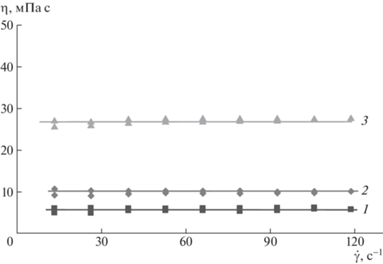
Исследование водных растворов полоксамеров показало, что в условиях эксперимента образцы проявляют ньютоновское поведение (рис. 1). Это позволяет в дальнейшем характеризовать растворы единственным значением динамической (ньютоновской) вязкости.
Рис. 1.
Типичные вязкостно-скоростные кривые для растворов полоксамеров на примере Kolliphor™ P 407 с концентрацией 4.7 (1), 10.4 (2) и 14.2 об. % (3). Цветные рисунки можно посмотреть в электронной версии.
Систематические исследования концентрационных (рис. 2) и температурных (рис. 3) зависимостей динамической вязкости растворов полоксамеров позволили выделить различные типы их термообратимого поведения. Концентрационные зависимости (рис. 3) имеют вид, обычный для растворов полимеров, однако взаимное расположение кривых показывает, что ожидаемого уменьшения вязкости раствора с повышением температуры не происходит. В двойных логарифмических координатах (рис. 2, вставка) указанные зависимости линеаризуются, причем тангенс угла наклона полученных прямых, соответствующий скейлинговому показателю степени δ в выражении η ~ φδ [18], изменяется в диапазоне от 1.56 до 3.70 с повышением температуры от 15 до 60°С. Таким образом, в исследуемых системах возможны взаимодействия по типу ассоциации, вероятность которых в общем возрастает с повышением температуры.
Рис. 2.
Типичные концентрационные зависимости динамической вязкости полоксамеров на примере Kolliphor P237 при температуре 15 (1), 25 (2), 35 (3), 45 (4) и 60°С (5). На вставке приведены двойные логарифмические анаморфозы этих зависимостей.
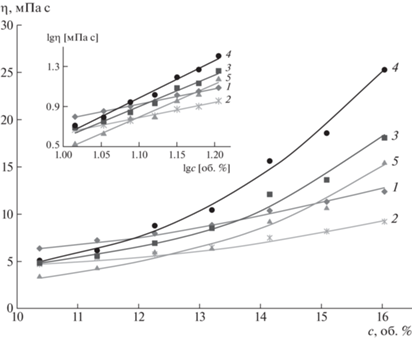
Рис. 3.
Типичные температурные зависимости динамической вязкости полоксамеров на примере Kolliphor P338 при его концентрации 5.7 (1), 9.4 (2), 10.4 (3), 11.3 (4), 12.3 (5), 13.2 (6) и 14.2 об. % (7).
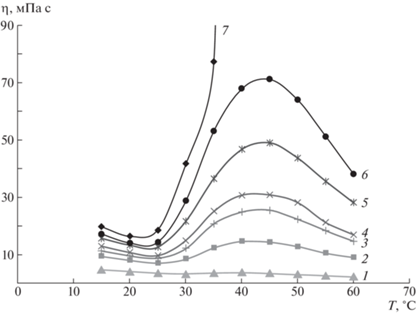
В то же время температурные кривые (рис. 3) в исследованной области концентраций можно разделить на три основных типа. При сравнительно низких содержаниях полоксамера растворы проявляют обычное для растворов полимеров поведение – уменьшение вязкости с увеличением температуры (рис. 3, кривая 1). Однако при более высоких концентрациях, начиная с некоторой температуры, вязкость заметно возрастает, причем зависимость представляет собой кривую с максимумом (рис. 3, кривые 2–6). Такой тип термообратимого поведения растворов полоксамеров не был описан в известной нам литературе и является новым. Наконец, при наибольших исследованных концентрациях повышение вязкости растворов при увеличении температуры заканчивается образованием геля – в этих случаях температурная зависимость вязкости круто возрастает и стремится к бесконечной величине η (рис. 3, кривая 7). Зависимости последнего типа характерны для описанных в литературе термообратимых растворов полоксамеров, способных к образованию нетекучего геля. Следует отметить, что значения температур, соответствующих максимумам и минимумам на кривых 2–6 (рис. 3), имеют общую тенденцию понижаться с повышением концентрации раствора.
Обобщение и интерпретацию полученных данных мы проводили на основании опубликованных сведений о надмолекулярной структуре молекул полоксамеров в водных растворах. Как было отмечено, эти блок-сополимеры проявляют свойства неионогенных поверхностно-активных веществ и выше некоторой концентрации способны образовывать мицеллоподобные упорядоченные структуры. Указанная концентрация – критическая концентрация мицеллообразования представляет собой пороговое значение, ниже которого молекулы полоксамера не образуют мицелл, а раствор представляет собой сравнительно бесструктурную систему, близкую к истинному раствору. Выше ККМ в растворах полоксамеров содержатся мицеллы, находящиеся в равновесии с неструктурированными макромолекулами. Таким образом, ККМ – важнейшая характеристика исследуемых растворов, которая может быть определена из концентрационных зависимостей динамической вязкости методом касательных (рис. 4) (обработку методом касательных проводили в соответствии с работой [19] с погрешностью 5–7%). Данные о ККМ, полученные при 25°С, представлены в табл. 2. Для сравнения там же представлены некоторые значения ККМ, опубликованные в литературе [20–23].
Рис. 4.
Пример определения критической концентрации мицеллообразования (1) и критической концентрации предгелеобразования (2) по концентрационной зависимости вязкости. Представлены данные для водного раствора полоксамера Kolliphor P188 при 25 (1) и 65°С (2).
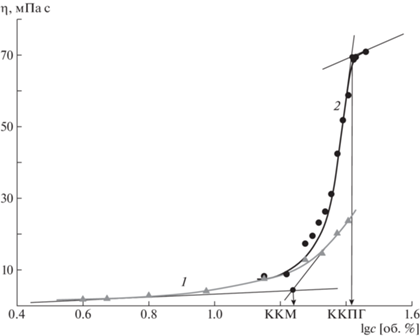
Следует отметить, что полученные результаты не всегда соответствуют известным из литературы данным. Разброс значений ККМ отмечается не только в работах разных авторов [25–27], но даже в работах одних и тех же исследователей [28, 29]. Это может быть связано с различием методов и условий (прежде всего температуры) определения ККМ, но также не исключено изменение механизмов мицеллообразования и гелеобразования [30, 31]. Интересно, что полученные значения ККМ в большинстве случаев ниже концентрации 16 об.%, соответствующей порогу перколяции твердых сфер [32, 33], что указывает на возможность взаимодействия сформировавшихся мицелл между собой, вероятность которого повышается с дальнейшим ростом концентрации полоксамера.
Для исследованных образцов ККМ корректно можно определить лишь в области температур, близких к комнатной – там, где реализуется обычный механизм течения (уменьшение значений вязкости при увеличении значений температуры). При повышении температуры для большинства составов вязкость начинает возрастать и образование мицелл перестает быть основным процессом, отвечающим за этот эффект. В результате формируется загущенная, но текучая структура, для которой возможно измерить вязкость. Мы предлагаем называть ее предгелем, а критическую концентрацию, до достижения которой можно наблюдать максимум динамической вязкости на температурных зависимостях, критической концентрацией предгелеобразования (ККПГ). Определение ККПГ (рис. 4, кривая 2) проводится аналогично определению ККМ (рис. 4, кривая 1), а полученные результаты сведены в табл. 2. Необходимо отметить, что для каждой марки полоксамера образование предгеля (достижение максимума вязкости) наблюдается при разных температурах, значения которых также представлены в табл. 2.
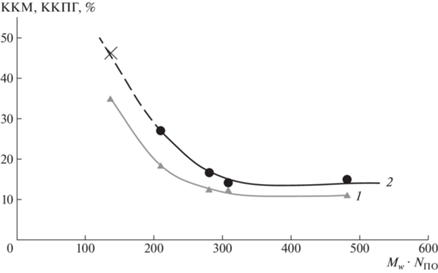
Полученные данные позволяют утверждать, что на значения ККМ и ККПГ влияют молекулярно-массовые характеристики полоксамеров (средняя молекулярная масса и соотношение звеньев сомономеров), а также температура эксперимента. При 25°С зависимость ККМ от среднемассовой молекулярной массы полоксамеров Mw и относительного содержания полиоксипропиленовых звеньев NПО можно приближенно выразить уравнением:
(1)
${\text{KKM}}({{M}_{w}},{{N}_{{{\text{ПО}}}}}) = 21.67 - 1.19{{M}_{w}} + 0.23{{N}_{{{\text{ПО}}}}},$(2)
${\text{KKПГ}}({{M}_{w}},{{N}_{{{\text{ПО}}}}}{\text{,T}}) = - 12.3 + 0.18{{N}_{{{\text{ПО}}}}} + 0.53T,$Рис. 5.
Типичные зависимости ККМ при 25°С (1) и ККПГ (2) от произведения молекулярной массы и концентрации оксипропиленовых звеньев.
Представление о мицеллярной структуре растворов полоксамеров позволяет предположить, что их нетипичное поведение в области концентраций между ККМ и ККПГ связано с расширением мицелл при повышении температуры. Для проверки этого предположения были проведены дополнительные исследования растворов методом динамического светорассеяния (рис. 6).
Рис. 6.
Типичное распределение числа частиц по размерам для водных растворов полоксамеров на примере Kolliphor™ P 407 с концентрацией 11.8 об. % при 25 (1), 35 (2) и 50°С (3).
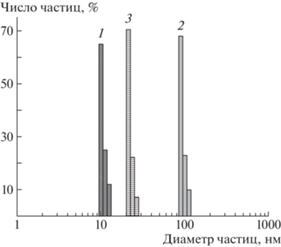
В водных растворах полоксамеров были зафиксированы центры светорассеяния, которые мы интерпретировали как мицеллы макромолекул полоксамера. На примере полоксамера Kolliphor™ P 407 (рис. 6) видно, что при повышении температуры от 25 до 35°С средний размер наблюдаемых частиц увеличивается практически на порядок – от 10 до 100 нм, а при дальнейшем росте температуры до 50°С наблюдается его уменьшение до 30 нм. Таким образом, изменение температуры сильно влияет на гидродинамический размер мицелл.
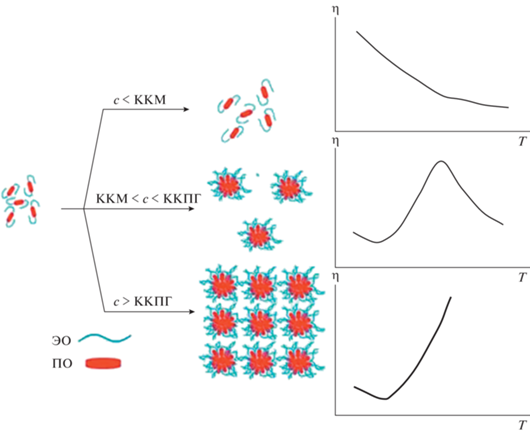
Сопоставление и анализ полученных результатов вискозиметрии и светорассеяния позволяют предложить схему, объясняющую поведение водных растворов полоксамеров в области концентраций от ККМ до ККПГ (рис. 7). Первый и третий случаи, когда концентрация полоксамера находится ниже ККМ или выше ККПГ описаны в работах [1, 34]. Как уже было отмечено выше, при низкой концентрации полоксамера в водном растворе (c < ККМ) макромолекулы не образуют мицелл, а раствор представляет собой сравнительно бесструктурную систему, близкую к истинному раствору. В связи с этим температурная зависимость динамической вязкости от температуры такого раствора соответствует классической закономерности аррениусовского типа [35]. При высоких концентрациях полоксамера в растворе (c > ККПГ), заведомо превышающей порог перколяции твердых сфер, макромолекулы образуют достаточное количество мицелл, которые при повышении температуры увеличиваются в объеме и вступают в контакт между собой. Следствием такого взаимодействия является образование достаточно плотной физической сетки мицелл, которая обеспечивает образование нетекучего геля, как это было отмечено в работах [14, 36]. В промежуточной области концентраций полоксамера (ККМ < c < ККПГ) выше порога перколяции мицеллы также образуются, но их концентрация, по-видимому, недостаточна для образования физической сетки. Тем не менее, на начальном этапе, по-видимому, за счет конформационных перестроек макромолекул в мицеллах, происходит увеличение гидродинамического объема этих структур и возрастает вероятность их взаимодействия. При достижении определенной температуры такая структурированная система, которая не образуют плотной сетки, но и не может дальше расширяться, снова подчиняться обычному аррениусовскому характеру – значения вязкости уменьшаются с увеличением температуры.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования получены концентрационные и температурные зависимости динамической вязкости, а также определен размер частиц в водных растворах полоксамеров с молекулярной массой (2.2–15.0) × 103 и относительным содержанием звеньев пропилен-оксида 19.9–57.0 мол. %. Установлено, что растворы проявляют ньютоновское поведение при сдвиговом течении. Выделены три типа термообратимого поведения растворов, переходы между которыми характеризуются двумя критическими концентрациями – ККМ и введенной нами критической концентрацией предгелеобразования. В интервале между ними водные растворы полоксамеров проявляют новый, не описанный ранее в литературе тип термообратимого поведения для этих объектов – экстремальную зависимость динамической вязкости от температуры с максимумом. Такое поведение растворов объяснено на основе предположений об их мицеллярной структуре и связано с эффектом расширения мицелл полоксамеров в растворах при нагревании.
Работа выполнена с использованием оборудования Центра коллективного пользования Российского технологического университета МИРЭА при поддержке Министерства образования и науки Российской Федерации.
Список литературы
Russo E., Villa C. // Pharmaceutics. 2019. V. 11. № 12. P. 671.
Mortensen K. // J. Phys., Condens. Matter. 1996. V. 8. P. A103.
Djekic L., Krajisnik D., Martinovic M., Djordjevic D., Primorac M. // Int. J. Pharm. 2015. V. 490. № 1–2. P. 180.
Kabanov A.V., Batrakova E.V., Alakhov V.Y. // J. Controlled Release. 2002. V. 82. № 2–3. P. 189.
Rey-Rico A., Cucchiarini M. // Int. J. Molec. Sci. 2018. V. 19. № 3. P. 775.
Zarrintaj P., Ramsey J.D., Samadi A., Atoufi Z., Yazdi M.K., Ganjali M.R., Amirabad L.M., Zangene E., Farokhi M., Formela K., Saeb M., Mozafari M., Thomas S. // Acta Biomater. 2020. V. 110. P. 37.
Jalaal M., Cottrell G., Balmforth N., Stoeber B. // J. Rheol. 2017. V. 61. № 1. P. 139.
Adhikari U., Goliaei A., Tsereteli L., Berkowitz M.L. // J. Phys. Chem. B. 2016. V. 120. № 26. P. 5823.
de Francisco L.M.B., Rosseto H.C., de Toledo L.D.A.S., dos Santos R.S., de Souza Ferreira S.B., Bruschi M.L. // J. Mol. Liq. 2019. V. 289. P. 111170.
da Silva J.B., Cook M.T., Bruschi M.L. // Carbohydr. Polym. 2020. V. 240. P. 116268.
Devi D.R., Sandhya P., Hari B.N.V. // J. Pharmaceut. Sci. Res. 2013. V. 5. № 8. P. 159.
Cabana A., Aït-Kadi A., Juhász J. // J. Colloid Interface Sci. 1997. V. 190. № 2. P. 307.
Pereira G.G., Dimer F.A., Guterres S.S., Kechinski C.P., Granada J.E., Cardozo N.S.M. // Quim. Nova. 2013. V. 36. № 8. P. 1121.
Wanka G., Hoffmann H., Ulbricht W. // Colloid Polym. Sci. 1990. V. 268. P. 101.
Домнина Ю.М., Кедик С.А., Суслов В.В., Шняк Е.А. // Разработка и регистрация лекарственных средств. 2018. № 4. С. 73.
Пат. 2016135431 Россия. 2018.
Гмурман В.Е. Теория вероятностей и математическая статистика: учебник для вузов. М.: Юрайт, 2021.
De Gennes P. Scaling Concepts in Polymer Physics. London: Cornell Univ. Press, 1979.
Лобко В.Н. Математические методы в химии и химической технологии. Численные методы решения алгебраических задач и обработки функций: учебное пособие. Владимир: Изд-во Владимирского гос. ун-та, 2019.
Alexandridis P., Hatton T.A. // Colloids Surf. A. 1995. V. 96. № 1–2. P. 1.
Lopes J.R., Loh W. // Langmuir. 1998. V. 14. № 4. P. 750.
Wanka G., Hoffmann H., Ulbricht W. // Macromolecules. 1994. V. 27. № 15. P. 4145.
Bohorquez M., Koch C., Trygstad T., Pandit N. // J. Colloid Interface Sci. 1999. V. 216. № 1. P. 34.
Gyulai G., Magyar A., Rohonczy J., Orosz J., Yamasaki M., Bősze S., Kiss É. // Express Polym. Lett. 2016. V. 10. № 3. P. 216.
Zhou A., Chu B. // Macromolecules. 1988. V. 21. № 8. P. 2548.
Linse P. // Macromolecules. 1994. V. 27. № 10. P. 2685.
Linse P. // Macromolecules. 1994. V. 27. № 22. P. 6404.
Batrakova E.V., Huai-Yun H., Alakhov V.Yu., Miller D.W., Kabanov A.V. // Pharm. Res. 1998. V. 15. № 6. P. 850.
Kabanov A.V., Nazarova I.R., Astafieva I.V., Batrakova E.V., Alakhov V.Yu., Yaroslavov A.V., Kabanov V.A. // Macromolecules. 1995. V. 28. № 7. P. 2303.
Holland R.J., Parker E.J., Guiney K., Zeld F.R. // J. Phys. Chem. 1995. V. 99. № 31. P. 11981.
Meguro K., Ueno M., Esumi K. // Nonionic Surfactants Physical Chemistry. New York: Marcel Dekker, 1987.
Иржак В.И. // Коллоид. журн. 2021. Т. 83. № 1. С. 51.
Эфрос А.Л. Физика и геометрия беспорядка. М.: Наука, 1982.
Prud’homme R.K., Wu G., Schnaider D.K. // Langmuir. 1996. V. 12. P. 4651.
Тагер А.А. Физикохимия полимеров. М.: Научный мир, 2007.
Rassing J., Attwood D. // Int. J. Pharm. 1983. V. 13. № 1. P. 47.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)