Высокомолекулярные соединения (серия А), 2022, T. 64, № 5, стр. 348-357
pH-ЧУВСТВИТЕЛЬНЫЕ МИКРОСФЕРЫ АЛЬГИНАТА КАЛЬЦИЯ, МОДИФИЦИРОВАННЫЕ ХИТОЗАНОМ, ДЛЯ ИММОБИЛИЗАЦИИ АНТИБИОТИКА ЦЕФОТАКСИМА
С. В. Шилова a, *, Г. М. Миргалеев a, В. П. Барабанов a
a Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
* E-mail: s_shilova74@mail.ru
Поступила в редакцию 05.04.2022
После доработки 11.05.2022
Принята к публикации 25.05.2022
- EDN: LRLEMR
- DOI: 10.31857/S2308112022700109
Аннотация
Методом ионотропного гелеобразования получены pH-чувствительные микросферы альгината кальция, модифицированные хитозаном, со средним диаметром 2.0 ± 0.05 мм для иммобилизации антибиотика цефотаксима. Эффективность инкапсулирования цефотаксима 95–97%. Методами кондуктометрии и динамического светорассеяния изучено формирование полиэлектролитного комплекса альгинат–хитозан в средах с различным значением pH. Установлено, что набухание микросфер и высвобождение цефотаксима из них в условиях in vitro в среды, имитирующие биологические жидкости в организме человека при пероральной доставке, являются pH-зависимыми процессами. Анализ кинетических данных набухания микросфер и высвобождения лекарственного средства в рамках математической модели Корсмейера–Пеппаса продемонстрировал отклонение механизма диффузии от классического фиковского механизма, вероятной причиной которого может быть взаимодействие лекарственного средства с полимерной матрицей. Показано, что наличие поверхностного слоя хитозана на микросферах альгината кальция позволяет увеличить время высвобождения цефотаксима.
ВВЕДЕНИЕ
Разработка систем контролируемой диффузии и переноса лекарственных средств вызывает большой интерес, так как они способны обеспечить адресную доставку активных лекарственных компонентов к патологическим образованиям, органам и тканям человека. Такие системы обладают рядом преимуществ по сравнению с традиционными препаратами: уменьшение дозировки лекарства, снижение частоты и интенсивности побочных эффектов, высокая избирательность фармакологической активности и длительный лечебный эффект [1–4].
Полимерные гидрогели успешно применяются в качестве носителей лекарственных средств. Особый интерес представляют так называемые умные (“smart”) гели, способные реагировать в ответ на небольшие изменения внешних условий, к которым относятся температура, свойства среды, электрическое или магнитное поле, а также величина pH. Различия физиологического рН в нормальном и патологическом состояниях в органах и тканях человека делает возможным использование рН-чувствительных полимерных гидрогелей для направленной доставки лекарственных веществ.
Альгинат натрия (Alg-Na) является биоразлагаемым нетоксичным полимером, который демонстрирует хорошие гелеобразующие свойства в присутствии двухзарядных катионов, и используется для иммобилизации лекарственных средств, липосом, живых клеток [5–7]. Однако достаточно часто недостатком индивидуальных полимерных носителей является быстрое высвобождение лекарственного средства из геля, что приводит к неэффективному расходованию биологически активного вещества и снижению терапевтического эффекта. Для обеспечения пролонгированного режима выхода лекарства из полимерных гелей используют модификацию полимерной матрицы другими полимерами или сшивающими агентами, которая может повлечь изменения как химической, так и физической структуры полимера [8, 9].
Перспективным полимером для модификации гелевых частиц альгината является природный физиологически активный полимер хитозан [6, 10–12]. Чувствительность данных полимеров к pH и их полиэлектролитная природа обеспечивают возможность применения комплексов на основе альгинатов и хитозана в разработке носителей для специфической доставки и контролируемого высвобождения лекарственных средств. Для проведения модификации поверхности частиц альгината хитозаном используются два основных метода: коацервация полимеров и формирование слоя хитозана при введении готовых гелевых частиц альгината в раствор хитозана [6, 11]. Однако изучению влияния способа модификации альгинатных частиц хитозаном на строение и свойства образующихся микросфер уделяется недостаточное внимание. Вместе с тем, условия формирования гелевых частиц определяют особенности взаимодействия полиэлектролитов друг с другом и взаимодействия полимерных компонентов с лекарственным средством, что в итоге отражается на эффективности его инкапсулирования и фармакокинетических профилях высвобождения в различных средах.
В качестве модельного лекарственного средства использовали натриевую соль цефотаксима. Это β-лактамный антибиотик III поколения, имеющий в своей структуре карбоксильную и аминотиазольную группы. Выбор данного лекарственного средства обусловлен тем, что антибиотики цефалоспоринового ряда широко применяются в лечении инфекционных заболеваний, малотоксичны и, соответственно, могут использоваться в виде водных растворов с высокой концентрацией.
Цель настоящей работы заключалась в получении pH-чувствительных гелевых микросфер альгината кальция, модифицированных хитозаном различными способами, для иммобилизации цефотаксима, обеспечивающих высокую эффективность инкапсулирования антибиотика и его контролируемое высвобождение.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе применяли образцы натриевой соли альгиновой кислоты с молекулярной массой М = = 1.08 × 105 (“Molecularmeal”, Россия) и хитозана с М = 3.8 × 104, степенью деацетилирования 80% (Закрытое акционерное общество “Биопрогресс”, Россия). Фармацевтический препарат натриевой соли цефотаксима, торговое название “Лифоран” (Акционерного общества “Фармасинтез”, Россия), использовали без дополнительной очистки. При приготовлении растворов использовали бидистиллированную воду, которую получали на установке “Бидистиллятор стеклянный БС” (Публичное акционерное общество “Химлаборприбор”, Россия). Чистоту воды контролировали по величине удельной электропроводности, которая составляла (1.0–3.0) мкСм/см.
Синтез полиэлектролитных комплексов (ПЭК) осуществляли путем смешения эквимольных растворов хитозана с концентрацией 0.01 осн-моль/л в 0.1 моль/л растворе HCl с водным раствором Alg-Na (0.01 осн-моль/л) в различных объемных соотношениях VAlg-Na : Vхитозан. Смеси интенсивно перемешивали на магнитной мешалке 1 ч и выдерживали в течение суток при комнатной температуре. Состав смесей полиэлектролитов выражали в виде отношения концентрации [Alg-Na] : : [хитозан] и изменяли его в интервале от 0 до 5.
Для получения гелевых микросфер альгината кальция (Alg-Сa) 2 мл 2%-ного (0.1 осн-моль/л) водного раствора Alg-Na, содержащего цефотаксим определенной концентрации, добавляли капельно с помощью шприцевого насоса “Shenchen ISPLab01” (скорость подачи 0.2 мл/мин) в раствор 0.1 моль/л СаСl2 ⋅ 2H2O (квалификация х.ч.; Акционерное общество “Реахим”, Россия) объемом 10 мл. Содержание цефотаксима (емкость загрузки) в образцах составляла 125 мг/г. После получения гелевые частицы несколько раз промывали бидистиллированной водой и сушили при комнатной температуре в течение 24 ч. Модификацию микросфер Alg-Сa хитозаном проводили двумя способами. В первом способе 2%-ный водный раствор Alg-Na с лекарственным средством добавляли в раствор СаСl2 (0.1 моль/л), содержащий хитозан 0.25% (0.0125 осн-моль/л). Во втором способе модификации 20 мг предварительно полученных по описанной выше методике микросфер Alg-Сa, содержащих цефотаксим, помещали на 5 мин в раствор хитозана (0.25%) объемом 10 мл. Дальнейшую обработку модифицированных образцов проводили так же, как в случае немодифицированных хитозаном гелевых частиц. Для оценки размера, формы и поверхности сферических частиц использовали поляризованный микроскоп “BX-51” (“Olympus”, Япония). Средний диаметр микросфер устанавливали по выборке из пяти образцов.
Эффективность иммобилизации цефотаксима в микросферах Alg-Сa определяли по разности исходного количества лекарственного средства, взятого для включения в микросферы, и равновесного количества цефотаксима.
Исследования осуществляли в средах, содержащих 0.1 моль/л HCl (pH 2.0) и фосфатно-солевой буфер (pH 7.2), имитирующих биологические жидкости в организме человека при пероральной доставке.
Для исследования деградации микросфер в кислых средах брали 10 мг микросфер и выдерживали в 10 мл 0.1 моль/л HCl в течение не менее 6 ч при комнатной температуре. Микросферы периодически извлекали из раствора HCl, промывали дистиллированной водой, выделяли, высушивали и взвешивали на аналитических весах. Потерю массы микросфер W выражали в виде отношения массы микросфер в момент времени t к ее исходной массе.
При изучении набухания 10 мг микросфер выдерживали в 10 мл фосфатно-солевого буфера в течение 6 ч при комнатной температуре. Микросферы периодически извлекали из буферного раствора, при помощи фильтровальной бумаги удаляли с их поверхности влагу и взвешивали. Равновесную степень набухания H (%) рассчитывали по формуле:
где Wt – масса влажных микросфер в момент времени t (мг), W0 – масса сухих микросфер до выдержки в фосфатно-солевом буфере (мг).Удельную электропроводность смесей полиэлектролитов измеряли с помощью кондуктометра “SevenCompact S-230” (“Mettler Toledo”, США). Дзета-потенциал ПЭК устанавливали методом динамического рассеяния света на анализаторе размера частиц серии “Zetasizer Nano-ZS” (“Malvern Instruments Ltd.”, Великобритания), оснащенном гелий-неоновым лазером (633 нм, 4 мВт). Определение дзета-потенциала проводили методом электрофоретического рассеяния света с применением технологии M3-PALS. Перед выполнением измерений образцы фильтровали через фильтры “Millipore” с мембраной Durapore PVDF и диаметром пор 0.45 мкм.
Анализ механизма транспорта воды и цефотаксима в гелевых микросферах осуществляли в рамках модели Корсмейера–Пеппаса [13], которая описывается уравнением
(2)
${{{{m}_{t}}} \mathord{\left/ {\vphantom {{{{m}_{t}}} {{{m}_{\infty }}}}} \right. \kern-0em} {{{m}_{\infty }}}} = k{{t}^{n}}$Здесь mt – количество вещества в момент времени t (мг); m∞ – равновесное количество вещества (мг); k – константа, связанная с параметрами взаимодействия полимер–диффундирующее вещество; n – показатель, характеризующий механизм переноса низкомолекулярного вещества.
Коэффициенты диффузии воды и лекарственного средства в гелевых образцах находили в рамках второго закона Фика. Решение этого уравнения для малых времен эксперимента (${{{{m}_{t}}} \mathord{\left/ {\vphantom {{{{m}_{t}}} {{{m}_{\infty }}}}} \right. \kern-0em} {{{m}_{\infty }}}} \leqslant 0.5$) имеет вид [14]
(3)
${{{{m}_{t}}} \mathord{\left/ {\vphantom {{{{m}_{t}}} {{{m}_{\infty }}}}} \right. \kern-0em} {{{m}_{\infty }}}} = {{({{16Dt} \mathord{\left/ {\vphantom {{16Dt} {\pi {{r}^{2}}}}} \right. \kern-0em} {\pi {{r}^{2}}}})}^{{0,5}}},$В работе коэффициент диффузии воды и цефотаксима вычисляли по уравнению
(4)
$D = \frac{{0.25\pi {{r}^{2}}}}{{16{{t}_{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}}}}$Кинетику высвобождения цефотаксима из микросфер изучали в условиях in vitro при температуре 37°С. Образцы микросфер массой 10 мг помещали в ячейку с 0.1 моль/л HCl или фосфатно-солевым буфером объемом 10 мл. Высвобождение цефотаксима в приемную среду контролировали спектрофотометрически с помощью сканирующего двухлучевого спектрофотометра “Lambda 35” (“Perkin Elmer Instrumental”, США). Пробу объемом 3 см3 отбирали и переносили в кварцевую кювету, после измерения сразу возвращали обратно в приемную среду. Выход цефотаксима из микросфер Alg-Сa оценивали по отношению количества лекарственного средства gt, высвободившегося из микросфер к моменту времени t, и равновесного количества цефотаксима g∞:
Моментом равновесия считали установление в растворе постоянной концентрации цефотаксима. Количество цефотаксима, высвободившегося из микросфер, рассчитывали по величине оптической плотности при длине волны 262 нм с использованием калибровочной зависимости. Предварительно установили, что зависимость оптической плотности от концентрации цефотаксима подчиняется закону Бугера–Ламберта–Бера при длине волны 262 нм, соответствующей максимуму поглощения лекарственного средства, в диапазоне концентрации 10–50 мкг/мл. Мольный коэффициент экстинкции цефотаксима в 0.1 моль/л HCl составил 2.28 × 104 л/моль см, в фосфатно-солевом буфере – 1.82 × 104 л/моль см.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Альгинат натрия проявляет способность к ионотропному гелеобразованию в присутствии двухзарядных катионов, таких, например, как катион кальция. Пространственная сетка геля образуется за счет взаимодействия карбоксильных групп альгината с катионами Ca2+ и дополнительно стабилизируется координационными связями между катионами кальция и гидроксильными группами остатков гиалуроновой кислоты [7]. В предварительно проведенных исследованиях нами было изучено влияние концентрации альгината натрия, температуры и времени его растворения, скорости подачи полимера в раствор CaCl2, концентрации хлорида кальция и содержания цефотаксима на размер, форму и структуру поверхности гелевых частиц Alg-Сa [15].
Полученные при подобранных значениях концентрации Alg-Na (2%) и CaCl2 (0.1 моль/л), емкости загрузки лекарственного средства (125 мг/г), скорости подачи полимера в раствор CaCl2 (0.2 мл/мин) сферические гелевые частицы Alg-Сa имели средний диаметр 2.0 ± 0.05 мм, отличались прозрачностью и обладали плотной однородной структурой. Эффективность включения цефотаксима в микросферы Alg-Сa составила 96 ± 1%.
Модификацию микросфер Alg-Сa хитозаном проводили двумя способами. В первом способе 2%-ный водный раствор Alg-Na с цефотаксимом добавляли в раствор СаСl2, содержащий хитозан (0.25%). Во втором способе предварительно приготовленные микросферы Alg-Сa с иммобилизованным цефотаксимом вводили в раствор хитозана той же концентрации. Эффективность включения цефотаксима в модифицированные хитозаном частицы альгината, полученные обоими способами, оказалась также очень высокой и составила 95 ± 1 и 97 ± 1% соответственно. Микросферы имели средний размер 2.0 ± 0.05 мм.
В обоих способах проведения модификации частиц альгината хитозаном сначала происходит формирование альгинатных частиц (“ядер”), а затем на их поверхность наслаивается хитозановое покрытие (“оболочка”). Согласно литературным данным, причиной такой последовательности процесса является бóльшая, чем у макромолекул хитозана, подвижность катионов кальция Ca2+, которые за счет координации с гиалуроновыми звеньями альгината быстро образуют гелевые частицы [6]. Формирование слоя хитозана на поверхности микросфер альгината протекает значительно медленнее. Процесс завершается образованием оболочки хитозана на предварительно сформированных ядрах Alg-Сa. Таким образом, в обоих способах модификации формировались микросферы, представляющие собой гель, покрытый снаружи эластичной гелеобразной оболочкой, т.е. структуру “гель в геле” или “ядро-оболочка”.
Образование адсорбционного слоя хитозана на поверхности микросфер альгината происходит посредством формирования ПЭК между макромолекулами полиэлектролитов вследствие электростатического взаимодействия протонированных аминогрупп хитозана и карбоксильных групп альгината. Известно, что ПЭК являются полимерными системами, восприимчивыми к незначительным изменениям внешних факторов, например величине pH среды [16].
Для выявления характера влияния pH среды на состояние модифицированных хитозаном микросфер исследовалось взаимодействие Alg-Na с хитозаном в растворе 0.1 моль/л HCl (pH 2.0) и фосфатно-солевом буфере (pH 7.2) методом кондуктометрического титрования.
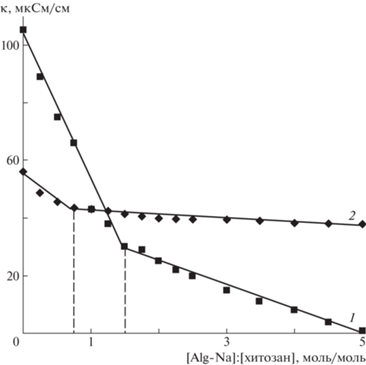
На зависимостях удельной электропроводности смесей Alg-Na и хитозана от их состава имеются выраженные перегибы, что указывает на образование стехиометрического ПЭК (рис. 1). Состав смесей полиэлектролитов, соответствующий формированию данного комплекса, зависит от pH среды. В кислой среде (кривая 1) комплекс обогащен звеньями альгиновой кислоты вследствие неполной диссоциации карбоксильных групп ([Alg-Na] : [хитозан] = 1.5). При pH 7.2 (кривая 2) происходит депротонирование аминогрупп хитозана, состав смеси изменяется ([Alg-Na] : : [хитозан] = 0.75), что свидетельствует о включении в комплекс бóльшего числа звеньев хитозана.
Рис. 1.
Зависимость удельной электропроводности смесей альгината натрия и хитозана от состава [Alg-Na] : [хитозан] при pH 2.0 (1) и 7.2 (2).
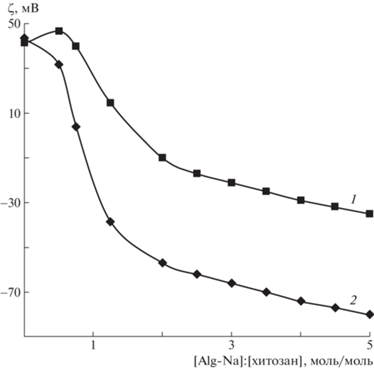
Влияние pH среды на взаимодействие хитозана с Alg-Na подтверждается характером изменения электрокинетического потенциала комплекса от состава смесей полиэлектролитов (рис. 2). Точки на оси ординат характеризуют ζ-потенциал макромолекул хитозана в отсутствие второго полиэлектролита. Введение противоположно заряженного Alg-Na в раствор хитозана приводит к снижению ζ-потенциала за счет компенсации зарядов противоположно заряженных функциональных групп полимеров. Как видно на рисунке, полная нейтрализация аминогрупп хитозана карбоксильными группами альгината и последующая инверсия знака ζ-потенциала ПЭК в кислой среде (кривая 1) наблюдается при бóльшем содержании Alg-Na по сравнению с фосфатно-солевым буфером (кривая 2). Составы, отвечающие нулевому заряду комплексов, соответствуют перегибам на кондуктометрических зависимостях. Таким образом, частицы альгинат–хитозан ведут себя как pH-зависимый полиэлектролитный комплекс.
Рис. 2.
Зависимость электрокинетического потенциала полиэлектролитного комплекса альгинат–хитозан от состава смесей [Alg-Na] : [хитозан] при pH 2.0 (1) и 7.2 (2).
Известно, что основным механизмом высвобождения низкомолекулярных веществ из полимерной матрицы считается диффузия. В ряде случаев десорбция лекарственного средства посредством диффузии сопровождается такими процессами как растворение, набухание и деструкция полимерной матрицы. Однако саму возможность переноса лекарственного средства во внешнюю среду обеспечивает первичный процесс набухания полимера за счет сорбции воды [17, 18]. С увеличением количества воды подвижность макромолекул увеличивается и, следовательно, растет свободный объем, доступный для диффузии.
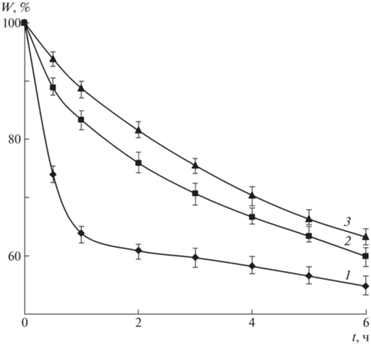
Для прогнозирования кинетики и механизма высвобождения цефотаксима изучено влияние pH среды на состояние микросфер Alg-Сa. Анализ результатов показал, что в кислой среде у всех микросфер отмечается потеря массы, т.е. происходит постепенное растворение полимерной матрицы (рис. 3). В бóльшей степени эффект проявляется для немодифицированных хитозаном микросфер Alg-Сa (кривая 1).
Рис. 3.
Кинетические кривые потери массы в растворе 0.1 моль/л HCl микросфер альгината кальция (1) и микросфер альгината кальция, модифицированных хитозаном, полученных по способу 1 (2) и способу 2 (3).
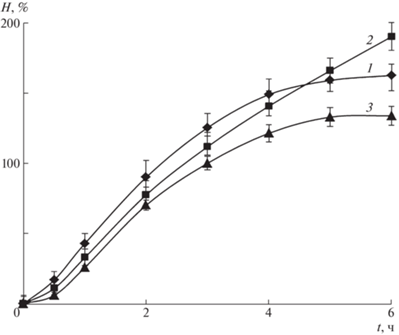
В фосфатно-солевом буфере при pH 7.2 наблюдается набухание микросфер, полученных как без лекарственного средства, так и в присутствии цефотаксима. На рис. 4 в качестве примера приведены кинетические кривые набухания микросфер Alg-Сa и модифицированных хитозаном микросфер в случае отсутствия цефотаксима в полимерной матрице.
Рис. 4.
Кинетические кривые набухания в фосфатно-солевом буфере микросфер альгината кальция (1) и микросфер альгината кальция, модифицированных хитозаном, полученных по способу 1 (2) и способу 2 (3).
Различие в поведении микросфер при pH 2.0 и 7.2 обусловлено, по-видимому, изменением структуры pH-зависимого ПЭК альгинат−хитозан, в котором функциональные группы ПЭК реагируют на изменение состава среды. В нейтральной и слабокислой средах функциональные группы ПЭК хорошо диссоциированы, поэтому образуется комплекс с максимальным количеством связей. В кислых средах при pH 2.0 преобладающие протонированные аминогруппы хитозана связывают все ионизированные карбоксильные группы альгината и препятствуют набуханию микросфер. При pH 7.2 происходит депротонирование аминогрупп хитозана, что ослабляет его взаимодействие с альгинатом в микросферах. Свободные ионизированные группы альгината поглощают воду, что приводит к высокой степени набухания геля.
На процесс набухания микросфер в фосфатно-солевом буфере оказывает влияние присутствие цефотаксима. Микросферы с иммобилизованным антибиотиком имеют более высокую степень набухания по сравнению со свободными гелевыми частицами, полученными без лекарственного средства. Аналогичный результат усиления набухания некоторых гидрогелей в присутствии антибиотиков из группы цефалоспоринов описан в ряде работ [8, 19]. Авторы объясняют изменение параметров набухания гелей дополнительной гидратацией, связанной с присутствием высокогидрофильных лекарственных средств (в случае цефотаксима ММ составляет 455), вследствие чего образуется гидрогель с большим объемом пор.
Для изучения механизма переноса воды в микросферах полученные кинетические закономерности набухания обрабатывали в рамках математической модели Корсмейера−Пеппаса. Преимуществом применения данной модели по сравнению с другими математическими моделями является то, что по значению показателя n можно определить механизм, по которому происходит транспорт воды. Благодаря этому, данная модель наиболее удобна для оценки механизма переноса низкомолекулярных веществ в полимерных пленках, сферах, цилиндрах в том случае, когда механизм транспорта неизвестен или когда одновременно в системе имеют место более одного механизма переноса. Для частиц сферической формы значение n ≤ 0.43 указывает на контролируемый диффузией перенос, протекающий по закону Фика. Промежуточные значения 0.43 < n < < 0.85 соответствуют аномальному транспорту за счет диффузии или релаксации полимера. В случае, когда n ≥ 0.85, наблюдается контролируемый релаксацией полимерной матрицы перенос (Case-II Тransport) [13].
Зависимость степени набухания микросфер от времени, построенная в логарифмических координатах $\lg {{{{m}_{t}}} \mathord{\left/ {\vphantom {{{{m}_{t}}} {{{m}_{\infty }}}}} \right. \kern-0em} {{{m}_{\infty }}}} = f\left( {\lg t} \right)$, позволяет вычислить показатель n в уравнении модели Корсмейера−Пеппаса как угол наклона линейной части зависимости и константу k, характеризующую взаимодействие полимера с диффундирующим веществом. Полученные для исследуемых гелевых микросфер результаты представлены в табл. 1. Так, для всех микросфер величина n > 0.85, что указывает на контролируемый набуханием полимерной матрицы транспорт воды.
Таблица 1.
Кинетические параметры набухания микросфер в фосфатно-солевом буфере (pH 7.2)
| Состав микросфер | t1/2, мин | n | – lgk | D × 108, см2/с |
|---|---|---|---|---|
| Альгинат кальция | 133.3 | 0.918 | 0.014 | 6.14 |
| Альгинат кальция–хитозан (способ 1) | 142.6 | 0.894 | 0.020 | 5.74 |
| Альгинат кальция–хитозан (способ 2) | 135.2 | 0.872 | 0.039 | 6.05 |
| Альгинат кальция–цефотаксим | 174.3 | 0.935 | 0.012 | 4.69 |
| Альгинат кальция–цефотаксим–хитозан (способ 1) | 182.2 | 0.864 | 0.012 | 4.49 |
| Альгинат кальция–цефотаксим–хитозан (способ 2) | 154.2 | 0.920 | 0.071 | 5.31 |
Время t1/2, при котором достигалась половина равновесной величины степени набухания, для каждого типа полученных микросфер в присутствии цефотаксима больше по сравнению со временем набухания сфер без лекарственного средства.
В наблюдаемом нами случае отклонения механизма диффузии воды в микросферах от классического фиковского механизма (n > 0.43), коэффициент диффузии D следует рассматривать как эффективную величину. Данные таблицы показывают, что для всех гелевых микросфер отмечается снижение коэффициентов диффузии воды при иммобилизации цефотаксима. Следует отметить, что способ модификации микросфер альгината хитозаном не столь сильно влияет на параметры набухания микросфер, нежели присутствие лекарственного средства.
Процесс высвобождения цефотаксима из микросфер изучали в условиях in vitro в модельных средах с различным значением pH. Концентрация лекарственного средства была рассчитана по величине оптической плотности на основе закона Бугера–Ламберта–Бера при длине волны 262 нм с использованием калибровочной зависимости для разных сред.
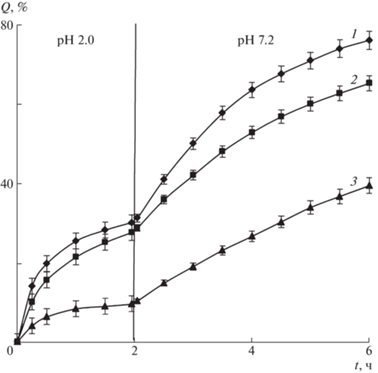
На рис. 5 приведены кинетические кривые высвобождения цефотаксима из микросфер Alg-Сa при различных значениях pH приемной среды. Обращает на себя внимание, что полученные немодифицированные и модифицированные хитозаном микросферы Alg-Сa демонстрируют pH-зависимое высвобождение антибиотика. В кислой среде от 9 до 28% цефотаксима высвобождается за 1–2 ч, в течение которых лекарственная форма, вводимая перорально, обычно остается в желудке человека (кривые 1–3). В фосфатно-солевом буфере наблюдается увеличение скорости высвобождения цефотаксима из микросфер Alg-Сa и сфер, модифицированных хитозаном по первому способу, до 65–76% за 4 ч (кривые 1, 2). Самое медленное высвобождение цефотаксима отмечается для микросфер, модифицированных хитозаном по способу 2 (кривая 3).
Рис. 5.
Кинетические кривые высвобождения цефотаксима из микросфер альгината кальция (1) и модифицированных хитозаном микросфер альгината кальция, полученных по способу 1 (2) и способу 2 (3).
Важнейшим фактором, определяющим механизм доставки лекарственного средства полимерными носителями на основе альгината натрия и хитозана, является комплекс конкурирующих межмолекулярных взаимодействий в сложной системе Alg-Ca–хитозан–цефотаксим–H2O. Помимо комплексообразования между полиэлектролитами, наличие реакционноспособных карбоксильных групп и аминогрупп в молекуле цефотаксима обеспечивает возможность его взаимодействия как с альгинатом, так и хитозаном.
Взаимодействия цефотаксима с хитозаном было изучено методом УФ-спектроскопии. В электронных спектрах растворов цефотаксима в 0.1 моль/л HCl и фосфатно-солевом буфере имеются полосы с максимумом поглощения при 262 нм, что согласуется с литературными данными [20]. Показано, что введение добавок хитозана (0.1–2.0%) в растворы цефотаксима приводит к существенным спектральным изменениям. Отмечается батохромный сдвиг полос поглощения и повышение их интенсивности с ростом концентрации полимера от 0.1 до 2.0%. Полученные данные свидетельствуют о сильном влиянии хитозана на электронную систему цефотаксима, которое обусловлено, по-видимому, комплексообразованием компонентов в результате взаимодействия карбоксильных групп лекарственного средства и протонированных аминогрупп хитозана. Образование комплексов состава 1 : 1 обнаружено также при взаимодействии хитозана с цефотаксимом в растворе уксусной кислоты [21].
Таблица 2.
Параметры высвобождения цефотаксима из микросфер альгината кальция в 0.1 моль/л HCl (pH 2.0) и фосфатно-солевой буфер (pH 7.2)
| Состав микросфер | pH 2.0 | pH 7.2 | ||||
|---|---|---|---|---|---|---|
| t1/2, мин | n | D × 107, см2/с | t1/2, мин | n | D × 108, см2/с | |
| Альгинат кальция–цефотаксим | 72.4 | 0.595 | 1.13 | 206.3 | 0.577 | 3.97 |
| Альгинат кальция–цефотаксим–хитозан (способ 1) | 74.2 | 0.594 | 1.10 | 235.6 | 0.485 | 3.47 |
| Альгинат кальция–цефотаксим–хитозан (способ 2) | 93.5 | 0.397 | 0.87 | 264.0 | 0.586 | 3.10 |
В кислых средах протонированные аминогруппы хитозана связывают функциональные группы альгината, препятствуя набуханию полимерной матрицы и тормозя высвобождение лекарственного средства. Оба фактора – отсутствие набухания, сильное взаимодействие ПЭК и цефотаксима в микросферах приводят к низкому выходу антибиотика в кислой среде.
С увеличением pH до 7.2 наблюдается ослабление взаимодействия депротонированного хитозана с альгинатом, а также сильное набухание микросфер вплоть до их распада. Присутствие цефотаксима также способствует увеличению степени набухания полимерной матрицы, обеспечивая устойчивое его высвобождение в фосфатно-солевом буфере.
На кинетику высвобождения цефотаксима из полимерной матрицы оказывает влияние и строение микросфер. Наличие хитозанового покрытия увеличивает толщину слоя, через который диффундирует лекарственное средство, что позволяет уменьшить скорость его высвобождения из альгинатного геля и обеспечивает пролонгированный режим высвобождения [22]. Самая низкая скорость высвобождения цефотаксима из микросфер, полученных при введении предварительно сформированных частиц альгината в раствор хитозана, объясняется, по-видимому, тем, что при таком способе в поверхностном слое хитозана изначально отсутствует цефотаксим. Дополнительно замедлению выхода лекарственного средства при данном способе модификации поверхности альгината может способствовать взаимодействие аминогрупп цефотаксима с карбоксильными группами поликислоты. В первом способе модификации альгинатных частиц хитозаном лекарственное средство диффундирует сразу из поверхностного слоя хитозана и альгинатной матрицы, в которых оно было распределено. Во втором способе получения хитозановое покрытие выступает в роли дополнительного “барьера”, через который молекулам цефотаксима, преодолевая силы межмолекулярного взаимодействия, нужно пройти в процессе диффузии из альгинатного геля до выхода в приемную среду.
Анализ механизма высвобождения лекарственного средства из микросфер проводился также в рамках модели Корсмейера−Пеппаса (табл. 2). Параметр n был определен из линейных зависимостей $\lg {{{{g}_{t}}} \mathord{\left/ {\vphantom {{{{g}_{t}}} {{{g}_{\infty }}}}} \right. \kern-0em} {{{g}_{\infty }}}} = f(\lg t)$. Величина параметра n в изученных средах лежит в пределах 0.4–0.6, что свидетельствует об аномальном высвобождении, контролируемом как диффузией лекарственного средства, так и набуханием полимерной матрицы. При pH 2.0 и 7.2 значения коэффициентов диффузии D свидетельствуют об уменьшении скорости высвобождения лекарственного средства при модификации микросфер хитозаном. Самые низкие коэффициенты диффузии по сравнению с остальными микрочастицами характерны для микросфер, модифицированных хитозаном по второму способу.
Отклонения закономерностей массопереноса от закона Фика наблюдалось и у других исследователей, например, при изучении высвобождения лекарственных средств из хитозановых пленок [17], а также сшитых гидрогелей на основе 2-гидроксиэтилметакрилата и акриловой кислоты [23]. Авторы объясняли отклонение от классического фиковского механизма неидеальностью системы полимер−диффундирующее вещество, т.е. сильным физическим взаимодействием полимерной матрицы с лекарственным средством.
ЗАКЛЮЧЕНИЕ
На основе альгината кальция и хитозана получены гелевые микросферы для эффективной иммобилизации антибиотика цефотаксима. Показано, что отличия в поведении микросфер при различных pH обусловлены изменением структуры pH-зависимого полиэлектролитного комплекса альгинат−хитозан и присутствием цефотаксима.
На скорость выхода цефотаксима из микросфер альгината кальция оказывает влияние pH среды, наличие хитозанового покрытия и способ проведения модификации частиц альгината хитозаном. Наиболее вероятной причиной отклонения механизма высвобождения цефотаксима из гелевых частиц от классического механизма диффузии является взаимодействие лекарственного средства с полимерными компонентами за счет межмолекулярных связей функциональных групп. Таким образом, микросферы на основе альгината кальция и хитозана можно рассматривать в качестве перспективных биосовместимых транспортных систем с контролируемым высвобождением лекарственных веществ гидрофильной природы. Для направленного регулирования свойств данных систем доставки необходимо учитывать комплекс конкурирующих межмолекулярных взаимодействий в системе “альгинат натрия–хитозан–цефотаксим–Ca2+–вода”.
Работа выполнена с использованием оборудования Центра коллективного пользования “Нанотехнологии и наноматериалы” Казанского национального исследовательского технологического университета.
Список литературы
Severin E.S. // Russ. Chem. Rev. 2015. V. 84. № 1. P. 43.
Shah A., Aftab S., Iftikhar F.J., Nisar J., Ashiq M.N. // J. Drug. Deliv. Sci. Tec. 2021. V. 62. ID:102426.
Volpatti L.R., Burns D.M., Basu A., Langer R., Anderson D.G. // J. Control. Release. 2021. V. 338. P. 71.
Cha G.D., Kang T., Baik S., Kim D., Choi S.H., Hyeon T. // J. Control. Release. 2020. V. 328. P. 350.
Kajjari P.B., Manjeshwar L.S., Aminabhavi T.M. // AAPS PharmSciTech. 2012. V. 13. № 4. P. 1147.
Grigor’ev D., Musabekov K.B., Musabekov N.K., Kusainova Z.Z. // Polymer Science A. 2017. V. 59. № 4. P. 506.
Teng K., An Q., Chen Y., Zhang Y., Zhao Y. // ACS Biomater. Sci. Eng. 2021. V. 7. № 4. P. 1302.
Pavlyuchenko V.N., Ivanchev S.S., Danilichev V.F., Proshina V.S., Primachenko O.N., Khaikin S.Y., Trunov V.A., Lebedev V.T., Kul’Velis Y.V. // Polymer Science A. 2011. V. 53. № 4. P. 323.
Mudarisova R.K., Badykova L.A., Azamatova G.A., Aznabaev M.T., Islamova R.M. // Rus. J. App. Chem. 2013. V. 86. № 4. P. 606.
Glycose F.M., Lollo G., Remnant-Lopez C., Quaglia F., Alonso M.J. // Biomacromolecules. 2009. V. 11. P. 1736.
Lacerda L., Praise A.L., Fávere V., Laranjeira M.C.M., Stulzer H.K. // Mater. Sci. Eng. C. 2014. V. 39. P. 161.
Pawar V., Topkar H., Srivastava R. // Int. J. Biol. Macromol. 2018. V. 115. P. 1131.
Ritger P.L., Peppas N.A. // J. Control. Release. 1987. V. 5. № 1. P. 23.
Crank J. The Mathematics of Diffusion. Oxford: Clarendon Press, 1975.
Шилова С.В., Миргалеев Г.М., Волкова М.В., Третьякова А.Я., Барабанов В.П. // Вестн. технол. ун-та. 2021. Т. 24. № 12. С. 56.
Kabanov V.A. // Russ. Chem. Rev. 2005. V. 74. № 1. P. 3.
Kulish E.I., Shurshina A.S., Kolesov S.V. // Polymer Science A. 2014. V. 56. № 3. P. 289.
Singh B., Chauhan N. // Acta Biomater. 2008. V. 4. № 5. P. 1244.
Белевитин А.Б., Бойко Э.В., Даниличев В.Ф., Павлюченко В.Н. // Вестн. Военно-медицинской академии. 2009. № 2 (26). С. 96.
Кулапина О.И., Каренко В.А., Кулапина Е.Г. // Изв. Сарат. ун-та. Нов. сер. Сер. Химия. Биология. Экология. 2016. Т. 16. № 2. С. 130.
Mudarisova R.Kh., Kulish E.I., Zinatullin R.M., Tamindarova N.E., Kolesov S.V., Khunafin S.N., Monakova Y.B. // Rus. J. App. Chem. 2006. V. 79. № 7. P. 1210.
Tavakol M., Vasheghani-Farahani E., Dolatabadi-Farahani T., Hashemi-Najafabadi S. // Carbohydr. Polym. 2009. V. 77. P. 326.
Singh B., Chauhan N. // Acta Biomater. 2008. V. 4. № 5. P. 1244.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


