Высокомолекулярные соединения (серия А), 2022, T. 64, № 5, стр. 333-347
НОВЫЕ АМФИФИЛЬНЫЕ СОПОЛИМЕРЫ N-ВИНИЛПИРРОЛИДОНА С МЕТАКРИЛОВОЙ КИСЛОТОЙ РАЗВЕТВЛЕННОГО СТРОЕНИЯ ДЛЯ БИОМЕДИЦИНСКИХ ПРИЛОЖЕНИЙ
С. В. Курмаз a, *, И. И. Иванова a, Н. В. Фадеева a, Е. О. Перепелицина a, М. А. Лапшина b, А. А. Балакина a, А. А. Терентьев a, c, d
a Институт проблем химической физики Российской академии наук
142432 Черноголовка, Московской обл., пр. Акад. Семенова, 1, Россия
b Институт физиологически активных веществ Российской академии наук
142432 Черноголовка, Московской обл., Северный проезд, 1, Россия
c Московский государственный университет им. М.В. Ломоносова
Факультет фундаментальной физико-химической инженерии,
119991 Москва, Ленинские горы, Россия
d Научно-образовательный центр Московского государственного областного университета
141014 Мытищи, Московской обл., ул. Веры Волошиной, 24, Россия
* E-mail: skurmaz@icp.ac.ru
Поступила в редакцию 31.03.2022
После доработки 08.06.2022
Принята к публикации 01.07.2022
- EDN: EZIEUX
- DOI: 10.31857/S2308112022700146
Аннотация
Амфифильные сополимеры N-винилпирролидона и метакриловой кислоты, разветвленные диметакрилатом триэтиленгликоля, синтезированы радикальной сополимеризацей в толуоле и в этаноле; определены их основные физико-химические характеристики (мономерный состав, абсолютная средневесовая молекулярная масса, полидисперсность и гидродинамический радиус в воде и водных средах с различным значением рН). Показано наличие у растворов сополимеров в слабокислых средах нижней критической температуры, которая сдвигается в область высоких значений в нейтральных и щелочных водных буферных растворах. Получены водорастворимые наноразмерные системы флуоресцирующего в красной области спектра тетрафенилпорфирината цинка с гидродинамическим радиусом около 50 нм (в водном нейтральном буферном растворе), стабильные в физиологически важном диапазоне температур. С помощью МТТ теста на различных линиях клеток – нормальных (FetMSC, Vero) и опухолевых (HepG2, HeLa) показано, что тройные сополимеры являются малотоксичными. Изучена динамика накопления полимерных частиц, загруженных красителем, в клетках HeLa и Vero с помощью флуоресцентной микроскопии. Сделан вывод о перспективности полученных сополимеров как носителей и средств доставки биологически активных соединений.
ВВЕДЕНИЕ
Поливинилпирролидон (ПВП) (коммерческое название − поливидон/повидон) относится к числу наиболее востребованных полимеров в биомедицинской практике. Он обладает уникальными физико-химическими свойствами: химически инертен, бесцветен, термостоек и pH-стабилен, хорошо растворим в воде и в органических растворителях различной полярности, отличается хорошими сорбционными свойствами [1–4]. Данный полимер признан безопасным Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и в связи с этим широко применяется в медицине, косметике, в фармацевтике и т.д. [5–9]. ПВП используется для разработки различных систем доставки лекарств, предназначенных как для перорального, местного, трансдермального и внутривенного введения [10], представляет интерес для доставки генов [11–15], адресной доставки биологически активных соединений различной природы [16, 17], может быть использован в регенерационной медицине [18–20]. Полимер обеспечивает контролируемое высвобождение лекарственного средства, улучшает биодоступность плохо растворимых в воде лекарственных средств, защищает активное соединение от внешних факторов (pH, температура и кислород).
В настоящее время амфифильные полимеры сложной архитектуры (дендримеры [21], сверхразветвленные, звездообразные и другие [22–24]) активно изучаются как носители и средства доставки биологически активных соединений. Благодаря своей топологии они обеспечивают пролонгированное действие лекарств, изменяют их распределение в организме, снижают токсичность и т.д. Амфифильные полимеры сложной архитектуры аналогично амфифильным линейным блок-сополимерам самоорганизуются в различные надмолекулярные структуры в растворах или на границах раздела фаз [23, 24]. Обычно они образуют мономолекулярные мицеллы размером менее 10 нм в растворе и мультимолекулярные мицеллы нано- и микронного размера [24]. Полимерные мицеллы, чувствительные к окружающей среде, могут изменить объем, структуру, свойства под действием различных факторов, таких как pH, температура, ионная сила. Так, мицеллы, содержащие термочувствительные сегменты цепи, претерпевают термоиндуцированный фазовый переход из водорастворимого в водонерастворимое состояние, что позволяет реализовать “умную” доставку биологически активных соединений. Внутриклеточные или внешние факторы, например связанные с изменением pH и температуры, используются для контролируемого высвобождения лекарств, загруженных в мицеллы.
Хеморазлагаемые терполимеры разветвленного строения были синтезированы посредством взаимодействия первичных гидроксильных групп в линейных терполимерах N-винилпирролидон (ВП) − кротоновая кислота−2-гидроксиэтилметакрилат с 1,6-гексаметилендиизоцианатом и показана возможность их применения в качестве носителей антибиотиков различных классов [25]. Амфифильные сополимеры ВП с диметакрилатами с контролируемой молекулярной массой, амфифильностью, размером макромолекулы и способностью к самоорганизации были получены радикальной сополимеризацией в растворах в одну стадию [26–32]. На их основе разработаны наноразмерные системы гидрофильного метформина, известного антидиабетического средства [27], липофильных органических комплексов платины (IV) c противоопухолевой активностью [28–30], тетрафенилпорфирината цинка как средства визуализации процесса внутриклеточного накопления [31, 32]. In vitro показана высокая биосовместимость полимерных носителей и их способность проникать в клетки HeLa и Vero; отсутствие токсичности у сополимера ВП с диметакрилатом триэтиленгликоля и его комплекса с метформином установлено in vivo [27].
Для модулирования физико-химических свойств в сополимеры ВП с диметакрилатом триэтиленгликоля (ДМТЭГ) могут быть легко введены звенья нетоксичных, иммуногенных и биосовместимых функциональных мономеров, в частности метакриловой кислоты (МАК). Ее полимеры и сополимеры используются в различных биомедицинских приложениях: от адресной доставки лекарств до микроинкапсулированного катализа и сенсоров [33]. Синтетические (со)полимеры МАК в качестве носителей лекарственных средств не оказывают токсического действия на клетки иммунной системы, не изменяют метаболической активности макрофагов и, таким образом, перспективны для создания новых лекарственных форм [34]. Кроме того, по функциональным группам СООН (со)полимеров могут быть ковалентно присоединены молекулы биологически активного соединения или получены их комплексы за счет невалентных взаимодействий (водородная связь, электростатические силы и т.д.). Линейные (со)полимеры МАК как полиэлектролиты при определенных значениях pH, соответствующих высокой степени ионизации групп СООН, могут разворачиваться в результате отталкивания их заряженных групп, вызывая резкий рост вязкости раствора [35]. Данный эффект практически полностью нивелируется в растворах разветвленной ПМАК благодаря архитектуре ее макромолекул [36]. С учетом этого новые тройные амфифильные сополимеры ВП–МАК–ДМТЭГ разветвленной топологии представляют значительный научный и практический интерес.
Цель настоящей работы – синтезировать тройные амфифильные сополимеры N-винилпирролидона с метакриловой кислотой, разветвленные диметакрилатом триэтиленгликоля, определить их основные физико-химические характеристики (мономерный состав, средневесовые молекулярные массы и гидродинамический радиус в водных средах) и изучить поведение в водных средах при варьировании температуры и рН для прогнозирования механизма высвобождения биологически активных соединений; оценить их цитотоксичность на клетках различных линий (нормальных и опухолевых) и получить наноразмерные системы флуоресцентного красителя 5,10,15,20-тетрафенил-21H,23H-порфиринат цинка (ZnТФП)–сополимер для изучения способности полимерных частиц проникать во внутриклеточное пространство.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали N-винилпирролидон (99%, “Acros Organics”), который предварительно очищали вакуумной перегонкой. ДМТЭГ (95%, “Aldrich”) и МАК (99.5%, “Acros Organics”) применяли без предварительной очистки. Инициатором служил ДАК, очищенный перекристаллизацией из этанола. В работе также использовали растворители − этанол, толуол (ч.д.а) и н-гексан (х.ч.), изопропиловый спирт (о.с.ч.). Этанол очищали перегонкой.
Сополимеры ВП–МАК–ДМТЭГ синтезировали в толуоле из мономерной смеси мольного состава 98 : 2 :2 (1) и в этаноле из мономерных смесей 98 : 2 : 2 (2) и 95 : 5 : 2 (3). Процесс осуществляли в трехгорлой колбе, снабженной обратным холодильником и термометром, при непрерывном барботировании аргоном в течение 2 ч при 80°C в термостате. Все компоненты реакционной смеси вводили одновременно. Содержание реагентов в растворителе составляло ~20 мас. %. Концентрация инициатора 0.02 моль/л.
В ходе синтеза в толуоле сополимер 1 частично осаждался из реакционной смеси. Растворимый в толуоле сополимер 1 выделяли осаждением в десятикратный избыток гексана и получали фракцию Ф-1. Не растворимую в толуоле фракцию Ф-2 сополимера 1 растворяли в хлороформе и также высаживали избытком гексана. Затем ее повторно переосаждали гексаном и получали фракцию Ф-2* сополимера 1. Из этанольных растворов десятикратным избытком осадителя н-гексана высаживали сополимеры 2 и 3. Сополимеры сушили от остатков растворителя и осадителя до постоянной массы на воздухе и в вакууме при 60°С. Выход сополимера 1 составлял ~92%, сополимеров 2 и 3 − около 98%. Фракции Ф-1 и Ф-2, Ф-2* сополимера 1 представляли собой аморфные порошки. Сополимеры 2 и 3 представляли собой стеклообразные продукты.
С помощью элементного анализа определяли содержание CHN в полученных сополимерах ВП на приборе анализатор “Vario cube” (“Elementar GmbH”). Содержание азота (%) во фракциях Ф-1, Ф-2 и Ф-2* сополимера 1, а также сополимеров 2 и 3 составляет 11.98 ± 0.01, 9.95 ± 0.01, 10.19 ± 0.07, 9.83 ± 0.15, 9.81 ± 0.02 соответственно. Оно закономерно снижается в данном ряду сополимеров в результате увеличения содержания (ди)метакрилатных звеньев.
Потенциометрическое титрование водных растворов сополимеров 2 и 3 выполняли с помощью иономера “Мультитест ИПЛ-201”; титрант – 0.01 моль/л раствор NaOH.
ИК-спектры сополимеров записывали в режиме нарушенного полного внутреннего отражения на приборе FTIR “Bruker α” в интервале 400–4000 см–1, число сканирований 16.
Спектры ЯМР 1Н растворов сополимеров в дейтерированном хлороформе (6 мг/мл) регистрировали на сверхпроводящем импульсном широкополосном двухканальном спектрометре “ЯМР AVANCE III 500 MHz” (“Bruker Biopin”).
Абсолютную молекулярную массу сополимеров ВП–МАК–ДМТЭГ определяли методом эксклюзионной хроматографии с помощью жидкостного хроматографа “Waters” (2 колонки PS-gel, 5 мкм, MIXED-C, 300 × 7.5 мм), снабженного рефрактометрическим детектором и детектором многоуглового светорассеяния “WYATT DAWN HELEOS II” (“Wyatt”), λ = 658 нм. Элюентом служил МП с добавкой хлорида лития (1 мас. %), который препятствует агрегации макромолекул в полярном растворителе. Температура измерения 70°С, скорость элюирования 1 мл/мин. Значения dn/dc определяли из данных детектора многоуглового светорассеяния. Все растворы полимеров предварительно фильтровали через фильтры с диаметром пор 0.2 мкм. Абсолютную среднемассовую молекулярную массу сополимера получали из данных детектора светорассеяния c помощью программного обеспечения Astra, версия 5.3.2.20.
Методом ДРС исследовали поведение сополимеров в водных растворах в диапазоне температуры 20−60°С при значениях рН 5, 6.8, 9.5, 12.5, а также наноструктур ZnTФП в водном буферном растворе. Перед измерениями виалы многократно промывали очищенным через фильтр PES 0.45 мкм растворителем, заполняли растворами и термостатировали при заданной температуре в течение 20 мин. Точность термостатирования ±0.1°. Измерения проводили на установке “Photocor Compact” (“Photocor Instruments Inc.”, США), оснащенной диодным лазером (λ 654 нм), при угле детектирования 90°. Экспериментальные данные обрабатывали с помощью программного обеспечения DynaLS, версия 2.8.3. Гидродинамический радиус сополимеров и наноструктур ZnТФП рассчитывали по формуле Стокса–Эйнштейна.
Критическую концентрацию агрегатообразования сополимеров в воде находили из зависимости интенсивности рассеянного света от логарифма концентрации сополимеров в воде при 22°С; точку излома интерпретировали как критическую концентрацию агрегатообразования сополимера в воде. Из зависимости интенсивности рассеянного света и гидродинамического радиуса рассеивающих центров от температуры делали выводы о стабильности водных растворов сополимеров.
В работе использовали флуоресцирующий в красной области спектра краситель ZnТФП (“Aldrich”), не растворимый в воде, но растворимый в хлороформе, бензоле, ацетоне и ДМСО. Инкапсулирование ZnТФП проводили по следующей методике: в 4 мл раствора сополимеров 2 (3 мг/мл) и 3 (2 мг/мл) в изопропиловом спирте вводили 0.3 мл раствора красителя в толуоле (0.7 мг/мл) при постоянном перемешивании с помощью магнитной мешалки. Получали визуально прозрачные растворы сиреневого цвета, испаряли органические растворители. Полученные полимерные пленки сополимеров 2 и 3, содержащие 1.8 и 2.6 мас. % красителя, растворяли в 8 мл водного нейтрального буферного раствора (PBS, рН 6.8). Концентрация сополимеров в растворе составляла 1.5 мг/мл.
Для биологических тестов готовили полимерную композицию, используя раствор сополимера 2 в изопропиловом спирте (2 мг/мл) и ZnТФП в толуоле (0.7 мг/мл). К 200 мл раствора сополимера по каплям при постоянном перемешивании с помощью магнитной мешалки вводили 15 мл раствора красителя. Органические растворители отгоняли в вакууме при комнатной температуре, полимерные пленки сушили на воздухе и в вакууме. В полимерных композициях содержание ZnТФП составляло 2.6 мас. % в расчете на сополимер.
Спектры поглощения водных растворов инкапсулированного в полимерные частицы красителя регистрировали с помощью сканирующего спектрофотометра “СПЕКС ССП-705-1”. Толщина кюветы 0.1 или 0.2 см.
Цитотоксичность тройного сополимера исследовали in vitro на культуре нормальных клеток – FetMSC (фибробласты человека), Vero (почка зеленой африканской мартышки) и опухолевых – HeLa (аденокарцинома шейки матки человека, клон M-HeLa) и HepG2 (карцинома печени человека), полученных из коллекции Института цитологии Российской академии наук.
Культивирование клеток проводили в атмосфере 5% СО2 и температуре 37°С в среде ЕМЕМ (“ПанЭко”, Россия) с добавлением 10% эмбриональной телячьей сыворотки.
Цитотоксические свойства сополимера 2 изучали с использованием МТТ-теста. Исследуемые линии клеток рассевали в культуральные 96-луночные планшеты в концентрации 5 × 104 клеток/мл. Соединения вносили в культуральную среду через 24 ч после рассева. Краситель МТТ (3-(4.5-диметилтиазол-2-ил)-2.5-дифенил-2Н-тетразолиум бромид) добавляли в инкубационную среду через 72 ч после введения сополимера в концентрации 0.5 мг ∙ мл–1. Образовавшиеся кристаллы формазана растворяли в 100% ДМСО. Оптическую плотность измеряли при основной длине волны 570 нм и фоновой длине волны 620 нм с использованием многофункционального микропланшетного ридера “Spark 10M” (“Tecan”, США).
Клеточную аккумуляцию полимерных частиц, загруженных флуоресцентым красителем, исследовали на клетках HeLa и Vero, полученных из коллекции клеточных культур позвоночных (Санкт-Петербург). Клетки HeLa были выращены в среде Игла МЕМ, клетки Vero – в среде ДМЕМ (“ПанЭко”, Россия), содержащей 10%-ную эмбриональную сыворотку (“Biowest”, Франция), пенициллин (50 ед/мл), стрептомицин (50 мг/мл) в атмосфере 5% CO2 при температуре 37°С.
Клетки, выращенные на покровных стеклах размером 24 × 24 мм, при плотности клеточной культуры 15 × 104/2 мл в шестилуночных планшетах, инкубировали с растворенными в PBSx1 наночастицами ZnТФП–сополимер 2. Конечная концентрация в инкубационной среде ZnТФП–сополимер 2 составляла 50 мкг/мл. Инкубацию с наночастицами проводили в течение 24 ч. Далее клетки отмывали от остатков среды раствором PBSx1 и фиксировали раствором 4%-ного параформальдегида 30 мин при комнатной температуре. Затем проводили пермеабилизацию в 0.5%-ном растворе Triton X-100 в PBSx1 в течение 10 мин при комнатной температуре. Далее образцы выдерживали в окрашивающем растворе DAPI (“Serva”, Германия) в течение 10 мин и после промывания в деионизованной воде сушили при комнатной температуре в темноте. После этого образцы помещали на предметное стекло в каплю фиксатора Fluoromount (“Sigma-Aldrich”, Германия). По периметру стекла заклеивали лаком.
Накопление и локализацию наночастиц в клетках изучали с помощью флуоресцентного микроскопа “Axio Scope.A1” (“Carl Zeiss”, Германия), используя объектив N-Achroplan 100×/1.25 Oil M27. Образцы фотографировали с применением разных флуоресцентных светофильтров: Fs 49 DAPI (EX G 365, EM BP 445/50), Fs 45 HQ TexasRed (EX BP 560/40, EM BP 630/75), используя цифровую камеру высокого разрешения AxioCam MRc 5 и программное обеспечение для обработки и анализа изображений Zen 2012 (blue edition).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и характеристики сополимеров ВП–МАК–ДМТЭГ
Радикальная сополимеризация моно- и бифункциональных мономеров в условиях ограничения роста первичных полимерных цепей с помощью обычных и каталитических передатчиков является одним из наиболее эффективных способов синтеза разветвленных полимеров [26, 36, 37]. Ранее мы показали, что сополимеры ВП–ДМТЭГ могут быть получены в отсутствие передатчика цепи при содержании бифункционального мономера (разветвляющего агента) не более 5 мол. % [31]. Это важно для получения биосовместимых сополимеров, не содержащих в своем составе токсичных концевых групп передатчика цепи, в частности 1-декантиола, который применяется для контроля их молекулярной массы. Данный подход был использован при синтезе сополимеров ВП–МАК–ДМТЭГ.
Константы сополимеризации ВП (М1) и МАК (М2) равны r1 = 0.04 и r2 = 0.56 [38], МАК (М1) и ММА (М2) – монофункционального аналога ДМТЭГ – r1 = 0.32 и r2 = 0.60 [39], следовательно метакриловые мономеры более активны в радикальной сополимеризации, чем ВП. На начальных стадиях сополимеризации все радикалы присоединяют более реакционноспособные мономеры ДМТЭГ и МАК, и образуются полимерные цепи, обогащенные этими мономерами. Распределение звеньев МАК и ДМТЭГ в них является статистическим, что приводит к ограничению вероятности межмолекулярного сшивания и образованию сшитого макрогеля. После полимеризации (ди)метакрилатов образуется полимерная структура с “подвешенными” связями С=С звеньев ДМТЭГ, по которым присоединяются растущие цепи ПВП. В результате формируется трехмерная структура с областями, состоящими в основном из метакрилатных фрагментов и образованными цепями ПВП. Эти предположения основаны на ранее полученных нами данных по изучению кинетики сополимеризации в широком диапазоне конверсий ВП и диметакрилата этиленгликоля (ДМЭГ), а также анализа мономерного состава образующихся сополимеров методами ИК-спектроскопии и изотермической калориметрии [26]. Из зависимостей конверсии мономеров ДМЭГ и ВП от времени, рассчитанных по убыли интенсивности соответствующих полос поглощения в ИК-спектрах, следовало, что скорость превращения ВП существенно ниже, чем диметакрилата. Зависимость приведенной скорости сополимеризации ВП и ДМЭГ от конверсии в этаноле носила двухступенчатый характер. Первый участок кинетической кривой, лежащий в области начальных и средних конверсий (до ~0.3) был связан с радикальной сополимеризацией ДМЭГ с ВП. Второй участок обусловлен протеканием привитой полимеризации ВП к сополимеру, содержащему “подвешенные” связи С=С, в результате чего увеличивалось содержание звеньев ВП в сополимере.
Сополимеры 1–3 синтезированы в различных по полярности растворителях – толуоле и этаноле. Процесс, протекавший в толуоле, носил гетерогенный характер, и имело место фазовое разделение реакционной смеси. Между тем, в этаноле реакция проходила в гомогенных условиях; фазовое разделение отсутствовало, и полимерные продукты были полностью растворимы в этаноле. Причиной таких различий, очевидно, является термодинамическое качество растворителя и его сродство с сополимером. В “хорошем” растворителе сополимер демонстрирует высокую растворимость; между протонным растворителем и функциональными группами мономерных звеньев – донорами электронов, подобно сополимерам ВП–ДМТЭГ [40], образуется водородная связь. Кроме того, при полимеризации в этаноле возможна передача цепи на растворитель, в результате которой на концах полимерных цепей появляются полярные группы, что повышает взаимодействие сополимеров с растворителем.
Растворимость полученных сополимеров исследовали в полярных растворителях – воде, водном буферном растворе (рН 6.8) и изопропиловом спирте. При концентрации 10 мг/мл растворы сополимеров 1–3 в воде (рН ~ 5) опалесцировали в разной степени в зависимости от их состава. Ограниченная растворимость в воде, по-видимому, обусловлена сильными межмолекулярными взаимодействиями полимерных цепей, содержащих звенья МАК, ВП и ДМТЭГ. Между тем, в водных нейтральных буферных растворах сополимеры были полностью растворимы. Это связано с образованием солевой формы звеньев МАК, ее диссоциацией и появлением ионизированных групп СОО¯ в полимерных цепях.
Сополимер 3 частично растворялся в изопропиловом спирте в отличие от других сополимеров, поскольку в его составе содержится не растворимая в спирте фракция с высоким содержанием метакрилатных звеньев, о чем свидетельствуют данные ИК-спектроскопии. Это позволяет сделать предположение о композиционной неоднородности данного сополимера.
В табл. 1 приведено содержание звеньев ВП в сополимерах, рассчитанное по содержанию в них азота, а также суммарное содержание звеньев МАК и ДМТЭГ. Видно, что фракция Ф-2 сополимера 1 обогащена (ди)метакрилатами и заметно отличается по мономерному составу от фракции Ф-1. В составе фракции Ф-2* незначительно снижается доля макромолекул, обогащенных (ди)метакрилатами. Увеличение содержания МАК в мономерной смеси приводит к росту метакрилатной составляющей в сополимере 3. Об этом свидетельствуют также данные потенциометрического титрования: содержание МАК звеньев в сополимерах 2 и 3 составляет − 3.8 и 6.7 мас. %.
Таблица 1.
Мономерный состав сополимеров ВП–МАК–ДМТЭГ, их абсолютные среднемассовые молекулярные массы Mw, критические концентрации агрегатообразования и гидродинамические радиусы
| Сополимер | Содержание ВП и метакрилатных звеньев (ДМТЭГ и МАК) в сополимерах 1–3, мол. % | Метод эксклюзионной хроматографии (RI + MALLS)* | Критическая концентрация агрегатообразования, мг/мл (22°С) | Rh**, нм (25°С) | |
|---|---|---|---|---|---|
| Мw × 10–4 | Ɖ | ||||
| Ф-1 | 97.0 : 3.0 | 3.9 | 1.6 | 2.0 | 4; 57 |
| Ф-2 | 86.3 : 13.7 | 19.6 | 5.4 | 0.1 | – |
| Ф-2* | 87.6 : 12.4 | 19.9 | 3.4 | – | 27; 408 |
| 2 | 85.6 : 14.4 | 7.6 | 2.1 | 5.0 | 7; 104 |
| 3 | 81.9 : 18.1 | 8.7 | 2.6 | 3.0 | 5; 57 |
Сополимеры были идентифицированы с помощью ИК-спектроскопии (рис. S1 , Дополнительный материал) по полосам поглощения, относящимся к валентным колебаниям групп С=О метакрильных и ВП-звеньев при волновых числах ~1720 см–1 и ~1665 см–1 соответственно. Разрешение и интенсивность полосы поглощения валентных колебаний связи С=О метакрильных групп зависит от мономерного состава сополимеров. Следует отметить, что идентифицировать звенья МАК по этой полосе невозможно из-за ее перекрывания с соответствующей полосой поглощения звеньев ДМТЭГ. В ИК-спектрах всех сополимеров в области 3600–3000 см–1 присутствует широкая полоса поглощения, характерная для валентных колебаний групп ОН адсорбированной воды, связанной водородной связью с амфифильными сополимерами [40]. Поглощение воды в данной области спектра препятствует идентификации звеньев МАК по соответствующим полосам поглощения.
В спектре ЯМР 1Н метакриловой кислоты протон группы ОН регистрируется при δ = 11 м.д., однако в спектрах сополимеров такой сигнал не наблюдается (рис. S2 , Дополнительный материал), по-видимому, вследствие низкого содержания этих звеньев в полимерных цепях или недостаточной концентрации сополимеров в растворах. Вместе с тем, регистрируются характерные сигналы протонов звеньев ВП и ДМТЭГ. Так, в спектрах наблюдаются две группы сигналов, относящиеся к звеньям ВП. Первая группа включает сигналы NCHα протонов в полимерной цепи и фрагментов СН2С=О пирролидона при δ = 3.0−4.0. Вторая группа представлена сигналами СН2 протонов в полимерной цепи и С–СН2-С и NСН2 фрагментов пирролидона при δ = 1.4−2.4 м.д. Сигналы протонов группы CH3 ДМТЭГ звеньев детектировались в спектре сополимеров при δ ~ ~ 0.9 м.д. В спектре ЯМР 1H проявляется широкий сигнал при δ = 4.1 м.д., соответствующий атомам водорода во фрагменте –СН2−СН2– прореагировавшего ДМТЭГ. Однако при δ ~ 5.6 и 6.2 м.д. наблюдаются слабые сигналы протонов “подвешенных” С=С-связей ДМТЭГ.
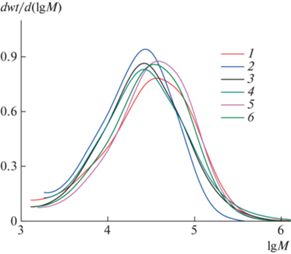
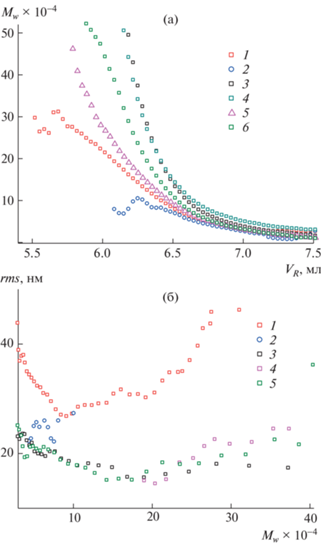
В табл. 1 приведены значения абсолютных среднемассовых молекулярных масс Mw сополимеров, полученные методом эксклюзионной хроматографии. Сополимеры, синтезированные по данной методологии, как правило, обладают широким ММР, поскольку представляют собой смесь макромолекул различной молекулярной массы и архитектуры [36, 37]. Так, например, сополимер МАК с дивинилбензолом, синтезированный в условиях передачи цепи на додекантиол при мольном соотношении 100 : 2 : 1, характеризуется значением P ~ 55 [36]. Тройные сополимеры ВП–МАК–ДМТЭГ подобно ПВП имеют узкое молекулярно-массовое распределение, о чем свидетельствуют унимодальные пики на кривых ММР с максимумами при М ~ 104.5 (рис. 1). Фракция Ф-1 сополимера 1 отличается от Ф-2 низкой величиной Mw и узким коэффициентом полидисперности. В свою очередь сополимер 2 обладает меньшей молекулярной массой и более узким ММР, чем фракции Ф-2 и Ф-2* сополимера 1 близкого мономерного состава. Это может быть обусловлено передачей цепи на растворитель (этанол) в процессе его синтеза. Об уровне ветвления полученных сополимеров можно судить по зависимостям молекулярной массы от элюентного объема Vr и среднеквадратичного радиуса инерции rms от Mw (рис. 2). Кривые Mw(VR) (рис. 2а) фракций Ф-2, Ф-2* сополимера 1 и сополимеров 2, 3 лежат значительно выше эталонного образца − линейного ПВП. Это означает, что при любом заданном VR элюируются сополимеры с одинаковым гидродинамическим объемом, но с большей молекулярной массой. Исключение составляет фракция Ф-1 сополимера 1, для которого зависимость Mw(VR) лежит ниже, чем линейного ПВП. Возможно, ее макромолекулы имеют топологию наногелей, образующихся в результате внутрицепной циклизации макромолекул и плохо набухающих в элюенте. Вместе с тем фракции Ф-2 и Ф-2* сополимера 1 характеризуются высокими молекулярными массами, а их макромолекулы отличаются высокой плотностью молекулярной упаковки полимерных цепей. В пользу этого свидетельствуют также зависимости rms от Mw (рис. 2б), полученные из данных детектора светорассеяния. Значения rms макромолекул сополимеров существенно ниже, чем у ПВП. Фактор Зимма g', рассчитанный для макромолекул с Mw ~ 105 как отношение его среднеквадратичного радиуса инерции и линейного полимера ВП указывает на разветвленный характер сополимера. Так, для макромолекул фракций Ф-2 сополимера с Mw ~ (0.5–1.0) × 105 и 2.5 × 105 значение g' изменяется от 0.6–0.7 до 0.45, т.е. с ростом молекулярной массы увеличивается их степень разветвления.
Поведение сополимеров ВП-МАК-ДМТЭГ в водных средах
В разбавленных растворах отдельные макромолекулы сополимеров, по-видимому, могут быть рассмотрены как мицеллоподобные структуры, в которых можно выделить малополярные и высокополярные части, образованные звеньями (ди)метакрилатов и ВП соответственно. При увеличении концентрации сополимеров в растворе они самоорганизуются в мультимолекулярные мицеллы [23, 24]. В пользу этого свидетельствуют зависимости интенсивности рассеяния света I водных растворов сополимеров от концентрации в полулогарифмических координатах. Точки излома на этих зависимостях были интерпретированы как критические концентрации агрегатообразования сополимеров (табл. 1). Фракция Ф-2 сополимера 1 характеризуется низкой величиной критической концентрации агрегатообразования и агрегирует в воде уже при малых концентрациях вследствие высокого содержания в полимерных цепях метакрилатных звеньев. Фракция Ф-1 сополимера 1 с высоким содержанием звеньев ВП агрегирует при значительно более высокой концентрации в воде. Сополимеры 2 и 3 менее склонны к агрегации, чем фракция Ф-1 сополимера 1, несмотря на более высокую молекулярную массу и содержание (ди)метакрилатных звеньев. Возможно, это обусловлено наличием в данных сополимерах молекул этанола, образующих Н-связь с полярными группами сополимеров, или его остатков на концах полимерных цепей в результате передачи цепи на растворитель.
Зависимости на рис. 3а получены путем обработки результатов измерения флуктуаций интенсивности рассеяния (Intensity Distribution) водными растворами сополимеров 1–3. В растворе фракции Ф-1 сополимера 1 распределение по размерам частиц является полимодальным, имеющиеся два типа рассеивающих центров следует отнести, по-видимому, к отдельным макромолекулам и их агрегатам. В растворах фракции Ф-2 сополимера 1 и сополимеров 2, 3 распределение практически унимодальное, гидродинамический радиус Rh рассеивающих центров основных пиков лежит в нанометровом диапазоне (табл. 1). Размеры макромолекул и их агрегатов (полимерных частиц) в водных средах удовлетворяют основным критериям, предъявляемым к средствам доставки и касающихся их выведения из организма почками и селезенкой [41–43]. Кроме того, частицы этого размера будут достаточное время циркулировать в кровотоке, что повысит эффективность действия инкапсулированных лекарств.
Рис. 3.
Кривые распределения интенсивности рассеяния света по размерам рассеивающих центров в водных растворах фракций Ф-1 (1), Ф-2* (2) сополимера 1 и сополимеров 2 (3), 3 (4) при 25°С (a), а также зависимости интенсивности I рассеяния света от температуры водными растворами соответствующих сополимеров (б). Концентрация сополимеров 5 мг/мл.
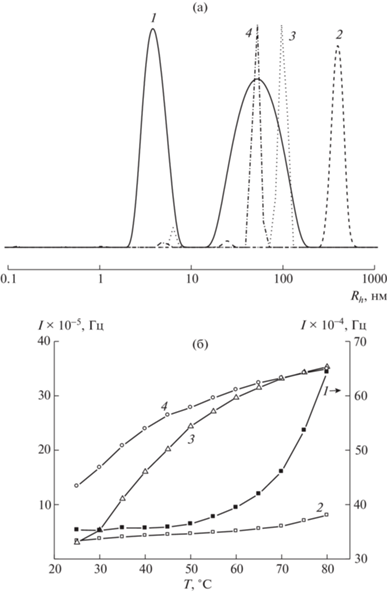
На рис. 3б видно, что интенсивность рассеяния света водного раствора фракции Ф-1 сополимера 1 на порядок выше ниже, чем у водных растворов фракции Ф-2 сополимера 1 и сополимеров 2, 3. Интенсивность рассеяния света всех водных растворов сополимеров возрастает с увеличением температуры, что указывает на усиление процессов агрегации макромолекул. Причиной этого, по-видимому, является разрушение водородных связей между молекулами воды и функциональными группами сополимера [40], коллапс полярной оболочки и рост гидрофобных взаимодействий таких макромолекул.
Анализируя зависимости I(T) и Rh(T), оценивали стабильность водных растворов исследованных сополимеров. Зависимости I(T) (рис. 3б) свидетельствуют о том, что точка помутнения водных растворов фракций Ф-1 и Ф-2* сополимера 1 сильно смещена в область высоких значений, как следствие, интенсивность рассеяния света их водными растворами практически не изменяется до 50°С. Между тем, сополимеры 2 и 3 сильно реагировали на изменение температуры. В отличие от фракций сополимера 1 резкий рост значения I имел место уже при ~30°С, и их водные растворы начинали опалесцировать вследствие агрегации макромолекул. Этот процесс был обратимым, и при охлаждении растворы снова становились прозрачными. Таким образом, сополимеры 2 и 3 обладают высокой “чувствительностью” к температуре при достаточно низких ее значениях. Следует отметить, что ПВП не относится к числу термочувствительных полимеров и растворяется в воде в широком диапазоне температур. Появление термочувствительности у сополимеров ВП–МАК–ДМТЭГ, безусловно, связано с содержанием в их полимерных цепях метакрилатных звеньев. Интервал термочувствительности полученных сополимеров не связан только с их мономерным составом. Из сравнения зависимостей I(T) (рис. 3б) фракции Ф-2* сополимера 1 и 2, имеющих близкий состав, можно заключить, что сополимер 2, полученный в этаноле, сильнее реагирует на изменение температуры. Вероятно, это обусловлено присутствием на концах полимерных цепей групп СH3CHОН, которые появляются в результате обрыва полимерных радикалов на молекулах растворителя. Водные растворы фракции Ф-1 сополимера 1, полученного в толуоле, являются стабильными в более широком интервале температуры.
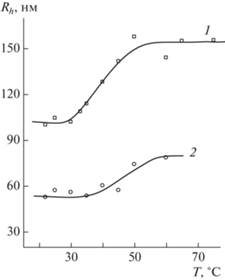
На рис. 4 приведены зависимости Rh(T) водных растворов сополимеров 2 и 3. Температурный диапазон, в котором наблюдается резкий рост размеров рассеивающих центров, у водных растворов этих сополимеров заметно отличается. Для сополимера 2 он составляет 30–50°С, а для сополимера 3 − 40–60°С. Точки перегиба, соответствующие точкам начала помутнения растворов, на указанных зависимостях составляют ~40 и ~50°С, т.е. у сополимера 3 она смещается в область более высоких температур в результате изменения состава макромолекул и их физико-химических характеристик. Таким образом, сополимеры 2 и 3 являются термочувствительными в подходящем диапазоне температуры и представляют интерес как “умные” средства доставки биологически активных соединений. С повышением температуры макромолекулы сначала уменьшаются в размерах из-за разрушения водородной связи между цепями ПВП и растворителем, а затем объединяются из-за усиления их гидрофобного взаимодействия. Такие структурные изменения будут способствовать высвобождению биологически активных соединений. Из двух потенциальных носителей биологически активных соединений термочувствительный в области физиологически важных температур сополимер 2 представляет наибольший интерес.
Рис. 4.
Зависимость гидродинамического радиуса рассеивающих центров водных растворов сополимеров 2 (1) и 3 (2) от температуры. Концентрация сополимеров 5 мг/мл.
Между тем, термочувствительность полимерного носителя зависит от рН среды. На рис. 5 приведены зависимости интенсивности рассеяния света водными растворами сополимера 2 при различных значениях рН. Видно, что водные и слабо кислые растворы (рН 5.1) сополимера сильнее рассеивают свет: значение I на порядок больше, чем у водных растворов сополимера с высокими значениями рН. С повышением температуры увеличивается интенсивность рассеяния света этих растворов вследствие агрегации полимерных частиц. Это свидетельствует об образовании водородных связей между функциональными группами сополимера и молекулами воды в данных средах при температуре ниже 30°С и их разрушении при более высоких температурах.
Рис. 5.
Кривые зависимости интенсивности рассеянного света от температуры сополимера 2 в воде (1) и в водных буферных растворах при pH 5.1 (2), 6.8 (3), 9.5 (4) и 12.5 (5). Концентрация сополимера 5 мг/мл.
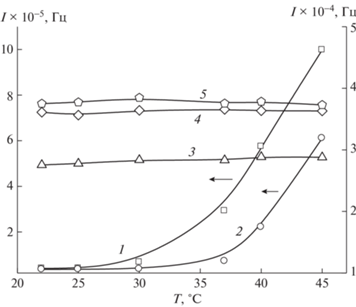
Интенсивность рассеяния света нейтрального/слабо щелочного и щелочного водного раствора сополимера 2 в исследованном диапазоне температур практически не изменяется и существенно ниже, чем в слабо кислых растворах, т.е. агрегация полимерных частиц подавлена. Таким образом, значение рН водного раствора оказывает заметное влияние на интенсивность рассеяния света и, по-видимому, сдвигает точку помутнения в область более высоких температур. В фосфатно-солевом буфере и в щелочных растворах существуют стабильные в физиологически важном интервале температур полимерные частицы с гидродинамическим радиусом менее 10 нм. Увеличение размера макромолекул и отсутствие их агрегации в этих средах обусловлено появлением заряженных карбоксильных групп звеньев МАК, что, по-видимому, приводит к разворачиванию полимерных цепей и стабилизации их растворов. Полученный результат позволяет прогнозировать механизм выделения инкапсулированного биологически активного соединения в сополимер при изменении рН среды при физиологической температуре.
Полимерные композиции ZnТФП в водном буферном растворе
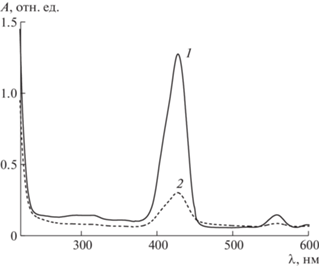
Коллоидные растворы полимерных композиций ZnТФП на основе сополимеров 2 и 3 (1.5 мг/мл) заметно опалесцировали. Из водного буферного раствора композиции ZnТФП–сополимер 3, содержащего 2.6% красителя, со временем осаждались крупные частицы. Однако раствор композиции ZnТФП–сополимер 2 аналогичного состава был стабильным. На рис. 6 приведены электронные спектры поглощения соответствующих водных буферных растворов; в спектре поглощения растворов имеется полоса поглощения Соре при длине волны 429 нм и Q-полосы в области 530–630 нм красителя. Это свидетельствует о присутствии в растворе водорастворимой формы красителя, который сохраняет свою структуру, и, как следствие, наблюдаются его характерные электронные переходы. Форма и значение оптической плотности полосы Соре зависят от типа полимерного носителя. Ее значение существенно ниже в водном буферном растворе композиции на основе сополимера 3, что может быть обусловлено осаждением ее некоторой части и/или сильной агрегацией молекул красителя, локализованного в полярных областях полимерных частиц. Очевидно, что полученные водорастворимые формы ZnТФП на основе сополимеров ВП–МАК–ДМТЭГ будут флуоресцировать в красной области спектра [31, 32]. Это позволит визуализировать изображение в экспериментах по изучению внутриклеточного накопления полимерных частиц методом флуоресцентной микроскопии.
Рис. 6.
Спектры поглощения водных буферных растворов ZnТФП, инкапсулированного в сополимеры 2 (1) и 3 (2). Кювета 0.2 см.
В работе исследовали поведение наноструктур ZnTФП на основе сополимера 2 в водном буферном растворе в диапазоне температур 25–42°С. На кривых ДРС (рис. 7) имеется интенсивный пик; значение Rh в его максимуме составляет ~50 нм. С увеличением температуры положение пика изменяется несущественно, что указывает на стабильность структур ZnTФП–сополимер 2 в исследованном диапазоне температур и возможности их применения в экспериментах по накоплению полимерных частиц в клетках.
Цитотоксичность сополимера ВП–МАК–ДМТЭГ
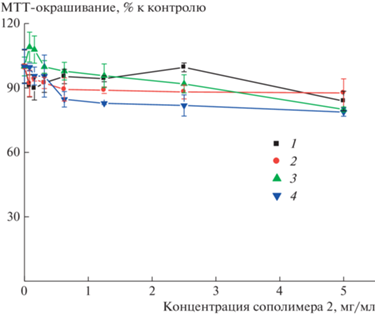
Использование полимеров для биомедицинских целей предполагает их низкую токсичность. Для оценки токсичности полученных сополимеров in vitro исследовали их влияние на жизнеспособность культивируемых клеток различных линий. Как видно на рис. 8, сополимер 2 в концентрации до 5 мг/мл оказывает незначительное влияние на жизнеспособность клеток; эффект сополимера не превышает 20%, что позволяет сделать предположение об инертности исследованного сополимера как платформы биологически активного соединения. В пользу этого свидетельствуют результаты исследования токсичности сополимеров ВП–ДМТЭГ и систем сополимер–биологически активное соединение in vivo [27], что, очевидно, справедливо и для других сополимеров ВП близкого мономерного состава, полученных в настоящей работе. Как следует из результатов исследования цитотоксичности сополимеров ВП–ДМТЭГ различного мономерного состава [24], высокое содержание звеньев ДМТЭГ во фракции 2 сополимера 1 не приведет к снижению его биосовместимости.
Внутриклеточное накопление полимерных частиц, загруженных ZnТФП
C применением метода флуоресцентной микроскопии была изучена способность проникать и накапливаться в клетках человека и животных наночастиц сополимера 2, загруженных гидрофобным красителем ZnТФП (рис. 9). В контрольных образцах флуоресценция отсутствует при возбуждении лазерной линией при 560–630 нм (рис. 9, ряды 1). Для клеток Vero характерно более равномерное распределение наночастиц сополимера с инкапсулированным ZnТФП в пределах цитоплазмы клеток (рис. 9б) по сравнению с клетками HeLa, где наночастицы образуют отдельные конгломераты, и интенсивность регистрируемого сигнала значительно выше. Следовательно, полимерные частицы проникают и накапливаются в клетках.
Рис. 9.
Флуоресцентная микроскопия клеток HeLa (а) и Vero (б) при совместной инкубации в течение 24 ч с наночастицами сополимера 2, загруженного ZnТФП. 1 – не обработанные клетки; 2 – клетки, обработанные наночастицами сополимера 2 с ZnТФП, в конечной концентрации 50 мкг/мл. Шкала бар 10 мкм.
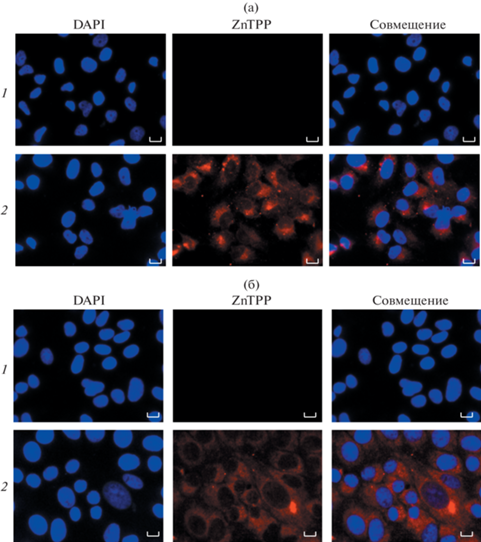
Применив методику окрашивания клеточных ядер красителем DAPI, мы пришли к выводу, что в данной концентрации наночастицы не токсичны и не нарушают целостность ядер, что указывает на отсутствие нарушений клеточной морфологии. Таким образом, методом радикальной сополимеризации в толуоле и этаноле синтезированы тройные сополимеры N-винилпирролидона с метакриловой кислотой и диметакрилатом триэтиленгликоля различного мономерного состава и молекулярной массы; в водных средах они присутствуют в виде отдельных макромолекул малого размера и/или их агрегатов, реагирующих на изменение температуры и рН среды. На основе сополимера ВП–МАК–ДМТЭГ получены водорастворимые формы гидрофобного красителя с гидродинамическим радиусом около 50 нм, стабильные в физиологически важном диапазоне температуры в фосфатно-солевом растворе. Методом МТТ на различных линиях клеток человека и животных показано, что сополимер ВП–МАК–ДМТЭГ малотоксичен и, по данным флуоресцентной микроскопии, проникает в клетки HeLa и Vero, локализуясь в цитоплазме. Предложено использовать новые амфифильные сополимеры ВП–МАК–ДМТЭГ как носители и средства доставки биологически активных соединений, обеспечивающие их контролируемое выделение.
В отличие от ПВП в боковых полимерных цепях сополимеров ВП содержатся сложноэфирные группы ДМТЭГ; по нашим данным, в кислой и щелочной среде по связям С–О олигомерного блока диметакрилата протекает гидролиз, и образуются полимерные цепи с концевыми группами ОН. В результате снижается молекулярная масса полимерных цепей в ответвлениях и всей макромолекулы. В организме эффективность процесса деградации под действием ферментов, очевидно, будет возрастать. Молекулярную массу сополимеров, получаемых радикальной сополимеризацией, легко регулировать с помощью специально подобранных соединений – ограничителей роста полимерных цепей, или условий синтеза – концентрации мономеров в растворе, инициатора, соотношения мономеров, природы растворителя. Изменяя соотношение сомономеров, легко управлять мономерным составом сополимеров, их функциональностью, амфифильностью, процессом самоорганизации и возможностями реагировать на температуру или рН среды, инкапсулировать в гидрофобные части макромолекул частично и полностью нерастворимые биологически активные соединения, получать наноразмерные системы, стабильные в водных средах. Отдельные макромолекулы и агрегаты в воде имеют малый размер, что важно для их эффективного клеточного и тканевого поглощения. Полученные результаты позволяют сделать вывод о необходимости проведения дальнейших исследований в области разработки полимерных 3D структур на основе ВП и оптимизации их характеристик.
Работа выполнена по теме государственного задания АААА-А19-119041090087-4 и АААА-А19-119071890015-6 с использованием оборудования АЦКП ИПХФ РАН https://equipments.icp.ac.ru/ ru/equipments/ckp/ackp.
Список литературы
Кирш Ю.Э. Поли-N-винилпирролидон и другие поли-N-виниламиды. М.: Наука, 1998.
Панарин Е.Ф., Лавров Н.А., Соловский М.В., Шальнова Л.И. Полимеры-носители биологически активных веществ. СПб.: Профессия, 2014.
Сидельковская Ф.П. Химия N-винилпирролидона и его полимеров М.: Наука, 1970.
Folttmann H., Quadir A. // Drug Deliv. Technol. 2008. V. 8. P. 22.
Bothiraja C., Shinde M.B., Rajalakshmi S., Pawar A.P. // J. Pharm. Pharmacol. 2009. V. 61. P. 1465.
Martins R.M., Pereira S.V., Siqueira S., Salomão W.F., Freitas L.A.P. // Food Res. Int. 2013. V. 50. P. 657.
Rasekh M., Karavasili C., Soong Y.L., Bouropoulos N., Morris M., Armitage D., Li X., Fatouros D.G., Ahmad Z. // Int. J. Pharm. 2014. V. 473. P. 95.
Fogaça R., Catalani L.H. // Soft Mater. 2013. V. 11. P. 61.
Del Consuelo I.D., Falson F., Guy R.H., Jacques Y. // J. Control. Release. 2007. V. 122. P. 135.
Franco P., De Marco I. // Polymers. 2020. V. 12. P. 1114.
Zheng X., Zhang T., Song X., Zhang L., Zhang C., Jin S., Xing J., Liang, X.-J. // J. Mater. Chem. B. 2015. V. 3. P. 4027.
Zhang L., Liang Y., Meng L., Wang C. // Polym. Adv. Technol. 2009. V. 20. P. 410.
Song Y., Zhang T., Song X., Zhang L., Zhang C., Xing J., Liang X.-J. // J. Mater. Chem. B. 2015. V. 3. P. 911.
Saxena A., Mozumdar S., Johri A.K. // Biomaterials. 2006. V. 27. P. 5596.
Sheu S.-J., Chou L.-C., Bee Y.-S., Chen J.-F., Lin H.-C., Lin P.-R., Lam H.-C., Tai M.-H. // Exp. Eye Res. 2005. V. 81. P. 673.
Ramalingam V., Varunkumar K., Ravikumar V., Rajaram R. // Sci. Rep. 2018. V. 8. P. 1.
Rose P.A., Praseetha P., Bhagat M., Alexander P., Abdeen S., Chavali M. // Technol. Cancer Res. Treat. 2013. V. 12. P. 463.
Hu M., Li C., Li X., Zhou M., Sun J., Sheng F., Shi S., Lu L. // Artif. Cells Nanomed. Biotechnol. 2018. V. 46. P. 1248.
Hecold M., Buczkowska R., Mucha A., Grzesiak J., Rac-Rumijowska O., Teterycz H., Marycz K. // J. Nanomater. 2017. V. 2017. P. 8706921.
Goetten de Lima G., de Lima D.W., de Oliveira M.J., Lugão A.B., Alcántara M.S., Devine D.M., de Sá M.J. // ACS Appl. Bio Mater. 2018. V. 1. P. 1842.
Besrour H., Tangour B., Linguerri R., Hochlaf M. // Spectrochim.Acta A. 2019. V. 217. P. 278.
Zeng X., Zhang Y., Wu Z., Lundberg P., Malkoch M., Nyström A.M. // J. Polym. Sci., Polym. Chem. 2011. V. 50. P. 280.
Zhou Y., Yan D. // Chem. Commun. 2009. V. 9. P. 1172.
Zhou Y., Huang W., Liu J., Zhu X., Yan D. // Adv. Mater. 2010. V. 22. P. 4567.
Solovskij M.V., Nikolskaya N.V., Tarabukina E.B., Denisov V.M., Adamov A.V., Klenin S. I. // Desig. Monomers Polym. 2004. V. 2. P. 83.
Kurmaz S.V., Pyryaev A.N. // Polymer Science B. 2010. T. 52. № 1. C. 1.
Kurmaz S.V., Fadeeva N.V., Soldatova Y.V., Faingold I.I., Poletaeva D.A., Ignat’ev V.M., Emel’yanova N.S., Shilov G.V., Kotelnikova R.A. // J. Polym. Res. 2021. V. 28. P. 345.
Kurmaz S.V., Sen’ V.D., Kulikov A.V., Konev D.V., Kurmaz V. A., Balakina A.A., Terent’ev A.A. // Russ. Chem. Bull. 2019. V. 68. P. 1769.
Kurmaz S.V., Fadeeva N.V., Fedorov B.S., Kozub G.I., Emel’yanova N.S., Kurmaz V.A., Manzhos R.A., Balakina A.A., Terentyev A.A. // Mendeleev Commun. 2020. V. 30. P. 22.
Kurmaz S.V., Fadeeva N.V., Fedorov B.S., Kozub G.I., Kurmaz V.A., Ignat’ev V.M., Emel’yanova N.S. // Russ. Chem. Bull. 2021. V. 70. P. 1832.
Kurmaz S.V., Obraztsova N.A., Balakina A.A., Terent’ev A.A. // Russ. Chem. Bull. 2016. V. 65. P. 2097.
Kurmaz S.V., Fadeeva N.V., Komendant A.V., Ignatiev V.M., Emelyanova N.S., Shilov G.V., Stupina T.S., Filatova N.V., Lapshina M.A., Terentyev A.A. // Polym. Bull. 2021. V. 10.
Zelikin A.N., Price A.D., Stadler B. // Artificial Organelles Small. 2010. V. 6. P. 2201.
Zhukova O.V., Arkhipova E.V., Kovaleva T.F., Ryabov S.A., Ivanova I.P., Golovacheva A.A., Zykova D.A., Zaitsev S.D. // Molecules. 2021. V. 26. P. 4855.
Leyte J.C., Mandel M.J. // J. Polym. Sci. A. 1964. V. 2. P. 1879.
Graham S., Cormack P.A.G., Sherrington D.C. // Macromolecules. 2005. V. 38. P. 86.
O’Brien N., McKee A., Sherrington D.C., Slark A.T., Titterton A. // Polymer. 2000. V. 41. P. 6027.
Bianco G., Gehlen H.H. // J. Photochem. Photobiol. A. 2002. V. 149. P. 115.
Gergiev G., Dakova I. // Colloid Polym. Sci. 1994. V. 272. P. 938.
Kurmaz S.V., Fadeeva N.V., Ignat’ev V.M., Kurmaz V.A., Kurochkin S.A., Emel’yanova N.S. // Molecules. 2020. V. 25. P. 6015.
Irvin-Choy N’Dea S., Nelson K.M., Gleghorn J.P., Day E.S. // J. Mater. Chem. B. 2020. V. 8. P. 6548.
Blanco E., Shen H., Ferrari M. // Nat. B. 2015. V. 33. P. 941.
Hoshyar N., Gray S., Han H., Bao G. // Nanomedicine. 2016. V. 11. P. 673.
Дополнительные материалы
- скачать ESM.docx
- Приложение 1. Рис. 1. ИК-спектры порошков: (а) фракций Ф1 (1), Ф2 (2), Ф2* сополимера 1 (3) и (б) сополимеров 2 (1) и 3 (2).
Приложение 1. Рис. 2. 1Н ЯМР спектры фракции Ф1 сополимера 1 (a), сополимеров 2 (б) и 3 (в) в дейтерированном хлороформе.
Инструменты
Высокомолекулярные соединения (серия А)