Высокомолекулярные соединения (серия А), 2022, T. 64, № 5, стр. 322-332
СИНТЕЗ И ГАЗОРАЗДЕЛИТЕЛЬНЫЕ СВОЙСТВА МЕТАТЕЗИСНОГО ПОЛИ(5-ПЕРФТОРБУТИЛ-2-НОРБОРНЕНА)
О. А. Аджиева a, *, Р. Ю. Никифоров a, М. Л. Грингольц a, Н. А. Белов a, М. П. Филатова a, Ю. И. Денисова a, Я. В. Кудрявцев a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
* E-mail: adzhieva@ips.ac.ru
Поступила в редакцию 10.06.2022
После доработки 25.07.2022
Принята к публикации 01.08.2022
- EDN: JWHEQO
- DOI: 10.31857/S230811202270016X
Аннотация
Впервые с использованием Ru-катализаторов Граббса первого и третьего поколений синтезирован метатезисный поли(5-перфторбутил-2-норборнен) в растворе с высоким выходом 85–98% и варьируемым соотношением цис/транс двойных связей. Подобраны условия получения исходного мономера 5-перфторбутил-2-норборнена с выходом до 98%. Исследование газоразделительных свойств полученного полимера показало, что введение перфторбутильного заместителя в повторяющееся звено полинорборнена увеличивает проницаемость для неконденсируемых газов за счет роста их коэффициентов диффузии. Идеальная селективность для пар газов, содержащих метан, при этом возрастает или почти не изменяется вследствие увеличения разницы в коэффициентах растворимости этих газов. Причины наблюдаемых изменений газоразделительных и других свойств полинорборнена могут быть связаны с жесткой конформацией и слабым взаимодействием фторалкильных заместителей, что сказывается на свободном объеме полимера и на энергии взаимодействия макромолекул между собой и с молекулами пенетранта. Исследование расширяет представления о газоразделительных и других свойствах класса фторзамещенных полинорборненов.
ВВЕДЕНИЕ
Фторсодержащие полимеры являются привлекательными объектами исследований благодаря комплексу полезных свойств, придаваемых фторсодержащими фрагментами: высокой термо- и хемостабильности, биоинертности, низким значениям поверхностной энергии, показателя преломления и диэлектрических характеристик [1, 2]. Фторзамещенные норборнены представляют интересный и удобный класс мономеров для макромолекулярного дизайна фторполимеров. Причина кроется в их несложном синтезе и способности образовывать полимеры с различным строением циклопентилен-виниленовой ненасыщенной основной цепи, образующейся по механизму циклораскрывающей метатезисной полимеризации (ROMP) [3–8], либо жесткой цепи с бициклическим мономерным звеном, получаемой методом аддитивной (винильной) полимеризации [9–11]. Макромолекулярный дизайн с использованием фторзамещенных норборненов направлен, как правило, на поиск структур с улучшенными газоразделительными [12, 13] или диэлектрическими [14–17] свойствами, получение материалов для фоторезистов [18–20], амфифильных полимеров [21] и других. Особенностью фторзамещенных норборненов является пониженная активность двойной связи в каталитической полимеризации в присутствии электроноакцепторных фторсодержащих заместителей. В связи с этим для полимеризации подбирают более активные катализаторы либо формируют структуру мономера с минимальным воздействием фторсодержащих фрагментов на двойную связь в нем. Последнее достигается расположением фторсодержащих групп на бòльшем расстоянии от двойной связи, что было показано на примере фторзамещенных норборнен-5,6-дикарбоксимидов и экзо-трициклононенов. Для исследования газоразделительных свойств был получен ряд норборнен-5,6-дикарбоксимидов с различным типом и числом фторсодержащих заместителей в фенильной группе у атома азота [22–24]. Их метатезисная полимеризация протекала с выходом 90–98%, что в полтора–два раза выше, чем для фторзамещенных норборненов. Высокую активность в ROMP также продемонстрировали фторзамещенные экзотрициклононены, что позволило синтезировать полимеры с высокой ММ и хорошими пленкообразующими свойствами и изучить их газоразделительные свойства [25–28]. Перфторфенилзамещенный трициклононен даже удалось вовлечь в эффективную аддитивную полимеризацию и исследовать газопроницаемость полученного полимера [29]. К настоящему времени газоразделительные свойства изучены для целого ряда метатезисных фторзамещенных норборнен-5,6-дикарбоксимидов и трициклононенов [22–28], одного представителя аддитивных политрициклононенов и только двух фторзамещенных метатезисных полинорборненов [7, 30].
В настоящей работе синтезирован поли(5-перфторбутил-2-норборнен) (ПНБФ) и изучены его газоразделительные свойства в рамках исследования связи между строением фторзамещенных полинорборненов и их газотранспортными и другими физико-химическими характеристиками. Стоит отметить, что в литературе приведен синтез 5-перфторбутил-2-норборнена (НБФ) и его метатезисная гомо- и блок-сополимеризация [31–34], а также аддитивная гомо- и сополимеризация [35, 36]. Вместе с тем лишь одна публикация посвящена непосредственно метатезисной гомополимеризации НБФ с использованием малоэффективной каталитической системы W(CO)3/C2H5AlCl2/O2 [37], две другие описывают его полимеризацию методом так называемой surface-initiated metathesis polymerization (SI-ROMP) на поверхности золотых субстратов с использованием катализатора Граббса первого поколения, в результате которой получают пленочное покрытие толщиной в несколько нанометров или микрон [32, 38]. Таким образом, нами впервые осуществлена метатезисная полимеризация НБФ на катализаторах Граббса в жидкой фазе, изучены термические и газоразделительные свойства полученного полимера.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты
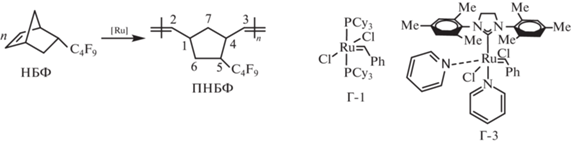
Дициклопентадиен (ДЦПД) (95%, “ACROS Organics”), 1H,1H,2H-перфтор-1-гексен (ФГ) (97%, “Alfa Aesar”), гидрохинон (“Реахим”) и 2,2'-метилен-бис-(6-трет-бутил-4-метилфенол) (“Sigma-Aldrich”) в качестве ингибиторов окисления, катализаторы Граббса первого (бис-(трициклогексилфосфин) бензилиден рутений дихлорид, Г-1) и третьего (дихлор[1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден](бензилиден) бис(3-бромпиридин)рутений(II), Г-3) поколения (“Sigma-Aldrich”), винилэтиловый эфир (99%, “Fluka”) использовали без дополнительной очистки. Перфторбензол (99%, “ПиМ-Инвест”) и хлороформ абсолютировали над CaH2, ТГФ абсолютировали над металлическим Na.
Методы измерений
Спектры ЯМР регистрировали для растворов образцов в дейтерохлороформе и смеси дейтерохлороформа и перфторбензола (ПФБ) (объемное соотношение CHСl3 : ПФБ = 1 : 1) при комнатной температуре на спектрометре “Avance III HD” (“Bruker”) c рабочей частотой 400.1 МГц по водороду, 100.6 МГц по углероду и 376.5 МГц по фтору. Химические сдвиги в спектрах ЯМР 1H и ЯМР 13C определяли с точностью не менее 0.001 м.д. относительно остаточного сигнала хлороформа. Для спектров ЯМР 19F в качестве внутреннего стандарта использовали ПФБ.
Хроматомасс-спектрометрический анализ (ГХ-МС) проводили на газо-хромато-масс-спектрометре “Finnigan MAT 95 XL” (энергия ионизация 70 эВ, диапазон масс 20–800 а.е.м., разрешение 1000, температура источника 200°С, скорость сканирования 1 с/декада масс) и хроматографе HP 6890+ с капиллярной колонкой 30 м × 0.25 мм с фазой DB-5 (полидиметилсилоксан, содержащий 5% фенильных групп), газ-носитель – гелий (деление потока 1:30).
Молекулярно-массовые характеристики определяли методом ГПХ на жидкостном хроматографе “Waters” с рефрактометрическим детектором “Chromatopack Microgel-5” (элюент хлороформ, скорость потока 1 мл/мин). ММ рассчитывали по стандартной методике относительно стандартных образцов монодисперсного полистирола.
Термические свойства полимеров исследовали методами дифференциальной сканирующей калориметрии и термогравиметрического анализа. Термограммы ДСК получали на приборе “Mettler Toledo DSC823e”. Образцы нагревали и охлаждали со скоростью 20 град/мин в атмосфере аргона со скоростью потока 70 мл/мин в интервале 20–150°C. Представительными считали результаты второго нагревания. ТГА полимеров проводили в атмосфере аргона на приборе “Mettler Toledo TGA/DSC-1” со скоростью нагревания 10 град/мин и скоростью потока 10 мл/мин в диапазоне температур от 30 до 1000°C. Образцы с массой 10 мг предварительно термостатировали при 30°C.
Синтез 5-перфторбутил-2-норборнена)
Мономер 5-(1,1,2,2,3,3,4,4,4-нонафторбутил)-бицикло[2.2.1]гептен-2 (5-перфторбутил-2-норборнен, НБФ) получали взаимодействием ДЦПД с ФГ в присутствии гидрохинона [39]. В стеклянную ампулу загружали 0.18 г гидрохинона, 3.5 мл перфторгексена (5.15 г, 0.02 моля) и 0.76 мл ДЦПД (0.745 г, 0.0056 моля). Ампулу запаивали, помещали в автоклав и проводили реакцию при 170°С. Через 72 ч ампулу вскрывали, продукт перегоняли. Мономер бесцветный, прозрачный, маслянистый, Ткип = 100°С, 90 мм рт.ст. Выход 3.39 г (98%). Соотношение эндо- : экзо-изомеров составило 75 : 25.
ЯМР 1Н (CDCl3) δ, м.д.: 6.20–6.16 (м, 1.25H, CH=CH), 5.98–5.95 (м, 0.75H, CH=CH), 3.17 (с, 1H, HC4, экзо/эндо), 2.98 (с, 0.26H, HC1, экзо), 2.94 (с, 0.77H, HC1, эндо), 2.85–2.72 (м, 0.78H, HC5), 2.12–2.03 (м,0.5Н, НC5), 2.01–1.95, 1.28–1.23 (м, 1.2H, H2C6), 1.84–1.81, 1.42–1.36 (м, 0.8H, H2C6), 1.53–1.46, 1.30 (м, 2H, H2C7, эндо/экзо) (дополнительные материалы, рис. S1 ).
ЯМР 13C (CDCl3) δ, м.д.: 138.44 (C2, экзо), 137.46 (C2, эндо), 136.50 (C3, экзо), 131.94 (C3, эндо), 119.43–115.91 (Ca, b, c, dF2), 49.84 (C7, эндо), 46.53 (C7, экзо), 43.79 (C4, эндо), 42.55 (C4, экзо), 42.16 (C1, эндо), 41.42 (C1, экзо), 41.23–40.82 (C5, экзо), 40.48–40.09 (C5, эндо), 27.70 (C6, эндо), 26.95 (C6, экзо) (дополнительные материалы, рис. S2 ).
Метатезисная полимеризация НБФ
Полимеризация с использованием катализатора Г-1. В двугорлую колбу объемом 50 мл с магнитной мешалкой в инертной атмосфере заливали 0.27 мл НБФ (0.5068 г, 0.0016 моля) и 1 мл ПФБ. Отдельно готовили раствор катализатора Г-1 (0.0020 г) в абсолютированном хлороформе (2.7 мл) и приливали 1.24 мл раствора (0.0009 г, 0.0011 ммоля) к мономеру. Через 24 ч в реакционную смесь добавляли винилэтиловый эфир (0.1 мл, мольное соотношение винилэтиловый эфир : Ru = 500 : 1), ПФБ и ингибитор окисления 2,2'-метилен-бис-(6-трет-бутил-4-метилфенол) (0.04 г, 10 мас. % от полимера). Полученный поли(5-перфторбутил-2-норборнен) (ПНБФ) высаживали в этиловый спирт и сушили при пониженном давлении до постоянной массы. Выход 0.4881 г (96%).
Полимеризация с использованием катализатора Г-3. Синтез проводили аналогичным образом. В реактор заливали 0.2 мл НБФ (0.3412 г, 0.0011 моля) и 1.7 мл абсолютированного ТГФ. Отдельно готовили раствор катализатора Г3 (0.0056 г) в абсолютированном ТГФ (0.15 мл) и приливали 0.1 мл раствора (0.0036 г, 0.0041 ммоля) к мономеру. Через 1 ч в реакционную смесь добавляли винилэтиловый эфир, ТГФ (2 мл) и ингибитор окисления (0.028 г). Полученный ПНБФ высаживали в этиловый спирт и сушили при пониженном давлении до постоянной массы. Выход 0.2904 г (85%).
ЯМР 1Н (CDCl3/С6F6) δ, м.д.: 5.57 (1.64H, CH=CH, транс), 5.36 (0.36H, CH=CH, цис), 3.42 (0.26H, HC5, цис, эндо), 3.26 (0.07H, HC5, цис, экзо), 3.06 (HC5, транс, эндо), 2.92 (HC5, транс, экзо), 2.78 (HC1,4, цис), 2.66 (HC1,4, транс), 2.13 (2Н, H2C6), 1.70–1.37 (2H, H2C7) (дополнительные материалы, рис. S8 ).
ЯМР 13C (CDCl3/С6F6) δ, м.д.: 134.12–132.49 (C2, цис/транс), 131.99 (C2,3), 130.50 (C3, транс), 129.14 (C3, цис), 122.42, 119.57, 116.71, 113.85, 111.54, 109.35, 106.75 (CF), 47.41 (С5, экзо, цис) 46.59 (С5, экзо, транс), 45.37 (C5, эндо, цис/транс), 44.22, 43.81 (C1), 43.05 (C7), 42.11, 41.77, 41.06, 40.23 (C4, C7), 38.89, 38.37, 38.19, 36.78 (C1, C4), 33.69–32.78 (C6) (дополнительные материалы, рис. S10–S12 ).
ЯМР 19F (С6F6/CDCl3) –δ, м.д.: 82.72 (CF3), 111.41 (CF), 114.82 (CF), 120.22–122.75 (CF2), 126.02–128.42 (CF2) (дополнительные материалы, рис. S9 ).
Определение газотранспортных параметров
Пленки ПНБФ готовили методом полива на целлофановую подложку 2.5 мас. % раствора полимера в ПФБ. После испарения растворителя пленку отделяли от подложки и вакуумировали до постоянной массы (остаточное давление не более 1 мбар). Толщина пленок составляла ~17 мкм. Коэффициенты проницаемости P и диффузии D газов He, H2, O2, N2, CO2, CH4 определяли на барометрической установке “Баротрон” [40] при 22 ± 2°С. Давление над мембраной варьировали в интервале 1–3 бар, давление под мембраной не превышало ∼12 мм рт. ст. (16 мбар). Стационарный поток через полимерную пленку измеряли в диапазоне (4–6)θ, где θ – время запаздывания. Коэффициент диффузии находили по методу Дейнеса–Баррера, используя соотношение D = l2/(6θ), в котором l – толщина исследуемой пленки. Коэффициент растворимости S газа находили как отношение P : D.
Долю свободного объёма полимера (the fraction of free volume, FFV) оценивали по методу Бонди [41] как FFV = 1 – 1.3ρpVw, где ρp – плотность полимера, определенная методом гидростатического взвешивания в изопропаноле с помощью аналитических весов “AND GR-200” (точность 10−4 г), а Vw – ван-дер-ваальсов объем мономерного звена, рассчитанный с помощью метода групповых вкладов Аскадского [42].
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез
Синтез НБФ проводили по реакции диеновой конденсации циклопентадиена и 1H,1H,2H-перфтор-1-гексена:
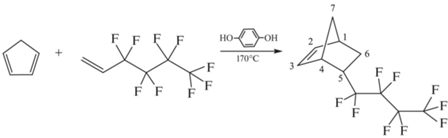
В литературе описаны различные варианты получения НБФ [32, 35, 37–39, 43], в которых в качестве диена использовали циклопентадиен (ЦПД) или ДЦПД, в основном, при эквимольном соотношении диена (в пересчете на ЦПД) и ФГ и температуре 170–200°С. Выход аддукта (НБФ) составлял преимущественно 36–50% [32, 35, 38, 43], хотя в первой публикации Е. Perez с соавторами [37] сообщалось о 75%-ном выходе в аналогичных условиях. Лишь недавно авторам [39] удалось получить НБФ с выходом 89% при использовании двукратного избытка диенофила к ДЦПД и нагревания при 200°С в течение 72 ч. Нами был проведен синтез НБФ с двукратным избытком ФГ, как в работе [39], но при более низкой температуре (170°С) в течение 72 ч, что позволило получить целевое соединение с выходом до 98%. ЯМР-спектры (дополнительные материалы, рис. S1, S2 ) соответствовали литературным, при этом впервые для НБФ были получены спектры JMODECHO (рис. S3–S5 ) и двумерный спектр HMQC (рис. S6 ). Соотношение энд-о/экзо-изомеров, определенное по сигналам протонов НC1 (2.94 м.д., эндо и 2.98 м.д., экзо) из спектров ЯМР 1Н или сигналов углеродов двойных связей С=С (137.46, 131.94 м.д., эндо и 138.44, 136.50 м.д., экзо) в спектре ЯМР 13С, составило 76 : 24. Согласно анализу ГХ-МС (рис. S7 ) мономер содержал два изомера (эндо : экзо = 80 : 20) с молекулярной массой 312, что соответствует молекулярной массе НБФ.
В литературе описана метатезисная полимеризация НБФ на W-содержащем катализаторе [37] и поверхностно-инициируемая метатезисная полимеризация НБФ с использованием Ru-катализаторов Граббса первого (Г-1) и второго (Г-2) поколения [32, 38]. На каталитической системе W(CO)3/C2H5AlCl2/O2 был получен ПНБФ с выходом 65%, температурой стеклования от –20 до –10°С и температурой разложения 300°С [37]. Полимер охарактеризован методами ЯМР 1H, ЯМР 19F и элементного анализа; указывается, что он придает хорошие водоотталкивающие свойства текстильным волокнам.
Нами впервые изучена полимеризация НБФ в растворе ПФБ на катализаторе Граббса первого поколения (Г-1) и полимеризация в ТГФ на катализаторе Граббса третьего поколения (Г-3) (табл. 1, опыты 1,2):
Таблица 1.
Метатезисная полимеризация НБФ, норборнена (НБ) и фторзамещенных трициклононенов (ТЦН) (температура комнатная)
| Опыт, № | Мономер | Катализатор | Растворитель | Концентрация мономера, , моль/л моль/л | τ, ч | Мольное соотношение [катализатор] : : [мономер] [мономер] | Выход, % | Цис/транс, % | Эндо/экзо, % | Mw × 10–3 | Ð | Тс, °С |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | НБФ | Г-1 | ПФБ | 0.8 | 24 | 1:1500 | 96 | 28/72 | 79/21 | 385 | 1.6 | 49 |
| 2 | НБФ | Г-3 | ТГФ | 0.5 | 1 | 1:270 | 85 | 45/55 | 78/22 | 86 | 1.5 | 57 |
| 3 | НБ | Г-1 | CHCl3 | 0.8 | 2 | 1:700 | 98 | 12/88 | − | 310 | 3.1 | 39 |
| 4⁎ | ТЦН-F4 [26] | Г-1 | ПФБ/CH2Cl2 | 0.3 | 4 | 1:1500 | 95 | − | − | − | − | 107 |
| 5⁎ | ТЦН-F3(C4F9) [26] | Г-1 | ПФБ/CH2Cl2 | 0.3 | 164 | 1:1500 | 61 | − | − | − | − | 89 |
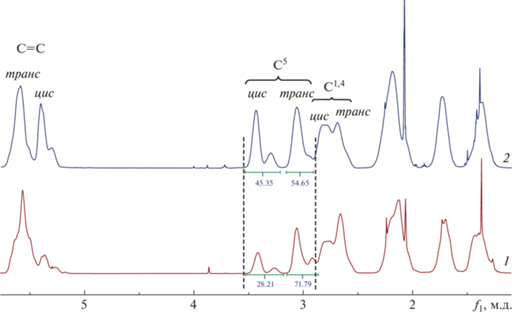
Для изучения газоразделительных параметров важно было получить полимер на катализаторе Г-1, поскольку уже имеющиеся в литературе сведения касаются фторсодержащих полинорборненов, синтезированных на катализаторе Г-1. Катализатор Г-3 – один из наиболее активных катализаторов метатезиса. Синтезированные полимеры растворимы в ТГФ, ПФБ, смеси бензола и ПФБ, смеси ПФБ и хлороформа и не растворимы в хлороформе, толуоле, бензоле, ДМФА и ацетоне. В связи с этим спектры ЯМР 1H (дополнительные материалы, рис. S8 ), ЯМР 19F (рис. S9 ) и ЯМР 13С (рис. S10–S12 ) регистрировали для образцов ПНБФ, растворенных в смеси дейтерохлороформа и ПФБ. Из спектров ЯМР 1Н определяли соотношение цис/транс двойных связей ПНБФ по интегралам сигналов НС=НС (5.36 м.д., цис и 5.57 м.д., транс) и соотношение эндо/экзо изомерных звеньев по интегралам сигналов НС5 (3.42 м.д., эндо и 3.26 м.д., экзо).
Нами получены гомополимеры ПНБФ с высоким выходом, отличающиеся ММ и соотношением цис/транс двойных связей. В выбранных условиях соотношение цис/транс С=С в полимере, синтезированном на катализаторе Г-3, близко к эквимольному, а в полимере, полученном на катализаторе Г-1, превалируют транс-С=С связи (табл. 1, опыты 1 и 2; рис. 1). Введение перфторбутильного заместителя в норборнен снижает его полимеризационную активность, так как близкий к количественному выход полимера достигается за большее время (табл. 1, опыты 1 и 3). Интересно, что замена одного атома фтора в тетрафторзамещенном трициклононене (ТЦН-F4) на н-C4F9 приводит к большей потере его активности в ROMP (табл. 1, опыты 4 и 5) [26], по-видимому, из-за наличия трех атомов фтора в мономерном звене.
Газотранспортные свойства
По данным рентгенофазового анализа, синтезированный ПНБФ является аморфным продуктом (дополнительные материалы, рис. S13 ), что позволяет сопоставить газотранспортные характеристики ПНБФ и ряда других аморфных стеклообразных фторсодержащих полинорборненов (табл. 2):
Таблица 2.
Коэффициенты проницаемости газов P (Баррер) в незамещенном и фторсодержащих полинорборненах
| Полимер | F, мол. % | Газ | Литература | |||||
|---|---|---|---|---|---|---|---|---|
| He | H2 | O2 | N2 | CO2 | CH4 | |||
| ПНБ | 0 | 15 | 18 | 2.3 | 0.43 | 9.3 | 0.78 | [44] |
| ПНБ-CpF2 | 9.5 | 35 | 33 | 5.1 | 1.1 | 23 | 1.5 | [45] |
| ПНБФ | 31 | 73 | 45 | 13 | 4.5 | 54 | 4.3 | Настоящая работа |
| ПНБ-F2(CF3)2 | 36 | – | 166 | 50 | 17 | 200 | 13 | [7] |
| ПНБ-F3(OC3F7) | 38 | – | 130 | 55 | 17 | 200 | 18 | [7] |
| ПТЦН-F4 | 19 | 29 | 20 | 4.1 | 1.1 | 16 | 0.9 | [26] |
| ПТЦН-F3(C4F9) | 36 | 280 | 175 | 57 | 24 | 210 | 16 | [26] |
Поскольку все представленные в табл. 2 производные полинорборненов были синтезированы на катализаторе Г-1, в первую очередь были изучены газоразделительные свойства ПНБФ, полученного на этом катализаторе. Синтез ПНБФ на катализаторе Г-3 как на одном из наиболее активных коммерчески доступных катализаторов метатезиса представлял интерес для изучения возможностей варьирования соотношения цис/транс двойных связей. Исследование газоразделительных параметров этого полимера планируется в дальнейшем.
Видно, что введение группы н-C4F9 в структуру ПНБ в качестве бокового заместителя вызывает значительный рост газопроницаемости (в пять раз для гелия и еще выше для кислорода, азота и метана). Ранее еще больший эффект наблюдали при замене одного из четырех атомов фтора в циклобутановом фрагменте мономерного звена политрициклононена (ПТЦН-F4) на группу н-C4F9 (ПТЦН-F3(C4F9)) [26]. Для дифторциклопропанированного ПНБ (ПНБ-CpF2) внедрение фторсодержащих групп в количестве 9.5 мол. % привело к увеличению газопроницаемости всего в 2–2.5 раза [45]. Для замещенных полинорборненов с бóльшим содержанием фтора в мономерном звене (ПНБ-F2(CF3)2 и ПНБ-F3O(C3F7)) наблюдали более существенный рост коэффициентов проницаемости в 10–30 раз [7].
Коэффициент проницаемости газа можно представить как произведение его коэффициентов диффузии и растворимости, которые являются независимыми величинами. Эти параметры для исследуемого ПНБФ и ряда замещенных полинорборненов приведены в табл 3. Как видно, увеличение коэффициентов проницаемости газов для изучаемого ПНБФ вызвано возрастанием как коэффициентов диффузии в 2–5 раз, так и коэффициентов растворимости в 1.2–3 раза. Данный эффект еще больше выражен для фторзамещенных полинорборненов ПНБ-F2(CF3)2 и ПНБ-F3O(C3F7) [7]. Однако имеются исключения из подобного поведения, ранее наблюдавшиеся для полипентафторстирола [46]. В случае ПНБ-CpF2 коэффициенты диффузии также незначительно изменялись по сравнению с незамещенным ПНБ, и увеличение коэффициентов проницаемости газов было следствием возрастания их коэффициентов растворимости (табл. 2, 3). Аналогичные результаты демонстрирует фторзамещенный ПНБ-F2(CF3)2 (табл. 3), но для него коэффициенты растворимости газов существенно выше и в 7−20 раз превосходят соответствующие величины для незамещенного ПНБ, что трудно объяснить, поскольку такие значения характерны для высокопроницаемых полимеров с большим свободным объемом – политриметилсилилпропина [47], полибензодиоксана PIM-1 [48] и аддитивного политрициклононена с двумя триметилсилильными группами [49].
Таблица 3.
Коэффициенты диффузии и растворимости газов для ПНБ, ПНБФ и других фторсодержащих полинорборненов
| Полимер | F, мол. % | D × 108, см2/с | S, см3(н.у.)/(см3 · атм) | Литература | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| O2 | N2 | CO2 | CH4 | O2 | N2 | CO2 | CH4 | |||
| ПНБ | 0 | 18 | 3.6 | 5.5 | 1.5 | 0.14 | 0.092 | 1.4 | 0.40 | [44] |
| ПНБ-CpF2 | 9.5 | 12 | 3.7 | 4.0 | 1.4 | 0.34 | 0.22 | 4.4 | 0.83 | [45] |
| ПНБФ | 31 | 30 | 13 | 15 | 6.9 | 0.32 | 0.26 | 2.8 | 0.48 | Настоящая работа |
| ПНБ-F2(CF3)2 | 36 | 14 | 8.4 | 8.4 | 3.3 | 2.7 | 1.5 | 18 | 3.0 | [7] |
| ПНБ-F3(OC3F7) | 38 | 57 | 44 | 40 | 23 | 0.73 | 0.29 | 3.8 | 0.59 | [7] |
| ПТЦН-F3(C4F9) | 36 | 160 | 100 | 76 | 28 | 0.27 | 0.18 | 2.1 | 0.43 | [26] |
Отдаление боковой фторсодержащей группы от основной цепи при переходе от мономерного звена ПНБ к соответствующему звену политрициклононенов (ПТЦН) приводит к увеличению коэффициента диффузии газа в 2.5–4.5 раза (табл. 3), в то время как коэффициенты растворимости газов для фторзамещенных ПНБ изменяются незначительно.
Общий рост коэффициентов диффузии и проницаемости газов для представленных в табл. 2 и 3 производных ПНБ можно связать с увеличением доли свободного объема в ряду полимеров, хотя оно не носит монотонный характер (табл. 4). Более высокая доля свободного объема, характерная для ПНБ с фторсодержащими заместителями, включая н-C4F9, может быть вызвана жесткостью этого фрагмента, что создает стерические затруднения при упаковке макромолекул. Согласно R.Pollice и P.Chen [50], данный фактор является ключевым и приводит к снижению энергии межмолекулярного взаимодействия для фторсодержащих соединений.
Стоит обратить внимание на то, что изменение коэффициентов проницаемости при варьировании боковых фторсодержащих функциональных групп мономерного звена полинорборнена происходит не одинаково для разных газов. Так, для незамещенного ПНБ более проницаемым газом является водород по сравнению с гелием (αP (He/H2) = 0.83) [44], для дифторциклопропанированного ПНБ-CpF2 величины проницаемости этих газов становятся сравнимыми [45], а для исследуемого полимера ПНБФ проницаемость гелия в 1.5 раза выше проницаемости водорода. Аналогичная качественная закономерность выполняется для пары N2/CH4, где с повышением содержания фтора в мономерном звене не только увеличивается общий уровень газопроницаемости, но и проницаемость метана становится меньше проницаемости азота, в то время как как для исходного ПНБ наблюдается обратная закономерность (табл. 2). Такое поведение можно объяснить повышенной селективностью растворимости αS(N2/CH4) для фторсодержащих полимеров по сравнению с углеводородсодержащими аналогами за счет пониженной растворимости метана во фторированных соединениях [51, 52]. Действительно, селективность растворимости N2/CH4 для полинорборненов с боковыми фторсодержащими группами возрастает примерно вдвое по сравнению с исходным ПНБ, тогда как изменение селективности диффузии менее существенно (табл. 5).
Таблица 5.
Селективности проницаемости, диффузии и растворимости пар газов для незамещенного и фторзамещенных полинорборненов
| Полимер | F, мол. % | αP | αD | αS | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| He/H2 | O2/N2 | N2/CH4 | CO2/CH4 | O2/N2 | N2/CH4 | CO2/CH4 | O2/N2 | N2/CH4 | CO2/CH4 | ||
| ПНБ [44] | 0 | 0.83 | 5.3 | 0.55 | 12 | 5.0 | 2.4 | 3.7 | 1.5 | 0.23 | 3.5 |
| ПНБ-CpF2 [45] | 9.5 | 1.10 | 4.6 | 0.73 | 15 | 3.2 | 2.6 | 2.9 | 1.5 | 0.27 | 5.3 |
| ПНБФ | 31 | 1.60 | 2.9 | 1.0 | 13 | 2.3 | 1.9 | 2.2 | 1.2 | 0.54 | 5.8 |
| ПНБ-F2(CF3)2 [7] | 36 | − | 2.9 | 1.30 | 15 | 1.7 | 2.5 | 2.5 | 1.8 | 0.50 | 6.0 |
| ПНБ-F3(OC3F7) [7] | 38 | − | 3.2 | 0.94 | 11 | 1.3 | 1.9 | 1.7 | 2.5 | 0.49 | 6.4 |
| ПТЦН-F3(C4F9) [26] | 36 | 1.60 | 2.4 | 1.50 | 13 | 1.6 | 3.6 | 2.7 | 1.5 | 0.42 | 4.9 |
Для пары газов O2/N2 в ряду замещенных полинорборненов наблюдается стандартное поведение: селективность снижается с ростом проницаемости, что обусловлено слабым изменением селективности растворимости и значительным уменьшением селективности диффузии O2/N2 при повышении содержания фтора в мономерном звене и свободного объема полимера (табл. 4). Для пары газов CO2/CH4 уменьшение αD сопровождается возрастанием αS настолько, что селективность проницаемости αP слабо меняется в зависимости от содержания фтора в структуре мономерного звена ПНБ.
Описанные выше изменения селективности проницаемости фторсодержащих полинорборненов могут быть представлены более наглядно с помощью диаграмм Робсона для трех пар газов (рис. 2). Из диаграмм видно, что коэффициент проницаемости варьируется в широком диапазоне, например P(O2) = 2−3 Баррер для ПНБ и P(O2) = 200 Баррер для ПТЦН-F3(C4F9), в то время как идеальная селективность αP изменяется в узком интервале значений. Незамещенный ПНБ и фторсодержащие полинорборнены с малым содержанием фтора в мономерном звене располагаются в общем облаке точек, а с увеличением доли фтора происходит рост коэффициента проницаемости, способствующий приближению газоразделительных характеристик рассматриваемых полимеров к верхней границе диаграммы.
Рис. 2.
Диаграммы Робсона для пар газов O2/N2 (а), N2/CH4 (б) и CO2/CH4 (в) c верхней границей 1991 и 2008 гг. [53]. 1 – ПНБ , 2 – ПНБ-CpF2, 3 – ПНБФ, 4 – ПНБ-F2(CF3)2, 5 – ПНБ-F3(OC3F7), 6 – ПТЦН-F4, 7 – ПТЦН-(CF3)4, 8 – ПТЦН-F3(C4F9), 9 – ПТЦН-F3(C6F13), 10 – ПТЦН-F(CF3)2(C2F5).
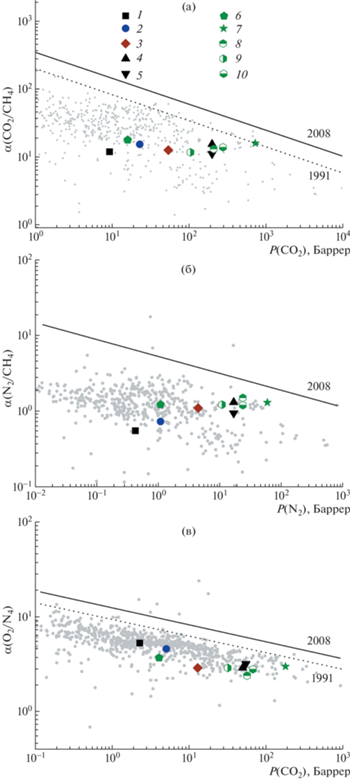
Таким образом, в результате введения перфторбутильной боковой группы в структуру мономерного звена ПНБ повышается температура стеклования и увеличивается газопроницаемость полимера относительно всех изученных газов. Интерес представляет улучшение газоразделительных параметров полимера для метансодержащих пар газов за счет роста селективности растворимости. Полученные результаты расширяют возможности макромолекулярного дизайна для данного класса полимеров.
Авторы выражают благодарность А.И. Возняк, Р.С. Борисову, И.С. Левину и Г.А. Шандрюку (ИНХС РАН) за помощь в характеризации полимеров.
Строение полученных соединений изучено с использованием научного оборудования Центра коллективного пользования ИНХС РАН “Аналитический центр проблем глубокой переработки нефти и нефтехимии”.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 20-03-00703).
Список литературы
Ameduri B., Boutevin B. Well-Architectured Fluoropolymers: Synthesis, Properties and Applications . Amsterdam: Elsevier, 2004.
Adamenko N.A., Bolbasov E.N., Buznik V.M., Vavilova S.Yu., Gnedenkov S.V., Dyachenko V.I., Zibareva I.V., Ignatyeva L.N., Igumnov S.M., Kazurov A.V., Kiryukhin D.P., Kichigina G.A., Kumeyeva T.Yu., Kushch P.P., Mashtalyar D.V., Melnik O.A., Nazarov V.G., Nikitin L.N., Okhlopkova A.A., Prorokova N.P., Safronova E.Yu., Serov S.A., Sinebryukhov S.L., Sleptsova S.A., Sokolov V.I., Sto-lyarov V.P., Tverdokhlebov S.I., Khatipov S.A., Tsvetnikov A.K., Shits E.Yu., Yaroslavtsev A.B. Fluoropolymer materials / Ed.by V.M. Buznik Tomsk: Scientific and Technical Literature (LLC “NTL”) 2017.
Feast J.W., Wilson B. // Polymer. 1979. V. 20. № 10. P. 1182.
Alimuniar A., Blackmore P.M., Edwards J.H., Feast W.J., Wilson B. // Polymer. 1986. V. 27. № 8. P. 1281.
Blackmore P.M., Feast W.J. // Polymer. 1986. V. 27. № 8. P. 1296.
Seehof N., Mehler C., Breunig S., Risse W. // J. Mol Catal. 1992. V. 76. № 1–3. P. 53.
Yampol’skii Y.P., Bespalova N.B., Finkel’shtein E.S., Bondar V.I., Popov A.V. // Macromolecules. 1994. V. 27. № 10. P. 2872.
Seehof N., Grutke S., Risse W. // Macromolecules. 1993. V. 26. № 4. P. 695.
Feiring A.E., Crawford M.K., Farnham W.B., Feldman J., French R.H., Junk C.P., Leffew K.W., Petrov V.A., Qiu W., Schadt F.L., Tran H.V., Zumsteg F.C. // Macromolecules. 2006. V. 39. № 9. P. 3252.
Tran H.V., Hung R.J., Chiba T., Yamada S., Mrozek T., Hsieh Y.-T., Chambers C.R., Osborn B.P., Trinque B.C., Pinnow M.J., MacDonald S.A., Willson C.G., San-ders D.P., Connor E.F., Grubbs R.H., Conley W. // Macromolecules. 2002. V. 35. № 17. P. 6539.
Sanders D.P., Connor E.F., Grubbs R.H., Hung R.J., Osborn B.P., Chiba T., MacDonald S.A., Willson C.G., Conley W. // Macromolecules. 2003. V. 36. № 5. P. 1534.
Finkelshtein E.S., Bermeshev M.V., Gringolts M.L., Starannikova L.E., Yampolskii Y.P. // Russ. Chem. Rev. 2011. V. 80. № 4. P. 341.
Wang X., Wilson T.J., Alentiev D., Gringolts M., Finkelshtein E., Bermeshev M., Long B.K. // Polym. Chem. 2021. V. 12. № 20. P. 2947.
Fujiwara T., Shinba Y., Sugimoto K., Mori Y., Tomikawa M. // J. Photopolym. Sci. Technol. 2005. V. 18. № 2. P. 289.
You Z., Song W., Zhang S., Jin O., Xie M. // J. Polym. Sci., Polym. Chem. 2013. V. 51. № 22. P. 4786.
Fang L., Zhou J., Tao Y., Wang Y., Chen X., Chen X., Hou J., Sun J., Fang Q. // ACS Sustain. Chem. Eng. 2019. V. 7. № 4. P. 4078.
Chen X., Sun J., Fang L., Tao Y., Chen X., Zhou J., Fang Q. // ACS Appl. Polym. Mater. 2020. V. 2. № 2. P. 768.
Rajarathinam V., Lightsey C.H., Osborn T., Knapp B., Elce E., Bidstrup Allen S.A., Kohl P.A. // J. Electron. Mater. 2009. V. 38. № 6. P. 778.
Evans P.J., Brick C.M., Bell A., Kandanarachchi P., Thoresen J., Rhodes L.F., Onishi O., Ikeda H., Benedikt G.M., Koronich E. // J. Appl. Polym. Sci. 2017. V. 134. № 24. P. 44952.
Rutenberg I.M., Scherman O.A., Grubbs R.H., Jiang W., Garfunkel E., Bao Z. // J. Am. Chem. Soc. 2004. V. 126. № 13. P. 4062.
Hou C., Zhou C., Cheng J. // Polymer. 2021. V. 213. P. 123310.
Cruz-Morales J.A., Vargas J., Santiago A.A., Vásquez-García S.R., Tlenkopatchev M.A., de Lys T., López-González M. // High Perform. Polym. 2016. V. 28. № 10. P. 1246.
Vargas J., Santiago A.A., Tlenkopatchev M.A., López-González M., Riande E. // J. Memb. Sci. 2010. V. 361. № 1–2. P. 78.
Santiago A.A., Tlenkopatchev M.A., Vargas J., Martı A., Aguilar-vega M. // J. Fluor. Chem. 2009. V. 130. P. 162.
Bermeshev M.V., Starannikova L.E., Sterlin S.R., Tyutyunov A.A., Tavtorkin A.N., Yampolskii Y.P., Finkelshtein E.S. // Pet. Chem. 2015. V. 55. № 9. P. 753.
Karpov G.O., Bermeshev M.V., Borisov I.L., Sterlin S.R., Tyutyunov A.A., Yevlampieva N.P., Bulgakov B.A., Volkov V.V., Finkelshtein E.S. // Polymer. 2018. V. 153. P. 626.
Bermesheva E.V., Wozniak A.I., Borisov I.L., Karpov G.O., Bermeshev M.V., Asachenko A.F., Topchiy M.A., Griba-nov P.S., Nechaev M.S., Volkov V.V., Finkelshtein E.S., Yevlampieva N.P., Vezo O.S. // Polymer Science C. 2019. V. 61. № 1. P. 86.
Borisov I.L., Akmalov T.R., Ivanov A.O., Volkov V.V., Finkelshtein E.S., Bermeshev M.V. // Mendeleev Commun. 2016. V. 26. № 2. P. 124.
Karpov G.O., Borisov I.L., Volkov A.V., Finkelshtein E.S., Bermeshev M.V. // Polymers. 2020. V. 12. № 6. P. 1282.
Teplyakov V.V., Paul D.R., Bespalova N.B., Finkel’shtein E.S. // Macromolecules. 1992. V. 25. № 16. P. 4218.
Perez E., Laval J.P., Bon M., Rico I., Lattes A. // J. Fluor. Chem. 1988. V. 39. № 2. P. 173.
Berron B.J., Payne P.A., Jennings G.K. // Ind. Eng. Chem. Res. 2008. V. 47. № 20. P. 7707.
Faulkner C.J., Fischer R.E., Jennings G.K. // Macromolecules. 2010. V. 43. № 3. P. 1203.
Ahmed E., Womble C.T., Cho J., Dancel-Manning K., Rice W.J., Jang S.S., Weck M. // Polym. Chem. 2021. V. 12. № 13. P. 1967.
Kim D.G., Bell A., Register R.A. // ACS Macro Lett. 2015. V. 4. № 3. P. 327.
Ji L., Liu J.-S., Wang X.-Y., Li J.-F., Chen Z., Liao S., Sun X.-L., Tang Y. // Polym. Chem. 2019. V. 10. № 26. P. 3604.
Perez E., Laval J.P., Bon M., Rico I., Lattes A. // J. Fluor. Chem. 1988. V. 39. № 2. P. 173.
Faulkner C.J., Fischer R.E., Jennings G.K. // Macromolecules. 2010. V. 43. № 3. P. 1203.
Ahmed E., Womble C.T., Cho J., Dancel-Manning K., Rice W.J., Jang S.S., Weck M. // Polym. Chem. 2021. V. 12. № 13. P. 1967.
Zhigarev V.A., Morontsev A.A., Nikiforov R.Y., Gringolts M.L., Belov N.A., Finkelshtein E.S., Komalenkova N.G., Lakhtin V.G. // Polymer Science C. 2019. V. 61. № 1. P. 107.
Bondi A.A. Physical Properties of Molecular Crystals, Liquids, and Glasses . New York; London; Sydney: Wiley, 1968.
Askadskii A.A. Computational Materials Science of Polymers. Cambridge; Int. Sci. Publ., 2003.
Mueller D.C., Miskiewicz P., Cull T., Wierzchowiec P., Bell A., Elce E., Rhodes L.F., Fujita K., Ng H., Kandanarachchi P., Smith. S. Pat. 2012/0056249 USA. 2012.
Belov N.A., Gringol’ts M.L., Morontsev A.A., Starannikova L.E., Yampolskii Y.P., Finkelstein E.S. // Polymer Science B. 2017. V. 59. № 5. P. 560.
Morontsev A.A., Zhigarev V.A., Nikiforov R.Y., Belov N.A., Gringolts M.L., Finkelshtein E.S., Yampolskii Y.P. // Eur. Polym. J. 2018. V. 99. P. 340.
Belov N.A., Nikiforov R.Y., Bermeshev M.V., Yampolskii Y.P., Finkelshtein E.S. // Pet. Chem. 2017. V. 57. № 11. P. 923.
Merkel T.C., Bondar V., Nagai K., Freeman B.D. // J. Polym. Sci., Polym. Phys. 2000. V. 38. № 2. P. 273.
Budd P.M., McKeown N.B., Ghanem B.S., Msayib K.J., Fritsch D., Starannikova L., Belov N., Sanfirova O., Yampolskii Y., Shantarovich V. // J. Memb. Sci. 2008. V. 325. № 2. P. 851.
Chapala P.P., Bermeshev M.V., Starannikova L.E., Belov N.A., Ryzhikh V.E., Shantarovich V.P., Lakhtin V.G., Gavrilova N.N., Yampolskii Y.P., Finkelshtein E.S. // Macromolecules. 2015. V. 48. № 22. P. 8055.
Pollice R., Chen P. // J. Am. Chem. Soc. 2019. V. 141. № 8. P. 3489.
Merkel T.C., Pinnau I., Prabhakar R. // Materal Science of Membranes for Cas and Vapor Separation / Ed. by B. Freeman, Y. Yampolskii. Chichester: Wiley, 2006. P. 251.
Yampolskii Y., Belov N., Alentiev A. // J. Memb. Sci. 2020. V. 598. P. 117779.
Robeson L.M. // J. Memb. Sci. 2008. V. 320. № 1–2. P. 390.
Дополнительные материалы
- скачать Fig.1-Fig.2.tiff
- Рис. S1. 1Н ЯМР спектр 5-перфторбутил-2-норборнена (НБФ)
Рис. S2. 1Н ЯМР спектр 5-перфторбутил-2-норборнена (область -СН, -СН2)
- скачать Fig.3-Fig.4.tiff
- Рис. S3. 13С JMOD ЯМР спектр 5-перфторбутил-2-норборнена
Рис. S4. 13С JMOD ЯМР спектр 5-перфторбутил-2-норборнена (область 139.00−115.00 м.д.)
- скачать Fig.5.tiff
- Рис. S5. 13С JMOD ЯМР спектр 5-перфторбутил-2-норборнена (область 51.00−26.00 м.д.)
- скачать Fig.6.tiff
- Рис. S6. HMQC спектр 5-перфторбутил-2-норборнена: (а) – область двойных связей, (б) – область -CH, -CH2
- скачать Fig.7.tiff
- Рис. S7. Хроматограмма (ГХ−МС) 5-перфторбутил-2-норборнена
- скачать Fig.8-Fig.9.tiff
- Рис. S8. 1H ЯМР спектр поли(5-перфторбутил-2-норборнена) (ПНБФ)
Рис. S9 19F ЯМР спектр поли(5-перфторбутил-2-норборнена) (ПНБФ)
- скачать Fig.10-Fig.12.tiff
- Рис. S10 13С ЯМР спектр поли(5-перфторбутил-2-норборнена) (ПНБФ)
Рис. S11. 13С ЯМР спектр поли(5-перфторбутил-2-норборнена) (ПНБФ) в области двойной связи и CF (145.00-106.00 м.д.)
Рис. S12. 13С ЯМР спектр поли(5-перфторбутил-2-норборнена) (ПНБФ) в области СH, CH2 (49.00−28.00 м.д.).
- скачать Fig.13.tiff
- Рис. S13. Рентгенограмма поли(5-перфторбутил-2-норборнена), синтезированного на катализаторе Г1
Инструменты
Высокомолекулярные соединения (серия А)