Высокомолекулярные соединения (серия А), 2023, T. 65, № 1, стр. 27-31
СВЯЗЫВАНИЕ КУРКУМИНА ЗВЕЗДООБРАЗНЫМИ ПОЛИОКСАЗОЛИНАМИ В ВОДНЫХ РАСТВОРАХ
А. Н. Блохин a, *, Н. Д. Козина a, А. Б. Разина a, А. В. Теньковцев a
a Институт высокомолекулярных соединений Российской академии наук
199004 Санкт-Петербург, Большой пр., 31, Россия
* E-mail: blokhin_an@hq.macro.ru
Поступила в редакцию 15.11.2022
После доработки 28.12.2022
Принята к публикации 20.01.2023
- EDN: UYWBLS
- DOI: 10.31857/S2308112023700293
Аннотация
Методом спектрофотометрии в ультрафиолетовой и видимой областях исследовано связывание биологически активного природного красителя куркумина звездообразными поли-2-алкил-2-оксазолинами различной структуры в водной среде. Объектами исследования были синтезированные и описанные ранее четырех- и восьмилучевые звездообразные поли-2-алкил-2-оксазолины с каликсареновыми центрами ветвления. Методом Бенеши‒Гильдебранда определены константы связывания молекул красителя мицеллами полимера. Полученные результаты демонстрируют высокоэффективное связывание куркумина макромолекулами и мицеллами полимеров в водных растворах. Показано, что эффективность связывания куркумина звездообразными полиоксазолинами определяется в большей степени не природой полиоксазолиновых лучей, а структурой гидрофобного каликсаренового центра ветвления.
ВВЕДЕНИЕ
Куркумин (диферулоилметан) – природный пигмент, входящий в состав корня куркумы. Куркумин обладает противораковым, противовоспалительным, антимикробным и иммуномодулирующим действием, что способствует излечению различных хронических заболеваний [1–4]. Несмотря на большой терапевтический потенциал куркумина, его низкая биодоступность ограничивает эффективность его воздействия. Растворимость куркумина в воде не превышает 0.6 мкг/мл [5]. Предложены различные способы повышения биодоступности куркумина, в числе которых инкапсуляция в водорастворимые формы макроциклических соединений, таких как циклодекстрин и каликсарены [6, 7]. Одним из преимуществ этого метода является повышение химической стабильности лекарственного вещества, участвующего в образовании соединений типа “гость–хозяин”. Кроме того, представляет интерес разработка более сложных систем доставки лекарственных веществ с возможностью их контролируемого извлечения. В настоящей работе для эффективного связывания куркумина в водной среде предложено использовать звездообразные поли-2-алкил-2-оксазолины (полиоксазолины) с каликсареновыми центрами ветвления.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и реагенты
Растворители – дистиллированную воду и метанол использовали без специальной подготовки. Четырех- и восьмилучевые звездообразные поли-2-алкил-2-оксазолины с каликс[n]ареновыми (n = 4, 8) центрами ветвления синтезировали в соответствии с методикой, описанной в работах [8, 9].

где n = 4, R = Et (1), n = 4, R = i-Pr (2); n = 8, R = Et (3); n = 8, R = i-Pr (4).
Полученные полимеры были охарактеризованы методом спектроскопии ЯМР 1H. Куркумин
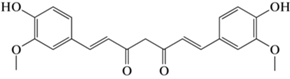
синтезировали в соответствии с изложенной в литературе методикой [10].
Измерение спектров поглощения водных растворов
Спектры поглощения водных растворов куркумина и исследуемых полимеров измеряли в кварцевых кюветах на спектрофотометре СФ-256 (Россия, “ЛОМО ФОТОНИКА”) при температуре 20°С.
Определение констант связывания куркумина в растворах полимера
Готовили серию водных растворов с постоянной концентрацией куркумина (6.79 × 10–6 моль/л) и переменной концентрацией выбранного полимера в диапазоне 10–6–10–4 моль/л. Полученные смеси выдерживали в темном месте 24 ч при комнатной температуре. Поглощение в диапазоне длин волн λ = 350–500 нм измеряли при 20°C. Константы связывания куркумина Kb рассчитывали в соответствии с уравнением Бенеши–Гильдебранда
где ΔD – изменение оптической плотности куркумина после добавления полимера, Δε – разница в молярных коэффициентах экстинкции свободного и связанного куркумина, Сp – исходная концентрация полимера в растворе, Сс – исходная концентрация куркумина в растворе. Для определения Kb строили графики зависимости 1/ΔD от 1/Сp. По наклонам полученных прямых рассчитывали константы связывания Kb.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Звездообразные полиоксазолины с каликсареновым центром ветвления
Термочувствительные амфифильные полиоксазолины известны как перспективные полимерные материалы для доставки лекарственных средств благодаря их способности образовывать внутри- и межмолекулярные водородные связи, приводящие к уплотнению и агрегации полимерных цепей. Особый интерес представляют звездообразные полиоксазолины с макроциклическим центром ветвления, которые могут образовывать соединения включения типа “гость–хозяин”. В частности, наличие каликс[n]аренового фрагмента в полимерах позволяет создавать макроциклические рецепторы, способные к многоточечному связыванию с органическими и неорганическими субстратами.
В настоящей работе объектами исследования являются четырех- и восьмилучевые звездообразные поли-2-алкил-2-оксазолины, синтезированные катионной полимеризацией 2-алкил-2-оксазолинов с раскрытием цикла с использованием мультифункциональных сульфонилхлоридных инициаторов, полученных на основе каликс[4]-, каликс[8]аренов (структуры 1–4).
Выбор объектов исследования обусловлен необходимостью изучить влияние структурных характеристик звездообразных полимеров на эффективность связывания ими куркумина в водных растворах. Для выполнения исследования взяты полимерные звезды с варьируемым размером макроциклического центра ветвления (каликс[4]арен, каликс[8]арен) и различным гидрофобно-гидрофильным балансом полиоксазолиновых лучей, который регулируется структурой бокового заместителя в полиоксазолиновых цепях (этил, изопропил). Среднечисленные молекулярные массы полимеров были рассчитаны с использованием данных спектроскопии ЯМР 1H [8, 9].
Связывание куркумина в водных растворах полимеров
Водные растворы комплексов куркумина с исследуемыми полимерами получали в аналитических количествах жидкофазным методом. В серию растворов фиксированного объема и варьируемой концентрации выбранного полимера прибавляли аликвоты раствора куркумина в метаноле постоянной концентрации. Полученные смеси интенсивно перемешивали в течение нескольких минут, после чего выдерживали в темном месте 24 ч при комнатной температуре для установления равновесного состояния в системах.
На рис. 1 изображены спектры поглощения полученных смесей в диапазоне длины волн 350–500 нм, который соответствует полосе поглощения куркумина. Как известно, спектр чистого куркумина в воде имеет два максимума поглощения, что характерно для химических структур, проявляющих кето-енольную таутамерию [11].
Рис. 1.
Спектры поглощения куркумина в водных растворах полимеров 1 (а), 2 (б), 3 (в) и 4 (г). Концентрация полимеров: а – 0.53 (1), 0.27 (2), 0.13 (3), 0.066 (4) и 0.033 мас. % (5); б – 1.0 (1), 0.50 (2), 0.25 (3), 0.12 (4) и 0.063 мас. % (5); в – 0.50 (1), 0.25 (2), 0.12 (3), 0.063 (4) и 0.031 мас. % (5); г – 0.25 (1), 0.12 (2), 0.075 (3) и 0.050 мас. % (4).
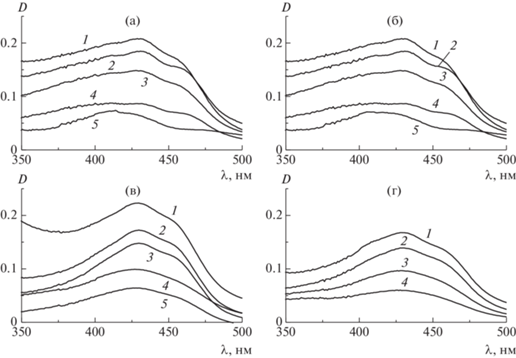
В сильно полярных средах присутствуют обе формы куркумина, причем полосы поглощения в коротковолновой области спектра (350–400 нм) и длинноволновой области (400–480 нм) относятся к кетонной и енольной формам соответственно. В спектрах поглощения исследуемых водных растворов наблюдается комплексная бимодальная полоса поглощения, свидетельствующая о смещении естественного равновесия таутомеров в сторону кетонной формы. Такая форма и положение полосы характерны для растворов куркумина в слабо полярных средах (этанол, хлороформ), что может свидетельствовать о возникновении гидрофобного окружения молекул красителя и связывании с гидрофобными фрагментами макромолекул звездообразных полимеров.
Определение констант связывания
Подобно линейным аналогам, звездообразные амфифильные полиоксазолины способны самоорганизовываться в водных растворах. Известно, что в умеренно разбавленных растворах (10–4–10–2 г/мл) аналогичных полимеров присутствуют как отдельные макромолекулы (мономицеллы), так и мицеллоподобные агрегаты с гидродинамическими радиусами в диапазоне 10–100 нм [12–15]. Таким образом, в этом концентрационном диапазоне процесс солюбилизации молекулы красителя частицами полимера можно рассматривать как равновесную реакцию образования комплекса краситель–мицелла
где CM – комплекс мицеллы с молекулой красителя, Kb – константа связывания [16].
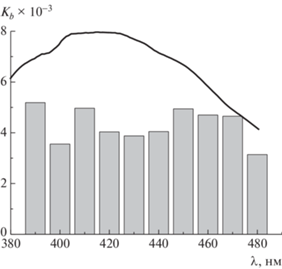
Константа связывания куркумина может быть найдена с помощью графического метода Бенеши‒Гильдебранда [16–18]. Согласно данному методу, исследуется изменение оптической плотности серии растворов с постоянной концентрацией поглощающего компонента (красителя) и переменной концентрацией Сp второго компонента, взятого в избытке, относительно поглощения чистого красителя. Графическую зависимость в координатах 1/ΔD – 1/Сp аппроксимируют и экстраполируют к оси ординат. Из тангенса угла наклона и отрезка, отсекаемого прямой на оси ординат, рассчитывают константу связывания Kb. Как известно, данный метод чувствителен к выбору длины волны, при которой измеряется изменение оптической плотности, поэтому для оценки его применимости необходимо рассмотреть влияние выбранной длины волны на результат определения Kb. На рис. 2 приведена диаграмма значений Kb, полученных графическим методом для полимера структуры 1 в зависимости от выбранной длины волны. Как видно, разброс полученных значений является случайным, выраженной тенденции к изменению Kb не наблюдается.
Рис. 2.
Диаграмма значений Kb, рассчитанных методом Бенеши‒Гильдебранда для полимера 1, в зависимости от выбора длины волны. Кривая – полоса поглощения куркумина в водном растворе полимера 1 с концентрацией 6.63 × 10–4 г/мл.
Зависимости 1/ΔD от 1/Сp для полимеров 1‒4 при длине волны λ = 420 нм, соответствующей максимуму поглощения куркумина в водном растворе полимера, представлены на рис. 3. Построенные зависимости близки к линейным и имеют коэффициенты корреляции в R2 диапазоне 0.97–0.99.
Рис. 3.
Зависимости Бенеши‒Гильдебранда для полимеров 1 (а), 2 (б), 3 (и) и 4 (г), полученные при длине волны 420 нм. R2 = 0.99 (а, б) и 0.97 (в, г).
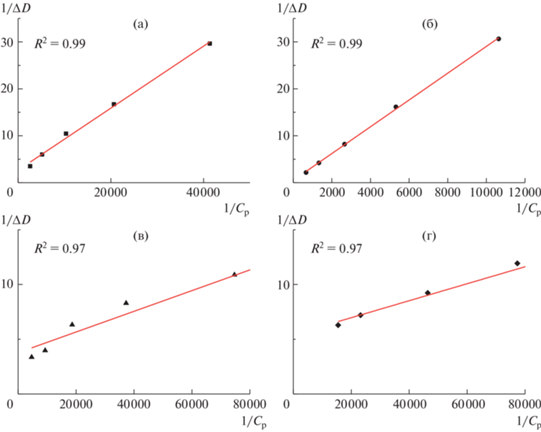
В результате обработки графических зависимостей Бенеши‒Гильдебранда для ряда из 10 значений длины волн в интервале 390–480 нм рассчитаны средние значения констант связывания куркумина Kb в водных растворах полимеров 1‒4 (табл. 1). Результаты таблицы демонстрируют высокоэффективное связывание куркумина мицеллами полимеров в водных растворах. Рассчитанные значения констант связывания куркумина сравнимы с величинами, полученными для низкомолекулярных водорастворимых производных каликсаренов [17], а также для биополимеров, таких, как ДНК/РНК [19] и альбумин [20]. Как видно из табл. 1, константы связывания слабо изменяются при варьировании алкильного заместителя в полиоксазолиновых лучах (1, 3 – этил, 2, 4 – изопропил), значения Kb близки и находятся в пределах случайных погрешностей. Однако при переходе от четырехлучевых к восьмилучевым образцам наблюдается значительное увеличение константы связывания, что свидетельствует о влиянии структуры центра ветвления на эффективность комплексообразования. Поскольку центр ветвления в исследованных полимерах относится к одному гомологическому ряду каликсаренов, рост константы связывания при переходе от каликс [4]арена (1, 2) к каликс [8]арену (3, 4), скорее всего, обусловлено увеличением внутренней полости макроцикла, и соответственно его вместимости для молекул куркумина.
ЗАКЛЮЧЕНИЕ
С использованием метода Бенеши‒Гильдебранда определены константы связывания молекул красителя в водных растворах четырех- и восьмилучевых звездообразных полиоксазолинов с каликсареновым центром ветвления. Полученные результаты демонстрируют высокоэффективное связывание куркумина мицеллами полимеров в водных растворах. Показано, что эффективность связывания куркумина звездообразными полиоксазолинами определяется в большей степени не природой полиоксазолиновых лучей, а структурой гидрофобного каликсаренового центра ветвления.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Государственная регистрация АААА-А16-116071450051-3).
Список литературы
Goel A., Kunnumakkara A.B., Aggarwal B.B. // Biochem. Pharmacol. 2008. V. 75. P. 787.
Xu P.H., Long Y., Dai F., Liu Z.L. // Vasc. Pharmacol. 2007. V. 47. P. 25.
Zorofchian Moghadamtousi S., Abdul Kadir H., Hassandarvish P., Tajik H., Abubakar S., Zandi K. // BioMed Res. Int. 2014. V. 2014. P. 186864.
Jagetia G.C., Aggarwal B.B. // J. Clin. Immunol. 2007. V. 27. P. 19.
Shin G.H., Li J., Cho J.H., Kim J.T., Park H.J. // J. Food Sci. 2016. V. 81. P. 494.
Moussa Z., Hmadeh M., Abiad M.G., Dib O.H., Patra D. // Food Chem. 2016. V. 212. P. 485.
Drakalska E., Momekova D., Manolova Y., Budurova D., Momekov G., Genova M., Antonov L., Lambov N., Rangelov S. // Int. J. Pharm. 2014. V. 472. P. 165–174.
Blokhin A.N., Razina A.B., Bursian A.E., Ten’kovtsev A.V. // Polymer Science B. 2021. V. 63. № 1. P. 52.
Blokhin A.N., Razina A.B., Tenkovtsev A.V. // Key Eng. Mater. 2021. V. 899. P. 300.
Ahmed M., Qadir M.A., Shafiq M.I., Muddassar M., Hameed A., Arshad M.N., Asiri A.M. // Acta Pharm. 2017. V. 67. P. 385.
Соколова Ю.Д., Челнакова П.Н., Коновалов Е.В. // Universum: химия и биология. 2016. № 12 (30).
Amirova A., Tobolina A., Kirila T., Blokhin A., Razina A., Tenkovtsev A., Filippov A. // Int. J. Polym. Anal. Charact. 2018. V. 23. P. 278.
Amirova A., Blokhin A., Razina A., Tenkovtsev A., Filippov A. // Mendeleev Commun. 2019. V. 29. P. 472.
Amirova A.I., Kirila T.U., Blokhin A.N., Razina A.B., Bursian A.E., Tenkovtsev A.V., Filippov A.P. // Mendeleev Commun. 2020. V. 30. P. 502.
Kirila T. Amirova, A., Blokhin A., Tenkovtsev A., Filippov A. // Polymers. 2021. V. 13. P. 2507.
Lebed A.S., Yefimova S.L., Guralchuk G.Ya., Sorokin A.V., Borovoy I.A., Malyukin Yu.V. // Biophysichny Vestnik. 2010. V. 24. P. 46.
Mareeswaran P.M., Babu E., Sathish V., Kim B., Woob S.I., Rajagopala S. // New J. Chem. 2014. V. 38. P. 1336.
Wang R., Yu Z. // Acta Phys.-Chim. Sin. 2007. V. 23. P. 1353.
Nafisi S., Adelzadeh M., Norouzi Z., Sarbolouki M.N. // DNA Cell Biol. 2009. V. 28. P. 201.
Mohammadi F., Bordbar A.K., Divsalar A., Mohammadi K., Saboury A.A. // Protein J. 2009. V. 28. P. 189.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия А)


