Высокомолекулярные соединения (серия С), 2019, T. 61, № 1, стр. 32-38
ИРИДИЙСОДЕРЖАЩИЕ ПОЛИМЕРЫ НА ОСНОВЕ НОРБОРНЕНОВЫХ И 7-ОКСА-НОРБОРНЕНОВЫХ МОНОМЕРОВ. СИНТЕЗ, ФОТОФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
Л. Н. Бочкарев a, *, Е. О. Платонова a, С. А. Лермонтова a, Л. Г. Клапшина a, А. Н. Конев a, Г. А. Абакумов a
a Институт металлоорганической химии им. Г.А. Разуваева Российской академии наук
603950 Нижний Новгород, ул. Тропинина, 49, Россия
* E-mail: lnb@iomc.ras.ru
Поступила в редакцию 17.09.2018
После доработки 12.11.2018
Принята к публикации 26.11.2018
Аннотация
Методом метатезисной полимеризации синтезированы полимеры, содержащие в боковых цепях олигоэфирные группы, аминокислотные фрагменты и люминофорные комплексы иридия(III). Изучены фотофизические свойства полученных соединений. Иридийсодержащие сополимеры проявили интенсивную фотолюминесценцию зеленого, сине-зеленого и красного цветов, причем цвет определяется природой входящих в состав полимерных эмиттеров комплексов иридия(III). Полимерные продукты растворимы в воде и образуют мицеллы со средними размерами 19–54 нм. Определена цитотоксичность полимеров по отношению к клеткам эпидермоидной карциномы человека линии А431.
Метатезисная полимеризация с раскрытием цикла (ROMP) является одним из наиболее эффективных способов получения функциональных полимерных материалов различного назначения [1–3]. Методом ROMP синтезированы амфифильные полимеры, обладающие способностью к адресной доставке лекарственных веществ и люминесцентных маркеров [4–7]. В качестве люминофорных групп, входящих в состав таких полимеров, использовали органические красители. Несомненный интерес представляет получение методом ROMP амфифильных полимеров, содержащих люминофорные металлокомплексы. Включение в макромолекулы различных по природе комплексов металлов позволяет целенаправленно регулировать люминесцентные характеристики маркеров и надежно отличать их излучение от люминесценции биологических тканей [8, 9]. Среди люминофорных металлокомплексов наиболее эффективными люминесцентными свойствами обладают циклометаллированные производные иридия(III) [10–13]. Ранее нами были получены норборненовые мономеры, содержащие циклометаллированные комплексы иридия(III), и на их основе методом ROMP синтезированы полимерные материалы, проявляющие эффективные фотолюминесцентные и электролюминесцентные свойства [14–20]. Представлялось целесообразным использовать иридийсодержащие норборненовые мономеры для получения новых амфифильных полимеров, обладающих свойствами средств доставки и люминесцентных маркеров.
Цель настоящей работы – синтез методом ROMP и исследование фотофизических и биологических свойств функционализированных полинорборненов, содержащих в боковых цепях олигоэфирные группы, аминокислотные фрагменты и люминофорные комплексы иридия(III).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все операции с легко окисляющимися и гидролизующимися веществами проводили в вакууме или в атмосфере аргона с использованием стандартной техники Шленка. 7-Окса-норборненовые мономеры с олигоэфирными группами (1) [21] и аминокислотными фрагментами (2) [22], иридийсодержащие норборненовые мономеры 3 [14], 4 [16], 5 [17] и (H2IMes)(3-Br-py)2(Cl)2Ru=CHPh (катализатор Граббса третьего поколения) [23, 24] синтезировали как описано в литературе.
Спектры ЯМР 1H получали на спектрометре “Bruker DPX-200” (ЯМР 1Н: 200 МГц). Химические сдвиги указаны в миллионных долях относительно сигнала остаточных протонов дейтерированного растворителя.
ИК-спектры снимали на ИК-фурье-спектрометре ФСМ 1201. Образцы готовили в виде тонких пленок между пластинами KBr.
Молекулярно-массовое распределение полимеров исследовали методом гельпроникающей хроматографии на хроматографе “Knauer” с дифференциальным рефрактометром “Smartline RID 2300” в качестве детектора, с набором из двух колонок Phenomenex с сорбентом Phenogel с размером пор 104 и 105 Å (элюент ТГФ, 2 мл/мин, 40°С, объем пробы 20 мкл, концентрация образца 10 мг/мл). Калибровку колонок производили по 13 полистирольным стандартам.
Размер полимерных частиц в водных растворах оценивали методом динамического светорассеяния на приборе “Brookhaven NanoBrook Omni”.
Электронные спектры поглощения полимеров в растворе CH2Cl2 и H2O снимали на спектрометре “Perkin Elmer Lambda 25”, спектры фотолюминесценции (ФЛ) – на флуоресцентном спектрометре “Perkin Elmer LS 55”. Квантовый выход ФЛ полимерных продуктов P1–P3 в растворах CH2Cl2 и H2O определяли при комнатной температуре и длине волны возбуждения 360 нм. Значения квантового выхода полимеров P1 и P2 рассчитывали относительно Родамина 6G в этаноле (0.95) [25], P3 – относительно Родамина B в этаноле (0.70) [26] по методике, описанной в литературе [27].
Жизнеспособность клеточной культуры оценивали с помощью МТТ-теста [28]. Клетки рассеивали на 96-луночный планшет в количестве 4000 клеток на лунку и инкубировали в течение ночи. Затем питательную среду в лунках культурального планшета заменяли на 100 мкл среды с полимером в различных концентрациях и инкубировали клетки в течение 4 ч, после чего среду в лунках планшета заменяли на свежую питательную среду. Через 24 ч в среду вносили 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2H-тетразолий бромид (МТТ-реагент, “Alfa Aesar”, Великобритания) до конечной концентрации 0.5 мг/мл и инкубировали клетки в течение 4 ч. Далее инкубационную среду отбирали, а кристаллы образованного окрашенного МТТ-формазана растворяли в 100 мкл диметилсульфоксида. Оптическую плотность содержимого каждой лунки измеряли на планшетном спектрофотометре “Synergy MX” (“BioTek”, США) при длине волны 570 нм. Жизнеспособность клеток оценивали по отношению величины оптической плотности раствора формазана в каждой пробе к контролю (без полимера).
Синтез полимера P1
К раствору мономера 1 (0.0747 г, 0.16 ммоля), мономера 2 (0.0229 г, 0.05 ммоля) и мономера 3 (0.0083 г, 0.01 ммоля) в 0.5 мл ТГФ добавляли раствор катализатора Граббса третьего поколения (0.0019 г, 0.0023 ммоля) в 0.5 мл ТГФ. Смесь перемешивали при 40°С. Методом тонкослойной хроматографии установили, что время полимеризации составило 12 ч. После завершения реакции к реакционной смеси добавляли несколько капель этилвинилового эфира для разложения катализатора и дополнительно перемешивали в течение 30 мин. Образовавшийся полимер осаждали гексаном и сушили в вакууме при комнатной температуре до постоянной массы. Получили 0.10 г (94%) сополимера P1 в виде желтого смолообразного вещества. ИК-спектр, ν, см–1: 2954, 2877 (Салиф–Н), 1742 (C=O), 1681 (C=N), 1538, (Cаром–Cаром), 1455, 1353 (Саром–Н), 1284, 1253, 1200, 1110 (С–О), 980, 853, 764, 693. Спектр ЯМР 1H (СDCl3), δ, м. д.: 8.23–7.27 м (20 Н), 7.16–6.30 м (11 Н), 5.85–5.51 м (42 Н), 5.04 м (40 Н), 4.68– 4.40 м (10 Н), 4.19 м (60 Н), 3.62 м (270 Н), 3.53 м (60 Н), 3.36 м (90 H), 3.11 м (10 Н), 2.37 м (3 Н), 1.55 м (34 Н), 0.89 м (63 Н).
Найдено, %: С 56.98; Н 7.46.
Для С480Н743N14О202Ir
вычислено, %: С 56.89; Н 7.39.
Mw = 28.4 × 103, Mn = 15.1 × 103, Mw/Mn = 1.9.
Синтез полимеров P2 и P3
Синтез полимеров P2, P3 проводили аналогично синтезу полимера P1.
Полимер P2. Выход 0.10 г (93%). ИК-спектр, ν, см–1: 2954, 2874 (Салиф–Н), 1742 (C=O), 1678 (C=N), 1535, (Cаром–Cаром), 1450, 1350 (Саром–Н), 1286, 1200, 1110 (С–О), 985, 850, 762, 693. Спектр ЯМР 1H (CDCl3, δ, м. д.): 8.51–7.31 м (20 Н), 7.17–6.38 м (7 Н), 5.85–5.51 м (42 Н), 5.06 м (40 Н), 4.68–4.48 м (10 Н), 4.19 м (60 Н), 3.62 м (270 Н), 3.53 м (60 Н), 3.36 м (90 H), 3.10 м (10 Н), 2.33 м (3 Н), 1.54 м (34 Н), 0.89 м (63 Н).
Найдено, %: С 56.92; Н 6.82.
Для С480Н739N14F4О202Ir
вычислено, %: С 56.82; Н 6.75.
Mw = 42.2 × 103, Mn = 21.7 × 103, Mw/Mn = 1.9.
Полимер P3. Выход 0.06 г (60%). ИК-спектр, ν, см–1: 2952, 2877 (Салиф–Н), 1745 (C=O), 1676 (C=N), 1535, (Cаром–Cаром), 1452, 1350 (Саром–Н), 1283, 1248, 1201, 1110 (С–О), 982, 853, 762, 695. Спектр ЯМР 1H (CDCl3, δ, м. д.): 8.38–7.33 м (20 Н), 7.16–6.78 м (11 Н), 5.85–5.52 м (42 Н), 5.04 м (40 Н), 4.63–4.57 м (10 Н), 4.19 м (60 Н), 3.62 м (270 Н), 3.53 м (60 Н), 3.36 м (90 H), 3.10 м (10 Н), 2.39 м (3 Н), 1.66 м (34 Н), 0.90 м (63 Н).
Найдено, %: С 56.82; Н 7.39.
Для С484Н743N4О202S2Ir
вычислено, %: С 56.73; Н 7.31.
Mw = 17.3 × 103, Mn = 9.1 × 103, Mw/Mn = 1.9.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Полимеры P1–P3 получены методом метатезисной сополимеризации 7-окса-норборненовых мономеров 1 и 2 [21, 22], содержащих олигоэфирные группы и аминокислотные фрагменты и мономеров 3–5 [14, 16, 17], в которых норборненовая группа связана с циклометаллированными комплексами иридия(III). Схема синтеза приведена ниже.
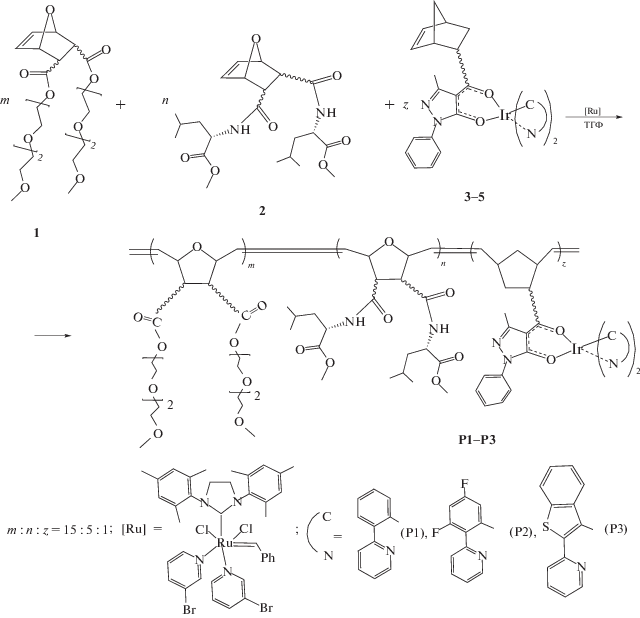
Применение мономеров 1–5 для синтеза целевых полимерных продуктов обусловлено следующими причинами. Известно, что полимеры, полученные на основе норборненовых мономеров с олигоэфирными группами, способны растворяться в воде [29]. В связи с этим мономер 1 использован для придания полимерным продуктам гидрофильных свойств, мономер 2 – для включения в макромолекулы аминокислотных фрагментов, способствующих направленному транспорту амфифильных полимеров к биологическим мишеням. Применение иридийсодержащих мономеров 3–5 обусловлено их способностью образовывать полимерные материалы, проявляющие интенсивную люминесценцию зеленого и красного цветов [14, 16, 17].
Реакции ROMP с участием мономеров 1–5 протекают в присутствии катализатора Граббса третьего поколения (1 мол. % по отношению к общему количеству сомономеров) и завершаются за 12 ч при 40°C. Полимерные продукты выделены в виде устойчивых на воздухе маслообразных веществ, растворимых в ТГФ, CH2Cl2, ДМСО, EtOH, H2O и не растворимых в гексане. После выдержки полимеров на воздухе в течение месяца их физико-химические и спектральные характеристики не изменяются. Молекулярно-массовые характеристики синтезированных полимеров P1–P3 (Mw = (17.3–42.2) × 103, Mw/Mn = 1.9) сопоставимы по значениям с аналогичными характеристиками известных полимеров биомедицинского назначения, полученных с использованием мономеров 1 и 2 [5, 6, 22]. Состав полимеров P1–P3 подтвержден элементным анализом и спектроскопией ЯМР 1H. Соотношение интегральных интенсивностей сигналов протонов в ароматических группах, олефиновых протонов в основной полимерной цепи и алифатических протонов в олигоэфирных и аминокислотных фрагментах соответствует формуле полимеров, приведенной на схеме синтеза.
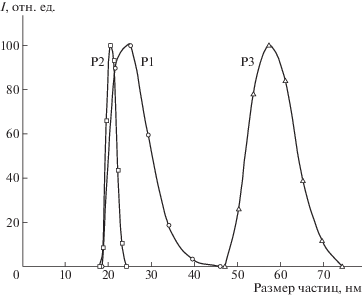
Методом динамического светорассеяния установлено, что полимерные продукты в водных растворах при концентрации 0.1–0.2 г/л образуют наночастицы со средними размерами 27 (P1), 19 (P2), 54 нм (P3). Распределение частиц полимеров P1–P3 по размерам представлено на рис. 1. Можно предположить, что эти частицы представляют собой мицеллы, оболочка которых состоит из олигоэфирных групп и аминокислотных фрагментов, а ядро включает боковые цепи с комплексами иридия.
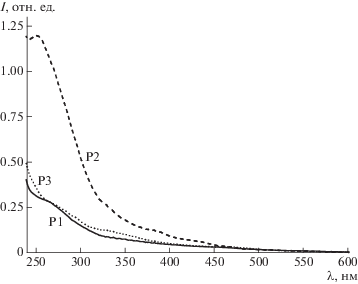
Изучение фотофизических свойств полимерных продуктов показало, что спектры поглощения сополимеров P1–P3 в хлористом метилене и в воде аналогичны и содержат интенсивные полосы в области 260–350 нм, обусловленные π → π*-переходами в ароматических системах лигандов, связанных с иридием, а также полосы низкой интенсивности в области 360–500 нм, соответствующие переходам с переносом заряда с металла на лиганд (MLCT) (рис. 2, табл. 1) [14, 16, 17].
Таблица 1.
Фотофизические характеристики полимеров P1–P3
| Полимер | λmaxabs, нм (lg ε) в СН2Cl2 | λmaxem, нм (СН2Cl2) | Квантовый выход*, % | Координаты цветности в диаграмме CIE (x; y) | |
|---|---|---|---|---|---|
| в СН2Cl2 | в воде | ||||
| P1 | 266 (4.63), 343 пл (4.07), 447 пл (3.67), 493 пл (3.31) | 518, 552 пл | 14.2/8.7 | 8.4/7.9 | 0.23; 0.67 |
| P2 | 262 (4.59), 330 пл (3.92), 381 пл (3.62), 434 пл (3.31), 462 пл (3.09) | 485, 510 пл | 7.7/5.5 | 11.1/10.8 | 0.13; 0.48 |
| P3 | 265 (3.54), 285 пл (3.44), 294 пл (3.38), 327 пл (3.18), 476 пл (2.55) | 612, 667 пл | 2.0/0.5 | 0.4/0.3 | 0.66; 0.34 |
В спектрах ФЛ сополимеров P1–P3 в хлористом метилене и в воде (рис. 3, табл. 1) проявляются широкие полосы с максимумами при 518 и 552 нм (P1), 485 и 510 нм (P2), 612 и 667 нм (P3), обусловленные 3MLCT и лиганд-центрированными (3LC) переходами в циклометаллированных комплексах иридия, связанных с полимерной цепью [14, 16, 17]. В спектре полимера P3 в водной среде наблюдается широкая полоса средней интенсивности с максимумом при 436 нм, относящаяся к эмиссии полимерной матрицы, что свидетельствует о недостаточно эффективной передаче энергии возбуждения в этих условиях с олигоэфирных и аминокислотных групп на комплексы иридия.
Рис. 3.
Нормализованные спектры ФЛ полимеров P1–P3 в дегазированном растворе CH2Cl2 (а) и в дегазированном водном растворе (б) при комнатной температуре. λex = 360 нм.
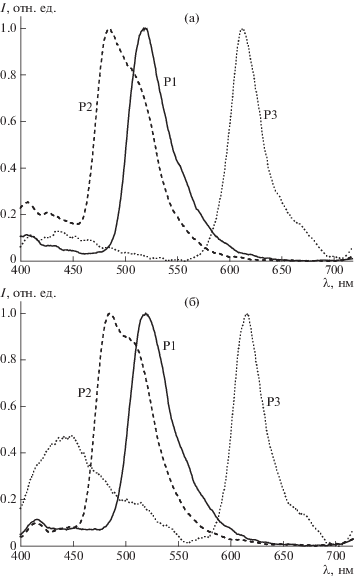
Координаты цветности ФЛ в диаграмме CIE (Commission Internationale de l’Eclairage) (табл. 1) соответствуют зеленому (P1), сине-зеленому (P2) и красному (P3) цветам. Квантовый выход ФЛ полимерных продуктов в дегазированном растворе CH2Cl2 (табл. 1) заметно больше квантового выхода в аэрированном растворе. Известно, что кислород является активным тушителем ФЛ циклометаллированных комплексов иридия [30]. По этой причине в аэрированном растворе интенсивность ФЛ сополимеров значительно уменьшается, что приводит к понижению квантового выхода. Следует отметить, что значения квантового выхода ФЛ сополимеров P1–P3 в аэрированных и дегазированных водных растворах (табл. 1) различаются в значительно меньшей степени по сравнению с величиной квантового выхода в растворах CH2Cl2. Можно предположить, что при образовании мицелл сополимерами P1–P3 в водной среде гидрофильная оболочка заметно ограничивает проникновение молекул кислорода к люминофорным комплексам иридия, находящимся в ядре мицелл, и в результате тушение ФЛ сополимеров в водных растворах происходит существенно в меньшей степени.
Полученные амфифильные полимеры представляют интерес как потенциальные средства доставки терапевтических препаратов и как люминесцентные маркеры биологических объектов. Для определения токсических свойств полимеров P1–P3 проведена количественная оценка их темновой цитотоксичности на клетках эпидермоидной карциномы человека линии А431. Известно, что широко распространенным экспериментальным методом такой оценки является измерение ингибирующей концентрации IC50, т.е. концентрации препарата, вызывающей снижение роста клеток (или их гибель) на 50%. Значения IC50 для полимеров P1–P3 составляют соответственно 0.14 г/л, 0.19 г/л и 0.74 г/л, что свидетельствует о низкой цитотоксичности синтезированных полимеров и определяет возможность их применения в качестве средства доставки противораковых препаратов.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 15-43-02178-р_поволжье_а). Определение цитотоксичности выполнено при поддержке Российского научного фонда (проект 18-73-00194).
Список литературы
Bielawski C.W., Grubbs R.H. // Progr. Polym. Sci. 2007. V. 32. P. 1.
Leitgeb A., Wappel J., Slugovc C. // Polymer. 2010. V. 51. P. 2927.
Zaquen N., Lutsen L., Vanderzande D., Junkers T. // Polym. Chem. 2016. V. 7. P. 1355.
Rao N.V., Ganivada M.N., Sarkar S., Dinda H., Chatterjee K., Dalui T., Das Sarma J., Shunmugam R. // Bioconjugate Chem. 2014. V. 25. P. 276.
Shao Y., Jia Y.-G., Shi C., Luo J., Zhu X.X. // Biomacromolecules. 2014. V. 15. P. 1837.
Tezgel A.Ö., Telfer J.C., Tew G.N. // Biomacromolecules. 2011. V. 12. P. 3078.
Gueugnon F., Denis I., Pouliquen D., Collette F., Delatouche R., Heroguez V., Gregoire M., Bertrand P., Blanquart C. // Biomacromolecules. 2013. V. 14. P. 2396.
Lo K.K.-W., Li S.P.-Y., Zhang K.Y. // New J. Chem. 2011. V. 35. P. 265.
Baggaley E., Weinstein J.A., Williams J.A.G. // Coord. Chem. Rev. 2012. V. 256. P. 1762.
Highly Efficient OLEDs with Phosphorescent Materials / Ed. by H. Yersin. Weinheim: Wiley-VCH, 2008.
You Y., Park S.Y. // Dalton Trans. 2009. № 8. P. 1267.
Rausch A.F., Homeier H.H.H., Yersin H. // Top Organomet. Chem. 2010. V. 29. P. 193.
Powell B.J. // Coord. Chem. Rev. 2015. V. 295. P. 46.
Begantsova Yu.E., Bochkarev L.N., Samsonov M.A., Fukin G.K. // Russ. J. Coord. Chem. 2013. V. 39. № 9. P. 661.
Bochkarev L.N., Begantsova Yu.E., Platonova E.O., Basova G.V., Rozhkov A.V., Il’ichev V.A., Baranov E.V., Abakumov G.A., Bochkarev M.N. // Russ. Chem. Bull. 2014. V. 63. № 4. P. 1001.
Bochkarev L.N., Begantsova Yu.E., Il’ichev V.A., Bara-nov E.V., Abakumov G.A. // Russ. J. Coord. Chem. 2015. V. 41. № 9. P. 555.
Platonova E.O., Il’ichev V.A., Baranov E.V., Bochkarev L.N. // Russ. J. Coord. Chem. 2016. V. 42. № 3. P. 187.
Platonova E.O., Il’icheva A.I., Parshina Yu.P., Rozhkov A.V., Bochkarev L.N. // Russ. J. Gen. Chem. 2016. V. 86. № 9. P. 2081.
Platonova E.O., Pushkarev A.P., Ilichev V.A., Baranov E.V., Kovylina T.A., Bochkarev L.N. // Russ. J. Coord. Chem. 2017. V. 43. № 8. P. 491.
Platonova E.O., Rozhkov A.V., Lermontova S.A., Klapshina L.G., Konev A.N., Bochkarev L.N., Abakumov G.A. // Russ. J. Gen. Chem. 2018. V. 88. № 4. P. 2081.
Hersey J.S., Meller A., Grinstaff M.W. // Anal. Chem. 2015. V. 87. P. 11863.
Sutthasupa S., Shiotsuki M., Matsuoka H., Masuda T., Sanda F. // Macromolecules. 2010. V. 43. P. 1815.
Scholl M., Ding S., Lee C.W., Grubbs R.H. // Org. Lett. 1999. V. 1. P. 953.
Love J.A., Morgan J.P., Trnka T.M., Grubbs R.H. // Angew. Chem. Int. Ed. 2002. V. 41. P. 4035.
Magde D., Wong R., Seybold P.G. // Photochem. Photobiol. 2002. V. 75. P. 327.
López Arbeloa F., Ruiz Ojeda P., López Arbeloa I. // J. Lumin. 1989. V. 44. P. 105.
Demas J.N., Crosby G.A. // J. Phys. Chem. 1971. V. 75. P. 991.
Freshney M.G. // Culture of Immortalized Cells. New York: Wiley-Liss, 2010.
Bauer T., Slugovc C. // J. Polym. Sci., Polym. Chem. 2010. V. 48. P. 2098.
Montalti M., Credi A., Prodi L., Gandolfi M.T. // Handbook of Photochemistry. Boca Raton: CRC Press, 2006.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)