Высокомолекулярные соединения (серия С), 2019, T. 61, № 1, стр. 83-95
НОВЫЕ СИЛАЦИКЛОПЕНТАНСОДЕРЖАЩИЕ ПОЛИНОРБОРНЕНЫ: СИНТЕЗ И ГАЗОРАЗДЕЛИТЕЛЬНЫЕ СВОЙСТВА
В. А. Жигарев a, А. А. Моронцев a, *, Р. Ю. Никифоров a, М. Л. Грингольц a, Н. А. Белов a, Н. Г. Комаленкова b, В. Г. Лахтин b, Е. Ш. Финкельштейн a
a Институт нефтехимического синтеза им. А.В. Топчиева Российской академии наук
119991 Москва, Ленинский пр., 29, Россия
b Государственный научно-исследовательский институт химии и технологии элементоорганических соединений
105118 Москва, ш. Энтузиастов, 38, Россия
* E-mail: morontsev@ips.ac.ru
Поступила в редакцию 29.01.2019
После доработки 17.03.2019
Принята к публикации 25.03.2019
Аннотация
Ранее было показано, что наличие объемных заместителей в мономерном звене метатезисных полинорборненов препятствует постмодификации и, в частности, исчерпывающему гем-дифторциклопропанированию двойных связей основной цепи. С целью снижения экранированности двойных связей в метатезисных полинорборненах синтезирован новый полинорборнен с диметилсилациклопентановым фрагментом в мономерном звене – поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецен-8), в котором силилметильная группа отдалена от двойной связи. Для этого впервые получен мономер 4,4-диметилтрицикло[5.2.1.02,6]-4-силадецен-8 по реакции диеновой конденсации 1,3-циклопентадиена и 1,1-дихлорсилациклопентена-3. Осуществлена полимеризация 4,4-диметил-трицикло[5.2.1.02,6]-4-силадецена-8 по схеме циклораскрывающего метатезиса в присутствии катализатора Граббса первого поколения, Cl2(PCy3)2Ru=CHPh. С выходом 99–100% получен и охарактеризован новый полимер поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецен-8). Изучено его гем-дифторциклопропанирование дифторкарбеном, генерируемым при термолизе хлордифторацетата натрия, найдены условия исчерпывающей замены двойных связей гем-дифторциклопропаном. Показано, что поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецен-8) более активен в постмодификации по сравнению с поли(5-триметилсилилнорборненом), но менее активен, чем незамещенный полинорборнен. Введение в структуру мономерного звена метатезисного полинорборнена силациклопентанового фрагмента и последующее его гем-дифторциклопропанирование приводят к увеличению проницаемости и диффузии газов и незначительному снижению идеальных селективностей разделения. Найдено, что гем-дифторциклопропанирование повышает температуру стеклования поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецена-8) на 60 градусов и делает его пленки стабильными при хранении на воздухе.
ВВЕДЕНИЕ
Поиск новых полимерных материалов для газоразделительных мембран остается актуальной задачей современного материаловедения [1, 2]. Значительные успехи в синтезе эффективных мембранных полимерных материалов, обладающих высокими газоразделительными параметрами (газопроницаемостью и селективностью газоразделения), достигнуты с использованием кремний- и фторсодержащих полимеров [3–9]. Немалая роль в поиске и установлении зависимостей структура полимера–газоразделительные свойства принадлежит норборненам с кремний- и фторсодержащими заместителями [6–9]. С их использованием синтезирован широкий круг полинорборненов с закономерно изменяемым строением как основной цепи, так и боковых заместителей [6, 8, 10–14]. Методология синтеза полинорборненов базируется на формировании структуры мономерного звена на стадии получения мономера путем введения необходимых заместителей с последующей полимеризацией по схемам метатезиса и аддитивной полимеризации [8, 11]. В ходе исследований было показано, что повышение проницаемости полинорборненов достигается путем введения бóльшего числа объемных заместителей и получением жесткой полимерной цепи полимеризацией норборненов по аддитивной схеме [6, 8]. Полинорборнены, синтезированные по схеме метатезиса, обладают менее жесткой основной цепью и демонстрируют, как правило, меньшую газопроницаемость. Следует отметить, что в последнее время получены новые данные о возможности синтеза метатезисных полинорборненов более проницаемых, чем аддитивные полинорборнены, при введении в мономерное звено боковых алкоксисилильных заместителей [13]. Недавно также было показано, что модификацией метатезисных полинорборненов с помощью полимераналогичных реакций по двойным связям основной цепи можно влиять на параметры газопроницаемости [15–17]. Так, эпоксидирование двойных связей существенно увеличивает селективность газоразделения [16], а гем-дифторциклопропанирование повышает коэффициенты газопроницаемости [17]. Можно подобрать условия получения полимера, содержащего эпоксидированные и дифторциклопропанированные звенья, и таким образом увеличить как проницаемость, так и селективность газоразделения. Вместе с тем оказалось, что при полимераналогичных реакциях наличие объемного Me3Si-заместителя в мономерном звене полинорборнена значительно снижает реакционную способность двойных связей полинорборенов, синтезированных по схеме метатезиса, вероятно, по причине их стерического экранирования. В случае эпоксидирования Si-замещенных метатезисных полинорборненов ужесточением условий реакции удается добиться исчерпывающей замены двойных связей оксирановым фрагментом [15]. При дифторциклопропанировании поли(5-триметилсилилнорборнена) степень превращения двойных связей не превышает 84% [17]. Синтез метатезисных полинорборненов, в которых объемные заместители отдалены от двойных связей, может быть эффективным приемом повышения активности двойных связей основной цепи в полимераналогичных реакциях.
Цель настоящей работы – синтез новых метатезисных полинорборненов с силациклопентановым фрагментом в мономерном звене, в которых кремнийсодержащая группа отдалена от двойной связи, а также изучение влияния строения мономерного звена на постмодификацию двойных связей основной цепи и на газоразделительные свойства синтезированных полимеров.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты
Хлордифторацетат натрия (96%), 2,2′-метилен-бис-(6-трет-бутил-4-метилфенол) в качестве ингибитора окисления, катализатор Граббса первого поколения Cl2(PCy3)2Ru=CHPh (97%), приобретенные в “Sigma-Aldrich”, метилйодид (99.5%, “КемикалЛайн”) и винилэтиловый эфир (99%, “Fluka”) использовали без дополнительной очистки. Метилбензоат (99%, “Sigma-Aldrich”) перегоняли в вакууме (20 мм рт. ст.) и хранили в атмосфере аргона. н-Гексан (“Экос-1”) перегоняли на воздухе. Толуол, ТГФ, приобретенные в “Экос-1” и диэтиловый эфир (“Кузбассоргхим”) абсолютировали над металлическим Na. Мелкодисперсный порошок Mg перед применением прогревали в вакууме. Цеолиты (4Å) активировали в вакууме (1–10 мм рт. ст.) при 350°С в течение 3 ч. Исходный 1,1-дихлорсилациклопентен-3 (СЦП), содержащий 13% 1,1-дихлорсилациклопентена-2 (α-СЦП), синтезированный по методике [18], перегоняли в атмосфере аргона, Ткип = 133–135°C. Циклопентадиен (ЦПД) получали непосредственно перед использованием мономеризацией предварительного высушенного над цеолитами дициклопентадиена (ДЦПД) (“Aldrich”) при 160–170°С, температура кипения циклопентадиена 41–43°С.
Методы измерений
Спектры ЯМР регистрировали для растворов образцов в дейтерохлороформе при комнатной температуре на спектрометре “Bruker Avance III”. Рабочая частота прибора составляет 500.13 МГц (ЯМР 1H), 470.59 МГц (ЯМР 19F), 125.76 МГц (ЯМР 13С), 99.36 МГц (ЯМР 29Si). Химические сдвиги на спектрах ЯМР 1H и ЯМР 13C определяли с точностью не менее 0.001 м.д. относительно остаточного сигнала внутреннего стандарта хлороформа. Для спектров ЯМР 29Si и ЯМР 19F в качестве внутренних стандартов использовали SiMe4 и СHF3 соответственно.
Масс-спектры регистрировали на приборе “TermoFocusDSQII”. Энергия ионизации 70 эВ, температура источника 230°C.
Молекулярно-массовые характеристики полимеров оценивали методом ГПХ на приборе “AgilentPL-GPC 220”, с колонкой PLgelOlexis (номинальный размер частиц 13 мкм, диапазон измерения молекулярных масс (2 × 104)–(1 × 107), откалиброванных по полистирольным стандартам). Элюентом служил ТГФ, скорость элюирования 1 мл/мин, температура 40°С.
Термические свойства полимеров исследовали методами дифференциальной сканирующей калориметрии и термогравиметрического анализа. Термограммы ДСК получали на приборе DSC823e “Mettler Toledo”. Нагревание и охлаждение образцов осуществляли со скоростью 20 град/мин в атмосфере аргона со скоростью потока 70 мл/мин в интервале 20−150°C. Представительными считали результаты второго прогревания. ТГА полимеров проводили в атмосфере аргона на приборе “Mettler Toledo TGA/DSC-1” со скоростью измерения 10 град/мин и скоростью потока 10 мл/мин при нагревании от 30 до 1000°C. Образцы с массой 10 мг предварительно термостатировали при 30°C.
Газоразделительные свойства полимеров исследовали по описанной в литературе методике [16] на установке “Баратрон”, разработанной в ИНХС РАН. Параметры газопроницаемости измеряли по изменению давления газа в камерах до и после полимерной мембраны из синтезированных в данной работе полимеров.
Синтез мономера и полимеров
Все опыты по синтезу мономеров, полимеров и их модификации проводили на стандартной вакуумной установке и линии Шленка в атмосфере аргона.
Синтез мономера 4,4-диметилтрицикло[5.2.1.02,6]-4-силадецена-8 (НБЦП). Д и е н о в а я к о н д е н -с а ц и я Ц П Д и С Ц П. ЦПД (5 г, 0.0761 моля) и СЦП (12 г, 0.0777 моля) помещали в стеклянную ампулу, дегазировали и запаивали в вакууме. Реакционную смесь выдерживали 24 ч при 210°С, после чего отгоняли целевую фракцию с Ткип = = 28–31°С при 0.16–0.18 мм рт. ст. Полученный продукт содержал 94% 4,4-дихлортрицикло[5.2.1.02,6]-4-силадецена-8 (ХНБЦП) и тримеры ЦПД. Максимальный выход ХНБЦП составил 24%. В спектрах продукта имеются сигналы аддукта ЦПД и 1,1-дихлорсилациклопентена-2 – 3,3-дихлортрицикло[5.2.1.02,6]-3-силадецена-8 (ХНБЦП-3).
ЯМР 1H (СDCl3) δH, м.д.: 5.95 (т, 2Н, НС8,9); 5.84 (с, 0.2Н, НС8’9’ ХНБЦП-3); 2.66 (м, 2Н, НС1,7); 2.39 (м, 2H, НC2,6); 2.34 (м, 0.2Н, ХНБЦП-3); 1.73 (м, 0.2H, ХНБЦП-3); 1.34, 1.32 (м, 1H, Н2С10); 1.30, 1.29 (м, 0.1H, ХНБЦП-3); 1.18, 1.17 (м, 0.1H, ХНБЦП-3); 1.15, 1.14 (м, 1H, Н2С10); 1.13, 1.11, 1.10, 1.09 (м, 2H, Н2C3,5); 1.07, 1.06, 0.40, 0.39, 0.37, 0.36 (м, 0.4H, ХНБЦП-3); 0.32, 0.31, 0.30, 0.29 (м, 2H, Н2C3,5).
ЯМР 13С (JMODECHO) (СDCl3) δC, м.д.: 136.62 (м, HС8,9); 136.54 (м, HС8’,9’ ХНБЦП-3); 49.97 (c, H2С10); 49.04 (c, HС1’,7’ ХНБЦП-3); 48.03 (с, HС1,7); 42.19 (м, H2C10’, ХНБЦП-3); 40.08 (м, HC2,6); 38.12 (м, HC2’,6’, ХНБЦП-3); 22.33 (м, H2C4’,5’, ХНБЦП-3); 20.46 (м, H2C3,5).
ЯМР 29Si (СDCl3) δSi, м.д.: 39.75 (c, ХНБЦП) (90%); 36.71 (c, ХНБЦП-3) (10%);
Хромато-масс-спектрометрия (ГХ-МС): 218 [M]+ (1%), 66 [М–C4H6SiCl2]+ (100%).
М е т и л и р о в а н и е Х Н Б Ц П. В трехгорлой колбе объемом 250 мл, снабженной магнитной мешалкой, капельной воронкой и обратным водяным холодильником готовили реактив Гриньяра прикапыванием раствора CH3I (5.1 мл, 0.0819 моля) в 5 мл диэтилового эфира к суспензии из 2 г (0.0817 моля) предварительно прогретого мелкодисперсного магния в 25 мл диэтилового эфира в течение 50 мин, после чего раствор кипятили в течение 40 мин. К полученному реактиву Гриньяра в течение 25 мин прикапывали раствор ХНБЦП (4.9 г, 0.0320 моля) в 4 мл диэтилового эфира, затем смесь кипятили 7 ч. Эфир отгоняли, постепенно углубляя вакуум до 7 мм. рт. ст. Продукт экстрагировали гексаном (5 раз по 10 мл). Экстракт фильтровали, пропуская через небольшой слой силикагеля “Silica 60”, гексан отгоняли. Целевой НБЦП выделяли разгонкой, Ткип = 48–52°С при 1.3–1.5 мм рт. ст. Получили 3.7 г (0.025 моля), выход 70%. Согласно ГЖХ, чистота НБЦП составляла не менее 96%. ЯМР–спектры свидетельствовали о присутствии 3,3-диметилтрицикло[5.2.1.02,6]-3-силадецена-8 (НБЦП-3) в количестве 10%.
ЯМР 1H (СDCl3) δH, м.д.: 6.15 (т, 2Н, НС8,9); 6.05 (т, 0.2H, HC8’9’, НБЦП-3); 2.76 (м, 2Н, НС1,7); 2.54 (м, 2H, НC2,6); 2.43 (м, 0.2H, НБЦП-3); 1.87 (м, 0.2H, НБЦП-3); 1.51, 1.49, 1.38, 1.36 (м, 2H, Н2С10); 1.34, 1.32, 1.31 (м, 0.2H, НБЦП-3); 0.90–0.85, 0.17…–0.08 (м, 1.0H, НБЦП-3); 0.70–0.66, –0.01…–0.06 (м, 4H, H2C3,5); 0.06, 0.01 (м, 6.6H, Si–H3C11,12).
ЯМР 13С (JMODECHO) (СDCl3) δC, м.д.: 137.27 (с, НС8’9’, НБЦП-3); 136.66 (с, HС8,9); 51.48 (с, H2C10); 49.28 (c, HC1’,7’, НБЦП-3); 48.46 (с, HС1,7); 43.62 (с, HC2,6); 42.34 (c, H2C10’, НБЦП-3); 41.67 (c, HC2’,6’, НБЦП-3); 18.20 (c, H2C4’,5’, НБЦП-3); 16.04 (м, H2C3,5); –1.65, –1.91 (м, Si-H3C11,12); –2.86 (м, Si-H3C11’,12’НБЦП-3).
ЯМР 29Si (СDCl3) δSi, м.д.: 24.51 (c, НБЦП) (90%), 22.19 (c, НБЦП-3) (10%).
ГХ-МС (НБЦП): 178 [M]+ (9%), 112 [М–C6H6]+ (80%), 97 [М–C6H6–CH3]+ (100%).
ГХ-МС (НБЦП-3): 178 [М]+ (12%), 97 [М–С6H6–СH3]+ (32%), 66 [M–C6H12Si]+ (100%).
Синтез поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецена-8) (ПНБЦП). В круглодонную двугорлую колбу объемом 50 мл, снабженную магнитной мешалкой, помещали 0.224 г (0.0013 моля) НБЦП, вакуумировали и заполняли аргоном. Затем добавляли раствор 1.8 мг (0.0021 ммоля) катализатора Граббса первого поколения, Cl2(PCy3)2Ru=CHPh, в 5.4 мл абсолютированного толуола. Реакционную смесь перемешивали 24 ч при комнатной температуре. Обрывали реакцию введением винилэтилового эфира в мольном соотношении эфир: катализатор, равном 500:1, после чего выдерживали 30 мин и добавляли ингибитор окисления. Полимер выделяли осаждением в метиловый спирт, сушили в вакууме до постоянной массы. В результате получили 0.22 г (98%) ПНБЦП.
ЯМР 1H (СDCl3) δH, м.д.: 5.28, 5.24 (м, 2.2Н, НС8,9,8’,9’); 2.90 (м, 0.2H, HC, ПНБЦП-3); 2.59 (м, 2Н, НС1,2,6,7); 2.46 (м, 2H, НC1,2,6,7); 2.08 (м, 0.4H, HC, ПНБЦП-3); 1.84, 1.37 (м, 2H, Н2С10); 0.88, 0.81 (м, 0.2H, ПНБЦП-3); 0.55 (м, 2H, H2C3,5); 0.42 (м, 2H, H2C3,5); 0.15 (м, 3.6H, Si-H3C11,12,11’,12’), 0.02 (м, 3.6H, Si-H3C11,12,11’,12’).
ЯМР 13С (JMODECHO) (СDCl3) δC, м.д.: 133.65–133.33 (м, HС8,9,8’,9’); 52.37, 49.36 (м, HC, ПНБЦП-3); 48.09 (м, HC1,7); 45.87 (м, HС2,6); 40.54 (м, HC, ПНБЦП-3); 38.21–38.07 (м, H2C, ПНБЦП-3); 37.10 (м, H2C10); 18.27 (м, H2C, ПНБЦП-3); 14.25 (м, HC3,5); –0.37…–2.15 (м, Si-H3C11’,12’, ПНБЦП-3); –1.32…–2.15 (м, Si-H3C11,12).
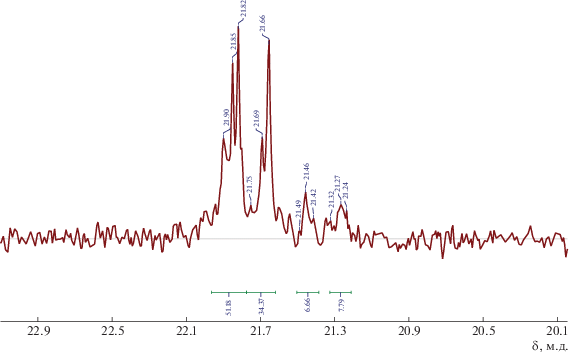
ЯМР 29Si (СDCl3) δSi, м.д.: 21.82 (м, ПНБЦП), 21.66 (м, ПНБЦП) (90%); 21.46 (м, ПНБЦП-3); 21.33 (м, ПНБЦП-3) (10%).
Найдено, %: С, 73.96; Н 10.07.
Для С10Н18Si
вычислено, %: С, 74.16; Н, 10.11.
Гем-дифторциклопропанирование ПНБЦП. Гем-дифторциклопропанирование ПНБЦП проводили по описанной ранее методике [17] в очищенной от следов кислорода атмосфере аргона. 40 мг (0.225 ммоля) ПНБЦП растворяли в течение 1.5 ч в 2.2 мл абсолютированного ТГФ с 3 мг ингибитора окисления в двугорлой колбе объемом 50 мл, снабженной магнитной мешалкой. К полученному раствору добавляли 2.0 мл метилбензоата, после чего отгоняли ТГФ при 20 мм рт. ст. Отдельно в двугорлой колбе объемом 50 мл, снабженной магнитной мешалкой, растворяли 0.34 г (2.25 ммоля) хлордифторацетата натрия в 4.1 мл метилбензоата. Затем в оба раствора добавляли цеолиты. Через 12–20 ч цеолиты удаляли из раствора ПНБЦП, после чего колбу оборудовали обратным холодильником и капельной воронкой, в которую переносили раствор хлордифторацетата натрия. Установку помещали в силиконовую баню, нагретую до 187°С, и при перемешивании равномерно прикапывали раствор хлордифтор-ацетата натрия к раствору полимера в течение 3 ч, затем реакционную смесь перемешивали 20 мин, после чего охлаждали до комнатной температуры. Смесь трижды промывали насыщенным раствором NaCl и дистиллированной водой. Из органического слоя (для разделения слоев использовали центрифугу, 4000 об./с, 1 мин) осаждали ПНБЦП метанолом. ПНБЦП дважды переосаждали из раствора хлороформа метанолом. Очищенный ПНБЦП сушили в вакууме до постоянной массы. Выход продукта составил более 92% со степенью конверсии двойных связей не менее 99%.
ЯМР 1H (СDCl3) δH, м.д.: 2.54 (м, 2Н, HC8,9); 1.94, 1.30 (м, 2Н, H2C10); 1.72 (м, 2Н, HC1,7); 1.06 (м, 2Н, HC2,6); 0.73, 0.42 (м, 4Н, H2C3,5); 0.18, 0.07 (м, 6Н, H3C11,12).
ЯМР 13С (JMODECHO) (СDCl3) δC, м.д.: 118.14–114.53 (м, С13); 45.13 (м, 2C8,9); 41.97 (м, 2C1,7); 31.88 (м, 2C2,6); 35.73 (м, C10); 14.31 (м, 2C3,5); –2.27 (м, 2C11,12).
ЯМР 29Si (СDCl3) δSi, м.д.: 20.53 (м).
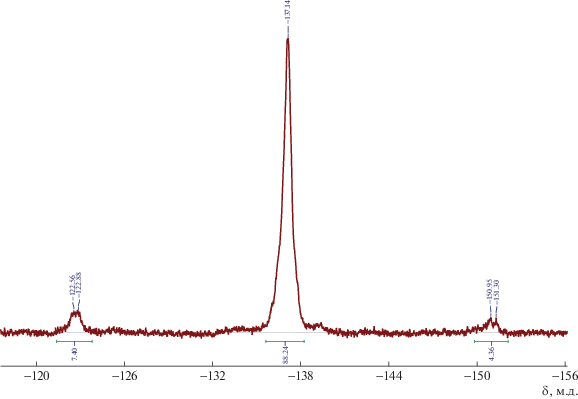
ЯМР 19F (СDCl3) δF, м.д.: –122.39…–122.93, –150.43…–151.28 (м, Fцис); 137.12 (м, Fтранс).
Найдено, %: С, 63.35; Н, 7.68.
Для С10Н18SiF2
вычислено, %: С 63.16; Н, 7.89.
Определение газотранспортных параметров
Коэффициенты проницаемости P и диффузии D газов He, H2, O2, N2, CO2, CH4 определяли на барометрической установке “Баратрон” (рис. 1) при 22 ± 2°С. Давление над мембраной варьировали в интервале 1–3 бар, давление под мембраной не превышало ∼12 мм рт. ст. (16 мбар).
Рис. 1.
Принципиальная схема барометрической установки Баратрон: 1, 4, 6, 7, 8, 11 – клапаны; 2, 10 – датчики давления; 3, 9 – емкости с калиброванными объемами; 12, 13 – воздушный термостат с сопутствующими элементами; 14 – система вакуумирования.
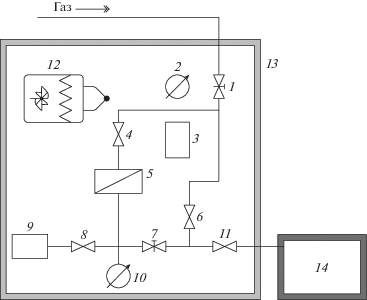
Измерение стационарного потока через полимерную пленку осуществляли при временах (4–6)·θ, где θ – время запаздывания. Для расчета коэффициента диффузии использовали метод Дейнеса–Баррера (метод времени запаздывания θ):
(l – толщина исследуемой пленки). Коэффициенты растворимости S газов оценивали как P/D.Подготовка образцов полимера для измерений газоразделительных свойств. Пленки готовили методом полива на целлофановую подложку 3 мас. % раствора полимера в толуоле и дальнейшего испарения растворителя. Полученную пленку отделяли от подложки и вакуумировали до постоянной массы (остаточное давление при вакуумировании не превышало 1 мм рт. ст.). Толщина пленок составляла 40–60 мкм.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Синтез и гем-дифторциклопропанирование поли(4,4-диметилтрицикло[5.2.1.02,6]-4-силадецена-8)
В настоящей работе с целью получения полинорборнена, у которого кремнийсодержащая группа расположена на бόльшем расстоянии от двойной связи по сравнению с триметилсилил-замещенным полинорборненом (ПТМСН) был синтезирован новый мономер 4,4-диметилтрицикло[5.2.1.02,6]-4-силадецен-8, осуществлена его полимеризация по схеме метатезиса и изучено поведение полимера в условиях дифторциклопропанирования. В НБЦП между атомом кремния и двойной связью расположены три атома углерода, в то время как в ПТМСН – два атома углерода. Мономер НБЦП был получен диеновой конденсацией циклопентадиена с 1,1-дихлорсила-циклопентеном
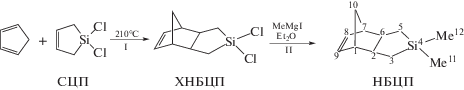 (1a)
(1a)
В литературе имеется пример диеновой конденсации ЦПД с 1-метил-1-хлорсилациклопентеном-3 [19].
Исходный СЦП содержал 13% 1,1-дихлорсила-циклопентена-2 (α-СЦП), поэтому в продуктах диеновой конденсации СЦП и ЦПД наблюдалось образование соответствующих изомеров.
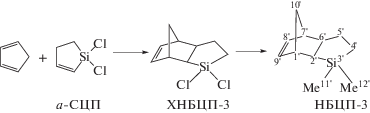 (1б)
(1б)
Так как в α-СЦП электроноакцепторная SiCl2 группа расположена ближе к двойной связи, чем в СЦП, последний должен быть менее активным в реакции с ЦПД. Изучение превращения изомеров во времени с помощью спектроскопии ЯМР 1Н показало, что СЦП и α-СЦП расходуются примерно с равной скоростью, по-видимому, из-за того, что концентрация СЦП в 6–7 раз выше концентрации α-СЦП. Подбор условий взаимодействия ЦПД с СЦП показал, что максимальный выход аддукта (ХНБЦП) (24%) наблюдается при 210°С. Наряду с образованием НБЦП интенсивно протекают побочные процессы димеризации и олигомеризации ЦПД. Дальнейшим метилированием хлораддукта реактивом Гриньяра был получен целевой мономер НБЦП с выходом 70% (схема (1а)). Продукт содержал 10% изомера 3,3-диметилтрицикло[5.2.1.02,6]-3-силадецена-8 (НБЦП-3) (схема (1б)). Строение ХНБЦП и НБЦП определено методами ГХ-МС, а также спектроскопии ЯМР 1Н, ЯМР 13С и ЯМР 29Si. Отнесение сигналов осуществлено с помощью ЯМР JMODECHO и двумерной С-Н корреляции HMQC (см. Экспериментальную часть).
Далее нами была осуществлена полимеризация НБЦП по схеме метатезиса, протекающая с раскрытием норборненового цикла и образованием полициклопентиленвинилена, содержащего двойные связи в каждом мономерном звене (схема (2) , стадия III). В присутствии катализатора Граббса первого поколения Cl2(PCy3)2Ru=CHPh, мольном соотношении [НБЦП] : [кат] = 580 : 1 практически с количественным выходом был получен ПНБЦП с Mw = 650 × 103 и Ð = 3.6. Широкое ММР, вероятно, объясняется присутствием в полимере 10% изомерного ПНБЦП-3. Условия полимеризации были выбраны для получения ПНБЦП с достаточно высокой молекулярной массой, чтобы обеспечить возможность отливки пленок для измерения газоразделительных свойств, но не слишком большой для дальнейшей эффективной постмодификации.
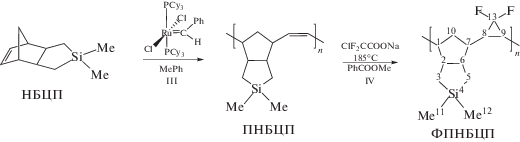 (2)
(2)
Для доказательства структуры впервые синтезированного полимера ПНБЦП были использованы спектры ЯМР 1Н, ЯМР 13С, ЯМР 29Si, JMODECHO, двумерные ЯМР COSY и HMQC, данные элементного анализа (см. Экспериментальную часть). Из спектров ЯМР 1Н, ЯМР 13С не удается однозначно выделить сигналы изомерных звеньев НБЦП-3. Более информативным оказался спектр ЯМР 29Si, на котором наблюдаются две пары сигналов атомов кремния в экзо- и эндо-звеньях, относящихся к ПНБЦП и ПНБЦП-3 (рис. 2). Из спектра было определено содержание звеньев ПНБЦП-3, равное 10–15%, что соответствует содержанию α-СЦП в исходном мономере. Соотношение экзо- и эндо-изомерных звеньев полимера, найденное из соотношения интегралов сигналов в каждой из пар, близко к эквимольному. На схеме (2) не представлены превращения НБЦП-3, поскольку его концентрация почти на порядок ниже содержания основного изомера НБЦП.
Постмодификацию ПНБЦП гем-дифторциклопропанированием проводили по отработанной ранее методике [17] в растворе метилбензоата с помощью хлордифторацетата натрия, при термолизе которого образуется дифторкарбен, реагирующий с двойными связями полимера (схема (2) , стадия IV). Для изучения активности ПНБЦП и подбора условий исчерпывающего гем-дифторциклопропанирования варьировали соотношение реагентов, время реакции и концентрацию полимера в реакционной смеси (табл. 1, опыты 2–6). В условиях, когда протекает исчерпывающее гем-дифторциклопропанирование незамещенного ПНБ (опыт 1), в ПНБЦП оставалось 80% непрореагировавших двойных связей (опыт 2). При увеличении количества дифторциклопропанирующего агента, времени реакции и разбавления реакционной смеси удалось практически полностью заменить двойные связи на дифторциклопропан (опыты 3, 4). Выход дифторциклопропанированного ПНБЦП (ФПНБЦП) составил до 92%, однако наблюдалось снижение молекулярной массы полимера. Использование образца ПНБЦП с более высокой молекулярной массой в условиях более высокой концентрации полимера в реакционной смеси и повышенной температуры реакции позволило получить модифицированный полимер ФПНБЦП, практически не содержащий двойные связи, с приемлемой для отлива пленок молекулярной массой (опыты 5, 6).
Таблица 1.
гем-Дифторциклопропанирование полинорборненов (метилбензоат, 185°С, 6 мас. % 2,2′-метилен-бис-(6-трет-бутил-4-метилфенол))
| Условия эксперимента | Продукт реакции | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Исходный полимер | Mw × 10–3 | Ð | Опыт, № | Мольное соотношение [ClF2CCOONa]:: [полимер] | [С], моль/л | τ, мин | Выход, % | Mw × 10–3 | Ð | Остаточные связи С=С, % |
| ПНБ | 363 | 3.1 | 1 [17] | 6 | 0.050 | 140 | 94 | 449 | 2.3 | 1 |
| ПНБЦП | 184 | 2.1 | 2 | 6 | 0.050 | 140 | 80 | – | – | 80 |
| 3 | 10 | 0.036 | 200 | 92 | 140 | 1.9 | 3 | |||
| 4 | 11 | 0.038 | 200 | 91 | 129 | 1.4 | 1 | |||
| ПНБЦП | 646 | 3.6 | 5 | 12 | 0.034 | 200 | 86 | 259 | 2.6 | 1 |
| 6 (195°С) |
12 | 0.101 | 200 | 92 | 327 | 3.3 | 1 | |||
| ПТМСН | 178 | 2.1 | 7 [17] | 12 | 0.035 | 520 | 84 | 121 | 2.3 | 16 |
Структура ФПНБЦП была доказана с помощью спектров ЯМР 1Н, ЯМР 13С, ЯМР 29Si, ЯМР 19F, JMODECHO и двумерных ЯМР COSY и HMQC, данными элементного анализа (см. Экспериментальную часть). Из спектра ЯМР 1Н определяли степень дифторциклопропанирования полимера интегрированием сигналов протонов остаточных двойных связей (5.28, 5.24 м.д.) и протонов в Si(CH2)2, (0.18, 0.07 м.д.) аналогично тому, как описано в работе [17]. Сигналы протонов экзо- и эндо-Si(CH2)2 хорошо разрешаются, и их интегрирование дает эквимольное соотношение экзо- и эндо-звеньев в ФПНБЦП. Соотношение цис-/транс дифторциклопропановых фрагментов удается определить из спектра ЯМР 19F (рис. 3) по аналогии с дифторциклопропанированным полинорборненом (ФПНБ) и ФПТМСН [17]. Геминальные атомы фтора в цис-дифторциклопропановом фрагменте на спектре представлены в виде дублета дублетов с хим. сдвигами –122.70, –150.93 м.д., в транс-фрагменте – в виде синглета –137.12 м.д.
Интегрированием указанных сигналов было определено, что ФПНБЦП содержит 12% цис- и 88% транс-звеньев. Поскольку известно, что при гем-дифторциклопропанировании сохраняется стереоконфигурация двойных связей [17], можно считать, что ПНБЦП также содержит 12% цис- и 88% транс-звеньев.
Сравнение активности полинорборненов при гем-дифторциклопропанировании в ряду ПНБ, ПНБЦП, ПТМСН показывает, что наиболее активным является ПНБ (табл. 1, опыт 1). Для исчерпывающего гем-дифторциклопропанирования ПНБЦП требуются более жесткие условия: более длительное время и больше дифторциклопропанирующего агента (опыты 4, 6). Наименее активным является ПТМСН, для которого не удается провести исчерпывающее гем-дифторциклопропанирование при использовании хлордифторацетата натрия (опыт 7). Приведенный ниже ряд активности полинорборненов в гем-дифторциклопропанировании коррелирует со степенью экранированности двойных связей в полимерной цепи.
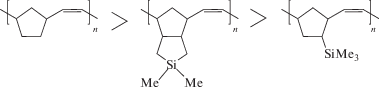
Термические свойства синтезированных полимеров
В табл. 2 приведена температура стеклования и разложения синтезированных ПНБЦП и ФПНБЦП, а также для сравнения полученные нами ранее данные для ПНБ, ФПНБ, ПТМСН и ФПТМСН. Введение силациклопентанового фрагмента или триметилсилильного заместителя в мономерное звено полинорборненов практически в равной степени повышают температуру стеклования на 60–70°С (табл. 2, опыты 1, 3, 5). Почти к такому же увеличению Tс (на 50–60°С) приводит гем-дифторциклопропанирование ПНБ и ПНБЦП (опыты 2, 4). В результате гем-дифторциклопропанирования ПТМСН температура стеклования модифицированного полимера (ФПТМСН) возрастает всего на 15°С (опыт 6). Возможной причиной может быть неполная модификация двойных связей в ПТМСН, либо жесткость цепи в большей степени определяется Me3Si-заместителем.
Таблица 2.
Термические свойства исходных и модифицированных полинорборненов
| Опыт, № | Полимер | Mw × 10–3 | Ð | Tс, °C | Цис-С=С, % | С=С, % | Tразл., °C (5%) (воздух/Ar) |
|---|---|---|---|---|---|---|---|
| 1 | ПНБ * | 330 | 2.8 | 41 | 12 | 100 | 415/421 |
| 2 | ФПНБ * | 449 | 2.3 | 94 | 12 | 1 | 320/360 |
| 3 | ПНБЦП | 646 | 3.6 | 111 | 12 | 100 | 277/357 |
| 4 | ФПНБЦП | 327 | 3.3 | 171 | 12 | 1 | 270/322 |
| 5 | ПТМСН* | 281 | 2.4 | 103 | 24 | 100 | 318/406 |
| 6 | ФПТМСН* | 198 | 2.0 | 117 | 24 | 18 | 300/336 |
* Термические свойства полимеров определены в работе [17].
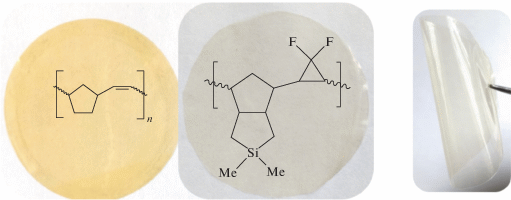
Термостабильность изученных полинорборненов в аргоне достаточно высокая (320–420°С). Температура разложения модифицированных полинорборненов несколько ниже, чем немодифицированных. На воздухе полинорборнен с силациклопентановым фрагментом менее стабилен, чем остальные полинорборнены (опыты 3, 4). Причины снижения термостабильности, вероятно, связаны с наличием напряженных силациклопентанового и гем-дифторциклопропанового фрагментов. Тем не менее, пленка из модифицированного силациклопентансодержащего полинорборнена ФПНБЦП после хранения в течение двух месяцев на воздухе при нормальных условиях демонстрирует большую стабильность, чем пленка из ПНБ, пожелтевшая после хранения при –2°С (рис. 4).
Газотранспортные параметры полимеров
Заметные сдвиги термических свойств в ряду метатезисных полинорборненов, которые обсуждались выше (табл. 2), должны соответствующим образом отражаться и на их газотранспортных параметрах. Изменения в структуре мономерного звена в изученных полинорборненах (ПНБ, ФПНБ, ПТМСН, ФПТМСН, ПНБЦП и ФПНБЦП) можно рассматривать с двух позиций – результат введения объемистой кремнийсодержащей группы и добавления фторсодержащего фрагмента.
Известно, что введение кремнийзамещенных фрагментов в полимерную цепь увеличивает коэффициенты проницаемости P газов [20, 21]. Однако этот эффект не постоянен: на примере силатрансодержащего метатезисного политрициклононена было показано, что присутствие бокового объемного силатранового фрагмента в мономерном звене не только не приводит к возрастанию P, но по некоторым газам вызывает их уменьшение [14]. Наибольший эффект достигается при введении в полинорборнены триметилсилильной группы, причем замена одной из метильных групп на, казалось бы, более объемный изопропильный радикал снижает этот эффект [8].
В рассматриваемых рядах полимеров (ПНБ–ПНБЦП–ПТМСН и ФПНБ–ФПНБЦП–ФПТМСН) наблюдается возрастание коэффициента проницаемости газов (табл. 3). Так, при добавлении в структуру мономерного звена метатезисного ПНБ диметилсилациклопентанового фрагмента коэффициент проницаемости газов P увеличивается в 2–3 раза, тогда как замена атома водорода в ПНБ на триметилсилильную группу вызывает бòльший эффект: коэффициент проницаемости возрастает в 7–24 раза.
В случае дифторциклопропанированных полинорборненов добавление силациклопентанового фрагмента оказывается сопоставимым с влиянием триметилсилильной группы: коэффициенты проницаемости газов при введении силациклопентанового фрагмента увеличиваются в 3–9 раз по сравнению с исходным ПНБ, в присутствии триметилсилильной группы наблюдается рост P газов в 4–14 раз. Отметим также, что степень повышения коэффициентов проницаемости не постоянна, а усиливается с увеличением размера молекулы пенетранта, т.е. наибольший эффект достигается для метана.
Ранее было показано, что гем-дифторциклопропанирование двойной связи в полимерной цепи метатезисных полинорборненов приводит к возрастанию коэффициентов проницаемости газов в 1.9–2.6 раза для ПНБ и в 1.1–1.6 раза для ПТМСН (табл. 3).
В текущем исследовании гем-дифторциклопропанирование силациклопентансодержащего метатезисного полинорборнена (ПНБЦП) оказывается более существенным. Так, коэффициенты проницаемости газов увеличиваются в 3–5 раз, и наибольшее возрастание в 7.7 раза достигается для азота, что, по-видимому, связано со специфическим перераспределением свободного объема в ФПНБЦП (табл. 3).
Значительные изменения коэффициентов проницаемости газов всегда сопровождаются симбатным изменением их коэффициентов диффузии [22]. Например, такое поведение можно наблюдать для P(N2) (Баррер) и D(N2) × 10–8 (см2с–1) в полиимиде [23], в поливинилтриметилсилане [24] и в полимере с внутренней микропористостью – политриметилсилилпропине [25]: 0.16/2.7, 8/33 и 6300/440 соответственно. Однако, когда коэффициенты проницаемости изменяются в узком интервале значений, закономерность может быть нарушена. Так, повышение коэффициентов проницаемости газов при гем-дифторциклопропанировании, рассмотренное выше, не сопровождалось соответствующим изменением их коэффициентов диффузии [17], напротив, наблюдалось уменьшение D для некоторых газов (табл. 4). Введение в настоящей работе силациклопентановой группы в структуру дифторциклопропанированного мономерного звена способствует возрастанию коэффициентов диффузии соответствующих газов в 1.1–2.3 раза (табл. 4).
Отношение коэффициентов проницаемости индивидуальных газов носит наименование идеальной селективности αP:
где индексы i и j соответствуют выбранной паре газов. Как следует из табл. 5, в ряду полимеров ПНБ–ПНБЦП–ПТМСН по мере введения кремнийсодержащего силациклопентанового фрагмента и триметилсилильной группы идеальные селективности разделения для всех представленных пар газов закономерно убывают с ростом их коэффициентов проницаемости. Такое поведение в литературе называется компенсационным эффектом [26] и связано преимущественно с потерей селективности полимерной матрицы с увеличением доли свободного объема.Аналогичное поведение идеальной селективности также наблюдается для исходного и модифицированного полимеров. Для всех представленных пар газов (за исключением He–H2) идеальные селективности разделения убывают в той или иной степени (табл. 5).
Стоит отметить, однако, что при дифторциклопропанировании ПНБ и ПТМСН величины αP либо не изменялись, либо слегка возрастали для пар газов, содержащих метан и водород, что объяснялось пониженным сродством водородсодержащих пенетрантов к фторсодержащей матрице полимера [17]. По-видимому, уменьшение αP для ФПНБЦП связано с преобладанием компенсационного эффекта над влиянием присутствия фторсодержащих групп.
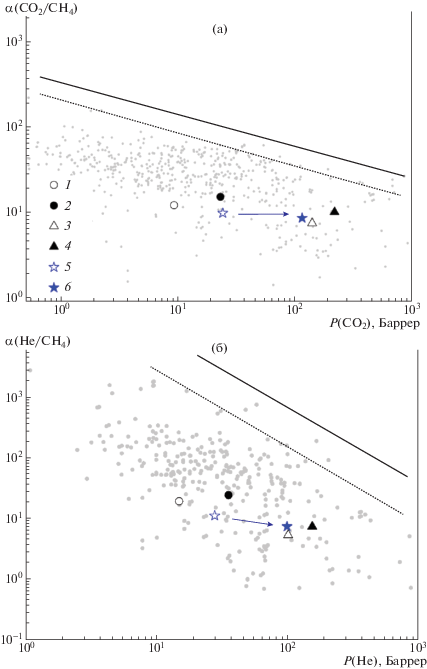
На диаграммах Рейтлингера–Робсона для различных пар газов (зависимость селективности разделения от коэффициента проницаемости более проницаемого пенетранта в логарифмических координатах) точки для рассматриваемых метатезисных полинорборненов и продуктов их гем-дифторциклопропанирования располагаются в общем облаке данных (рис. 5). Как уже отмечалось, ФПНБ и ФПТМСН в отличие от ФПНБЦП, характеризуются более выгодным положением на диаграммах по сравнению с их прекурсорами.
ЗАКЛЮЧЕНИЕ
Таким образом, в настоящем исследовании впервые синтезирован норборненовый мономер с силациклопентановым фрагментом и метатезисный полимер на его основе – ПНБЦП. Изучена модификация ПНБЦП путем гем-дифторциклопропанирования двойных связей основной цепи. Найдены условия исчерпывающей замены двойных связей в ПНБЦП на гем-дифторциклопропан. Установлен ряд активности полинорборненов при гем-дифторциклопропанировании. Снижение стерической нагрузки на внутрицепные двойные связи в полинорборненах путем отдаления объемного кремнийсодержащего заместителя значительно повышает активность полинорборненов в постмодификации. Изучены термические и газоразделительные свойства силациклопентансодержащих полинорборненов. Показано, что введение в структуру мономерного звена метатезисного полинорборнена силациклопентанового фрагмента и последующее гем-дифторциклопропанирование приводят к увеличению проницаемости и диффузии газов и незначительному снижению идеальных селективностей разделения. Модификация двойных связей в силациклопентансодержащем полинорборнене путем гем-дифторциклопропанирования увеличивает температуру стеклования и повышает стабильность пленок полимеров при хранении.
Строение полученных соединений изучено с использованием оборудования Центра коллективного пользования ИНХС РАН и Центра исследования строения молекул ИНЭОС РАН. Авторы благодарят А.С. Перегудова за помощь в определении строения мономера и полимеров, Г.А. Шандрюка за проведение ДСК и ТГА-анализов и С.А. Корчагину за проведение ГПХ-анализа.
Работа выполнена в рамках Государственного задания ИНХС РАН.
Список литературы
Galizia M., Chi W.S., Smith Z.P., Merkel T.C., Baker R.W., Freeman B.D. // Macromolecules. 2017. V. 50. № 20. P. 7809.
Adewole J.K., Ahmad A.L., Ismail S., Leo C.P. // Int. J. Greenh. Gas Con. 2013. V. 17. P. 46.
Membrane Materials for Gas and Vapor Separation: Synthesis and Application of Silicon-Containing Polymers / Ed. by Yu. Yampolskii, E. Finkelshtein. Chichester: Wiley, 2017.
Cruz-Morales J.A, Vargas J., Santiago A.A., Vásquez-García S.R., Tlenkopatchev M.A., Lys T.d., López-González M. // High Perform. Polym. 2016. V. 28. № 10. P. 1246.
Borisov I.L., Akmalov T.R., Ivanov A.O., Volkov V.V., Finkelshtein E.Sh., Bermeshev M.V. // Mendeleev Commun. 2016. V. 26. № 2. P. 124.
Finkelshtein E.Sh., Bermeshev M.V., Gringolts M.L., Starannikova L.E., Yampolskii Yu.P. // Russ. Chem. Rev. 2011. V. 80. № 4. P. 341.
Yampolskii Yu.P., Starannikova L.E., Belov N.A., Bermeshev M.V., Gringolts M.L., Finkelshtein E.Sh. // J. Membr. Sci. 2014. V. 453. № 3. P. 532.
Finkelshtein E.Sh., Gringolts M.L., Bermeshev M.V. Chapala P.P., Rogan Y.V. // Membrane Materials for Gas and Vapor Separation / Ed. by Yu. Yampolskii, E. Finkelshtein. Chichester: Wiley, 2017. P. 143.
Flid V.R., Gringolts M.L., Shamsiev R.S., Finkelshtein E.Sh. // Russ. Chem. Rev. 2018. V. 87. № 12. P. 1169.
Karpov G.O., Bermeshev M.V., Borisov I.L., Sterlin S.R., Tyutyunov A.A., Yevlampieva N.P., Bulgakov B.A., Volkov V.V., Finkelshtein E.Sh. // Polymer. 2018. V. 153. P. 626.
Chapala P.P., Bermeshev M.V., Starannikova L.E., Belov N.A., Ryzhikh V.E., Shantarovich V.P., Lakhtin V.G., Gavrilova N.N., Yampolskii Yu.P., Finkelshtein E.Sh. // Macromolecules. 2015. V. 48. № 22. P. 8055.
Bermeshev M.V., Chapala P.P. // Prog. Polym. Sci. 2018. V. 84. P. 1.
Alentiev D.A., Egorova E.S., Bermeshev M.V., Starannikova L.E., Topchiy M.A., Asachenko A.F., Gribanov P.S., Nechaev M.S., Yampolskii Yu.P., Finkelshtein E.Sh. // J. Mater. Chem. A. 2018. V. 6. № 40. P. 19393.
Alentiev D.A., Dzhaparidze D.M., Chapala P.P., Bermeshev M.V., Belov N.A., Nikiforov R.Yu., Starannikova L.E., Yampolskii Yu.P., Finkelshtein E.Sh. // Polymer Science B. 2018. V. 60. № 5. P. 612.
Morontsev A.A., Gringolts M.L., Filatova M.P., Finkelshtein E.Sh. // Polymer Science B. 2016. V. 58. № 6. P. 695.
Belov N.A., Gringolts M.L., Morontsev A.A., Starannikova L.E., Yampolskii Yu.P., Finkelshtein E.Sh. // Polymer Science B. 2017. V. 59. № 5. P. 560.
Morontsev A.A., Zhigarev V.A., Nikiforov R.Yu., Belov N.A., Gringolts M.L., Finkelshtein E.Sh., Yampolskii Yu.P. // Eur. Polym. J. 2018. V. 99. P. 340.
Чернышев E.A., Комаленкова Н.Г., Башкирова С.А., Соколов В.В. // Журн. общ. химии. 1978. Т. 48. № 110. С. 830.
Kim Y.K., Bourrie D.B., Pierce O.R. // J. Polym. Sci. A. 1978. V. 16. № 2. P. 483.
Ямпольский Ю.П., Дургарьян С.Г., Наметкин Н.С. // Высокомолек. соед. Б. 1979. Т. 21. № 8. С. 616.
Masuda T., Iguchi Y., Tang B.Z., Higashimura T. // Polymer. 1988. V. 29. P. 2041.
Alentiev A.Yu., Yampolskii Yu.P., Ryzhikh V.A., Tsarev D.A. // Petrol. Chem. 2013. V. 53. P. 554.
Zhao H.Y., Cao Y.M., Ding X.L., Zhou M.Q., Yuan Q. // J. Membr. Sci. 2008. V. 323. № 1. P. 176.
Ievlev A.L., Teplyakov Y.Y., Durgaryan S.G., Nametkin N.S. // Proc. USSR Acad. Sci. 1982. V. 264. № 6. P. 1421.
Merkel T.C., Bondar V.I., Nagai K., Freeman B.D. // J. Polym. Sci., Polym. Phys. 2000. V. 38. № 2. P. 273.
Robeson L.M. // J. Membr. Sci. 2008. V. 320. № 1–2. P. 390.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)