Высокомолекулярные соединения (серия С), 2020, T. 62, № 2, стр. 228-236
СУЛЬФИРОВАННЫЕ ПОЛИФЕНИЛХИНОКСАЛИНЫ: СИНТЕЗ, ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ, ПРОТОННАЯ ПРОВОДИМОСТЬ
Н. М. Беломоина 1, Е. Г. Булычева 1, *, Р. В. Писарев 2, Е. В. Герасимова 2, А. В. Писарева 2, Ю. А. Добровольский 2
1 Институт элементоорганических соединений им. А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
2 Институт проблем химической физики Российской академии наук
142432 Черноголовка, пр. ак. Семенова, 1, Россия
* E-mail: bulychev@ineos.ac.ru
Поступила в редакцию 02.03.2020
После доработки 07.05.2020
Принята к публикации 21.05.2020
Аннотация
Представлен краткий анализ литературы по синтезу полифенилхиноксалинов, их сульфированию и исследованию термической устойчивости и протонной проводимости. Осуществлен синтез полифенилхиноксалина на основе 3,3',4,4'-тетрааминодифенилоксида и 1,4-бис-(фенилглиоксалил)бензола, проведено его сульфирование. Получены пленки сульфированного полифенилхиноксалина с содержанием серы 0.6, 1.7, 6.0 и 8.0%, изучены их термическая устойчивость, протонная проводимость и тестирование в качестве протонпроводящей мембраны в мембранно-электродном блоке топливного элемента.
ВВЕДЕНИЕ
Разработка новых протонпроводящих полимерных электролитов для водородно-воздушных топливных элементов − одна из актуальных задач полимерной химии и электрохимии [1–5]. Особенно интенсивно ведутся работы по созданию протонпроводящих электролитов на основе сульфированных ароматических конденсационных полимеров (полиэфиркетоны, полиариленэфирсульфоны, полиимиды и другие) [6–12]. В ряду ароматических конденсационных полимеров, используемых для получения протонпроводящих мембран, полифенилхиноксалинам (ПФХ) уделено недостаточное внимание, тогда как ПФХ обладают наиболее перспективной гетероциклической системой, в структуре которой потенциально заложены высокая термическая, термоокислительная, гидролитическая и химическая устойчивость. Так, в работе [13] рассмотрены тенденции развития поликонденсационных полимеров, в частности ПФХ, связанные с их высокой термостойкостью и термопластичностью. Полифенилхиноксалины выделяются среди полигетероариленов (ПГА) уникальным сочетанием высоких термических характеристик с растворимостью, перерабатываемостью в циклизованном виде, высокими деформационно-прочностными характеристиками изделий, способностью к пленкообразованию, что делает их весьма выгодными в практическом отношении [14, 15]. Для дальнейшей переработки могут быть непосредственно использованы реакционные растворы ПФХ, так как они отличаются хорошей стабильностью при хранении.
Несмотря на все эти ценные свойства и способность к полимераналогичным превращениям, например, получение сульфированных полифенилхиноксалинов, на сегодняшний день удалось найти лишь несколько патентов [16, 17] и публикаций в периодической печати [18–28]. В опубликованных работах по электрохимическим характеристикам мембран сульфированных ПФХ [17, 22] нет планомерных исследований зависимости протонной проводимости от степени сульфирования, влажности и температуры.
В настоящей работе были осуществлены синтез ПФХ на основе 3,3',4,4'-тетрааминодифенилоксида и 1,4-бис-(фенилглиоксалил)бензола, сульфирование ПФХ, получение пленок сульфированных ПФХ, изучение их термической устойчивости, протонной проводимости и оценка в качестве протонпроводящей мембраны в составе мембранно-электродного блока топливных элементов.
СИНТЕЗ ПОЛИФЕНИЛХИНОКСАЛИНОВ
Синтез полифенилхиноксалинов осуществлен низкотемпературной поликонденсацией бис-(α-дикетонов) с бис-(α-диминами). Для этой данной реакции характерна чрезвычайная легкость замыкания хиноксалинового цикла, так как в отличие от синтеза других ПГА замыкание протекает одностадийно уже при комнатной температуре и приводит к полностью циклизованным высокомолекулярным полимерам [13]. ПФХ могут быть получены с количественным выходом как в расплаве, так и в растворе, причем наиболее подходящими растворителями являются м-крезол и смесь хлороформа с метанолом (10:1), где за 2−3 ч при комнатной температуре образуются высокомолекулярные продукты; в ДМФ и ДМАА получены лишь низкомолекулярные ПФХ (даже при кипячении). Последнее объясняется плохой растворимостью образующихся ПФХ, которые выпадают из реакционной смеси на начальных стадиях реакции [29]. Изучена кинетика реакции и предложен механизм образования ПФХ, показано, что м-крезол выступает не только растворителем, но и донором протонов [30]. Математическим планированием эксперимента проведена оптимизация синтеза ПФХ в хлороформе с использованием в качестве катализатора метанола и были найдены оптимальные условия получения полимеров с заданными вязкостными характеристиками, а следовательно, и с определенной молекулярной массой [31]. Таким образом, установлено, что молекулярную массу ПФХ можно регулировать путем изменения одного или нескольких параметров эксперимента: температуры реакции, времени введения в реакцию мономера при строго стехиометрическом отношении и количества катализатора. Увеличение количества метанола влечет изменение фазового состояния реакционной смеси, так как метанол является не только катализатором, но и осадителем ПФХ. Вязкость ПФХ, полученных двухфазной полигетероциклизацией, как правило, выше, чем полимеров, синтезированных в растворе. Наиболее чувствительными параметрами, вызывающими резкое понижение вязкости ПФХ, можно назвать время пребывания тетрамина в исходной суспензии и количество взятого в реакцию метанола, а также введение в реакцию тетракетона в твердом виде. Донор протонов (катализатор) реагирует с обоими мономерами, введение в реакцию тетракетона в растворе, содержащем катализатор (активированный мономер атакует нейтральную молекулу тетрамина), сокращает время реакции и обусловливает образование наиболее высокомолекулярного полимера.
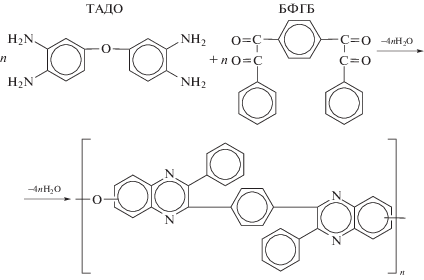
Синтез ПФХ для настоящей работы проведен согласно работе [14] по схеме (1) на основе 3,3´,4,4´-тетрааминодифенилоксида (ТАДО) и 1,4-бис-(фенилглиоксалил)бензола (БФГБ). Ранее авторы работ [17, 19, 22, 23] использовали 3,3´-диаминобензидин, ТАДО же обладает меньшей токсичностью и более устойчив к окислению. Термодинамика данной реакции изучена в работе [32], где было показано, что изменение энергии Гиббса реакции синтеза ПФХ отрицательно, т.е. процесс термодинамически разрешен, причем его равновесие практически полностью сдвинуто в сторону образования полимера в области температуры 100−500°С. Синтез ПФХ, осуществленный взаимодействием ТАДО с БФГБ в среде хлороформа с применением метанола в качестве донора протонов, приводит к получению высокомолекулярного полимера (ηприв = = 0.65 дл/г, Мw = 33274), полностью растворимого в хлороформе, бензиловом спирте, N-метилпирролидоне, м-крезоле и H2SO4 [33]:
В работах [34, 35] был протестирован метод синтеза ПФХ в сверхкритическом или жидком СО2 с катализатором и без него при различных условиях (давление, температура, продолжительность реакции). Так, показано, что ПФХ не образуется в жидком СО2 и сверхкритическом СО2 без катализатора, при добавлении катализатора (метанола) без нагревания [34]. В отсутствии катализатора при комнатной температуре реакция не идет, необходимо повышение температуры реакционной смеси и добавление катализатора, например метанола. Полимеры с различной молекулярной массой были получены в сверхкритическом СО2 при изменяющихся параметрах поликонденсации (температура, время реакции, давление, наличие катализатора) [34, 35]. Данная методика является достаточно перспективной с точки зрения замены токсичных растворителей и отсутствия в конечном полимере остатка высококипящих растворителей. Представленные полимеры по своим свойствам подобны синтезируемым в обычных органических растворителях.
СУЛЬФИРОВАНИЕ ПОЛИФЕНИЛХИНОКСАЛИНОВ
Способность ПФХ к полимераналогичным превращениям, в частности сульфированию для получения сульфированных полифенилхиноксалинов, описана в ряде публикаций [16–28].
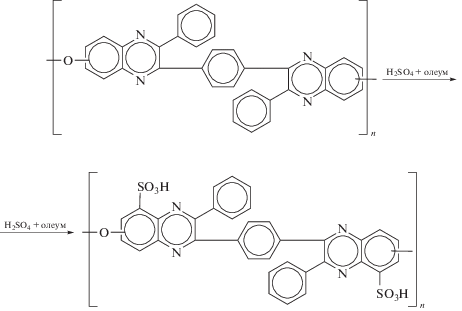
Ранее в нашей работе [33] было проведено сульфирование ПФХ при нагревании полимера в смеси концентрированной H2SO4 с олеумом (3:1) согласно схеме (2) при температуре 120°С в течение 5−35 ч, степень сульфирования (содержание серы) возрастала в процессе реакции (результаты работы обобщены в табл. 1):
Таблица 1.
Некоторые характеристики продуктов сульфирования ПФХ [33]
| Время сульфирования, ч | Содержание серы, % | Тразм., °С | ηприв, дл/г (N-метилпирролидон, Т = 25°С) |
|---|---|---|---|
| 0 | − | 280 | 0.65* |
| 5 | 0.7 | 285 | 0.96 |
| 20 | 1.7 | 315 | 1.76 |
| 30 | 6.0 | 325 | 1.15 |
| 35 | 8.0 | 360 | 0.72 |
Увеличение вязкости полимеров с ростом степени сульфирования было отмечено ранее [36, 37] и объяснялось не ростом молекулярной массы, а более высокой концентрацией полярных групп. Превращение ПФХ в сульфированные ПФХ сопровождалось существенным изменением растворимости. Так, полимер c содержанием серы >1.7% теряет растворимость в хлороформе, а полимер, содержащий 8.0% серы, растворяется в этаноле. Повышение температуры размягчения полимеров с ростом степени сульфирования, отмеченное ранее [18, 33], можно связать с развитием системы межмолекулярных водородных связей при углублении процесса сульфирования [38].
ТЕРМИЧЕСКАЯ СТАБИЛЬНОСТЬ ПФХ и СПФХ
Хорошая растворимость ПФХ и относительно низкие значения температуры сульфирования (<300°С) определяются аморфностью структуры, конфигурационным и конструкционным “беспорядком”, обусловленным разнозвенностью полимеров за счет возможности образования различных геометрических изомеров [13, 15]. Разнозвенность является причиной термопластичности ПФХ и определяет большой диапазон между значениями температуры размягчения (<300°С) и разложения (∼500°С), что выделяет их среди остальных ПГА и создает преимущества при переработке в изделия. В работе [39] методом калориметрии от 0 до 297°С определены характеристики процессов трансформации ПФХ. Изучено изотермическое старение ПФХ в области 200−700°С [15], получены данные для выбора оптимальных режимов переработки и эксплуатации этих полимеров. ПФХ практически не теряют в массе до 475−500°С, при более же высоких значениях температуры начинается глубокое разложение. В работе [40] изучены основные направления химических реакций и кинетических закономерностей процессов термической деструкции ПФХ в вакууме. Так, показано, что в области 200−400°С происходят структурные изменения – полимеры сшиваются.
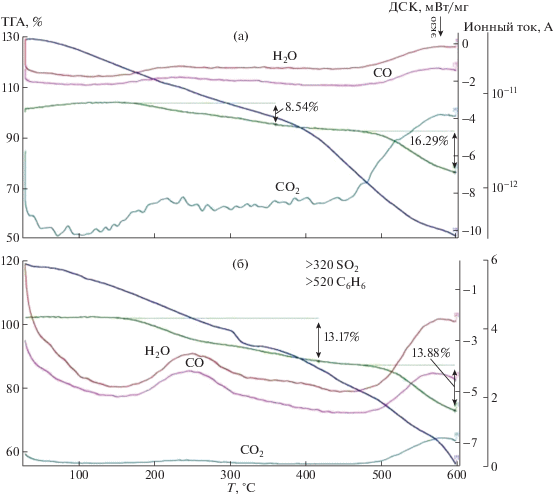
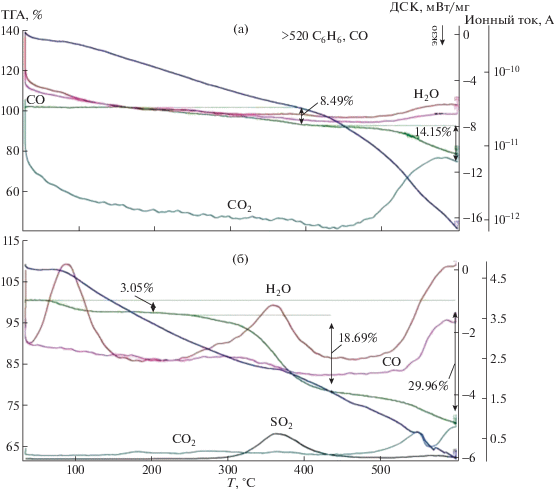
Введение сульфогрупп в ПФХ влечет снижение его термостабильности: при температуре ∼100°С появляется область десорбции воды, при 300−400°С происходит десульфирование [18, 25]. Нами была исследована термическая стабильность полимерных сульфированных ПФХ с содержанием серы от 0.7 до 8.0% в температурном интервале 25−600°С методом синхронного термического анализа с масс-спектрометрическим детектированием продуктов разложения (рис. 1 и 2). Как следует из полученных данных, первичные потери массы связаны с выделением воды; при температуре более 320°С наблюдается выделение SО2, обусловленное десульфированием сульфированных ПФХ, а при значениях температуры выше 520°С продуктами деструкции являются СО и С6Н6, что свидетельствует о деструкции фенилхиноксалиновых фрагментов.
ИССЛЕДОВАНИЕ ПРОТОННОЙ ПРОВОДИМОСТИ СУЛЬФИРОВАННЫХ ПФХ
В опубликованных ранее работах по электрохимическим характеристикам мембран сульфированных ПФХ [17, 22, 24–28] не представлено подробных исследований зависимости протонной проводимости от степени сульфирования, влажности и температуры. Практически все измерения осуществлены при 100% относительной влажности и высокой температуре, протонная проводимость достигала величин 10–3–10–1 См/см.
В настоящей работе рассмотрена протонная проводимость полимеров сульфированных ПФХ с содержанием серы от 0.7 до 8.0% методом импедансной спектроскопии. Измерения импеданса (комплексного сопротивления) электрохимической ячейки, образованной исследуемым образцом мембраны с прижатыми углеродными электродами площадью 1 см2, были проведены в атмосфере воздуха с определенным значением влажности в диапазоне частот 106–1 Гц на импедансметре Z-350M (“Элинс”). Типичные спектры импеданса, изображенные в координатах комплексного сопротивления (годографы), показаны на рис. 3. При наличии только ионного сопротивления мембраны и емкости двойного слоя годограф имеет вид вертикальной прямой. В нашем случае отклонение графиков от вертикальной прямой обусловлено адсорбционной емкостью и диффузионной релаксацией электродов [41].
Рис. 3.
Типичные годографы при Т = 22 (1) и 60°С (2) импеданса мембран с углеродными электродами. Цифрами у кривых обозначена частота в Гц; на вставке приведен участок аппроксимации годографов на ось абсцисс.
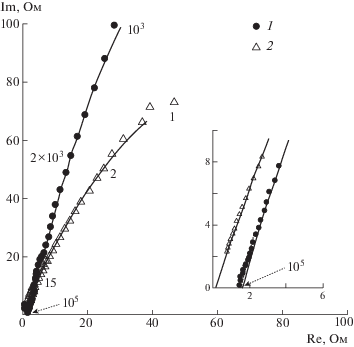
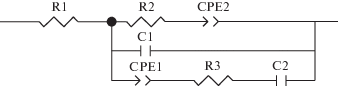
Определение величины протонной проводимости мембраны было выполнено при помощи программного пакета ZView фирмы “Scribner Association”. Использован расчет всех релаксационных параметров в соответствии с эквивалентной схемой, приведенной на рис. 4 [42]. В качестве объемного ионного сопротивления пленки использован элемент R1 схемы, так как, предположительно, остальная ее часть отвечает за адсорбционную релаксацию на электродах и диффузионные процессы в пленке. Таким образом, величина объемного сопротивления была получена расчетом по частотной зависимости импеданса во всем диапазоне частот, или, по крайней мере, в диапазоне от 500 кГц до 1 Гц. Такой метод позволяет наиболее точно определить сопротивление пленки, в отличие от измерения проводимости на высоких частотах, где проявляются искажения, вносимые геометрической емкостью (см. высокочастотную часть годографа импедансного спектра на врезке для Т = 22°С). На врезке на начальном участке видны сопротивления мембран, отсекаемые на действительной оси экстраполяцией годографов. Экстраполяция проведена по частотной зависимости эквивалентных схем, наиболее адекватно описывающих частотные зависимости импеданса измеряемой системы (сплошные кривые); цифры у точек – частоты в Гц.
Рис. 4.
Эквивалентная схема для расчета параметров электрохимической ячейки – мембраны с углеродными электродами: R1 – объемное протонное сопротивление пленки; R2, CPE2 – ограниченная диффузия в пленке; C1 – емкость двойного слоя на границе электронного и протонного проводников (слоя Гельмгольца); CPE1, R3, C2 − цепочка, моделирующая адсорбционную релаксацию двойного слоя.
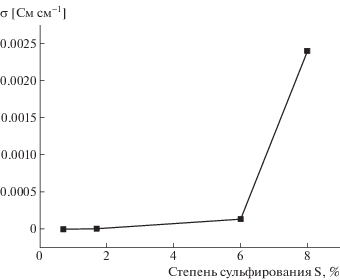
Зависимость проводимости сульфированных ПФХ при комнатной температуре 22°С от степени сульфирования при относительной влажности воздуха 75% показана на рис. 5. При увеличении степени сульфирования серы от 0.7 до 8.0%, протонная проводимость возрастает от <10–7 до 2.4 × × 10–3 См см–1. C ростом степени сульфирования (>1.7% серы) в полимере образуется непрерывная сетка водородных связей и проводимость возрастает.
Рис. 5.
Зависимость проводимости сульфированных ПФХ при температуре 22°С и относительной влажности воздуха 75% от степени сульфирования.
Для образцов полимеров ПФХ с содержанием серы 8.0% ранее были получены зависимости протонной проводимости от влажности и температуры [33]. Повышение температуры в интервале 22−60°С при относительной влажности 75% приводит к повышению проводимости от 2.35 × × 10–3 до 1.82 × 10–2 См см–1. Температурная зависимость проводимости подчиняется уравнению Аррениуса с энергией активации 0.44 эВ (0.2 эВ – мембрана Nafion [43]). При понижении относительной влажности <60% происходит разрыв сетки водородных связей в полимере и величина проводимости значительно снижается. Значения проводимости и энергии активации при высокой влажности приближаются к значениям для мембраны Nafion [43].
ТЕСТИРОВАНИЕ СУЛЬФИРОВАННЫХ ПФХ В СОСТАВЕ МЕМБРАННО-ЭЛЕКТРОДНОГО БЛОКА ТОПЛИВНЫХ ЭЛЕМЕНТОВ
Мембраны на основе сульфированных ПФХ с различным содержанием серы исследованы в составе водородно-воздушного топливного элемента в измерительной ячейке ElectroChem с активной областью 1 см2. Катализатор был изготовлен следующим образом. Pt/C (20% Pt) E-TEK диспергирован в ультразвуковой ванне в течение 2 ч в водном растворе Nafion (25% сухого иономера от массы катализатора). Далее каталитическая смесь наносилась на газодиффузионный слой Toray TGP-H-060 при температуре 80°С. Полученный электрод высушивался на воздухе в течение 1 ч. Сборка мембранно-электродного блока осуществлялась методом горячего прессования при температуре 100°С и давлении 60 атм/см2. Тестирование выполнялось при комнатной температуре и относительной влажности входящих газов 75 и 95%.
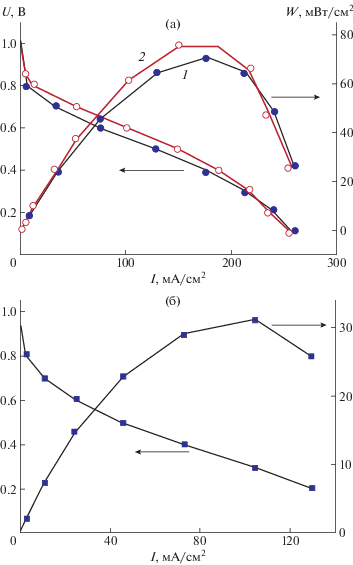
Результаты электрохимических измерений мощностных характеристик мембранно-электродного блока с мембранами сульфированных ПФХ с содержанием серы 6.0 и 8.0% представлены на рис. 6. Характеристики топливных элементов в значительной степени зависят от степени сульфирования ПФХ. Максимальная мощность, развиваемая мембранно-электродным блоком с мембраной на основе сульфированных ПФХ c содержанием серы 8.0% составляет ∼80 мВт/см2 (рис. 6а). Мощность, получаемая на мембране Nafion NRE-212 при использовании электродов, приготовленных тем же методом, при аналогичных условиях измерения составила 120 мВт/см2.
Рис. 6.
Вольтамперные характеристики мембранно-электродного блока с мембраной сульфированных ПФХ с содержанием серы 8.0 (а) и 6.0% (б), толщиной 25 и 20 мкм соответственно, при относительной влажности: а − 75 (1) и 95% (2); б − 75%.
Таким образом, можно сделать вывод, что сульфированные полифенилхиноксалины, благодаря высокой протонной проводимости, перспективны для использования в качестве протонообменных мембран для топливных элементов.
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (синтез полифенилхиноксалинов и сульфированных полифенилхиноксалинов различного состава), а также госзадания, государственная регистрация № АААА-А19-119061890019-5 (исследование термической устойчивости и протонной проводимости) и при поддержке Российского научного фонда, проект № 17-79-30054 (тестирование мембранно-электродного блока топливных элементов).
Список литературы
Kerres A. // J. Membr. Sci. 2001. V. 185. № 1. P. 3.
Rikukawa M., Sanui K. // Prog. Polym. Sci. 2000. V. 25. P. 140.
Kordesch K., Simander G. // Chem. Rev. 1995. V. 95. № 1. P. 191.
Shaari N., Kamarudin S.K. // Int. J. Energy Res. 2019. V. 43. Iss. 7. P. 2756.
Wong C.Y., Wong W.Y., Ramya K., Khalid M., Loh K.S., Daud W.R.W., Lim K.L., Walvekar R., Kadhum A.A.H. // Int. J. Hydrogen Energy. 2019. V. 44. Iss. 12. P. 6116.
Li Q., He R., Jensen J.Q., Bjerrum N.J. // Chem. Mater. 2003. V. 15. P. 4896.
Hickner M.A., Ghassemi H., Kim Y.S., Einsla B.R., McGrath J.E. // Chem. Rev. 2004. V. 104. № 10. P. 4587.
Rusanov A.L., Likhachev D.Y., Mullen K. // Russ. Chem. Rev. 2002. V. 71. № 9. P. 761.
Rusanov A.L., Likhatchev D.Yu., Kostoglodov P.V., Mullen K., Klapper M. // Adv. Polym. Sci. 2005. V. 197. P. 83.
Dobrovol`skii Yu.A., Volkov E.V., Pisareva A.V., Fedotov Yu.A., Likhachev D.Yu., Rusanov A.L. // Russ. J. Gen. Chem. 2007. V. 77. № 4. P. 766.
Dobrovolsky Yu.A., Jannasch P., Lafitte B., Belomoina N.M., Rusanov A.L., Likhachev D.Yu. // Russ. J. Electrochem. 2007. V. 43. № 5. P. 489.
Jannasch P. // Curr. Opin. Coll. Interface Sci. 2003. V. 8. P. 96.
Кронгауз Е.С. // Высокомолек. соед. A. 1984. Т. 26. № 2. С. 227.
Коршак В.В., Кронгауз Е.С., Берлин А.М., Раубах Х. А. с. 483409 СССР // Б. И. 1975. № 33. С. 80.
Коршак В.В., Павлова С.А., Грибкова П.Н., Власова И.В., Берлин А.М., Кронгауз Е.С. // Высокомолек. соед. A. 1975. Т. 17. № 11. С. 2407.
Кронгауз Е.С., Беломоина Н.М., Русанов А.Л., Кирш Ю.Э., Януль Н.А., Смирнов С.А. // Пат. 1819418 РФ. 1994.
Park K., Kim H., Min M., Kim J.H., Bae I. Pat. US20180226670A1, 2018.
Беломоина Н.М., Русанов А.Л., Януль Н.А., Кирш Ю.Е. // Высокомолек. соед. В. 1996. Т. 38. № 2. С. 355.
Kopitzke R.W., Linkous C.A., Nelson G.L. // J. Polym. Sci., Polym. Chem. 1998. V. 36. P. 1197.
Rusanov A.L., Belomoina N.M., Bulycheva E.G., Yanul N.A., Likhatchev D.Yu., Dobrovolskiy Yu.A., Iojoiu C., Sanchez J.-Y., Voytekunas V., Abadie M.-J.-M. // High Perform. Polym. 2008. V. 20. № 6. P. 627.
Kirsh Yu.E., Yanul N.A., Belomoina N.M., Rusanov A.L. // Russ. J. Electrochem. 1996. V. 32. № 2. P. 151.
Kopitzke R.W., Linkous C.A., Anderson H., Randolph N., Gordon L. // J. Electrochem. Soc. 2000. V. 145. № 5. P. 1677.
Kopitzke R.W., Linkous C.A., Anderson H., Nelson G.L. // Polym. Degrad. Stab. 2000. V. 67. P. 335.
Bulycheva E.G., Belomoina N.M., Vasiliev V.G., Elmanovich I.V., Wasserman L.A., Hsu S.L.-C., Cheng P.-Y. // Dokl. Phys. Chem. 2016. V. 471. P. 190.
Vasil'ev V.G., Buzin M.I., Nikiforova G.G., Belomoina N.M., Bulycheva E.G., Papkov V.S. // Dokl. Phys. Chem. 2014. V. 458. P. 149.
Zhou W.L., Wan M.X., Lu F.C. // Polymer. 1994. V. 35. Iss. 14. P. 2977.
Gong F.X., Li N.W., Zhang S.B. // Polymer. 2009. V. 50. Iss. 25. P. 6001.
Linkous C.A., Anderson H.R., Kopitzke R.W., Nelson G.L. // Int. J. Hydrogen Energy. 1998. V. 23. Iss. 7. P. 525.
Hergenrother P.M., Levne H.H. // J. Polym. Sci., Polym. Chem. 1967. V. 5. № 6. P. 1453.
Коршак В.В., Кронгауз Е.С., Травникова А.П. // Высокомолек. соед. A. 1980. Т. 22. № 7. С. 1450.
Коршак В.В., Кронгауз Е.С., Травникова А.П. // Высокомолек. соед. Б. 1983. Т. 25. № 5. С. 353.
Карякин Н.В., Рабинович И.Б., Сапожников В.П., Камелева Г.П., Кронгауз Е.С., Коршак В.В., Травникова А.П. // Высокомолек. соед. Б. 1977. Т. 19. № 6. С. 457.
Rusanov A.L., Dobrovolsky Yu.A., Gerasimova E.V., Belomoina N.M., Bulycheva E.G. // Unique Properties of Polymers and Composites: Pure and Applied Science Today and Tomorrow / Eds. by Y.N. Bubnov, V.A. Vasnev, A.A. Askaskii, G.E. Zaikov. Hauppauge; New York: Nova Publishers, 2012. P. 83. V. 2.
Belomoina N.M., Bulycheva E.G., Nikitin L.N., Bruma M. // Dokl. Chem. 2012. V. 446. Part 2. P. 201.
Belomoina N.M., Bulycheva E.G., Nikitin L.N., Vasil’ev V.G., Elmanovich I.V., Bruma M. // J. Supercritical Fluids. 2016. V. 113. P. 166.
Fujimoto C.H., Hickner M.A., Cornelius C.J., Loy D.A. // Macromolecules. 2005. V. 38. P. 5010.
Harrison W.L., Wang F., Mecham J.B., Bhanu V.A., Hill M., Kim Y.S., McGrath J.E. // J. Polym. Sci., Polym. Chem. 2003. V. 41. P. 2264.
Miyatake K., Hay A.S. // J. Polym. Sci., Polym. Chem. 2001. V. 39. P. 3211.
Smirnova N.N., Markin A.V., Samosudova Ya.S., Bykova T.A., Shifrina Z.B., Serkova E.S., Kuchkina N.V. // Russ. J. Phys. Chem. A. 2018. V. 92. Iss. 2. P. 226.
Волощук К.А., Цейтлин Г.М., Блюменфельд А.Б., Забельников Н.С., Атрушкевич А.А. // Высокомолек. соед. А. 1989. Т. 31. № 2. С. 295.
Ukshe E.A., Bukun N.G. // Sov. Electrochem. 1990. V. 26. № 11. P. 1221.
Bukun N.G., Ukshe A.E., Ukshe E.A. // Sov. Electrochem. 1993. V. 29. № 1. P. 110.
Kusoglu A., Weber A.Z. // Chem. Rev. 2017. V. 117. P. 987.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)