Высокомолекулярные соединения (серия С), 2020, T. 62, № 2, стр. 122-144
СИНТЕЗ РАЗВЕТВЛЕННЫХ ПОЛИИМИДОВ РАЗНОЙ ТОПОЛОГИЧЕСКОЙ СТРУКТУРЫ
А. А. Кузнецов 1, *, А. Е. Солдатова 1, А. Ю. Цегельская 1, Г. К. Семенова 1
1 Институт синтетических полимерных материалов им. Н.С. Ениколопова Российской академии наук
117393 Москва, ул. Профсоюзная, 70, Россия
* E-mail: kuznetsov@ispm.ru
Поступила в редакцию 30.04.2020
После доработки 27.05.2020
Принята к публикации 15.06.2020
Аннотация
Представлен обзор публикаций по синтезу, исследованию структуры и применению полиимидов с макромолекулами разветвленной структуры: сильно разветвленных, сверхразветвленных, звездообразных и дендримеров. Специальный раздел посвящен работам по синтезу сильно разветвленных и звездообразных полиимидов методом одностадийной высокотемпературной каталитической полициклоконденсации.
ВВЕДЕНИЕ
В последние годы развитие новых синтетических подходов в полимерной химии открыло возможности для получения новых разветвленных полимеров различной, часто весьма сложной топологии. Интерес к ним связан с необычными свойствами, которые существенно отличаются от свойств аналогичных линейных полимеров того же химического строения и близкой молекулярной массы. К настоящему времени синтезировано громадное количество полимеров разветвленной и дендритной структуры, принадлежащих к разным классам по химическому строению.
Достигнутые успехи в синтезе и изучении полимеров сложной топологической структуры оказывают большое воздействие и на химию полигетероариленов (ПГА), которая получила новое “топологическое” направление развития. Действительно, комбинирование в одном полимере специальных свойств, присущих разветвленным и дендритным структурам ‒ хорошей растворимости, низкой вязкости, значительного свободного объема, возможности размещения большого количества функциональных групп с сохранением базовых свойств ПГА является чрезвычайно плодотворной идеей для создания новых функциональных материалов с улучшенными характеристиками.
Полиимиды в ряду ПГА занимают особое место, поскольку среди последних являются одним из наиболее представительных классов. Задача настоящего миниобзора – обобщить информацию по синтезу, структуре и потенциальным областям применения разветвленных и дендритных полиимидов.
Согласно классификации, предложенной в работах [1, 2], по топологическим признакам (количеству, типу и характеру расположения центров ветвления) в макромолекуле среди разветвленных полимеров можно выделить следующие типы: полимеры со случайным образом расположенными ветвями [3], полимерные звезды [4], гребнеобразные полимеры и молекулярные щетки [5], дендримеры [6–12], Н-полимеры [13–15], pom-pom-полимеры [16], сверхразветвленные полимеры [17–21], циклические разветвленные полимеры [22], критически разветвленные кластеры [23]. Синтезировано также много новых (“гибридных”) сильноразветвленных полимеров смешанной структуры. К ним относятся “дендриграфы” [24, 25] – гребнеобразные полимеры с дендритными фрагментами [26], звезды с привитыми лучами в виде молекулярных щеток [27] и т.д.
Для каждого из перечисленных структурных типов разветвленных полимеров имеются соответствующие обзорные статьи, в которых изложена общая методология получения макромолекул разветвленной и дендритной структуры, современное состояние проблемы и области применения. Наличие обширной обзорной литературы общего характера избавляет нас от необходимости описывать для каждого типа разветвленных и дендритных полимеров ключевые структурные особенности и позволяет сфокусировать внимание в основном на вопросах синтеза разветвленных и дендритных ПИ. Следует отметить, что в большинстве рассмотренных публикаций синтез этих объектов исследования трудоемок и осуществляется по весьма сложным многостадийным схемам. Это существенно ограничивает возможности развития лабораторной методики на стадии масштабирования. Учитывая то, что результаты работ по синтезу разветвленных и дендритных полиимидных структур могут иметь практическое применение, важным направлением исследований является создание подходов, позволяющих по возможности упростить и сделать эффективным процесс синтеза разветвленных и дендритных полиимидных макромолекул. Разработке одного из таких подходов, предложенного авторами обзора и позволяющего синтезировать сильно- и сверхразветвленные, а также звездообразные полиимиды в одну стадию, посвящен отдельный раздел.
ДЕНДРИМЕРЫ
Из рассматриваемых в настоящем обзоре разветвленных полимеров дендримеры представляют наиболее хорошо структурно организованный тип объектов. В структуре дендримера имеется центральный разветвляющий фрагмент, от которого отходят одинаковые дендритные фрагменты – дендроны. Для дендримеров характерно наличие сферической симметрии в расположении дендронов и очень узкое распределение по размерам и молекулярной массе (Mw/Mn = 1.0). В их структуре имеются два типа фрагментов, а именно дендритные (d) и терминальные (t). Степень разветвления дендримеров DP = 1.0.
Тематика, связанная с синтезом дендримеров, развивается в мире начиная с 1978–1985 годов с пионерских работ групп под руководством F. Vogtle [28], D.A. Tomalia [29] и G.R. Newkome [30]. К настоящему времени по тематике синтеза и строения дендримеров имеются обстоятельные обзоры [6–12], посвященные как общим структурным закономерностям, так и описанию основных подходов для получения дендримеров (конвергентного и дивергентного) применительно к разным химическим классам полимеров. Одно из значительных сравнительно недавних событий в хронологии изучения дендримеров – отказ от первоначально существовавшего представления об этих объектах как о макромолекулах-частицах, имеющих абсолютно правильную геометрическую структуру. Методом малоуглового нейтронного рассеяния было установлено, что по мере увеличения номера генерации дендронная цепь, исходящая из центра, выходит на поверхность и загибается по поверхности, образуя внешний слой дендримера [31]. Это означает, что нет теоретического предела, ограничивающего число возможных генераций. Cложный синтез, однако, служит серьезным препятствием на пути практического использования дендримеров.
Синтез полиимидных дендримеров
Публикаций, посвященных синтезу дендримеров полиимидной структуры, сравнительно немного.
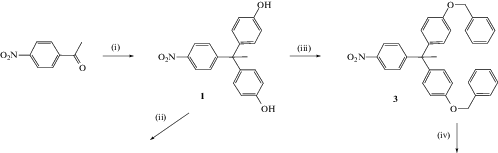
Впервые полиимидные (точнее, полиэфир-имидные) дендримеры были синтезированы, по-видимому, в работе [32]. Синтез проводили в несколько стадий с использованием конвергентного подхода
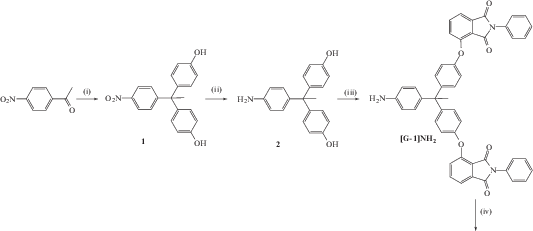
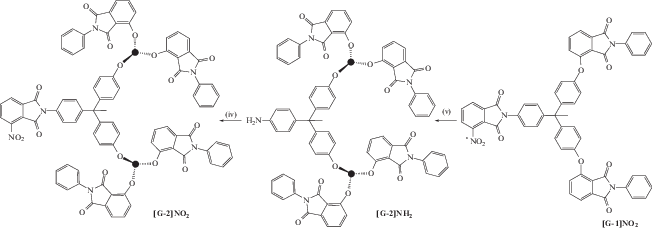
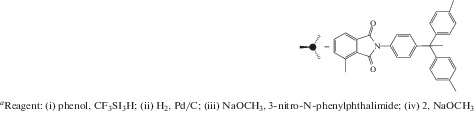
В качестве строительных блоков использовали 1-(4-аминофенил)-1,1-бис-(4-гидроксифенил)этан и 3-нитро-N-фенилфталимид либо 3-нитрофталевый ангидрид. Чередовали реакции нуклеофильного замещения нитрогруппы фенолят-ионами для формирования простой эфирной связи и конденсации аминогруппы с ангидридной группой 3-нитрофталевого ангидрида с образованием имидного цикла. В результате были получены дендримеры второй генерации.
Был синтезирован дендример с меньшим количеством имидных фрагментов с привлечением той же методики [33], исследовано влияние алкильных заместителей и гидроксильных групп на свойства ПИ-дендримера:
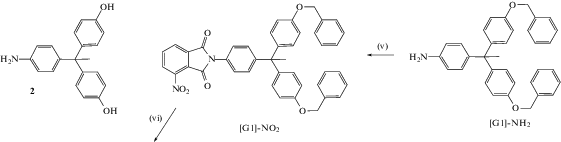
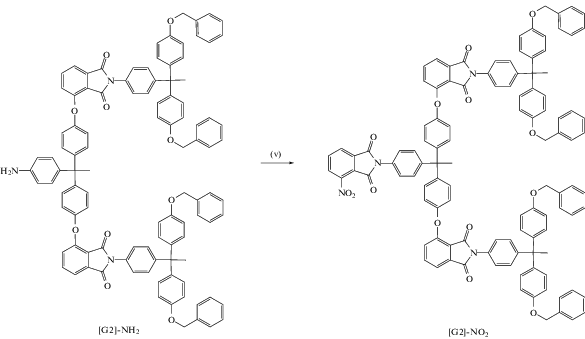
Дендримеры третьей генерации получены в работе [34] с использованием конвергентного подхода. Авторы синтезировали мономер ABB' в латентной форме – этиловый эфир 4-(2,4-диаминофенокси)фталевой кислоты. Имидные циклы получали двумя способами.
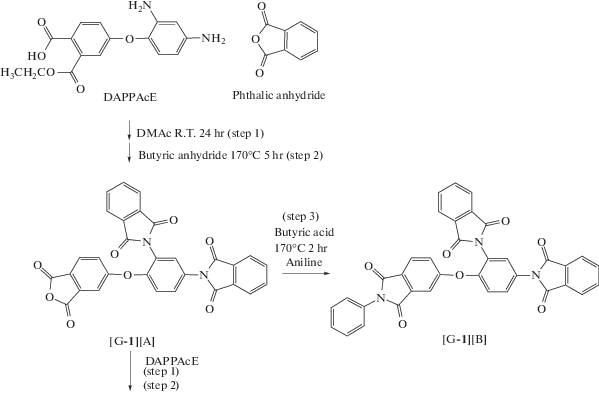
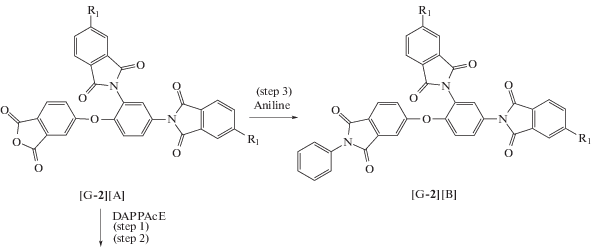
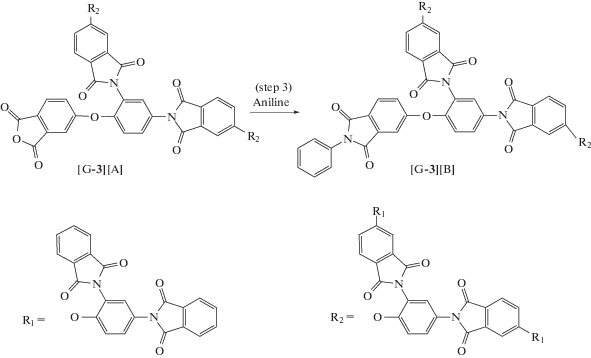
Если в реакции участвовал мономер ABB' с ангидридной группой в латентной форме, то через стадию образования полиамидокислоты (ПАК) в ДМАА с последующей имидизацией в присутствии масляной кислоты и ее ангидрида. Если в реакции участвовали производные мономера ABB' с ангидридной группой, то циклоконденсацию проводили в одну стадию в масляной кислоте.
Полиимидные дендримеры с периленимидными фрагментами синтезировали также с привлечением конвергентного подхода [35]. В данной работе получены три вида дендримеров первой генерации. В отличие от предыдущих исследований использовали мономеры с одинаковой функциональностью – трис-(4-аминофенил)амин и декациклентриангидрид, а также монофункциональный мономер-моноимидпериленового ангидрида.
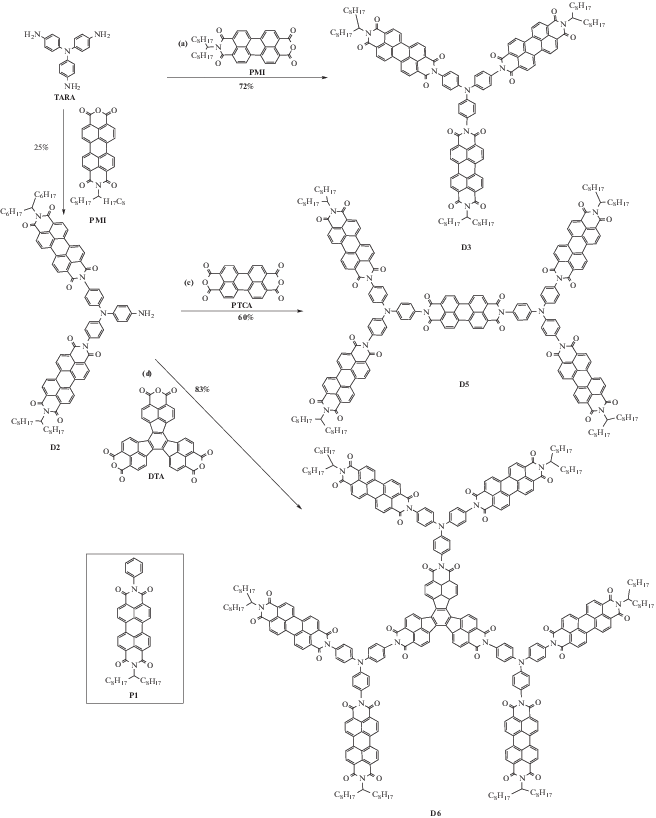
Поскольку применяли мономеры с одинаковой функциональностью, при синтезе несимметричных строительных блоков (например, D2), целевой продукт получили с выходом 25%. Стоит отметить, что использовался нетрадиционный способ синтеза – катализатор ацетат цинка и растворитель имидазол (12 ч, 180°С).
В целом, проанализировав результаты работы, можно сделать следующие выводы: данные по синтезу полиимидных дендримеров имеют фрагментарный характер, а синтетические возможности подобных полимеров ограничены труднодоступностью мономеров АВ2-типа.
СВЕРХРАЗВЕТВЛЕННЫЕ ПОЛИМЕРЫ
Сверхразветленные (СВР) полимеры в отличие от дендримеров – это статистически ветвящиеся макромолекулы, в структуре которых помимо дендритных и терминальных, имеются случайным образом расположенные линейные (l) (неполностью замещенные) звенья. Для описания топологической структуры подобных соединений используется термин степень разветвленности DB [36]. Она рассчитывается как отношение общего количества дендритных d и терминальных t фрагментов к суммарному содержанию дендритных, терминальных и линейных фрагментов:
К СВР-полимерам относят полимеры, у которых DB = 0.4–0.6, тогда как для дендримеров этот параметр строго равен 1.0.
Важной отличительностью структурной особенностью СВР-полимеров является наличие в их макромолекулах большого количества оставшихся реакционных групп, способных к дальнейшим полимераналогичным превращениям. Интерес к этим объектам связан прежде всего с возможностью их использования в качестве полимерных носителей функциональных материалов.
СВР-полимеры могут иметь функциональные свойства, близкие к свойствам дендримеров, однако отсутствие строгой пространственной упорядоченности и, как правило, широкое молекулярно-массовое распределение являются недостатками СВР-полимеров. Но данный недостаток искупается колоссальным преимуществом СВР-полимеров – возможностью их синтеза в одну стадию.
Синтез СВР-полиимидов с использованием схемы АВn
Пионерские работы в области получения СВР-полиимидов выполнены H.R. Kricheldorf и M.-A. Kakimoto. В работе [37] автополиконденсацией синтезирован сложный СВР-полиэфир, содержащий имидные циклы, на основе мономера ABn-типа.
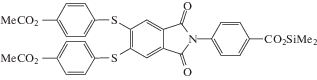
По близкой схеме в работе [38] был получен простой СВР-полиэфир с имидными циклами.
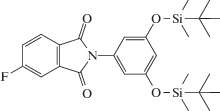
В работах [39, 40] описан первый успешный синтез СВР-полиимидов на основе AB2-мономера с концевыми аминогруппами.
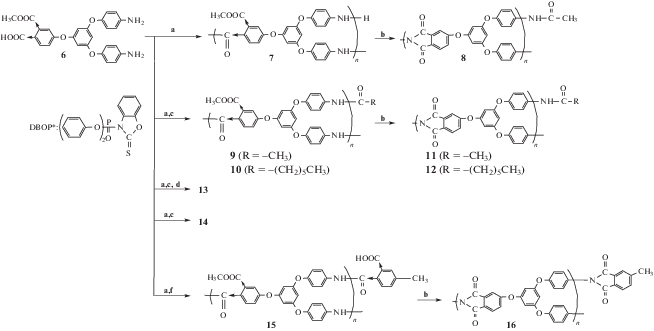
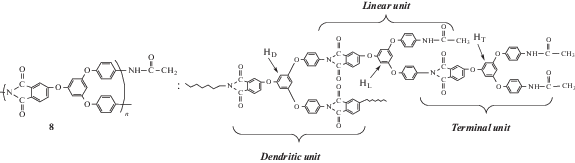
AB2-мономер – моноалкиловый эфир 4-[3,5-бис-(4-аминофенокси)фенокси]фталевой кислоты был получен многостадийным синтезом исходя из 3,5-диметоксифенола.Обращает на себя внимание то обстоятельство, что ангидридная группа мономера AB2 переведена в латентную сложноэфирную форму. Синтез СВР-полиимидов осуществляли двустадийным методом. На первой стадии прямой автополиконденсацией мономера АВ2 в присутствии конденсирующего агента дифенилового эфира (2,3-дигидро-2-тиоксо-3-бензоксазолил)фосфониевой кислоты (DBOP) – был получен СВР-полиамидоэфир. Далее для синтеза СВР-полиимидов проводили его химическую имидизацию.
Аналогично были получены СВР-полиимиды с концевыми ангидридными группами из мономера A2B-типа [41].
Синтез СВР-полиимидов с использованием схемы A 2+Bn
Мономеры ABn-типа для синтеза ПИ труднодоступны в связи с многостадийным синтезом и высокой реакционной способностью функциональных групп. В связи с этим для синтеза СВР-полиимидов наибольшие перспективы имеет подход A2+Bn.
Впервые данный подход использован в работе [42].
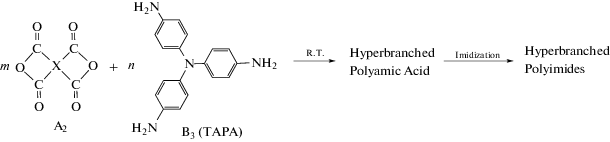
СВР-полиимиды были получены двустадийным методом в ДМАА с последующей химической имидизацией. Чтобы избежать начального гелеобразования, синтез проводили при низкой концентрации исходных веществ и медленном смешении. Были получены две серии СВР-полиимидов: с концевыми аминогруппами, при этом к раствору трис-(4-аминофенил)амина медленно добавляли ароматические диангидриды, соотношение мономеров составляло 1 : 1; вторая серия полимеров с концевыми ангидридными группами была получена при медленном добавлении трис-(4-аминофенил)амина к раствору диангидрида и соотношении исходных мономеров 1 : 2.
M.-A. Kakimoto с сотрудниками сравнили два метода получения СВР полиимидов с концевыми ангидридными группами по схеме A 3+B2 [43].
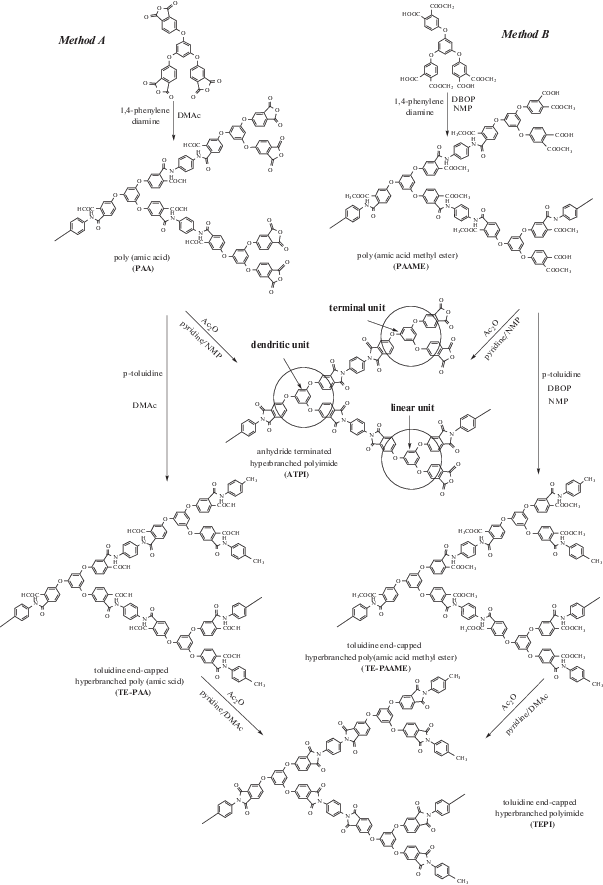
Первый метод – компонент А3 находится в ангидридной форме; при этом используют традиционный двустадийный способ через образование полиамидокислоты (метод А). Во втором методе ангидридные группы мономера A3 переводили в сложноэфирную форму и с использованием конденсирующего агента дифенил(2,3-дигидро-2-тиоксо-3-бензоксазолил)фосфоната проводили реакцию получения полиамидоэфира (метод B). Было показано, что применение компонента А3 в форме метилового эфира позволяет добавлять 1,4-фенилендиамин одной порцией без гелеобразования на начальной стадии при низкой концентрации мономеров (не более 0.1 г/мл). При концентрации более 0.1 г/мл образуется гель. При двустадийном способе в ДМАА с использованием А3 в ангидридной форме необходимо порционное добавление 1,4-фенилендиамина,чтобы избежать гелеобразования на начальной стадии.
В работе [44], меняя мольное соотношение исходных триамина и ангидрида, была получена серия СВР-полиимидов с аминными и ангидридными концевыми группами: высокотемпературной одностадийной полициклизацией в растворе в N-метилпирролидоне и двустадийным способом через образование преполимера ПАК.
Известны работы по использованию мономеров для синтеза СВР-полиимидов с разной реакционной способностью функциональных групп. Так, в работе [45] авторы использовали N',N'-бис-(4-аминофенил)-4-(трет-бутил)бензол-1,3-диамин, одна аминогруппа которого менее реакционноспособна, и ароматические диангидриды.
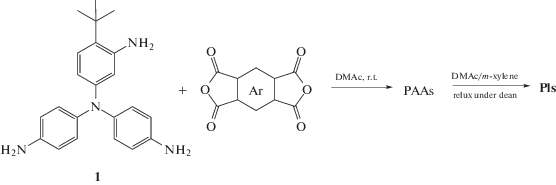
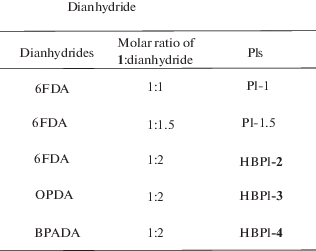
При мольном соотношении 1:1 и 1:1.5 исходных мономеров образуется линейный продукт, при мольном соотношении 1:2 происходит образование сильноразветвленных и сверхразветвленных полиимидов (DP = 0.39–0.45).
В последнее время появились работы по получению СВР-полиимидов по схеме A 2+B4, позволяющей синтезировать макромолекулы с большим количеством функциональных групп.
Так, S. Guan и соавторы [46] получили СВР-полиимиды с концевыми ангидридными группами на основе предварительно синтезированного тетрамина 4,4-ди[3,5-ди(2-трифторметил-4-аминофенокси]сульфона и так называемых “шарнирных” диангидридов (с двумя и более шарнирными кислородными мостиками):
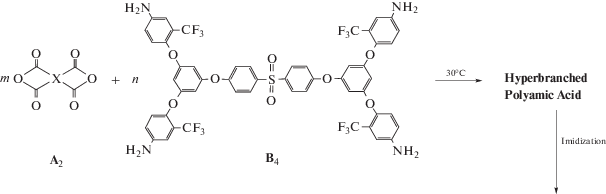
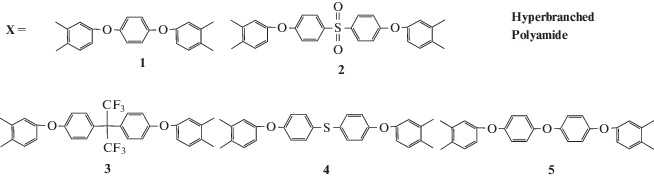
При использовании подхода A2+B4 в отличие от системы A2+B3 необходим тщательный контроль кинетики процесса в связи с возможностью гелеобразования на более низких конверсиях для расчета точки гелеобразования при взаимодействии двух мономеров разной функциональности при произвольном соотношении сомономеров [47]:
(2)
${{{\alpha }}_{{\text{A}}}}{{{\alpha }}_{{\text{B}}}}({{\bar {f}}_{{w{\text{A}}}}} - 1)({{\bar {f}}_{{w{\text{B}}}}} - 1) = 1,$Обращает на себя внимание тот факт, что в литературе по СВР-полиимидам, полученным с использованием схемы A 2+B4, не приводятся данные по степеням разветвления. При расчете DB в подобных системах необходимо учитывать наличие одного терминального, одного дендритного и двух типов линейных фрагментов.
Тем не менее, указанные работы послужили отправной точкой для резкого возрастания работ в области синтеза СВР-полиимидов по схеме A 2 + Bn.
Синтез СВР-полиимидов не ограничивается схемами AB n, A2+B3 и A2+B4, для получения таких объектов используют также более сложные схемы AB 2+AB [48], A2+B2B'+B2 [49–51] и т.д.
Из рассмотренных работ можно выделить основные условия для успешного получения СВР-полиимидов традиционными методами с использованием схемы A 2+Bn: низкую концентрацию исходных мономеров (не более 0.1 г/мл); медленное добавление одного мономера к раствору другого; перевод функциональных групп в латентную форму. Кроме того, при получении СВР-полиимидов двустадийным методом с использованием термической имидизации ПАК возникает проблема обратимости реакции образования ПАК, приводящей к неопределенной структуре конечного продукта.
ЗВЕЗДООБРАЗНЫЕ ПОЛИМЕРЫ
Звездообразные полимеры имеют широкий спектр потенциальных применений. Структура звездообразных полимеров может быть очень разнообразна. Центральное ядро может быть как низкомолекулярным [52], так высокомолекулярным соединением различной архитектуры [53]. Лучи могут быть гомополимерной [54] или блок-сополимерной природы [55]. Лучи могут различаться также по химической природе [56], длине [57] (так называемые “mictoarm” stars), типу концевых групп [58] и т.д. Благодаря компактной форме макромолекул и меньшей степени переплетения полимерных цепей они демонстрируют лучшую растворимость по сравнению с линейными аналогами.
Наиболее изучены полимерные звезды, полученные в рамках подхода “corefirst” (“прививка на”) методами контролируемой цепной полимеризации на полифункциональном инициаторе-ядре [59–62]. Они имеют узкое ММР (<1.1).
Возможность использования ступенчатых процессов для получения звездообразных полимеров впервые была продемонстрирована P. Flory [63] на примере реакции тетра- и октафункциональных кислот с ε-капролактамом (в данном случае реализуется схема B n+AB'). ε-Капролактам в ходе реакции переходит ε-аминокапроновую кислоту – мономер АВ. P. Flory теоретически показал, что индекс полидисперсности n-лучевой звезды должен быть равен 1 + 1/n, где n – функциональность разветвляющего центра. В более поздних работах было показано, что данное условие справедливо в случае только 100%-ного превращения [64].
Интересно, что звезды с узкодисперсным ММР (<2) могут быть получены из готовых цепей с одной концевой реакционной группой по методу “armfirst”. Это можно объяснить с позиций теории вероятности [65, 66]. Так, при объединении в звезде f-числа лучей с полидисперсностью, равной двум, индекс полидисперсности звездообразных полимеров будет меньше двух. В более общем случае зависимость между показателями полидисперсности конечной звезды и исходных прививаемых к ядру цепей может быть выражена уравнением
(3)
$\frac{{{{M}_{w}}}}{{{{M}_{n}}}} = 1 + \frac{1}{f}\left( {\frac{{{{M}_{{w,~arm}}}}}{{{{M}_{{n,~arm}}}}} - 1} \right),$В работе [67] для получения звездообразных полимеров использован метод синтеза по схеме B n+AB' по механизму так называемой“цепной” поликонденсации:
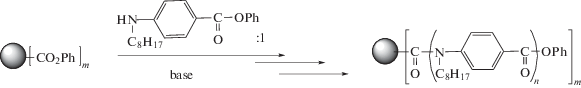
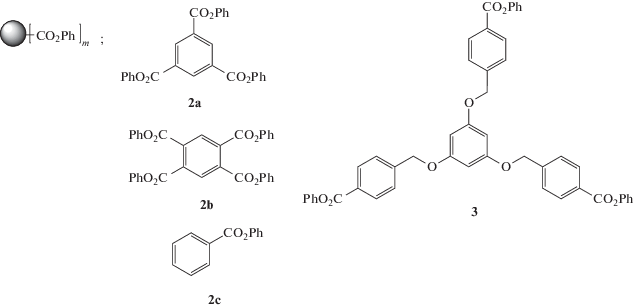
Авторами подобраны мономеры А'В', которые не активны в реакции автополиконденсации, но могут присоединяться к активным группам трехфункционального ядра, причем в ходе присоединения концевая группа присоединившегося мономерного звена активируется за счет мезомерного эффекта и способна присоединять следующее звено АВ, реализуя рост от ядра.
По другому варианту реакцию наращивания лучей проводят в двухфазной системе, содержащей два несмешивающихся раствора, причем мультифункциональный инициатор Bn (не обязательно активный), находится в одной фазе (рабочей), а мономер АВ'– в другой. Из-за низкой растворимости в рабочей фазе текущая концентрация мономера АВ' в любой момент времени мала по сравнению с концентрацией Bn. Но постепенно весь мономер АВ' расходуется в реакции ступенчатого роста лучей “от ядра” с образованием звезды. Скорость транспорта мономера АВ' из одной фазы в другую контролируется добавлением разного количества комплексообразователя – краун-эфира, что обеспечивает попадание в реакционную зону мономера с необходимой скоростью.
Синтез звездообразных полиимидов
Звезды с лучами из полиимидов впервые были получены T. Takeichi и J.K. Stille в 1986 г. [68]. Авторы использовали подход Bn+(A2+B2), согласно которому сначала получали ПАК с концевыми ангидридными группами, используя мольное соотношение диангидрид 3,3',4,4'-бензофенонтетракарбоновой кислоты и 4,4-оксидианилина 2 : 1. Далее к образовавшейся ПАК добавляли 1,3,5-трис(4-аминофенокси)бензол, в соотношении 6 : 1 и, используя азеотропную отгонку воды с толуолом, осуществляли имидизацию. Для большинства работ по синтезу звездообразных полиимидов характерно использование подхода Bn+(A2+B2) вместо предложенной Флори схемы B n+AB'. Очевидно, такие объекты нельзя однозначно отнести к звездообразным полимерам, поэтому авторы используют термин “star-branched”, т.е. “звездообразно-разветвленные”.
В работе [69] получили серию звездообразно-разветвленных полиимидов и сополиимидов с концевыми ангидридридными группами на основе 4,4'-оксидианилина, п-фенилендиамина и диангидрида 3,3',4,4'-бис-фенилтетракарбоновой кислоты и разветвляющего агента 2,2-бис-[4-(2,4-диаминофенокси)фенил]гексафторпропана по схеме B 4+(A2+B2)
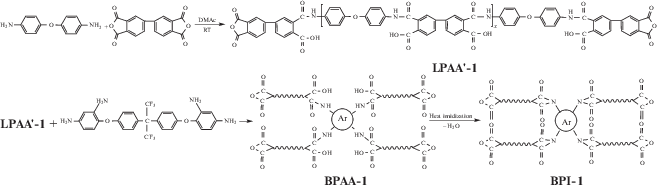
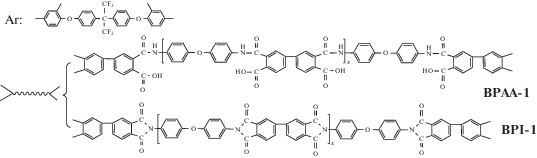
Синтез тетралучевых звездообразно-разветвленных полиимидов осуществляли двустадийным методом in situ. На первой стадии синтезировали ПАК с концевыми ангидридными группами, а затем добавляли тетрафункциональный амин. Полученную полиамидокислоту отливали на стеклянную поверхность и проводили термическую имидизацию; конечные продукты представляли собой гибкие прозрачные пленки.
При использовании в качестве ядра СВР-полимера с функциональными группами в рамках подхода armsfirst возникают сложности, связанные с наличием некоторого числа концевых функциональных групп СВР-полимера, взаимодействие с которыми стерически затруднено. В работе [70] были получены звездообразные полимеры по методу “armsfirst”: к сверхразветвленному полиимидному ядру с концевыми ангидридными группами прививали полиэтиленоксидные лучи с одной OH-группой или олигомер с двумя аминогруппами. По данным ЯМР 1H, было показано, что степень прививки полиэтиленоксидных лучей к полиимидному ядру составляла от 44 до 69%. В обоих случаях показатель полидисперсности был достаточно высокий – от 7.5 до 24. Такое широкое молекулярно-массовое распределение связано, по всей видимости, с неполной конверсией по концевым ангидридным группам свехразветвленного полиимидного ядра.
Анализ литературы по полиимидным звездам показывает, что на данный момент для получения этих объектов используют только схему B n+(A2+B2), что приводит к образованию звездообразно-разветвленных полиимидов с широким молекулярно-массовым распределением. Также при синтезе двустадийным методом часто не учитывают возможность протекания побочной реакции – деструкции ПАК, которая имеет место при получении линейных полиимидов термической имидизацией ПАК и может привести к расширению молекулярно-массового распределения [71]. В связи с этим принципиально важным моментом является выбор метода синтеза звездообразных полиимидов, который был бы лишен данного недостатка.
ПРИМЕНЕНИЕ ПОЛИИМИДОВ РАЗВЕТВЛЕННОЙ СТРУКТУРЫ
Известно применение разветвленных ПИ для получения газоразделительных и протонопроводящих мембран, основанное на предположении о том, что звездообразная и сверхразветвленная структура должна приводить к увеличению свободного объема и таким образом служить фактором, способствующим проницаемости для молекул и ионов.
Так, К. Friess с сотрудниками [72] использовали СВР-полиимиды на основе диангидрида 6F, триаминотрифенилметана и полидиметилсилоксана с концевыми аминогруппами для газоразделительных мембран. Мембраны, полученные из данных СВР-полиимидов в смеси с мезопористыми кремнеземными частицами, обладали селективностью для пары CO2/CH4 достигающей 23.3 [73]. Q. Wang с сотрудниками [74] получили мембраны на основе диангидрида 6F, триаминопиримидина в качестве разветвляющего центра и B2B' мономера, 4,4'-оксидианилина как гибкоцепного фрагмента и 5-амино-2-(4-аминофенил)бензоксазола в качестве жесткоцепного фрагмента:
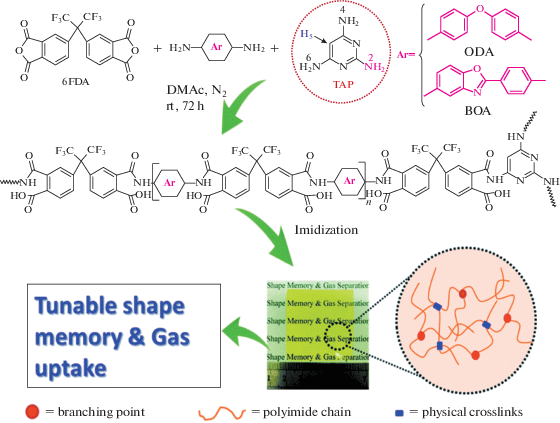
Полученные пленки обладали памятью формы, сорбционной емкостью для CO2, достигающей 36.93 см3/г и сорбционной селективностью для пары CO2/N2, равной 66. В работе показано, что свойства материалов можно варьировать за счет соотношения гибких и жестких звеньев.
В работе [75] синтезировали серию звездообразных полиимидов с ядром из полиэдрического силсесквиоксана (POSS) и полиимидными лучами с целью получения материала с низкими диэлектрическими постоянными. Авторы работы [70] использовали в качестве ядра СВР-полиимид, а лучей – полиэтиленоксид; такие гибридные звездообразные полиимиды интересны для потенциального применения в газоразделительных мембранах.
Разветвленные полиимиды с сульфогруппами или в комбинации с полимерами, содержащими эти группы, являются перспективными в качестве протонопроводящих мембран. B. Liu с сотрудниками [76] использовали смесь СВР-полиимидов с концевыми аминогруппами и сульфонированным PEEK для получения протонопроводящих мембран с проводимостью 0.12–0.16 См/см при 100°C. При этом по сравнению с исходным сульфонированным PEEK введение СВР-полиимида способствует улучшению физико-механических свойств. Звездообразные полимеры с ядром из СВР-полиимида используют в качестве мембран для топливных элементов [77]. Для получения таких звездообразных полиимидов предварительно синтезируют СВР-полиимидов по схеме B 3+А2 на основе диангидрида 6F и трис-(4-аминофенил)амин, полученный СВР-полиимид по каплям добавляют к раствору линейных ПИ с концевыми ангидридными группами разной молекулярной массы, полученным из дианигидрида 1,4,5,8-нафталинтетракарбоновой кислоты и 4,4'-диамино-бифенил-2,2'-дисульфоновой кислоты. Поскольку в качестве ядра использовали СВР-полиимид с большим количеством функциональных аминогрупп, полученные звездообразные полиимиды представляли собой объекты со структурой ядро–оболочка. В работе было показано, что с увеличением длины лучей гидрофильного фрагмента (М × 10–3 = 320, 500 и 830 по ПС-стандартам) проводимость мембраны возрастала (0.34, 0.46 и 0.51 см/см соответственно; для сравнения, Nafion обладает проводимостью 0.15 см/см).
СВР-полиимиды благодаря высокой функциональности, вариативности структуры и развитой 3D-топологии являются привлекательными объектами для создания на их основе устройств для хранения информации “сандвичного” типа, в которых полимерный слой находится между двумя электродами. В таких объекта химидное кольцо – электроноакцепторный фрагмент, а роль донора электронов могут выполнять трифениламинные, карбазольные, сульфосодержащие и другие фрагменты. Спонтанное образование комплексов с переносом заряда уменьшает пороговое значение напряженности поля, при котором возникает электрическая проводимость.
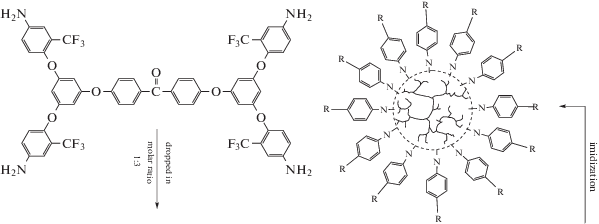
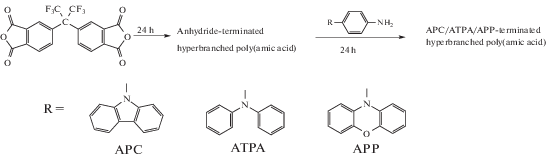
В работе [78] показана возможность использования СВР-полиимидов в качестве материалов, имеющих потенциальное применение как устройства для хранения информации. Были получены СВР-полиимиды с концевыми ангидридными группами, по которым в дальнейшем шла модификация макромолекул с различными концевыми фрагментами, такими как порфириновые [79], ферроценовые [80] и ароматическими с концевыми группами [81]:
Полимеры с фрагментами трифениламина – привлекательные объекты для создания солнечных батарей, органических светодиодов и т.д. Синтез СВР-полимеров является удобным способом для создания материалов с большим количеством трифениламинных фрагментов. Так, в работе [82] получены электроактивные СВР-полиимиды по схеме
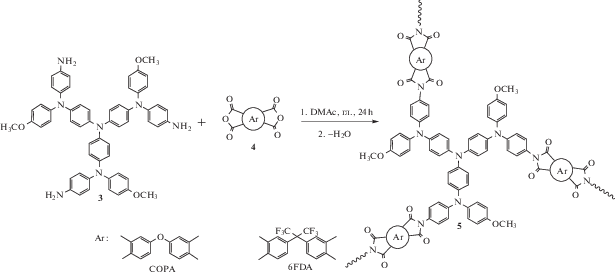
Полученные полимеры обладали высоким оптическим контрастом (63% при 443 нм), низким временем отклика (2.6 с/1.9 с при 443 нм), высокой интенсивностью окрашивания (196 см2 С–1 при 443 нм), исключительной стабильностью и воспроизводимостью характеристик в условиях многократного переключения. Модификация определенными соединениями разветвленных ПИ позволяет использовать их в биомедицинских целях. Полученный в работе [83] СВР-поли-имид, модифицированный 2-метакрилоилоксиэтил фосфорилхолином обладает биосовместимостью, антикоагулянтными и антибактериальными свойствами:
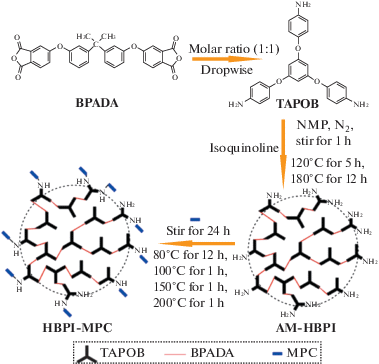
Данные СВР-полиимиды могут быть перспективными как материалы для клеточной инженерии.
Еще одним многообещающим направлением является использование СВР-полиимидов в качестве гетерогенных катализаторов. Так, авторы работы [84] функционализировали СВР-полиимиды на основе пиромеллитового диангидрида и триаминофенилбензола TEMPO-группами. Полученный полимер оказался эффективным гетерогенным катализатором аэробного окисления бензилового спирта. После фильтрования и рецикла катализатор оставался активным.
В работах [68, 85] предложено использовать звездообразные олигоимиды с концевыми эндиковыми фрагментами в качестве термоотверждаемых олигомеров с низкой вязкостью расплава для получения сшитых полиимидных матриц.
ИСПОЛЬЗОВАНИЕ ОДНОСТАДИЙНОЙ ВЫСОКОТЕМПЕРАТУРНОЙ ПОЛИКОНДЕНСАЦИИ В РАСПЛАВЕ БЕНЗОЙНОЙ КИСЛОТЫ ДЛЯ СИНТЕЗА РАЗВЕТВЛЕННЫХ ПОЛИИМИДОВ
Синтез сильно- и сверхразветвленных полиимидов
Возможность получения СВР-полиимидов с использованием метода одностадийной высокотемпературной каталитической поликонденсации продемонстрирована нами в 2005 г. [86, 87]. СВР-полиимид был синтезирован автополициклоконденсацией мономера АВ2 4,5-бис-(3-аминофенокси)фталевой кислоты
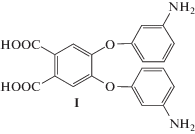
в каталитически активном растворителе – расплавленной бензойной кислоте при 140–160°С.
Первоначально расплав бензойной кислоты был предложен нами в качестве нетоксичного и экологически чистого растворителя для одностадийного синтеза гомо- и статистических сополиимидов линейного строения [88, 89]; впоследствии круг ПИ, получаемых этим способом, был значительно расширен [90].
Сополициклоконденсацией в расплаве бензойной кислоты мономера I с 3-аминофеноксифталевой кислотой
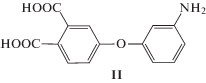
по схеме АВ2+АВ получены также разветвленные со-ПИ с разным соотношением дендритных и линейных фрагментов [87]: Синтез мономера I осуществляли последовательным замещением 3-бром-4-нитрофталодинитрила 3-(N-ацетиламино)фенолятом калия сначала по нитрогруппе, затем по атому брома с последующим омылением цианогрупп до карбоксильных и снятием ацильной защиты с аминогруппы [86, 91]. Мономер II получали по реакции активированного нуклеофильного нитрозамещения 4-нитрофталодинитрила с 3-ацетиламинофенолятом калия с последующим омылением нитрильных групп и снятием ацильной защиты с атома азота [91].
Продукты (со)полициклоконденсации мономеров I и II в расплаве бензойной кислоты были выделены в виде аморфных порошков полиимидного строения с логарифмической вязкостью ηlog = 0.11–0.13 (СВР поли-I) и 0.12–0.35 дл/г (сополи-I+II) и температурой стеклования 230–260°С.
Предполагаемый механизм автополициклоконденсации аминофеноксифталевых кислот в расплаве бензойной кислоты [92] подобен механизму образования линейных полиимидов из диаминов и диангидридов [93]. Согласно данным ИК-спектроскопии, мономер II в кристаллическом состоянии находится в латентной цвиттер-ионной форме. При его растворении в расплаве бензойной кислоты (140°С) он переходит в “открытую” форму. Далее происходит дегидратация фрагмента фталевой кислоты до ангидрида, который вступает с аминогруппой в реакцию автополиконденсации с образованием карбоксиамидных звеньев, с их последующей in situ имидизацией. Выделяющаяся при имидизации вода в данных условиях легко удаляется из реактора с током инертного газа, что делает процесс необратимым. Длительность всего процесса получения ПИ составляет 1–3 ч; продуктом является полностью имидизованный высокомолекулярный полиэфиримид.
Хотя эффективная реакционная способность гетеромономеров АВ и АВ2 в процессе автополициклоконденсации ниже, чем для соответствующих пар А2+В2 из-за взаимного дезактивирующего влияния реакционных групп, можно полагать, что кинетические закономерности процесса синтеза СВР-полиимидов и сильно разветвленных полиимидов не должны существенно отличаться от таковых для схемы А2+В2. Специфическим отличием высокотемпературного синтеза ПИ в бензойной кислоте от синтеза в “инертных” растворителях является тот факт, что стадия образования ПАК из сомономеров в данных условиях кинетически исчезает. Это происходит из-за низких значений констант равновесия стадии образования–распада амидокислотных звеньев (Kр = = 10–20 л/моль [93]) в сочетании с мощным катализом прямой и обратной реакции образования–распада ПАК бензойной кислотой по бифункциональному механизму. В результате равновесная степень полимеризации цепи на стадии образования ПАК не превышает 3–5, причем вследствие катализа она достигается практически мгновенно, и брутто-скорость процесса определяется скоростью имидизации звеньев ПАК. Реакция имидизации в таких условиях необратима, поскольку пары воды, выделяющейся при имидизации, эффективно удаляются из системы с током инертного газа. Таким образом, замена инертного высококипящего растворителя на каталитический (расплав бензойной кислоты) переводит весьма медленный процесс роста полиимидной цепи в режим быстрой и необратимой реакции, причем в сравнительно мягких условиях. Благодаря этому синтез в расплаве бензойной кислоты в целом может быть оценен как удобный и универсальный способ для получения ПИ разного химического строения [90].
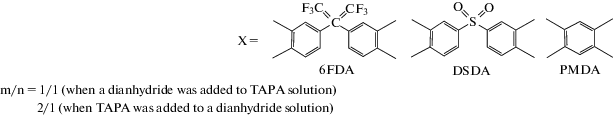
В работах [94–96] синтез сильноразветвленных ПИ проводили по схеме (Вn+А2), где n = 3 [94, 95] или 4 [96] при мольном соотношении 1 : 1 по мономерам. В качестве разветвляющих агентов (Bn) использовали три- или тетрафункциональные мономеры дисульфат 1,3,5-триаминотолуола (структура III), 2,4,6-трис-(4-аминофенокси)-толуол (структура IV), 1,4-бис-(3,5-диаминофенокси)бензол (ТАФБ, структура V), а также диамидотетраамины 4,4'-бис-(3,5-диамино-N-3,5-бензамидо)оксидифенил (VI) и 9,9'-бис-[4-(3,5-ди-амино-N-3,5-бензамидо)фенилфлуорен] (VII), полученные на основе диаминобензойной кислоты и оксидианилина или анилинфлуорена:
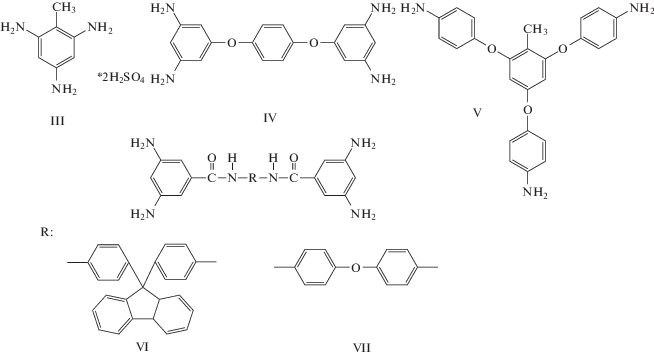
Для подбора условий процесса образования сильно разветвленных ПИ проводили модельную реакцию триамина III с фталевым ангидридом, за ходом процесса наблюдали по выделению воды. Через 1.5 ч после начала реакции с количественным выходом был выделен 2,4,6-трис-фталимидтолуол [94]. Это указывает на то, что все три аминогруппы мономера III принимают участие в процессе циклоконденсации. В структуре всех других разветвляющих агентов независимость реакционной способности обеспечивается тем, что аминогруппы по отношению друг к другу находятся либо в мета-положении, либо в разных ароматических фрагментах.
Триамин V и тетраамин IV получены конденсацией тринитробензола с гидрохиноном и 1,4-гидроксибензолом соответственно с последующим восстановлением нитрогрупп [94, 96], тетраамины VI, VII – конденсацией N-BOC-дизамещенных производных 3,5-диаминобензойной кислоты с 4,4'-оксидианилином и 9,9-дианилинфлуореном с последующим снятием защитных групп [97]. В качестве мономеров А2 использовали 2,2-пропилиден-бис-(1,4-фенилен-окси)дифталевый ангидрид (ДАА), 2,2-гексафторпропилидендифталевый ангидрид (ДА 6F).
Полициклоконденсацией мономеров III–VII по схеме В3+А2, B4+А2 в расплаве бензойной кислоты синтезированы сильноразветвленные ПИ как c аминными, так и с ангидридными концевыми группами. Для получения последних [94] использовали триангидрид, предварительно полученный конденсацией III c ДАА в расплаве бензойной кислоты в условиях большого избытка ДАА. Сильное уширение полос в спектре ЯМР С13 не позволило определить степень ветвления.
Наличие в макромолекуле сильно разветвленных ПИ концевых аминогрупп подтверждено результатами анализа продуктов их обработки уксусным ангидридом. В спектрах обработанных сильно разветвленных ПИ исчезают сигналы протонов аминогрупп и появляются сигналы ацетамидных фрагментов в области 10.1 м.д. (N–H) и 2.0 м.д. (СН3). Данные интегрирования сигналов соответствуют ожидаемой структуре. Синтезированные сильно разветвленные ПИ растворимы в амидных растворителях и в ДМСО, имеют Мw = = (2–5) × 104 (по полистирольным стандартам) и полидисперсность существенно выше двух. Они являются аморфными высокомолекулярными соединениями с температурой стеклования, зависящей от структуры исходных мономеров и природы концевых групп. Так для сильно разветвленных ПИ на основе ТАФБ-ДАА с аминными концевыми группами температура стеклования составляет 190°С, с ацетамидными и фталимидными – 220°С, а для сильно разветвленных ПИ на основе ТАФБ-6F c фталимидными группами – 254°С.
Синтез звездообразных олигоимидов
Интересными объектами с точки зрения возможности использования их в качестве полимерных носителей являются звездообразные олигоимиды с концевыми реакционными группами. Возможность их получения в расплаве бензойной кислоты по схемам В3+АВ', В4+АВ' продемонстрирована нами в работах [97–99]. В качестве центрального мультифункционального ядра использованы три- и тетраамины III–VI. В качестве исходного мономера АВ' было взято соединение II. Синтез звездообразных олигоимидов проводили в режиме медленного добавления АВ' к мультифункциональному “ядру”, растворенному в расплаве бензойной кислоты (БК). Схема процесса получения трехлучевых полиимидных звезд звездообразного олигоимида IV с концевыми аминогруппами представлена ниже.
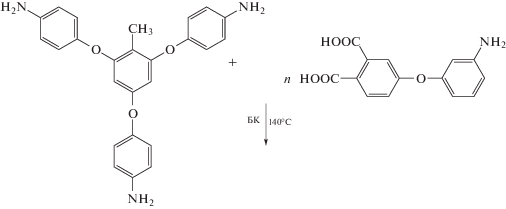
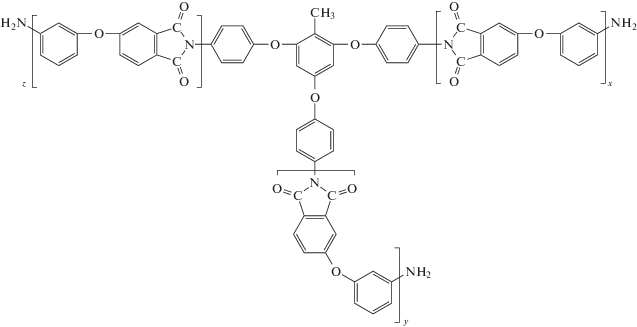
Полученные звездообразные олигоимиды являются полностью имидизованными олигомерами, что подтверждается появлением в их ИК-спектрах характерных полос поглощения имидного цикла. Они растворимы в хлороформе, ДМСО и амидных растворителях.
На рис. 1 приведены хроматограммы ГПХ синтезированных образцов звездообразных олигоимидов при разном соотношении мономеров II:IV. Как видно, кривые имеют унимодальный характер и смещаются в сторону больших ММ при увеличении мольного соотношения АВ :Bn. Обращает на себя внимание тот факт, что образцы характеризуются узким ММР (табл. 1). Это может быть следствием либо реализации механизма роста лучей “corefirst” (от ядра), либо эффектом сужения ММР звезды по сравнению с ММР присоединяющихся цепей, предсказанного Флори для механизма роста цепи “armsfirst” (прививка цепей), вытекающего из статистического анализа (см. раздел “Звездообразные полимеры”).
Рис. 1.
Хроматограммы ГПХ звездообразных олигоимидов с разной длиной луча звездообразных олигоимидов на основе мономера II и тетраамина IV при их соотношении 10 (1), 20 (2), 40 (3) и 100 (4).
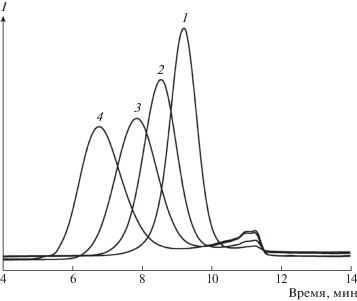
Таблица 1.
Молекулярно-массовые характеристики трехлучевых звездообразных олигомеров
| Соотношение II : IV | Mw | Mn | Мw/Mn |
|---|---|---|---|
| 10 | 13 145 | 11 570 | 1.13 (1.08)⁕ |
| 20 | 19 794 | 15 180 | 1.3 (1.08)⁕ |
| 40 | 29 180 | 16 860 | 1.73 (1.16)⁕ |
| 100 | 53 349 | 20 720 | 2.57 (1.17)⁕ |
Все образцы звездообразных олигоимидов содержат небольшой максимум в низкомолекулярной части хроматограммы ГПХ, отнесенный к низкомолекулярным циклическим олигомерам, которые в небольшом количестве могут образоваться из соответствующих линейных олигомеров – продуктов автополициклоконденсации мономера II.
Путем обработки звездообразных олигоимидов эндиковым ангидридом получены звездообразные олигоимиды с эндиковыми концевыми фрагментами, из которых методом горячего прессования были получены механически прочные пленки с температурой стеклования 210–250°С, нерастворимые в органических растворителях.
ЗАКЛЮЧЕНИЕ
По изложенному материалу можно сделать следующие выводы.
Идея использования химического дизайна для комбинирования в одном материале характеристик полиимидов как химического класса полимеров (химическая, тепло-, термо-, фото- и радиационная стойкость, огнезащищенность и т.д.) с характеристиками, которые привносит разветвленная архитектура макромолекул (низкая вязкость, возможность размещения функциональных групп, большой свободный объем и т.д.) является безусловно плодотворной, поскольку такое сочетание дает возможность получения новых функциональных материалов с уникальным комплексом свойств.
Из обзора следует, что к настоящему времени синтезировано большое разнообразие полиимидов разветвленного и дендритного строения. Однако по количеству публикаций сильно разветвленные полиимиды пока значительно уступают сильно разветвленным полимерам других химических классов. По-видимому, это связано с тем, что при синтезе сильно разветвленных полиимидов встречаются дополнительные технические проблемы – труднодоступность разветвляющих агентов, наличие, как правило, двух и более технологических стадий, обратимость стадии образования ПАК, опасность гелирования реакционной системы и связанная с этим необходимость использования мономеров в латентной форме и при низких концентрациях, зависимость результатов от режима введения компонентов. В связи с этим главным итогом большинства представленных работ по синтезу полиимидных сильно разветвленных полимеров и полимерных звезд являются не свойства конечных продуктов, а скорее демонстрация искусства преодоления авторами указанных выше трудностей.
Представленный в разделе “Использование одностадийной высокотемпературной поликонденсации в расплаве бензойной кислоты для синтеза разветвленных полиимидов” подход к синтезу разветвленных полиимидов методом одностадийной полициклоконденсации мономера АВ2 или по схемам В3+А2, B4+A2, B3+AB', B4+AB' в расплаве бензойной кислоты, с нашей точки зрения, вносит заметный вклад в развитие рассматриваемой тематики. Этот подход позволяет проводить процесс в одну стадию, с высокой скоростью и при высокой концентрации исходных мономеров; он экологически безопасен, универсален и имеет хороший потенциал для дальнейшего развития. Такие преимущества позволяют прогнозировать возможность применения синтезированных реакционных звездообразных и сильно разветвленных макромолекул в качестве платформы для получения новых функциональных полимерных материалов. Достоинством звездообразных макромолекул, получаемых указанным методом, является хороший структурный контроль и узкое ММР при возможности размещения в олигомере трех–четырех реакционных групп. Для сверхразветвленных и сильно разветвленных полиимидов структурный контроль хуже, ММР продуктов более широкое, но есть огромное преимущество – простота синтеза и возможность размещения в макромолекуле существенно большего количества реакционных групп, особенно для полиимидов, полученных по схеме В4+А2. Такие объекты могут быть использованы в качестве мультифункциональных ядер для получения полимерных наночастиц структуры ядро–оболочка, полимерных носителей для катализаторов, для конструирования материалов с нелинейно-оптическими свойствами, для получения блок-сополимерных звезд, многофункциональных сшивающих агентов и т.д.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта 19-03-00820А).
Список литературы
Irzhak V.I. // Russ.Chem. Revs. 2006. V. 75. № 10. P. 919.
Peleshanko S., Tsukruk V.V. // Progr. Polym. Sci. 2008. V. 33. № 5. P. 523.
Таганов Н.Г. // Высокомолек. соед. А. 1981. Т. 23. № 12. С. 2772.
Hadjichristidis N., Pitsikalis M., Pispas S., Iatrou H. // Chem. Revs. 2001. V. 101. № 12. P. 3747.
Sheiko S.S., Sumerlin B.S., Matyjaszewski K. // Progr. Polym. Sci. 2008. V. 33. № 7. P. 759.
Muzafarov A.M., Rebrov E.A. // J. Polym. Sci., Polym. Chem. 2008. V. 46. № 15. P. 4935.
Lo S.-C., Burn P.L. // Chem. Revs. 2007. V. 107. № 4. P. 1097.
Smith D.K., Hirst A.R., Love C.S., Hardy J.G., Brignell S.V., Huang B. // Progr. Polym. Sci. 2005. V. 30. № 3. P. 220.
Tomalia D.A. // Progr. Polym. Sci. 2005. V. 30. № 3. P. 294.
Matyjaszewski K. // Progr. Polym. Sci. 2005. V. 30. № 8. P. 858.
Tomalia D.A., Fréchet J.M.J. // J. Polym. Sci., Polym. Chem. 2002. V. 40. № 16. P. 2719.
Freire J.J. Conformational Properties of Branched Polymers: Theory and Simulations. Berlin; Heidelberg: Springer, 1999.
McLeish T.C.B., Allgaier J., Bick D.K., Bishko G., Biswas P., Blackwell R., Blottière B., Clarke N., Gibbs B., Groves D.J., Hakiki A., Heenan R.K., Johnson J.M., Kant R., Read D.J., Young R.N. // Macromolecules. 1999. V. 32. № 20. P. 6734.
Perny S., Allgaier J., Cho D., Lee W., Chang T. // Macromolecules. 2001. V. 34. № 16. P. 5408.
Li Y.-G., Shi P.-J., Pan C.-Y. // Macromolecules. 2004. V. 37. № 14. P. 5190.
Velis G., Hadjichristidis N. // Macromolecules. 1999. V. 32. № 2. P. 534.
Voit B.I., Lederer A. // Chemical Reviews. 2009. V. 109. № 11. P. 5924.
Kuchanov S., Slot H., Stroeks A. // Progr. Polym. Sci. 2004. V. 29. № 6. P. 563.
Gao C., Yan D. // Progr. Polym. Sci. 2004. V. 29. № 3. P. 183.
Kim Y.H., Webster O. // J. Macromol. Sci. C. 2002. V. 42. № 1. P. 55.
Jikei M., Kakimoto M.-A. // Progr. Polym. Sci. 2001. V. 26. № 8. P. 1233.
Kricheldorf H.R., Vakhtangishvili L., Schwarz G. // J. Polym. Sci., Polym. Chem. 2004. V. 42. № 22. P. 5725.
Kwak S.-Y., Lee H.Y. // Macromolecules. 2000. V. 33. № 15. P. 5536.
Gauthier M., Moeller M. // Macromolecules. 1991. V. 24. № 16. P. 4548.
Trollsås M., Hedrick J.L. // J. Am. Chem. Soc. 1998. V. 120. № 19. P. 4644.
Tomalia D.A., Hedstrand D.M., Ferritto M.S. // Macromolecules. 1991. V. 24. № 6. P. 1435.
Schramm O.G., Pavlov G.M., Van Erp H.P., Meier M.A.R., Hoogenboom R., Schubert U.S. // Macromolecules. 2009. V. 42. № 6. P. 1808.
Buhleier E., Wehner W., Vögtle F. // Synthesis. 1978. V. 1978. № 02. P. 155.
Tomalia D.A., Baker H., Dewald J., Hall M., Kallos G., Martin S., Roeck J., Ryder J., Smith P. // Polym. J. 1985. V. 17. № 1. P. 117.
Newkome G.R., Yao Z., Baker G.R., Gupta V.K. // J. Org. Chem. 1985. V. 50. № 11. P. 2003.
Ozerin A.N., Svergun D.I., Volkov V.V., Kuklin A.I., Gordelyi V.I., Islamov A.K., Ozerina L.A., Zavorotnyuk D.S. // J. Appl. Crystallogr. 2005. V. 38. № 6. P. 996.
Leu C.-M., Chang Y.-T., Shu C.-F., Teng C.-F., Shiea J. // Macromolecules. 2000. V. 33. № 8. P. 2855.
Leu C.-M., Shu C.-F., Teng C.-F., Shieab J. // Polymer. 2001. V. 42. № 6. P. 2339.
Hsieh C.-W., Chen Y.-H., Jeng R.-J., Dai Sh.-A. // Adv. Mater. Res. 2013. V. 716. P. 438.
Toma F.M., Puntoriero F., Pho T.V., La Rosa M., Jun Y.-Si, Tremolet de Villers B.J., Pavlovich J., Stucky G.D., Campagna S., Wudl F. // Angew. Chem. 2015. V. 54. № 23. P. 6775.
Hawker C.J., Lee R., Frechet J.M.J. // J. Am.Chem. Soc. 1991. V. 113. № 12. P. 4583.
Kricheldorf H.R., Bolender O., Wollheim T. // High Performance Polymers. 1998. V. 10. № 3. P. 217.
Orlicki J.A., Thompson J.L., Markoski L.J., Sill K.N., Moore J.S. // J. Polym. Sci., Polym. Chem. 2002. V. 40. № 8. P. 936.
Yamanaka K., Jikei M., Kakimoto M.-A. // Macromolecules. 2000. V. 33. № 4. P. 1111.
Yamanaka K., Jikei M., Kakimoto M.-A. // Macromolecules. 2000. V. 33. № 19. P. 6937.
Hao J., Jikei M., Kakimoto M.-A. // Macromolecules. 2003. V. 36. № 10. P. 3519.
Fang J., Kita H., Okamoto K.-I. // Macromolecules. 2000. V. 33. № 13. P. 4639.
Hao J., Jikei M., Kakimoto M.-A. // Macromolecules. 2002. V. 35. № 14. P. 5372.
Li Q., Xiong H., Pang L., Li Q., Zhang Y., Chen W., Xu Z., Yi C. // High Performance Polymers. 2014. V. 27. № 4. P. 426.
Yi L., Wu X., Shu C., Huang W., Yan D. // Polymer. 2017. V. 133. P. 171.
Liu S., Zhang Y., Wang X., Tan H., Song N., Guan S. // RSC Adv. 2015. V. 5. № 130. P. 107793.
Иржак В.И. Архитектура полимеров. М.: Наука, 2012.
Markoski L.J., Thompson J.L., Moore J.S. // Macromolecules. 2000. V. 33. № 15. P. 5315.
Chen Y., Zhang Q., Sun W., Lei X., Yao P. // J. Membr. Sci. 2014. V. 450. P. 138.
Peter J., Khalyavina A., Kříž J., Bleha M. // Eur. Polym. J. 2009. V. 45. № 6. P. 1716.
Peter J., Kosmala B., Bleha M. // Desalination. 2009. V. 245. № 1. P. 516.
Ye W., Wei W., Fei X., Lu R., Liu N., Luo J., Zhu Y., Liu X. // J. Appl. Polym. Sci. 2017. V. 134. № 2. P. 44384.
Knischka R., Lutz P.J., Sunder A., Mülhaupt R., Frey H. // Macromolecules. 2000. V. 33. № 2. P. 315.
Shi Z., Guo F., Tan R., Niu H., Li T., Li Y. // Polym. Chem. 2017. V. 8. № 9. P. 1449.
McKenzie T.G., Ren J.M., Dunstan D.E., Wong E.H.H., Qiao G.G. // J. Polym. Sci., Polym. Chem. 2016. V. 54. № 1. P. 135.
Khanna K., Varshney S., Kakkar A. // Polym. Chem. 2010. V. 1. № 8. P. 1171.
Gao H., Matyjaszewski K. // Macromolecules. 2006. V. 39. № 21. P. 7216.
Sudo Y., Kawai R., Sakai H., Kikuchi R., Nabae Y., Hayakawa T., Kakimoto M.-A. // Langmuir. 2018. V. 34. № 2. P. 653.
Ren J.M., McKenzie T.G., Fu Q., Wong E.H.H., Xu J., An Z., Shanmugam S., Davis T.P., Boyer C., Qiao G.G. // Chem. Revs. 2016. V. 116. № 12. P. 6743.
Jagur-Grodzinski J. // J. Polym. Sci., Polym. Chem. 2002. V. 40. № 13. P. 2116.
Uchiyama M., Satoh K., Kamigaito M. // Macromolecules. 2015. V. 48. № 16. P. 5533.
Braunecker W.A., Matyjaszewski K. // Progr. Polym. Sci. 2007. V. 32. № 1. P. 93.
Schaefgen J.R., Flory P.J. // J. Am. Chem. Soc. 1948. V. 70. № 8. P. 2709.
Yan D., Zhou Z., Jiang H., Wang G. // Macromol. Theory Simulations. 1998. V. 7. № 1. P. 13.
Burchard W. Solution Properties of Branched Macromolecules. Berlin; Heidelberg: Springer, 1999.
Gao H. // Macromol. Rapid Commun. 2012. V. 33. № 9. P. 722.
Sugi R., Hitaka Y., Yokoyama A., Yokozawa T. // Macromolecules. 2005. V. 38. № 13. P. 5526.
Takeichi T., Stille J.K. // Macromolecules. 1986. V. 19. № 8. P. 2093.
Wu F., Zhou X., Yu X. // RSC Advances. 2017. V. 7. № 57. P. 35786.
Yin Y., Yang L., Yoshino M., Fang J., Tanaka K., Kita H., Okamoto K.-I. // Polym. J. 2004. V. 36. № 4. P. 294.
Камзолкина Е.В., Нечаев П.П., Маркин В.С., Выгодский Я.С., Григорьева Т.В., Заиков Г.Е. // Докл. АН СССР. 1974. V. 219. № 3. С. 650.
Sysel P., Patrova A., Lanc M., Friess K. // e-Polymers. 2018. V. 18. № 2. P. 105.
Lanč M., Sysel P., Šoltys M., Štěpánek F., Fónod K., Klepić M., Vopička O., Lhotka M., Ulbrich P., Friess K. // Polymer. 2018. V. 144. № P. 33.
Yang Z., Wang Q., Wang T. // J. Mater. Chem. A. 2017. V. 5. № 26. P. 13823.
Seçkin T., Köytepe S., Adıgüzel H.İ. // Mater. Chem. Phys. 2008. V. 112. № 3. P. 1040.
Wang P., Wu X., Zhang H., You K., Liu Z., Liu B. // Chem. J. Chinese Univ. 2018. V. 39. № P. 405.
Suda T., Yamazaki K., Kawakami H. // J. Power Sources. 2010. V. 195. № 15. P. 4641.
Yu H., Liu H., Tan H., Yao H., Song Y., Zhu S., Song N., Zhang B., Guan S. // Dyes Pigments. 2018. V. 158. P. 97.
Tan H., Yu H., Yao H., Song Y., Zhu S., Tian Y., Liu H., Guan S. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 17. P. 1953.
Tan H., Yu H., Song Y., Zhu S., Zhang B., Yao H., Guan S. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 5. P. 505.
Tan H., Yu H., Yao H., Song Y., Zhu S., Song N., Shi K., Zhang B., Guan S. // Dyes Pigments. 2018. V. 151. P. 179.
Sun N., Meng S., Zhou Z., Chao D., Yu Y., Su K., Wang D., Zhao X., Zhou H., Chen C. // Electrochim. Acta. 2017. V. 256. P. 119.
Li Q., Li J., Liao G., Xu Z. // J. Mater. Sci., Mater. Medicine. 2018. V. 29. № 8. P. 126.
Nabae Y., Kakimoto M.-A. // Polymers. 2018. V. 10. № 12. P. 1344.
Nguyen B.N., Eby R.K., Meador M.A. NASA Glenn Research Center. 1999. 2 p.
Кузнецов А.А., Бузин П.В., Яблокова М.Ю., Абрамов И.Г., Смирнов А.В. Пат. 2260017 Россия. 2004.
Кузнецов А.А., Бузин П.В., Яблокова М.Ю., Абрамов И.Г., Смирнов А.В. Пат. 2260016 Россия. 2004.
Лавров С.В., Берендяев В.И., Котов Б.В., Кузнецов А.А. Пат. 2070210 Россия. 1992.
Kuznetsov A.A. // High Performance Polymers. 2000. V. 12. № 3. P. 445.
Kuznetsov A.A., Tsegelskaya Y.A. Synthesis of Polyimides in the Melt of Benzoic Acid. IntechOpen, 2019.
Кузнецов А.А., Бузин П.В., Яблокова М.Ю., Абрамов И.Г., Смирнов А.В. 2259352 Россия. 2003.
Buzin P.V., Yablokova M.Y., Kuznetsov A.A., Smirnov A.V., Abramov I.G. // High Performance Polymers. 2004. V. 16. № 4. P. 505.
Kuznetsov A.A., Tzegel’skaya A.Y., Buzin P.V. // Polymer Science A. 2007. V. 49. № 11. P.1157.
Akimenko S.N., Perov N.S., Semenova G.K., Shakhnes A.K., Shevelev S.A. // Polymer Science B. 2014. V. 56. № 1. P. 41.
Chukova S.N., Shakhnes A.K., Perov N.S., Krasovskii V.G., Shevelev S.A., Kuznetsov A.A. // Russ. Chem. Bull. 2015. V. 64. № 2. P. 473.
Tsegelskaya A., Dutov M., Serushkina O., Semenova G., Kuznetsov A. // Macromol. Symp. 2017. V. 375. № 1. P. 1600202.
Tsegelskaya A.Y., Soldatova A., Semenova G., Dutov M., Abramov I., Kuznetsov A. // Polymer Science B. 2019. V. 61. № 2. P. 148.
Soldatova A., Tsegelskaya A.Y., Semenova G., Abramov I., Kuznetsov A. // Russ. Chem. Bull. 2018. V. 67. № 11. P. 2152.
Kuznetsov A.A., Soldatova A.E., Tokmashev R.Y., Tsegelskaya A.Y., Semenova G.K., Shakhnes A.K., Abramov I.G. // J. Polym. Sci., Polym. Chem. 2018. V. 56. № 17. C. 2004.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)


