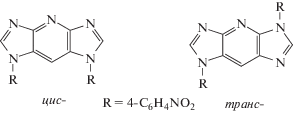Высокомолекулярные соединения (серия С), 2020, T. 62, № 2, стр. 220-227
НОВЫЕ ПОЛИМЕРЫ, СОДЕРЖАЩИЕ ЗВЕНЬЯ N-ФЕНИЛЕНБЕНЗИМИДАЗОЛА И N-ФЕНИЛЕНДИИМИДАЗОПИРИДИНА, ДЛЯ ПРОТОНПРОВОДЯЩИХ МЕМБРАН ТОПЛИВНЫХ ЭЛЕМЕНТОВ
И. И. Пономарев 1, Д. Ю. Разоренов 1, *, В. А. Муравьева 1, К. М. Скупов 1, Ю. А. Волкова 1, Ив. И. Пономарев 1, М. М. Ильин 1, Е. М. Чайка 1
1 Институт элементоорганических соединений имени А.Н. Несмеянова Российской академии наук
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: razar@ineos.ac.ru
Поступила в редакцию 19.02.2020
После доработки 30.04.2020
Принята к публикации 15.05.2020
Аннотация
Впервые синтезирован ряд сополимеров на основе 5(6),5′(6′)-бис-(бензимидазол)оксида, 1,7-дигидродиимидазо[4.5-b:4'.5'-e]пиридина и 4,4′-дифторбензофенона. Изучены закономерности синтеза, молекулярно-массовые и термические характеристики сополимеров. Полимеры обладают хорошими пленкообразующими свойствами, поэтому на их основе путем допирования ортофосфорной кислотой получены протонпроводящие мембраны. Для оптимального набухания мембран в фосфорной кислоте установлен режим термической “сшивки” исходных пленок. Измерена протонная проводимость мембран, достаточная для их использования в среднетемпературных водородно-воздушных топливных элементах.
ВВЕДЕНИЕ
Ароматические гетероциклические полимеры – полигетероарилены (ПГА) имеют множество высокотехнологичных применений в передовых областях науки и техники. Одним из актуальных, важных и востребованных является использование ПГА в составе протонпроводящих мембран водородно-воздушных топливных элементов. В среднетемпературных водородно-воздушных топливных элементах подобные мембраны, представляющие собой комплексы полимеров с фосфорной кислотой, могут работать при повышенных значениях температуры (120–200°С), что увеличивает эффективность платиновых катализаторов и позволяет применять в качестве топлива более доступный риформинговый водород, загрязненный оксидом углерода [1–8].
Для протонпроводящих мембран среднетемпературных топливных элементов важным параметром значится не только высокая протонная проводимость, но и способность удерживать фосфорную кислоту в условиях работы мембранно-электродного блока [6]. В мембранах полибензимидазольного и полипиридинового типа фосфорная кислота удерживается за счет взаимодействия с атомами азота, поэтому можно предположить, что увеличение количества азота в элементарном звене полимера будет способствовать лучшему ее удержанию, но при условии выполнения некоторых требований, выдвигаемых к мембране: механической прочности, термо- и хемостойкости.
Синтез полимеров реакцией нуклеофильного ароматического замещения имеет преимущества перед традиционным поликонденсационным синтезом в среде полифосфорной кислоты и реагента Итона [9, 10]. Тогда вместо канцерогенных и химически нестойких тетраминов применяют заранее синтезированные гетероциклические мономеры, имеющие в своем составе функциональные группы –NH– [11–17]. В случае использования таких мономеров в цепи конечного ПГА отсутствуют недоциклизованные звенья, а поликонденсация протекает при высоких значениях концентрации в рекуперируемых органических растворителях. Осаждение полимера после синтеза осуществляется водой и не сопровождается образованием большого количества кислотных стоков, как это происходит при получении полибензимидазола традиционными методами в среде полифосфорной кислоты или реагента Итона [9, 10].
Ранее [18] был разработан новый метод синтеза мономера – 1,7-дигидродиимидазо[4.5-b:4'.5'-e]пиридина (ДИП) методом восстановительной гетероциклизации 2,3,5,6-тетрааминопиридина в среде муравьиной кислоты. Следует отметить, что на синтез ДИП в литературе имеются лишь три ссылки [19–21], причем достоверно его строение подтверждается методом ЯМР‑спектроскопии только в работе [21].
Для установления возможности использования ДИП в качестве мономера была подробно исследована модельная реакция нуклеофильного ароматического замещения групп –NH– ДИП4‑нитрофторбензолом [18]. Потенциал использования ДИП-звеньев в составе ПГА заключается в том, что он содержит пять атомов азота, которые могут участвовать в образовании полимер-электролитного комплекса с ортофосфорной кислотой. Модельная реакция протекает с высоким выходом и образованием смеси цис- и транс-изомеров в соотношении 7 : 3 (схема 1). Кристаллическая структура и их пространственное строение установлены методом РСА, позволяя тем самым оценить вклад соответствующих звеньев в конформацию основной цепи синтезируемых полимеров.
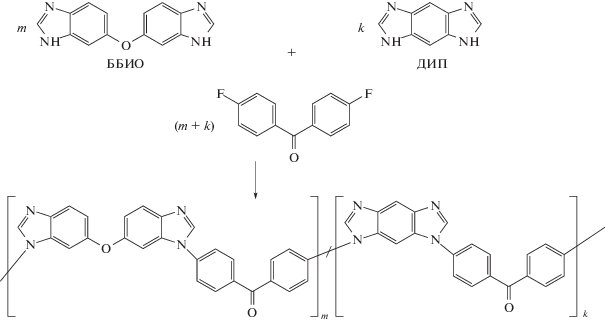
Несмотря на то, что модельная реакция протекает с высоким выходом, первые попытки осуществить синтез гомополимера с использованием ДИП и 4,4′-дифторбензофенона в качестве мономеров не привели к образованию высокомолекулярных пленкообразующих полимеров. Поэтому было решено провести синтез ряда сополимеров с использованием сомономера 5(6),5′(6′)-бис-(бензимидазол)оксида, на основе которого ранее [16, 17] уже были синтезированы полимеры, пригодные для получения протонпроводящих мембран.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
1,7-Дигидродиимидазо[4.5-b:4'.5'-e]пиридин получали из 2,6-диамино-3,5-динитропиридина восстановительной гетероциклизацией по описанной методике [18] в форме моногидрата, и затем сушили в вакууме при 180°С до безводной формы. 5(6),5′(6′)-Бис-(бензимидазол)оксид (ББИО) синтезировали по методике [16] из 3,3′,4,4′-тетрааминодифенилового эфира. 4,4′-Дифторбензофенон, N,N-диметилацетамид, N-метилпирролидон и ортофосфорную кислоту производства “Sigma-Aldrich” использовали без дополнительной очистки. K2CO3 измельчали в ступке и прогревали при 160°С в течение 4 ч в шкафу с циркуляцией воздуха:
В предварительно прокаленную при 160°С в течение 1 ч с K2CO3 (0.003 моля) двугорлую колбу помещали навеску гетероциклических мономеров в количестве 0.002 моля. Мольное соотношение ББИО : ДИП для полимеров 1–7 (табл. 1) варьировали c шагом в 10%: 100 : 0, 90 : 10, 80 : 20, 70 : 30, 60 : 40, 50 : 50 и 0 : 100 соответственно. К мономерам добавляли 1 мл растворителя ДМАА, после чего смесь нагревали до 60°С в токе аргона при диспергировании в ультразвуковой бане в течение 30 мин. Затем вводили 1 мл толуола и при перемешивании повышали температуру до 100°С на 30 мин для удаления следов воды из реакционной смеси в виде азеотропа. Далее добавляли 4,4′-дифторбензофенон (0.002 моля), поднимали температуру до 140°С и продолжали синтез в течение 8 ч. Реакционную массу разбавляли 5 мл N-метилпирролидона, осаждали горячей дистиллированной водой. Выпавший осадок очищали, промывали на фильтре горячей водой и экстрагировали в аппарате Сокслета смесью этанол : ацетон = = 1 : 1 по объему в течение 3 ч. Полимеры сушили в вакууме при температуре 80°С в течение 3 ч.
Таблица 1.
Характеристики сополимеров 1–3
| Полимер, № | Доля ББИО, % | Доля ДИП, % | Вязкость, дл/г | Mn × 10–3 | Mw × 10–3 |
|---|---|---|---|---|---|
| 1 | 100 | – | 1.52 | 54 | 112 |
| 2 | 90 | 10 | 1.15 | 43 | 96 |
| 3 | 80 | 20 | 0.57 | 26 | 58 |
| 4 | 70 | 30 | 0.52 | – | – |
| 5 | 60 | 40 | 0.20 | – | – |
| 6 | 50 | 50 | 0.39 | – | – |
| 7 | – | 100 | 0.15 | – | – |
Спектры ЯМР полимеров регистрировали на приборе “Bruker Avance 400” в виде растворов в смеси CF3COOD:D2O (5:1 по массе). Термомеханический анализ выполняли на приборе “UIP‑70M” (СССР) при постоянном давлении 0.1 МПа и скорости подъема температуры 2.5 град/мин. Динамический термогравиметрический анализ осуществляли на приборе “Derivatograph-C” (“MOM”, Венгрия) на навесках ∼12 мг при скорости подъема температуры 5 град/мин. Приведенные значения вязкости полимеров измеряли в 98% серной кислоте при концентрации 0.5 г/дл при температуре 25°С.
Молекулярную массу и молекулярно-массовое распределение полимеров измеряли методом ГПХ на жидкостном хроматографе фирмы “Knauer” (Германия) с термостатированием колонки при 25°С. Применяли колонку фирмы “Phenomenex–Phenogel” (300 × 7.8 мм, 5 мкм) 10E4 Å, наполненную сополимером стирола с дивинилбензолом, рабочий диапазон М = (5–500) × × 103; для калибровки колонки задействовали ПС-стандарты. В качестве растворителя для исследуемых полимеров, а также элюента для ГПХ использовали N-метилпирролидон. Расход элюента составлял 1 мл/мин. Расчет ММ характеристик полимеров осуществляли при помощи программно-аппаратного комплекса “Экохром” (Россия).
Пленки сополимеров отливали на стекло из растворов в 90% муравьиной кислоте с концентрацией 0.1 г/мл и выдерживали при 40°C в течение суток для испарения растворителя. Для определения оптимальной температуры “сшивки” пленки прогревали в термошкафу с циркуляцией воздуха в следующем режиме: нагревание в течение 1 ч до заданной температуры (200–350°C), выдерживание 4 ч, затем охлаждение в течение 1 ч до комнатной температуры. Растворимость пленок в ортофосфорной кислоте определяли при температуре 160°C. Допирование пленок осуществляли в 85% ортофосфорной кислоте при комнатной температуре. Для полученных таким образом мембран двухточечным методом вычисляли поперечную протонную проводимость на потенциостате с измерителем импеданса “Elins Z500 PRO” в потенциостатическом режиме. Проводимость устанавливали в диапазоне температуры 25–200°C с шагом 10°C.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Ряд полимеров 1–7, синтезированных методом ароматического нуклеофильного замещения, представлен в табл. 1. Все полученные полимеры растворимы в 90% НСООН, однако их растворимость в N-метилпирролидоне с повышением содержания ДИП снижается, поэтому методом ГПХ молекулярно-массовые характеристики были определены только для образцов 1–3. Значения приведенной вязкости для полимеров 4–7 с ростом содержания ДИП уменьшаются, что, возможно, свидетельствует о снижении их молекулярных масс. Можно предположить, что в процессе синтеза фракция полимера с бόльшим содержанием ДИП быстрее теряет растворимость, и взаимодействие концевых групп с новыми порциями мономеров, сольватированных на поверхности поташа, происходит уже в условиях осадительной поликонденсации.
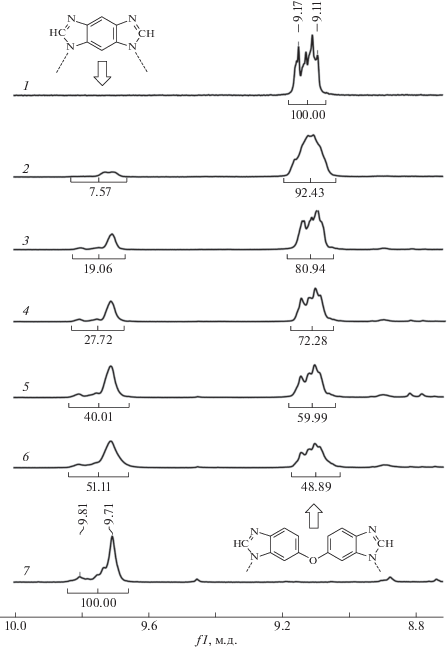
Химическое строение и состав сополимеров подтверждаются методом спектроскопии ЯМР 1Н. Спектр ЯМР 1H гомополимера 1 (100% ББИО) содержит следующие сигналы δ: 9.20–9.08 (m, 2H), 8.20–7.97 (m, 4H), 7.88–7.59 (m, 6H), 7.47–7.25 (m, 4H); гомополимера 7 (100% ДИП) сигналы δ: 9.86–9.67 (m, 2H), 8.62–8.54 (m, 1H), 7.88–7.59 (m, 6H), 7.47–7.25 (m, 4H). В спектрах сополимеров 2–6 происходит наложение сигналов от разных звеньев, но в области 9.9–8.9 м.д. проявляются характерные сигналы –СH= протонов имидазольных гетероциклов, по соотношению интегральных интенсивностей которых можно судить о взаимосвязи звеньев ББИО–ДИП (рис. 1).
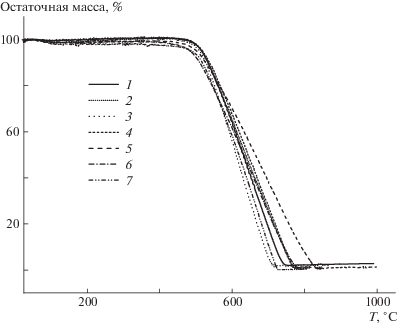
Термогравиметрический анализ (рис. 2) полученных полимеров на воздухе показал, что температура 5%-ной потери массы для всего ряда сополимеров выше 480°С, а интенсивное разложение происходит в области 600°С.
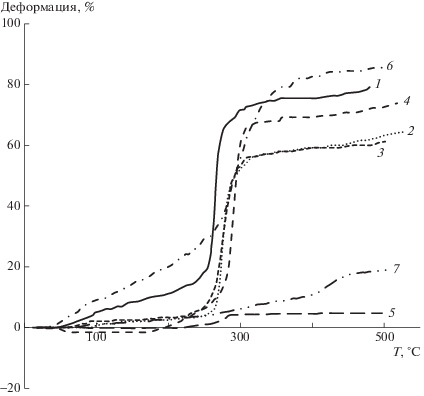
Теплостойкость полимеров была исследована методом ТМА. Термомеханические кривые сополимеров представлены на рис. 3. Можно отметить, если для гомополимера 1 температура размягчения находится около 250°С, то при появлении в цепи сополимера даже 10% звеньев ДИП, в сополимере 2 эта температура поднимается на 10°С выше. Дальнейшее увеличение содержания звеньев ДИП в сополимерах влечет повышение температуры размягчения. Для сополимеров 3–6 оно происходит в интервале температуры 260–282°С. Гомополимер 7 (100% ДИП), в котором отсутствуют “гибкие звенья” ББИО, размягчается выше 410°С. Особенности формы термомеханических кривых и наблюдаемые различия величины деформаций можно объяснить отличием размеров, плотности упаковки и внешнего вида порошков полимеров, полученных при осаждении, – от волокон и шариков до сильно электризующихся после сушки хлопьев и мелких порошков, особенно для сополимеров с большим содержанием ДИП.
Высокая термостойкость и хорошие термомеханические характеристики сополимеров обеспечивают возможность их длительной эксплуатации в экстремальных условиях, в том числе в качестве мембран среднетемпературных топливных элементов.
Для полимеров 1–7 была изучена способность к пленкообразованию. Пленки отливались из растворов в 90%-ной муравьиной кислоте и концентрации полимеров 0.1 г/мл (рис. 4). Муравьиная кислота, по нашему наблюдению, не является оптимальным растворителем для получения пленок, предназначенных для производства мембран, но в данном случае она позволила получить растворы и сравнить пленки из всего ряда сополимеров 1–7.
Для наиболее высокомолекулярных полимеров 1–3 с содержанием ДИП от 0 до 20% были получены прочные и эластичные пленки, пригодные для изготовления протонпроводящих мембран. Пленки 1–3 подвергались термической “сшивке” на воздухе, после которой они теряли растворимость в ортофосфорной кислоте (табл. 2).
Таблица 2.
Увеличение массы при допировании пленок 1–3 , полученных при различной температуре “сшивки”, ортофосфорной кислотой
| Температура прогревания на воздухе, °С | Увеличение массы пленок (1–3) при допировании с содержанием ДИП, % | Растворимость в H3PO4 | ||
|---|---|---|---|---|
| 0 (1) | 10 (2) | 20 (3) | ||
| 200 | – | – | – | растворяется |
| 250 | – | – | – | растворяется |
| 300 | 920 | 866 | 1600 | набухает избыточно |
| 320 | 510 | 514 | 520 | набухает оптимально |
| 350 | 464 | 450 | 516 | набухает ограниченно |
В отличие от множества других полибензимидазолов, для “сшивки” которых необходима предварительная обработка пленок разбавленной серной кислотой, применение солей циркония [22], алкилирующих агентов, например α,α′-ди-бром-п-ксилола [23], или введение в состав мембран дополнительных полимеров с ионогенными группами [24 ] , в данном случае никаких дополнительных реагентов не требуется. Так, при прогревании выше 300°С пленки теряют растворимость в ортофосфорной кислоте, набухают с увеличением линейных размеров и не растворяются даже при нагревании до 160°С. Механизм сшивки данных сополимеров, вероятно, связан с взаимодействием карбонильных групп с гетероциклами с образованием “мостиков” между цепями полимеров. Температура “сшивки” пленок, при которой происходит оптимальное набухание мембран, составляет 320°С (рис. 5).
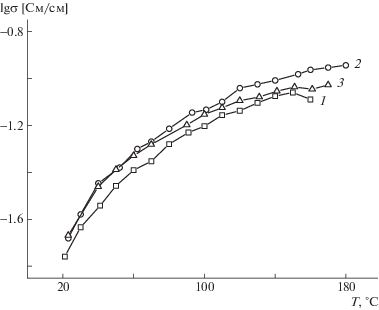
Для допированных на 510–520% пленок была исследована их протонная проводимость при разной температуре (рис. 6). Видно, что сополимерам 2 и 3, содержащим 10 и 20% звеньев ДИП соответственно, присуща несколько более высокая протонная проводимость по сравнению с гомополимером 1 (100% ББИО). Максимальной протонной проводимостью обладают мембраны сополимера 2 (10% ДИП), которая при 180°С достигает 113 мСм/см, что располагается на уровне лучших высокотемпературных протонпроводящих мембран, описанных в литературе [1, 2].
ЗАКЛЮЧЕНИЕ
Впервые синтезированы полимеры на основе 5(6),5′(6′)-бис-(бензимидазол)оксида, 1,7-дигидродиимидазо[4.5-b:4'.5'-e]пиридина и 4,4′-дифторбензофенона, а также изучены закономерности синтеза и характеристики полученных сополимеров. Из некоторых сополимеров получены мембраны, подобран режим термической “сшивки” для оптимального набухания в фосфорной кислоте. Протонная проводимость нескольких образцов лежит на уровне лучших высокотемпературных протонпроводящих мембран, описанных в литературе, что позволяет рассчитывать на их использование в среднетемпературных водородно-воздушных топливных элементах.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 18-13-00421). Исследования ЯМР-спектров проведены при поддержке Министерства науки и высшего образования Российской Федерации с использованием научного оборудования Центра исследования строения молекул ИНЭОС РАН.
Коллектив авторов благодарит А.А. Лысову (ИОНХ РАН) за измерения протонной проводимости мембран, М.И. Бузина (ИНЭОС РАН) за термогравиметрический анализ сополимеров и О.И. Артюшина (ИНЭОС РАН) за помощь в регистрации ЯМР-спектров.
Список литературы
Li Q., Jensen J.O. // Membranes for Energy Conversion / Ed. by K.V. Peinemann, S. Pereira-Nunes. Weinheim: Wiley, 2008. P. 61. V. 2
Li Q., Aili D., Hjuler H.A., Jensen J.O. High Temperature Polymer Electrolyte Membrane Fuel Cells, Approaches, Status and Perspectives. Cham; Heidelberg; New York; Dordrecht; London: Springer, 2016.
Borup R., Meyers J., Pivovar B., Kim Y.S., Mukundan R., Garland N., Myers D., Wilson M., Garzon F., Wood D., Zelenay P., More K., Stroh K., Zawodzinski T., Boncella J., McGrath J.E., Inaba M., Miyatake K., Hori M., Ota K., Ogumi Z., Miyata S., Nishukata A., Siroma Z., Uchimoto Y., Yasuda K., Kimijima K., Iwashita N. // Chem. Rev. 2007. V. 107. P. 3904.
Araya S.S., Zhou F., Liso V., Sahlin S.L., Vang J.R., Thomas S., Gao X., Jeppesen C., Kaer S.K. // Int. J. Hydrogen Energy. 2016. V. 41. P. 21310.
Chandan A., Hattenberger M., El-kharouf A., Du S., Dhir A., Self V., Pollet B.G., Ingram A., Bujalski W. // J. Power Sources. 2013. V. 231. P. 264.
Seel D.C., Benicewicz B.C., Xiao L., Schmidt T.J. // Handbook of Fuel Cells – Fundamentals, Technology and Applications / Ed. by W. Vielstich, H. Yokokawa, H.A. Gasteiger. Hoboken: Wiley, 2009. P. 1. V. 5.
Zeis R. // Beilstein J. Nanotechnol. 2015. V. 6. P. 68.
Arsalis A. // Renew. Sust. Energ. Rev. 2019. V. 105. P. 391.
Fomenkov A.I., Blagodatskikh I.V., Timofeeva G.I., Ronova I.A., Ponomarev Iv.I., Volkova Yu.A., Pono-marev I.I., Khokhlov A.R. // Polymer Science B. 2008. V. 50. № 11–12. P. 345.
Fomenkov A.I., Blagodatskikh I.V., Ponomarev Iv.I., Volkova Yu.A., Ponomarev I.I., Khokhlov A.R. // Polymer Science B. 2009. V. 51. № 5–6. P. 166.
Hlil R., Matsumura S., Hay A.S. // Macromolecules. 2008. V. 41. P. 1912.
Connell J.W., Hergenrother P.M., Smith, J.G., Jr. Pat. US5410012 USA. 1995.
Connell J.W., Hergenrother P.M., Smith, J.G., Jr. Pat. US5412059. 1995.
Chang G., Yang J., Huang Y., Cao K., Zhang L. // Polym. J. 2013.V. 45. P. 1188.
Ponomarev I.I., Ponomarev Iv.I., Volkova Yu.A., Zharinova M.Y., Razorenov D.Y. // Mendeleev Commun. 2012. V. 22. P. 162.
Razorenov D.Y., Skupov K.M., Volkova Y.A., Ponomarev Iv.I., Chaika E.M., Buzin M.I., Blagodatskikh I.V., Ponomarev I.I. // Macromol. Symp. 2017. V. 375. P. 1600152.
Razorenov D.Y., Makulova S.A., Fedyanin I.V., Lysenko K.A., Skupov K.M., Volkova Y.A., Ponomarev Iv.I., Ponomarev I.I. // Mend. Comm. 2019. V. 29. P. 181.
Bredereck H., Effenberger F., Rainer G. // Liebigs Ann. Chem. 1964. V. 673. P. 82.
Guozheng Z., Ming L. // Hanneng Cailiao Chin. J. Energ. Mater. 2013. V. 21. P. 194.
Wang Z.-G., Zhu J., Zhu Z.-S., Xu J., Lu M. // Appl. Organomet. Chem. 2014. V. 28. P. 436.
Kondratenko M.S., Ponomarev I.I., Galyamov M.O., Razorenov D.Y., Volkova Y.A., Kharitonova E.P., Khokhlov A.R. // Beilstein J. Nanotechnol. 2013. V. 4. P. 481.
Valtcheva I.B., Marchetti P., Livingston A.G. // J. Membrane Sci. 2015. V. 493. P. 568.
Kerres J., Atanasov V. // Int. J. Hydrogen Energ. V. 215. P. 14723.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)