Высокомолекулярные соединения (серия С), 2022, T. 64, № 1, стр. 69-80
СИНТЕЗ, СВОЙСТВА И БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА И НАНОКОМПОЗИТОВ СЕРЕБРА НА ЕГО ОСНОВЕ
Г. Ф. Прозорова a, А. С. Поздняков a, *
a Иркутский институт химии им. А.Е. Фаворского Сибирского отделения Российской академии наук
664033 Иркутск, Фаворского ул., 1, Россия
* E-mail: pozdnyakov@irioch.irk.ru
Поступила в редакцию 05.04.2021
После доработки 08.12.2021
Принята к публикации 22.12.2021
- EDN: YPYRPS
- DOI: 10.31857/S2308114722010010
Аннотация
В обзоре обобщены сведения по синтезу и изучению физико-химических свойств и биологической активности поли-1-винил-1,2,4-триазола и нанокомпозитов с наночастицами серебра на его основе. Представлены результаты исследования антибактериальной и противоопухолевой активности полимеров и нанокомпозитов, иммуномодулирующей способности, токсичности и взаимодействия с клетками организма, а также перспективность их использования для разработки материалов медицинского назначения.
Возрастающая потребность современной медицины и фармацевтики в эффективных биологически активных материалах способствует интенсивности создания новых функциональных полимерных металлосодержащих нанокомпозитов, перспективных для разработки антибактериальных и иммуномодулирующих препаратов, систем направленной доставки контрастирующих и лекарственных средств, модификаторов и биосенсоров. Указанные материалы должны обладать такими важными свойствами, как фармакологическая активность, гидрофильность, нетоксичность, биосовместимость, устойчивость к агрессивным средам, а также возможность связывания с различными веществами, в том числе лекарственными.
Полимеры способны эффективно стабилизировать наночастицы, предотвращая их агрегацию, повышать водорастворимость и усиливать биологическую активность нанокомпозитов [1‒8]. Так, матрицами для биологически активных нанокомпозитов служат синтетические и природные полимеры ‒ поливинилпирролидон, полиакриламид, поливиниловый спирт, хитозан, арабиногалактан и другие [1, 9‒21]. При разработке высокотехнологичных материалов также большое внимание уделяется функциональным полимерам, содержащим в своем составе азотсодержащие гетероциклические фрагменты, обусловливающие многообразие практически значимых свойств. Среди азотсодержащих полимеров особый интерес представляют водорастворимые гомо- и сополимеры 1-винил-1,2,4-триазола, которые обладают целым комплексом практически важных свойств: высокая гидрофильность, растворимость в диполярных органических растворителях, способность к комплексообразованию и кватернизации, химическая стабильность, биосовместимость, термостойкость и т.д. Триазолсодержащие полимеры показывают себя эффективными стабилизирующими матрицами при формировании металлосодержащих нанокомпозитов, в которых проявляется синергизм уникальных свойств полимеров (растворимость, биосовместимость, высокая координирующая способность) и оптических, каталитических и биологических свойств наночастиц металлов [22‒25].
В связи с возникновением различных штаммов грамположительных и грамотрицательных бактерий, устойчивых к антибиотикам, все больше внимания уделяется медицинским препаратам на основе серебра. Наночастицы серебра демонстрируют антимикробную, иммуномодулирующую и противовирусную активность, выступая эффективными агентами против многих патогенных вирусов человека, таких как респираторно-синцитиальный вирус, вирус гепатита В, норовирус, вирус иммунодефицита человека, коронавирус COVID-19 и прочие [26‒28]. Биологическая активность наноразмерных частиц зависит от различных факторов, среди которых основными выступают размер, форма, концентрация и поверхностный заряд [29]. Функциональные полимеры способны обеспечить контроль параметров наноразмерной фазы и ее эффективную стабилизацию на ранних этапах формирования, что определяет свойства данных систем. Полимерные нанокомпозиты с наночастицами серебра обладают широкой биологической активностью [8‒33]. При этом требования к параметрам наночастиц металлов (размеры, морфология, агрегативная устойчивость и другие) и свойствам полимерной составляющей (лиофильность, биосовместимость, нетоксичность, химическая и термическая стойкость) неуклонно растут. В этой связи разработка новых биологически активных полимерных материалов относится к приоритетным областям исследований современной медицины.
В настоящем обзоре представлены результаты синтеза гомополимера 1-винил-1,2,4-триазола и нанокомпозитов с наночастицами серебра на его основе, а также комплексного изучения их физико-химических свойств и биологической активности.
СИНТЕЗ ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА
В большинстве случаев полимеризацию 1-винил-1,2,4-триазола (ВТ) осуществляют путем радикального инициирования в присутствии ДАК [33‒45]. Например, в работе [38] авторы исследовали кинетику радикальной полимеризации в различных растворителях (вода, ДМФА, ДМАА) методами дилатометрии, калориметрии и гравиметрии. Реакцию вели при температуре 50‒90°C, варьируя концентрацию ДАК (1 × 10‒3‒ 3 × 10‒2 моль/л) и ВТ (0.5‒0.6 моль/л). Независимо от природы растворителя кинетические кривые имели S-образный характер. Величина индукционного периода не зависит от концентрации ВТ и обратно пропорциональна концентрации инициатора, что, вероятно, является следствием ингибирования процесса полимеризации следами кислорода, который с трудом удаляется из полярных растворителей. Скорость полимеризации ВТ и молекулярной массы полимера в воде выше, чем в ДМФА и ДМАА. В диполярных растворителях скорость практически одинаковая. Авторы отмечают, что молекулярная масса образующегося при этом поли-1-винил-1,2,4-триазола (ПВТ) не зависит от концентрации инициатора. Характеристическая вязкость ПВТ, полученного в воде, в 3.5 раза выше, чем в ДМАА. Отмечено, что введение воды (более 0.05 моль/л) при полимеризации в ДМФА и ДМАА увеличивает ММ полимера. Такое поведение авторы работы [38] связывают с увеличением реакционной способности ВТ вследствие специфической сольватации мономера и растущего макрорадикала водой. Гидратация растущего полимерного радикала может влиять на его реакционную способность, уменьшая скорость реакции бимолекулярного обрыва цепи, как при полимеризации N-виниламидов [39]. Данное обстоятельство можно объяснить изменением заряда на концевом атоме углерода или присутствием гидратного слоя вблизи радикала. В результате сближение концевых радикалов, принадлежащих разным молекулярным цепям, будет затруднено из-за электростатического отталкивания одноименных зарядов или необходимостью вытеснения гидратных слоев.
Характерной особенностью радикальной полимеризации ВТ является первый порядок реакции по концентрации мономера. Порядок реакции по концентрации инициатора меняется в ряду ДМАА<Н2О<ДМФА от 1.0 до 0.8, что характерно для деградационной передачи цепи на мономер либо при ингибировании полимеризации. На основании полученных экспериментальных данных можно сделать вывод о том, что при радикальной полимеризации ВТ кинетические закономерности обусловлены как бимолекулярным, так и мономолекулярным (в бóльшей степени) механизмом гибели макрорадикалов [38].
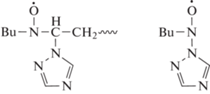
Методом ЭПР с использованием спиновой ловушки 2-метил-2-нитрозопропана (BuNO) удалось подтвердить механизм мономолекулярного обрыва растущих макрорадикалов, идентифицировав радикалы растущей цепи и 1,2,4-триазола [40]:
Проведение полимеризации в апротонном растворителе ацетонитриле в присутствии ДАК носит стационарный характер без индукционного периода с начальными значениями скорости, зависящими от концентрации реагентов и температуры. Концентрация инициатора демонстрирует дробный порядок реакции (0.5), что свидетельствует о бимолекулярном обрыве растущей цепи. В отличие от полимеризации в диполярных растворителях (ДМФА, ДМАА) и воде, в ацетонитриле наблюдается зависимость ММ полимера от концентрации инициатора. Добавление воды при полимеризации приводит к повышению скорости реакции и увеличению молекулярной массы [41].
Вследствие того что ВТ является слабым основанием (p${{K}_{{{\text{B}}{{{\text{H}}}^{ + }}}}}$ = 3.11), кинетические параметры реакции полимеризации, вероятно, будут зависеть от pH среды. Так, в работе [42] авторы показали, что скорость реакции носит экстремальный характер с минимумом pH ~ 7. Понижение pH от 7 до 3 увеличивает скорость реакции, этому способствует протонирование триазольного цикла, и, соответственно, усиливает электроноакцепторные свойства триазольного кольца и радикала растущей макромолекулы. Повышение pH от 7 до 10 также приводит к увеличению скорости полимеризации. Вероятно, такое поведение является результатом донорно-акцепторного взаимодействия пиридинового атома азота триазольного кольца с катионом щелочного металла, что, по аналогии с протонированием в кислых средах, повышает полимеризационную активность ВТ [43].
В отличие от радикальной полимеризации ВТ в водной среде, при электрохимической полимеризации скорость процесса оказывается ниже, хотя основным продуктом электролиза выступает 1-этил-1,2,4-триазол. Последний образуется гидрированием ВТ водородом, который выделяется при частичном электролизе воды. При проведении электролиза в массе и ДМФА 1-винил-1,2,4-триазол не восстанавливается до этильного производного, при этом выход ПВТ с М = (2.8‒5.3) × 105 не превышал 4%. Значительно проще электролиз ВТ проходит в присутствии легко восстанавливающихся соединений, например персульфата калия, который, как известно, используют в качестве инициатора при полимеризации винильных соединений. Введение небольшого количества данных соединений увеличивает выход полимера до 70% с М = 6 × 105.
Необходимо отметить, что полимеризация протекает как в приэлектродном слое, так и в объеме [44, 45]. В зависимости от плотности тока при электрохимической полимеризации ВТ образуются различные продукты реакции: при низкой плотности тока (до 450 мА/см2) ‒ ПВТ, при более высоких значениях плотности тока (450‒2000 мА/см2) ‒ полисопряженные структуры. Сополимеры содержат два типа звеньев, формирующиеся за счет раскрытия винильной группы и триазольного кольца:
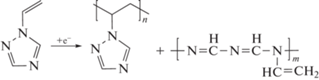
Повышение плотности тока выше 2000 мА/см2 приводит к образованию черных графитоподобных полимеров, формирующихся из-за вторичных реакций по двойным связям винильной группы [45].
Полученный при радикальной полимеризации ПВТ представляет собой белый порошок, хорошо растворимый в воде, уксусной кислоте и полярных растворителях ДМФА, ДМСО, ДМАА.
СВОЙСТВА ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА
Поли-1-винил-1,2,4-триазол является гидрофильным полимером, изучению водных растворов которого посвящены работы [46‒48]. В воде ПВТ обладает высокой термодинамической гибкостью, сегмент Куна для него равен 3.3 нм [46]. Концентрационные зависимости теплоты разбавления растворов ПВТ характеризуются отрицательными эффектами, что свидетельствует о сильном взаимодействии ПВТ с водой. Абсолютные значения (ккал/моль) энтальпии, энтропии (TΔS) и свободной энергии смешения ПВТ с водой составляют ΔH = –68.9, TΔS = ‒31.1 и ΔG = = ‒37.8 соответственно. Экзотермический тепловой эффект, по-видимому, связан с сильным взаимодействием звеньев ПВТ с молекулами воды, вследствие образования водородных связей с участием неподеленных электронных пар атомов азота триазольных циклов. Таким образом, ПВТ при взаимодействии с водой выступает в качестве электронодонора, демонстрируя основные свойства [47].
С целью изучения природы гидратации в работе [48] авторы рассматривали теплоемкость разбавленных водных растворов ПВТ и коэффициент диффузии воды в его пленках. Полученные данные свидетельствуют о гидрофильной гидратации за счет взаимодействия водородных атомов воды с неподеленной электронной парой “пиридинового” атома азота гетерокольца [48].
В работе [49] проведено термохимическое исследование растворов ПВТ в сильно донорных растворителях ‒ ДМФА (донорное число 26.6, акцепторное число 16.0), ДМАА (донорное число 27.8, акцепторное число 13.6) и метилпирролидоне (донорное число 27.3, акцепторное число 13.3). ПВТ неограниченно растворим во всех трех растворителях. Отмечено, что растворение полимера сопровождается большими экзотермическими эффектами. Рассматриваемые растворители при взаимодействии с ПВТ выступают как доноры электронов (высокие донорные числа), акцептором электронов служит ПВТ. Акцепторные свойства ПВТ обусловлены присутствием в его составе ароматического кольца, т.е. ПВТ является по своей природе амфотерным соединением. По этой же причине ПВТ растворим и в ДМСО (донорное число 29.8, акцепторное число 19.3).
Помимо сильно донорных растворителей, ПВТ растворим и в сильно акцепторных растворителях, таких как уксусная и муравьиная кислоты. При этом он выступает, как и в случае с водой, в качестве донора. В таких растворителях, как ацетон, тетрагидрофуран, ацетонитрил, спирт, диоксан, гептан, нитрометан, диэтиловый эфир и дихлорэтан, ПВТ не растворим.
Методами вискозиметрии и светорассеяния были исследованы гидродинамические свойства растворов ПВТ в воде и ДМФА, определены константы K и α в уравнении Марка‒Куна‒Хаувинка [46]. Соотношения между [η] ПВТ при 25°С и Mw следующие: в воде ‒ [η] = 5.44 × 10‒4 × $M_{w}^{{0.64}}$ дл/г; в ДМФА ‒ [η] = 2.27 × 10‒3 × $M_{w}^{{0.5}}$ дл/г.
Полимер гидролитически достаточно устойчив, не подвержен термоокислительной деструкции (до 360°С) [50] и способен образовывать комплексы с ионами металлов [51], тем самым позволяя эффективно использовать его для разработки водной закалочной среды и флокулянтов осветления, стабилизации соков и вин [52‒55].
ПВТ является слабым амфотерным полиэлектролитом, донорные свойства которого можно определить атомом азота, находящимся в четвертом положении триазольного кольца, а акцепторные ‒ π-сопряженной системой цепи. Добавление к растворам низкомолекулярной соли NaCl повышает его основность, понижая при этом кислотность. Нейтрализация раствора ПВТ кислотой на 5‒6% приводит к падению основности на два‒три порядка [56]. Учитывая ранее изложенные сведения о донорно-акцепторном взаимодействии водного раствора ПВТ, вероятно, триазольные звенья по отношению друг к другу могут выступать и донорами, и акцепторами, тем самым усиливая основность:
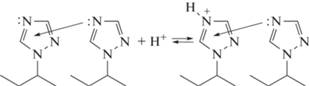
Возрастание на полимерной цепи положительного заряда при добавлении небольшого количества кислоты влечет разрыв связей между триазольными фрагментами, вследствие чего основность резко падает.
Необычное поведение кривой pH раствора наблюдается при добавлении небольшого количества оснований (LiOH, NaOH, KOH). Сначала кривые титрования раствора ПВТ находятся ниже соответствующих кривых для чистых растворов щелочей, затем они сдвигаются в более основную область. Такое поведение можно объяснить взаимодействием триазольных циклов с катионами и анионами диссоциированных гидроокисей:
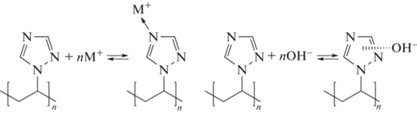
Добавление низкомолекулярной соли приводит к смещению кривых титрования в щелочную область, что, по-видимому, связано с протеканием конкурирующих реакций взаимодействия триазольного кольца с анионами, вследствие чего в растворе увеличивается концентрация гидроксильных групп. С увеличением заряда на макромолекуле (добавление кислоты или щелочи) усиливается ее жесткость и изменяется конформация на более развернутую, что сопровождается ростом вязкости [56].
ПВТ является водорастворимым, биосовместимым и нетоксичным (LD50 > 5000 мг/кг, пероральное введение) полимером с М = 104–106, обладающим биологической активностью. Полимер демонстрирует противосиликотические свойства, защищает мембраны клеток от цитотоксического действия кремнезема при взаимодействии пыли с клетками эритроцитов и брюшнополостных макрофагов, обладает защитными функциями при пылевом фиброзе [55]. ПВТ повышает активность клеток, стимулирует развитие грануляционно-фиброзной ткани, способствует активации деятельности клеток соединительнотканной капсулы [57].
В последние годы интенсивно изучается способность гомо- и сополимеров ВТ стабилизировать наночастицы металлов при формировании новых полимерных металлосодержащих нанокомпозитов [58‒63]. Значимые результаты получены при исследовании биологической активности полимерных нанокомпозитов с наночастицами серебра.
ОСОБЕННОСТИ ФОРМИРОВАНИЯ ПОЛИМЕРНЫХ НАНОКОМПОЗИТОВ СЕРЕБРА
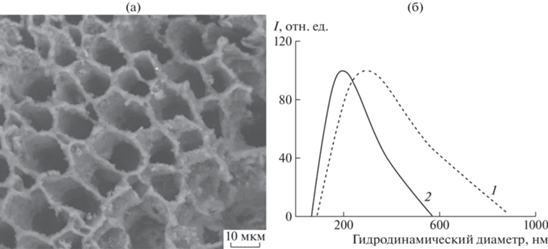
Для синтеза полимерных нанокомпозитов с наночастицами нульвалентного серебра в качестве стабилизирующей матрицы использовался ПВТ с М = 26 × 103, обладающий хорошей растворимостью в воде, высокой термостойкостью (до 330°C), биосовместимостью и нетоксичностью. В твердом состоянии полимер рентгеноаморфен и характеризуется “ячеистой” структурой (рис. 1а). По результатам фотонной корреляционной спектроскопии, макромолекулы ПВТ существуют в водном растворе в виде статистических клубков со средним гидродинамическим диаметром 292 нм (рис. 1б) [64].
Рис. 1.
СЭМ-изображение ПВТ (а) и кривые распределения частиц по размерам (б) исходного ПВТ (1) и нанокомпозита с наночастицами серебра (2).
Формирование наночастиц металлического серебра в полимерной матрице осуществлялось методом химического восстановления ионов серебра из нитрата серебра с использованием боргидрида натрия, глюкозы или формальдегида в качестве восстановителей [65‒67]. Реакции проводились в водном растворе ПВТ с варьированием продолжительности и температуры реакции, а также соотношения полимера и металлического прекурсора. Формирование металлополимерных нанокомпозитов протекает через образование комплексов ПВТ с ионами серебра, сопровождающееся увеличением вязкости раствора и образованием гелеобразных суспензий [68]. Это обусловлено специфической координационной сшивкой между линейными макромолекулами ПВТ, где в роли координационно-сшивающего агента выступают ионы серебра:
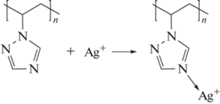
Последние имеют координационное число 2 (и более) и могут одновременно образовывать несколько (минимум две) координационных связей с триазольными циклами как в пределах одной полимерной молекулы, так и между макромолекулами. Полимерные комплексы формируются за счет донорно-акцепторного взаимодействия катионов серебра с атомами азота в четвертом положении триазольного цикла [68].
При последующем добавлении восстановителя (боргидрида натрия, глюкозы или формальдегида) катионы серебра восстанавливаются до металлического состояния. В присутствии координирующих макромолекул ПВТ наночастицы инкорпорируются в макромолекулы с образованием комплексных нанокомпозитных частиц, в которых металлические наночастицы удерживаются в макромолекулярной матрице ПВТ посредством координационных связей между триазольными циклами и атомами серебра на поверхности. При этом результирующая связь серебряных наночастиц с матрицей ПВТ будет многократно усилена кооперативным многоточечным координационным связыванием. Гидродинамический диаметр таких комплексных нанокомпозитных частиц уменьшается по сравнению с исходными макромолекулами ПВТ (с 292 нм у ПВТ до 195 нм у нанокомпозитов на основе ПВТ). Это можно объяснить компактизацией достаточно развернутых в водном растворе относительно неплотных макромолекулярных клубков исходных полимерных молекул за счет более плотного сворачивания под действием множественных кооперативных сил координационной сшивки, осуществляемой наночастицами серебра. Увеличение концентрации наночастиц серебра приводит к образованию нерастворимого сшитого нанокомпозита, что наблюдается при содержании серебра выше 10%. Эффект снижения растворимости нанокомпозитов с высоким содержанием серебра обусловлен возрастающим вкладом (по мере увеличения содержания серебра) реакций комплексообразования поверхностных атомов серебряных наночастиц с триазольными циклами, которые в данном случае составляют конкуренцию процессу гидратации полимера. Таким образом, при высоком содержании серебра альтернативные реакции комплексообразования с участием триазольных гетероциклов могут стать превалирующими над гидратацией макромолекул ПВТ [57]. В результате при увеличении содержания серебра нанокомпозиты сначала частично, а затем и полностью теряют растворимость во всех доступных растворителях. Реакция завершается образованием коричневых золей, из которых были выделены нанокомпозиты в виде темно-коричневых порошков (табл. 1).
Таблица 1.
Условия синтеза и свойства нанокомпозитов с наночастицами серебра в матрице ПВТ
| Наноком-позит | Соотношение полимер : : AgNO3, моль | Восстановитель | Содержание Ag, мас. % | Размер наночастиц Ag, нм | Выход, % | Растворимость в Н2О |
|---|---|---|---|---|---|---|
| 1 | 50 : 1 | NaBH4 | 1.8 | 2‒8 | 80 | + |
| 2 | 20 : 1 | NaBH4 | 5.0 | 2‒10 | 84 | + |
| 3 | 15 : 1 | NaBH4 | 10.1 | 2‒10 | 86 | + |
| 4 | 10 : 1 | NaBH4 | 13.6 | 2‒10 | 82 | +/– |
| 5 | 5 : 1 | NaBH4 | 20.8 | 2‒12 | 87 | – |
| 6 | 20 : 1 | Формальдегид | 3.9 | 2‒14 | 81 | + |
| 7 | 20 : 1 | Глюкоза | 5.0 | 2‒26 | 79 | + |
Варьированием условий реакции были синтезированы новые полимерные нанокомпозиты с разным содержанием наночастиц серебра (1.8‒20.8%), размерами 2‒26 нм, равномерно распределенных в полимерной матрице (табл. 1).
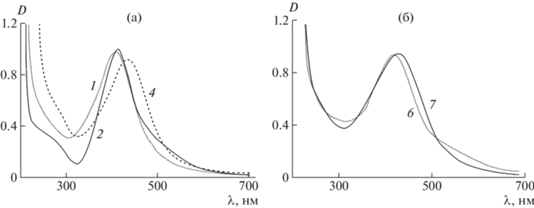
В спектрах оптического поглощения водных растворов нанокомпозитов, в отличие от водных растворов исходных нитрата серебра и ПВТ, появляются характерные полосы плазмонного резонансного поглощения (ППР) электронов проводимости серебряных металлических наночастиц с максимумом в области 409‒433 нм при восстановлении боргидридом натрия (рис. 2а). Необходимо отметить, что ПВТ в области от 300 до 700 нм спектрально чист. При восстановлении глюкозой и формальдегидом максимумы полос ППР можно видеть при 418 и 426 нм соответственно (рис. 2б).
Рис. 2.
Спектры поглощения водных растворов нанокомпозитов 1, 2, 4 (а) и 6, 7 (б). Номера спектров ‒ по табл. 1.
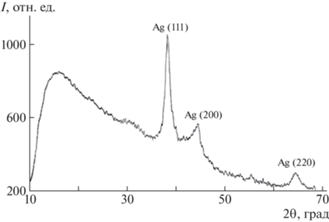
На рентгеновских дифрактограммах нанокомпозитов дифференцируются аморфное гало полимерной матрицы и интенсивные рефлексы нуль-валентного металлического серебра (рис. 3), идентифицированного путем сопоставления значений межплоскостных расстояний и относительных интенсивностей с эталонными для металлического серебра.
Формирующиеся наночастицы серебра имеют преимущественно сферическую форму, их размерность и полидисперсность зависят от природы восстановителя (рис. 4).
Рис. 4.
Микрофотографии нанокомпозитов (а, в, д) и диаграммы распределения наночастиц серебра (б, г, е) по размерам в образцах, синтезированных с использованием восстановителей NaBH4 (а, б), формальдегида (в, г) и глюкозы (д, е).
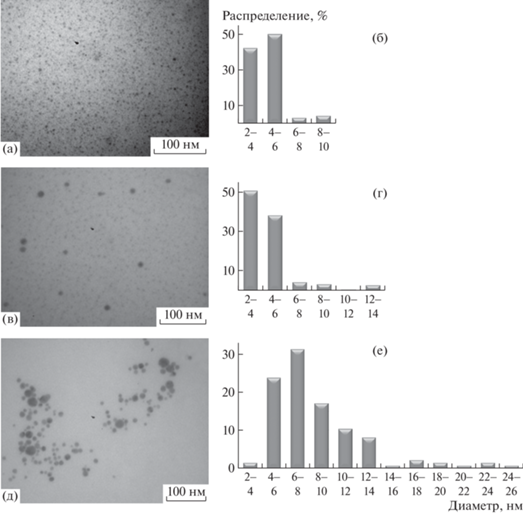
При применении сильного восстановителя NaBH4 наночастицы серебра в полимерной матрице характеризуются узкой полидисперсностью: 92% частиц имеют размеры 2‒6 нм. Использование глюкозы (слабого восстановителя) приводит к формированию наночастиц размером до 26 нм с более широкой полидисперсностью.
Термостойкость полимерных нанокомпозитов снижается на 50‒70°С по сравнению с термостойкостью исходного ПВТ, что обусловлено каталитическими особенностями наночастиц серебра, приводящими к снижению энергии активации термодеструкции и окисления полимерной матрицы.
АНТИМИКРОБНАЯ АКТИВНОСТЬ НАНОКОМПОЗИТОВ НА ОСНОВЕ ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА
Полученные нанокомпозиты на основе ПВТ с наночастицами серебра демонстрируют высокую антимикробную активность в отношении различных грамотрицательных и грамположительных микроорганизмов [63, 69, 70‒74]. Они характеризуются низкими значениями минимальной ингибирующей и минимальной бактерицидной концентрации (табл. 2).
Таблица 2.
Минимальные ингибирующие (МИК) и минимальные бактерицидные (МБК) значения концентрации нанокомпозита на основе ПВТ (5.0% Ag) [63]
| Микроорганизмы | МИК, мкг/мл | МБК, мкг/мл |
|---|---|---|
| Escherichia coli (АТСС 25922) | 0.5 | 1.0 |
| Pseudomonas aeruginosa (АТСС 27853) | 4.0 | 4.0 |
| Klebsiella pneumonia (АТСС 700603) | 4.0 | 8.0 |
| Enterococcus faecalis (АТСС 29212) | 4.0 | 8.0 |
| Staphylococcus aureus (АТСС 25923) | 8.0 | 16.0 |
При исследовании механизма взаимодействия нанокомпозита с клетками Escherichia. coli в течение 1‒24 ч наблюдались процессы гомогенизации цитоплазмы и постепенное разрушение бактерий [63]. В процессе эксперимента нанокомпозит и ПВТ оставались неизменными, не подвергались биодеградации и проявили устойчивость к микробному биоразложению.
ТОКСИКОЛОГИЧЕСКИЕ СВОЙСТВА ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА И НАНОКОМПОЗИТОВ СЕРЕБРА НА ЕГО ОСНОВЕ
Важным показателем антибактериальных Ag(0)-наноматериалов выступает степень их токсичности. Установлено, что ПВТ и нанокомпозит с наночастицами серебра являются нетоксичными, так как клетки млекопитающих после инкубации с образцами оставались жизнеспособными, не изменялись морфологически и не теряли способность делиться и синтезировать коллаген [63, 75‒77]. У экспериментальных животных отсутствовали симптомы интоксикации и гибели, внутренние органы не подвергались изменениям, кровоизлияний не наблюдалось. Наночастицы размерами 2‒10 нм активно проникают во внутренние органы животных, накапливаясь в тканях почек (0.19 мкг/кг), печени (0.14 мкг/кг) и в мозге (0.05 мкг/кг) [75‒79]. На протяжении длительного (6 месяцев) периода наблюдений не обнаружены изменения, свидетельствующие об активации апоптоза в нервных клетках [77, 78]. Нанокомпозит демонстрирует химическую устойчивость, не распадается на отдельные компоненты, не встраивается в цепь биологических реакций в организме и выводится практически в неизменном виде [77, 78]. Величина летальной дозы LD50 для ПВТ и нанокомпозита на его основе с наночастицами серебра выше 5000 мг/кг [75‒77].
ПРОТИВООПУХОЛЕВАЯ АКТИВНОСТЬ НАНОКОМПОЗИТОВ СЕРЕБРА НА ОСНОВЕ ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА
В работе [80] проведены комплексные исследования цитотоксических свойств полимерных нанокомпозитов на основе ПВТ на нормальных и трансформированных клетках человека in vitro. В качестве модельных систем использованы первичные эндотелиоциты HUVEC, выделенные из пупочной вены новорожденных, первичные фибробласты GF, полученные из ткани десны человека, клетки аденокарциномы молочной железы Mсf-7 и клетки цервикальной аденокарциномы HeLa. Определены значения концентрации нанокомпозитов, при которых наблюдается гибель половины клеток ТС50 (табл. 3).
Таблица 3.
Значения ТС50 (мг/мл) для нанокомпозитов 1 (5% Ag) и 2 (7.8% Ag)
| Нанокомпозит | Клетки | |||
|---|---|---|---|---|
| HUVEC | GF | Mсf-7 | HeLa | |
| 1 | 0.63 | 0.27 | 2.34 | 0.86 |
| 2 | 0.66 | 0.03 | 0.53 | 0.02 |
Нанокомпозит НК-2 проявляет токсичность для первичных фибробластов и клеток линии HeLa. Он способен накапливаться в лакунах опухолей и увеличивать зоны некроза, существенно ухудшая условия для жизнедеятельности клеток опухоли, и является перспективным для разработки противоопухолевых препаратов.
ИММУНОМОДУЛИРУЮЩИЕ СВОЙСТВА ПОЛИ-1-ВИНИЛ-1,2,4-ТРИАЗОЛА И НАНОКОМПОЗИТОВ СЕРЕБРА НА ЕГО ОСНОВЕ
Разработка эффективных иммунобиологических препаратов является актуальным направлением в медицине. Особое внимание уделяется биологической безопасности, а именно разработке вакцин против возбудителей особо опасных инфекционных заболеваний [81, 82]. Однако из-за токсичности и негативных побочных эффектов только незначительная часть соединений, обладающих иммуномодулирующей активностью, имеет практическую значимость [82‒97]. Водорастворимые полимерные нанокомпозиты на основе ПВТ с наночастицами серебра не токсичны, демонстрируют антибактериальную, цитотоксическую активность и являются перспективными для разработки современных эффективных иммуномодуляторов [65, 69, 70, 75‒80].
Проведены комплексные исследования иммуномодулирующего действия указанных нанокомпозитов на иммунную систему экспериментальных животных, влияние на клеточный состав периферической крови и костного мозга, а также эффективность использования при разработке вакцин для профилактики и лечения социально опасных инфекционных заболеваний, таких как чума и сибирская язва [86‒94]. Установлено, что нанокомпозиты не вызывают необратимых патологических изменений в паренхиматозных органах лабораторных животных, в лейкограмме, количественном содержании эритроцитов и лейкоцитов периферической крови опытных белых мышей. Уже на ранних сроках наблюдения (3‒7 суток) регистрируется иммунный ответ в костном мозге животных, происходит активация грануло- и моноцитарных ростков костномозгового гемопоэза, стимулируется созревание гранулоцитов и лимфоцитов, что подтверждается увеличением содержания В-лимфоцитов и Т-хелперов в селезенке животных, а также свидетельствует о повышении защитных свойств организма [89]. Нанокомпозит стимулирует выработку эффективных форм кислорода фагоцитами, в 2.5 раза повышает продукцию метаболитов оксида азота (по сравнению с контролем), способствует снижению в клетке высокотоксичных радикалов кислорода посредством активации каталитической способности супероксиддисмутазы [90]. Нанокомпозит проявляет защитные свойства при инфекции, вызванной вирулентным штаммом Y. Pestis И-2638 у чувствительных к чуме белых мышей. Подкожное введение нанокомпозита за 60 мин до заражения в дозе 10 и 100 мг/кг способствует выживаемости 30 и 50% инфицированных животных соответственно. Однократное применение нанокомпозита в дозе 10 мг/кг (подкожно) за 8 суток до заражения защищает от гибели 89% животных [90].
Учитывая способность нанокомпозитов на основе ПВТ повышать защитные свойства организма [87‒93], изучена их эффективность в формировании его резистентности к сибирской язве [95‒102]. В качестве модели были выбраны клетки системы мононуклеарных фагоцитов и полиморфноядерных лейкоцитов, а также антигенный препарат S-1 штамма B. Anthracis Sterene 34F2. Проведено комплексное исследование воздействия нанокомпозитов в условиях in vitro и in vivo на кислородозависимые и кислородонезависимые бактерицидные механизмы фагоцитов, восприимчивых к сибирской язве экспериментальных животных – белых мышей и морских свинок. Установлено, что нанокомпозиты оказывают стимулирующее воздействие на энергетический метаболизм фагоцитов, способствуют повышению индекса стимуляции ферментов окислительного взрыва глюкозо-6-фосфатдегидрогеназа, никотинамидадениндинуклеотид фосфата и миелопероксидаза, по сравнению с контролем на 34, 46 и 12%, соответственно [94]. Происходит повышение продукции супероксиддисмутазы и метаболитов оксида азота в 1.3 и 2.5 раза соответственно, по сравнению с контролем. Нанокомпозиты обладают способностью повышать активность ферментов окислительного взрыва, оказывают стимулирующий эффект на кислороднезависимый метаболизм фагоцитов и обладают выраженными антиоксидантными свойствами [94].
Таким образом, полимерные нанокомпозиты на основе ПВТ с наночастицами серебра обладают иммуномодулирующей активностью, проявляют протективный эффект в отношении чумного микроба и сибирской язвы, перспективны для разработки препаратов, повышающих неспецифическую резистентность организма, служат действенными средствами иммунопрофилактики.
Представленные выше результаты свидетельствуют о высокой практической значимости ПВТ и нанокомпозитов с наночастицами серебра на его основе, а также перспективности их использования при разработке материалов медицинского назначения.
Список литературы
Помогайло А.Д., Розенберг А.С., Уфлянд И.Е. Наночастицы металлов в полимерах. М.: Химия, 2000.
Помогайло А.Д. // Рос. хим. журн. 2002. № 5. С. 64.
Zezin A.A. // Polymer Science C. 2016. V. 58. № 1. P. 118.
Rao C.N.R., Müller A., Cheetham A.K. Nanomaterials Chemistry: Recent Developments and New Directions Weinheim: Wiley-VCH, 2007.
Gorbunova M., Lemkina L. // J. Biomed. Mater. Res. A. 2016. V. 104. P. 630.
Zezin A.A., Feldman V.I., Abramchuk S.S., Ivanchenko V.K., Zezina E.A., Shmakova N.A., Shvedunov V.I. // Polymer Science C. 2011. V. 53. № 1. P. 61.
Bakar A., De V.V., Zezin A.A., Abramchuk S.S., Güven O., Feldman V.I. // Mendeleev Comm. 2012. V. 22. P. 211.
Благитко Е.М., Бурмистров В.А., Колесников А.П., Михайлов Ю.И., Родионов П.П. Серебро в медицине. Новосибирск: Наука-Центр, 2004.
Панарин Е.Ф. // Инновации. 2008. № 6 (116). С. 50.
Krutyakov Yu.A., Kudrinskiy A.A., Olenin A.Yu., Lisichkin G.V. // Russ. Chem. Rev. 2008. V. 77. № 3. P. 233.
Zezin A.A., Klimov D.I., Zezina E.A., Mkrtchyan K.V., Feldman V.I. // Radiat. Phys. Chem. 2020. V. 169. P. 108076.
Prabhu S., Poulose E.K. Silver Nanoparticles: Mechanism of Antimicrobial Action, Synthesis, Medical Applications, and Toxicity Effects // Int. Nano Lett. 2012. V. 2. P. 32.
Nam G., Purushothaman B., Rangasamy S., Song J.M. // Int. Nano Lett. 2016. V. 6. № 1. P. 51.
Klimov D.I., Zezina E.A., Zezin S.B., Yang M., Wang F., Shvedunov V.I., Feldman V.I., Zezin, A.A. // Radiat. Phys. Chem. 2018. V. 142. P. 65.
Zezin A.A. // Polymer Science A. 2019. V. 61. № 6. P. 754.
Gorbunova M., Lemkina L., Borisova I. // Eur. Polym. J. 2018. V. 105. P. 426.
Duval R.E., Gouyau J., Lamouroux E. // Nanomaterials. 2019. V. 9. № 12. P. 1775.
Yin I.X., Zhao I.S., Mei M.L., Lo E.C., Tang J., Li Q., So L.Y., Chu C.H. // Int. J. Nanomed. 2020. V. 15. P. 3207.
Yin I.X., Zhang J., Zhao I.S., Mei M.L., Li Q., Chu C.H. // Int. J. Nanomed. 2020. V. 15. P. 2555.
Das C., Paul S.S., Saha A., Singh T., Saha A., Im J., Biswas G. // Int. J. Nanomed. 2020. V. 15. P. 9301.
Huang M., Ye K., Hu T., Liu K., You M., Wang L., Qin H. // Int. J. Nanomed. 2021. V. 16. P. 1345.
Pozdnyakov A., Emel’yanov A., Kuznetsova N., Ermakova T., Bolgova Y., Trofimova O., Albanov A., Borodina T., Smirnov V., Prozorova G. // Synlett. 2015. V. 27. P. 900.
Kuznetsova N.P., Ermakova T.G., Pozdnyakov A.S., Emel’yanov A.I., Prozorova G.F. // Russ. Chem. Bull. 2013. V. 62. P. 2509.
Ermakova T.G., Shaulina L.P., Kuznetsova N.P., Volkova L.I., Pozdnyakov A.S., Prozorova G.F. // Russ. J. Appl. Chem. 2012. V. 85. P. 35.
Prozorova G., Kuznetsova N., Shaulina L., Bolgova Y., Trofimova O., Emel’yanov A., Pozdnyakov A. // J. Organomet. Chem. 2020. V. 916. P. 121273.
Galdiero S., Falanga A., Vitiello M., Cantisani M., Marra V., Galdiero M. // Molecules. 2011. V. 16. P. 8894.
Jeremiah S.S., Miyakawa K., Morita T., Yamaoka Y., Ryo A. // Biochem. Biophys. Res. Comm. 2020. V. 533. P. 195.
Das C., Paul S.S., Saha A., Singh T., Saha A., Im J., Biswas G. // Int. J. Nanomed. 2020. V. 15. P. 9301.
Мелешко А.А., Афиногенова А.Г., Афиногенов Г.Е., Спиридонова А.А., Толстой В.П. // Инфекция и иммунитет. 2020. Т. 10. № 4. С. 639.
Gorbunova M., Lemkina L., Lebedeva I., Kisel’kov D., Chekanova L. // J. Mater. Sci. Mater. Med. 2017. V. 28. P. 40.
Tsivileva O.M., Perfileva A.I., Ivanova A.A., Pozdnyakov A.S., Prozorova G.F. // J. Polym. Environ. 2021. V. 29. P. 1287.
Gorbunova M.N., Kisel’kov D.M., Nebogatikov V.O. // Russ. J. Appl. Chem. 2015. V. 88. P. 320.
Gorbunova M., Lemkina L., Eroshenko D., Gileva K. // Polym. Adv. Technol. 2019. V. 30. P. 336.
Hopff H., Lippay M. // Makromol. Chem. 1963. V. 66. P. 157.
Lonza S.A. // Chem. Abstr. 1965. V. 62. P. 13270.
Lippay M. // J. Appl. Chem. 1965. V. 15. № 3. P. 310.
Татарова Л.А., Ермакова Т.Г., Лопырев В.А., Кедрина Н.Ф. // Б.И. 1979. № 6. С. 85.
Татарова Л.А., Ермакова Т.Г., Берлин Ал.Ал., Разводовский Е.Ф., Лопырев В.А., Кедрина Н.Ф., Ениколопян Н.С. // Высокомолек. соед. А. 1982. Т. 24. № 10. С. 2205.
Кирш Ю.Э. Поли-N-винилпирролидон и другие поли-N-виниламиды: синтез и физико-химические свойства. М.: Наука, 1998.
Лопырев В.А., Татарова Л.А., Вакульская Т.И., Ермакова Т.Г. // Высокомолек. соед. Б. 1985. Т. 27. № 3. С. 221.
Tsypina N.A., Kizhnyaev V.N., Pokatilov F.A., Smirnov A.I. // Polymer Science B. 2003. V. 45. № 1‒2. P. 41.
Kizhnyaev V.N., Tsypina N.A., Smirnov A.I. // Polymer Science A. 2003. V. 45. № 8. P. 735.
Мазяр Н.Л. Дис. … канд. хим. наук. Иркутск: Иркутский гос. ун-т, 1999.
Лопырев В.А., Кашик Т.Н., Протасова Л.Е., Ермакова Т.Г., Воронков М.Г. // Высокомолек. соед. Б. 1984. Т. 26. № 8. С. 594.
Лопырев В.А., Кашик Т.Н., Ермакова Т.Г., Бродская Э.И. // Высокомолек. соед. А. 1990. Т. 32. № 1. С. 149.
Татарова Л.А., Ермакова Т.Г., Кедрина Н.Ф., Касаикин В.А., Новиков Д.Д., Лопырев В.А. // Высокомолек. соед. Б. 1982. Т. 24. № 9. С. 697.
Тагер А.А., Сафронов А.П., Лопырев В.А., Ермакова Т.Г., Татарова Л.А., Кашик Т.Н. // Высокомолек. соед. А. 1987. Т. 29. № 11. С. 2421.
Сафронов A.П., Тагер A.A., Шарина С.В., Лопырев В.А., Ермакова Т.Г., Татарова Л.А., Кашик Т.Н. // Высокомолек. соед. А. 1989. Т. 31. № 12. С. 2662.
Сафронов А.П., Тагер А.А., Войт В.В., Лопырев В.А., Ермакова Т.Г., Татарова Л.А., Шаглаева Н.С. // Высокомолек. соед. А. 1988. Т. 30. № 11. С. 2360.
Лопырев В.А., Салауров В.Н., Курочкин В.Н., Татарова Л.А., Ермакова Т.Г. // Высокомолек. соед. Б. 1985. Т. 27. № 2. С. 145.
Кокорин А.И., Полинский А.С., Пшежецкий В.С., Кузнецова Н.П., Ермакова Т.Г., Лопырев В.А., Кабанов В.А. // Высокомолекул. соед. А. 1985. Т. 27. № 9. С. 1834.
Воронков М.Г., Лопырев В.А., Кухарская Э.В., Ермакова Т.Г., Татарова Л.А. // ЖПХ. 1985. Т. 58. № 1. С. 190.
Зинченко В.И., Макаров А.С., Лопырев В.А., Ермакова Т.Г., Татарова Л.А. // Пиво и напитки. 1999. № 4. С. 58.
Зинченко В.И., Макаров А.С., Лопырев В.А., Ермакова Т.Г., Татарова Л.А. // Хранение и переработка сельхоз. сырья. 2000. № 3. С. 29.
Ермакова Т.Г., Кузнецова Н.П. // Наука производству. 2003. № 6. С. 55.
Мазяр Н.Л., Анненков В.В., Круглова В.А. // Изв. РАН. Сер. Хим. 2000. № 12. С. 2047.
Мансурова Л.А., Скорнякова А.Б., Севастьянова Н.А., Татарова Л.А., Ермакова Т.Г., Лопырев В.А., Казимировская В.Б., Слуцкий Л.И. // Хим.-фарм. журн. 1991. № 8. С. 22.
Zezin A.A., Emel’yanov A.I., Prozorova G.F., Zezina E.A., Feldman V.I., Abramchuk S.S., Pozdnyakov A.S. // Mendeleev Commun. 2019. V. 29. P. 158.
Pozdnyakov A.S., Ivanova A.A., Emel’yanov A.I., Bolgova Y.I., Trofimova O.M., Prozorova G.F. // J. Organomet. Chem. 2020. V. 922. P. 121352.
Farooq T. // Advances in Triazole Chemistry. Amsterdam: Elsevier, 2021. P. 223.
Zezina E.A., Emel’yanov A.I., Pozdnyakov A.S., Prozo-rova G.F., Abramchuk S.S., Feldman V.I., Zezin A.A. // Radiat. Phys. Chem. 2019. V. 158. P. 115.
Pozdnyakov A.S., Ivanova A.A., Emel’yanov A.I., Prozorova G.F. // Russ. Chem. Bull. 2020. V. 69. P. 715.
Hameed A., Farooq T. // Advances in Triazole Chemistry. Amsterdam: Elsevier, 2021. P. 143.
Shurygina I.A., Prozorova G.F., Trukhan I.S., Rorzhova S.A., Fadeeva T.V., Pozdnyakov A.S., Dremina N.N., Emel’yanov A.I., Kuznetsova N.P., Shurygin M.G. // Nanomaterials. 2020. V. 10. P. 1477.
Myachina G.F., Korzhova S.A., Ermakova T.G., Sukhov B.G., Trofimov B.F. // Dokl. Chem. 2008. V. 420. P. 123.
Prozorova G.F., Korzhova S.A., Kon´kova T.V., Ermakova T.G., Pozdnyakov A.S., Sukhov B.G., Arsent´ev K.Yu., Likhoshvai E.V., Trofimov B.A. // Dokl. Chem. (Engl. Transl.). 2011. V. 437. № 1. P. 47.
Прозорова Г.Ф., Коржова С.А., Конькова Т.В., Ермакова Т.Г., Поздняков А.С., Сапожников А.Н., Пройдакова О.А., Сухов Б.Г., Арсентьев К.Ю., Лихошвай Е.В., Трофимов Б.А. // ЖСХ. 2010. Т. 51. С. 109.
Tikhonov N.I., Khutsishvili S.S., Larina L.I., Pozdnyakov A.S., Emel’yanov A.I., Prozorova G.F., Vashchenko A.V., Vakulskaya T.I. // J. Mol. Struct. 2019. V. 1180. P. 272.
Prozorova G.F., Korzhova S.A., Kon’kova T.V., Pozdnyakov A.S., Ermakova T.G., Fadeeva T.V., Vereshchagina S.A., Trofimov B.A. // Russ. Chem. Bull. 2011. V. 60. P. 671.
Prozorova G.F., Pozdnyakov A.S., Kuznetsova N.P., Korzhova S.A., Emel’yanov A.I., Ermakova T.G., Fadeeva T.V., Sosedova L.M. // Int. J. Nanomed. 2014. V. 9. P. 1883.
Saliev T., Baiskhanova D.M., Akhmetova A., Begimbetova D.A., Akishev M., Kulsharova G., Molkenov A., Nurgozhin T., Alekseyeva T., Mikhalovsky S. // Electromagn. Biol. Med. 2019. V. 38. P. 21.
Ivask A., Kurvet I., Kasemets K., Blinova I., Aruoja V., Suppi S., Vija H., Käkinen A., Titma T., Heinlaan M., Visnapuu M., Koller D., Kisand V., Kahru A. // PLoS ONE. 2014. V. 9. № 7. P. e102108.
Ávalos A., Haza A.I., Morales P. // Folia Biol. 2015. V. 61. P. 33.
Bacali C., Baldea I., Moldovan M., Carpa R., Olteanu D.E., Filip G.A., Nastase V., Lascu L., Badea M., Constantiniuc M., Badea F. // Clin. Oral. Investig. 2020. V. 24. P. 2713.
Novikov M.A., Titov E.A., Vokina V.A., Yakimova N.L., Sosedova L.M., Korzhova S.A., Pozdnyakov A.S., Eme-lyanov A.I., Proydakova O.A., Ermakova T.G., Prozorova G.F. // Acta Biomed. Scientifica. 2012. № 2. Part 2. P. 121.
Prozorova G.F., Pozdnyakov A.S., Korzhova S.A., Ermakova T.G., Novikov M.A., Titov E.A., Sosedova L.M. // Russ. Chem. Bull. 2014. V. 63. № 9. P. 2126.
Sosedova L.M., Novikov M.A., Titov E.A. // Токсикологический вестник. 2016. Т. 141. № 6. С. 48.
Novikov M.A., Titov E.A., Vokina V.A., Sosedova L.M. // Acta Biomed. Scientifica. 2018. V. 3. № 6. P. 150.
Sosedova L.M., Novikov M.A., Titov E.A., Pozdnyakov A.S., Korzhova S.A., Ermakova T.G., Prozorova G.F. // Pharm. Chem. J. 2019. V. 52. № 11. P. 912.
Morozkin E.S., Zaporozhchenko I.A., Kharkova M.V., Cherepanova A.V., Laktionov P.P., Vlasov V.V., Su-khov B.G., Prozorova G.F., Trofimov B.A., Khvostov M.V., Tolstikova T.G. // Chem. Sustainable Development. 2013. V. 21. P. 147.
Зверев В.В., Семенов Б.Ф., Хаитов Р.М. Вакцины и вакцинация: национальное руководство. М.: ГЭОТАР-Медиа, 2011.
Медуницин Н.В. Вакцинология. М.: Триада-Х, 2010.
Петров Р.В., Хаитов Р.М. Иммуногены и вакцины нового поколения. М.: ГЭОТАР-Медиа, 2011.
Немировская Т.И., Ковтун В.П., Абрамцева М.В., Александрова Н.В., Тарасов А.П., Салахова Р.Д., Волков В.А., Меркулов В.А. // Биопрепараты. Профилактика, диагностика, лечение. 2014. Т. 51. № 3. С. 19.
Смирнов В.С. Профилактика и лечение гриппа и острых респираторных вирусных инфекций. СПб.: АЙСИНГ, 2012.
Дубровина В.И., Витязева С.А., Коновалова Ж.А., Старовойтова Т.П., Мухтургин Г.Б., Сухов Б.Г., Прозорова Г.Ф., Александрова Г.П. // Нанотехнологии и охрана здоровья. 2012. Т. 4. № 3 (12). С. 31.
Витязева С.А., Старовойтова Т.П., Дубровина В.И., Коновалова Ж.А. // Бюлл. ВСНЦ СО РАМН. 2012. Т. 87. № 5‒2. С. 103.
Войткова В.В., Дубровина В.И., Витязева С.А., Старовойтова Т.П., Балахонов С.В. // Эпидемиология и вакцинопрофилактика. 2013. № 6 (73). С. 89.
Войткова В.В., Дубровина В.И., Витязева С.А., Старовойтова Т.П., Корытов К.М., Балахонов С.В. // Бюлл. ВСНЦ СО РАМН. 2014. № 5 (99). С. 52.
Prozorova G.F., Korzhova S.A., Pozdnyakov A.S., Emel’yanov A.I., Ermakova T.G., Dubrovina V.I. // Russ. Chem. Bull. 2015. V. 64. P. 1437.
Дубровина В.И., Балахонов С.В., Войткова В.В., Витязева С.А., Старовойтова Т.П., Корытов К.М., Прозорова Г.Ф., Александрова Г.П., Колесников С.И. // Бюлл. экспериментальной биологии и медицины. 2016. Т. 162. № 11. С. 621.
Иммуномодулирующее действие металлосодержащих нанокомпозитов / Под ред. С.В. Балахонова. Иркутск: Мегапринт, 2017.
Dubrovina V.I., Balakhonov S.V., Voitkova V.V., Vityazeva S.A., Starovoitova T.P., Korytov K.M., Prozorova G.F., Aleksandrova G.P., Kolesnikov S.I. // Bull. Exp. Biol. Med. 2017. V. 162. № 11. P. 666.
Клеточные и гуморальные факторы иммунитета в патогенезе сибирской язвы / Под ред. С.В. Балахонова. Иркутск: ИНЦХТ, 2018.
Черкасский Б.Л. Эпидемиология и профилактика сибирской язвы. М.: ИнтерСЭН, 2002.
Воробьев А.А., Миронов А.Ю. // Альманах клинической медицины. 2009. № 21. С. 17.
Онищенко Г.Г. // Журн. микробиологии, эпидемиологии и иммунобиологии. 2006. № 3. С. 58.
Hahn U.K., Aichler M., Boehm R., Beyer W. // Vaccine. 2006. V. 24. № 21. P. 4595.
Chitlaru T., Gat O., Grosfeld H., Inbar I., Gozlan Y., Shafferman A. // Infect. Immun. 2007. V. 75. № 6. P. 2841.
Cybulski R.J. jr., Sanz P., O′Brien A.D. // Mol. Asp. Med. 2009. V. 30. № 6. P. 490.
Jesus S., Borges O. // World J. Vaccines. 2011. № 1. P. 79.
Попова П.Ю., Микшис Н.И. // Журн. микробиологии, эпидемиологии и иммунобиологии. 2016. № 1. С. 79.
Дополнительные материалы отсутствуют.
Инструменты
Высокомолекулярные соединения (серия С)