Водные ресурсы, 2020, T. 47, № 1, стр. 86-93
Температурная зависимость процессов биодеградации акриламида в суспензиях речных илов при их инокуляции селекционированными бактериальными штаммами
Ю. Г. Максимова a, *, Г. В. Овечкина a, А. А. Селянинов b, А. А. Баранова c, А. Ю. Максимов a, b
a Институт экологии и генетики микроорганизмов,
фил. Пермского федерального исследовательского центра,
614081
, Пермь, Россия
b Пермский национальный исследовательский политехнический университет,
614990
, Пермь, Россия
c Пермская государственная фармацевтическая академия,
614990 Пермь, Россия
* E-mail: yul_max@mail.ru
Поступила в редакцию 15.07.2018
После доработки 25.02.2019
Принята к публикации 11.04.2019
Аннотация
Изучена зависимость от температуры скорости биодеградации акриламида посредством микроорганизмов илов малых рек Пермского края – антропогенно загрязненной р. Данилихи, протекающей по территории г. Перми, и относительно чистого притока р. Сюзьвы на территории Нытвенского района. Повышение скорости биодеградации акриламида достигнуто при внесении в речной ил биомассы бактерий штаммов Alcaligenes faecalis 2 и Acinetobacter guillouiae 11h, селекционированных в направлении увеличения амидазной активности. Показано, что при температуре окружающей среды 30°С полная деградация 100 мМ раствора акриламида посредством микробиоценоза илов р. Данилихи и притока р. Сюзьва была достигнута к 21-м и 28-м сут соответственно, тогда как при 5°С и 16–20°С даже к 63-м сут было отмечено лишь незначительное снижение концентрации акриламида. Внесение биомассы предварительно селекционированных бактерий позволяет значительно сократить время полной деградации акриламида. При температуре 5°С утилизация акриламида в концентрации 7 г/л может осуществляться только при инокуляции илов биомассой амидазосодержащих микроорганизмов. Представлена математическая модель биодеградации акриламида в суспензиях илов малых рек, приведены кинетические кривые изменения его концентрации и получены температурные зависимости скорости биодеградации для различных вариантов процесса.
Акриламид – высокотоксичное вещество, обладающее канцерогенным и мутагенным эффектом в отношении животных и человека. Этот мономер используется в химической промышленности для синтеза акриловых полимеров, которые находят применение в нефтехимической [8], лакокрасочной, бумажной промышленности, водоподготовке [7] и сельском хозяйстве [10]. Широкое использование полимеров акриламида и его сополимеров с акриловой кислотой в различных отраслях производства приводит к попаданию этого вещества в наземные и водные экосистемы [11]. Поскольку акриламид не связывается с частицами почвы и обладает высокой растворимостью в воде (максимальная – 2155 г/л), подвижен и способен легко просачиваться в грунты, увеличивается риск загрязнения им поверхностных и грунтовых вод [20].
Агентство по охране окружающей среды США (“US Environmental Protection Agenc”) установило ограничение уровня содержания этого мономера в природной среде – 0.05% [20]. Директивой Европейского Совета по качеству питьевой воды обозначен предел содержания акриламида – 0.1 мкг/л [14].
Основной источник загрязнения вод акриламидом – производства по получению акриламида из акрилонитрила, синтеза полиакриламидов и других полимеров. В выбросах предприятий такого рода содержится до 1 г мономера акриламида на 1 л эффлюента. Кроме того, акриламид может попадать в воду в процессе водоподготовки, после флокуляции с полиакриламидами, при герметизации канализации и в процессе переработки макулатуры. Так, остаточная концентрация акриламида в 32-х различных флокулянтах, одобренных для использования в установках водоочистки, составила от 0.5 до 600 частей на 1 млн. Время биодеградации акриламида зависит от природной среды, в которой происходит процесс. Так, обнаружено, что мономер акриламида остается стабильным >2 мес. в водопроводной воде [12]. В [12] показано, что акриламид сохраняется несколько дольше в эстуариях и соленой воде, чем в пресной; время полужизни мономеров акриламида в реках составляет от нескольких недель до нескольких месяцев. Акриламид в концентрации <2 мг/л в речной воде подвергается полной деградации за 9–12 сут, тогда как в концентрации >2 мг/л может быть токсичен для микробиоты, и, как результат, скорость деградации будет низкой. Продемонстрировано, что время, необходимое для полной биодеградации акриламида, может варьировать от 480 до 1100 ч в зависимости от типа образцов воды – водопроводной, речной или озерной. Эти различия объясняются тем, что некоторые виды живых организмов в воде могут взаимодействовать с акриламидом, ускоряя или мешая деградации мономера [20]. Очевидно, что микробная деградация акриламида будет сильно зависеть не только от состава биоценоза и концентрации этого токсичного вещества, но и от температуры окружающей среды.
Несмотря на высокую токсичность акриламида, некоторые микроорганизмы способны использовать его как источник углерода для своего роста. Так, различными исследовательскими группами выделены микроорганизмы, относящиеся к родам Arthrobacter, Bacillus, Pseudomonas, Rhodococcus, Rhodopseudomonas, Enterobacter, Stenotrophomonas и Moraxella, способные утилизировать акриламид в качестве субстрата [11, 16, 17, 19, 21]. Известно, что акриламидамидогидролазы (КФ 3.5.1.4) микроорганизмов трансформируют акриламид до ионов аммония и акрилата [18], а акриловая кислота в дальнейшем может быть метаболизирована до пропионата либо ацетил-КоА [12].
Внесение биомассы микроорганизмов, которые были предварительно подвергнуты селекции с целью повышения биодеградационной активности, в загрязненные среды наряду с добавлением питательных веществ для стимулирования автохтонной микрофлоры – широко распространенная стратегия биоремедиации [15]. Такой подход относится к “зеленым технологиям” удаления органических загрязнителей из окружающей среды. Инокуляция природных сред (почвы, активных илов, осадков, воды) микроорганизмами, обладающими требуемой каталитической активностью, в основном рекомендована для мест, где количество аборигенных микроорганизмов, способных деградировать поллютанты, недостаточно, либо природные популяции не обладают метаболическими путями для трансформации таких соединений [13]. Однако при внесении биомассы аллохтонных микроорганизмов возникает проблема их “приживаемости” в чужеродном биотопе. Кроме того, природные среды, в том числе наземные и водные, подвергаются температурным колебаниям, что также неминуемо изменяет способность микробиоценоза к деградации органических загрязнителей. В связи с этим цель работы – изучение влияния температуры окружающей среды на деградацию акриламида посредством микробных сообществ илов малых рек различного исходного уровня загрязненности как в нативном состоянии, так и при инокуляции бактериальными штаммами, обладающими амидазной активностью.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Образцы илов двух малых рек Пермского края – Данилихи (58°00.107′ с.ш.; 56°12.566′ в.д.) и левого притока р. Сюзьва (58°07.870′ с.ш.; 55°32.906′ в.д.) отобраны в сентябре 2016 г. Штаммы протеобактерий Alcaligenes faecalis 2 и Acinetobacter guillou-iae 11h, обладающие амидазной активностью, были изолированы из активного ила коммунальных биологических очистных сооружений г. Перми (ООО “Новогор-Прикамье”) в июне 2011 г. [4].
Биомасса A. faecalis 2 и A. guillouiae 11h получена при выращивании в течение 5 сут на минимальной солевой среде следующего состава, г/л: КН2РО4 – 1.0, К2НРО4 · 3Н2О – 3.7, NaCl – 0.5, MgSO4 · 7Н2О – 0.5, FeSO4 · 7Н2О – 0.005, CoCl2 · 6Н2О – 0.01, рН 7.2–7.4, с 0.1 М ацетамидом в качестве единственного источника углерода и азота. Биомассу центрифугировали при 10 000 g, отмывали однократно 30 мл калий-фосфатного буфера (рН 7.2 ± 0.2) и ресуспендировали в свежем буфере.
Амидазную активность суспензии клеток A. faecalis 2 и A. guillouiae 11h определяли по количеству акриловой кислоты, образуемой за 1 ч при 30°С из 100 мМ раствора акриламида в 1 мл 0.01 М калий-фосфатного буфера (рН 7.2 ± 0.2) при перемешивании на шейкере со скоростью вращения 100 об/мин. Реакцию останавливали добавлением концентрированной HCl до конечной концентрации 5%. Пробы центрифугировали при 14 500 g, надосадочную жидкость отбирали, замораживали при –18°С и анализировали методом ВЭЖХ. Активность амидазы выражали в мкмоль акриловой кислоты, образуемой за 1 мин клетками в количестве 1 мг (мкмоль/мг/мин).
К 5 г сырых илов р. Данилихи (3.43 г сухого веса) и притока р. Сюзьвы (1.74 г сухого веса), по отдельности ресуспендированным в 30 мл калий-фосфатного буфера (рН 7.2 ± 0.2), добавили по 1 мл суспензии A. faecalis 2 (100 мг сухой биомассы) и A. guillouiae 11h (14.3 мг сухой биомассы) и внесли раствор 1 М акриламида до конечной концентрации 100 мМ. Илы инкубировали при 5, 16–20 и 30°С с периодическим перемешиванием, пробы отбирали по 0.5 мл с периодичностью каждый час в течение 5 ч в первые сутки, затем ежедневно до 14 сут, затем еженедельно до 49–63 сут. Трансформацию акриламида останавливали добавлением 25 мкл концентрированной HCl, пробы центрифугировали при 14 500 g, надосадочную жидкость отбирали, замораживали при –18°С и анализировали методом ВЭЖХ.
Концентрацию акриламида и акриловой кислоты в среде определяли методом ВЭЖХ (LC-10, “Shimadzu”, Япония) на колонке (250 × 4.6 мм) Synergi 4u Hydro–RP 80A, используя 25 мМ NaH2PO4 и 5% ацетонитрила в качестве подвижной фазы; скорость потока составляла 0.500 мл/мин при 25°C.
Начальную скорость деградации акриламида посредством микробиоты илов или биомассы бактерий определяли по формуле:
где mа, мг – количество акриламида в пробе в момент времени ta, ч; mb, мг – количество акриламида в пробе в момент времени tb, ч; mc, мг – масса высушенного до постоянного веса ила, г, или биомасса клеток, мг, и скорость v, мг/ч/г или мг/ч/мг.Статистическую обработку проводили с использованием непараметрического Т-критерия Вилкоксона и U-критерия Манна–Уитни с использованием пакета стандартных программ Statistica 10.0 (“StatSoft Inc.”, 2012). Различия считали достоверными при p < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В модельном эксперименте изучена деградация акриламида сообществом микроорганизмов илов антропогенно загрязненной малой р. Данилихи, протекающей по территории г. Перми, и более экологически чистого притока р. Сюзьвы, на территории Нытвенского района Пермского края. Проводили инокуляцию илов биомассой штаммов A. faecalis 2 и A. guillouiae 11h, обладающих амидазной активностью, с целью повышения биодеградационной способности микробиоценоза по отношению к акриламиду. По данным авторов статьи, амидазная активность A. faecalis 2 и A. guillouiae 11h по акриламиду составляла 0.34 и 0.17 мкмоль/мг/мин соответственно. За 50 ч инкубации при 30°С данные штаммы полностью трансформировали 100 мМ акриламид в акриловую кислоту в составе консорциума речных илов р. Данилихи и притока р. Сюзьвы, тогда как без инокуляции бактериальными штаммами с амидазной активностью полная биодеградация акриламида посредством естественного микробиоценоза ила наблюдалась лишь на 21-е сут (рис. 1, 2). При ферментативной трансформации акриламида происходило накопление акриловой кислоты в среде, которая в дальнейшем утилизировалась в качестве источника питания микробным сообществом. При трансформации акриламида без внесения амидазосодержащих штаммов при 30°С накопление акриловой кислоты было незначительным и не превышало 0.4 и 2 г/л для образцов илов р. Данилихи и притока р. Сюзьвы соответственно, а полная минерализация акриловой кислоты достигалась за 20 и 35 сут соответственно. При инокуляции биомассой бактериальных штаммов акриловая кислота также полностью подвергалась деструкции; следовательно, при 30°С может утилизироваться не только акриламид, но и продукт его дальнейшей ферментативной трансформации, а внесение биомассы предварительно селекционированных бактерий позволяет значительно сократить время деградации акриламида.
Рис. 1.
Биодеградация акриламида посредством микробного сообщества ила притока р. Сюзьвы (1, 4) с инокуляцией A. faecalis 2 (2, 3) при 30°С: концентрация акриламида – 1, 3 и акриловой кислоты – 2, 4.
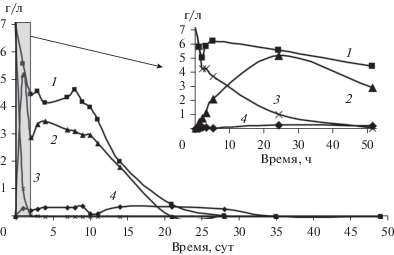
Рис. 2.
Биодеградация акриламида посредством микробного сообщества ила р. Данилихи (1, 4) с инокуляцией A. faecalis 2 (2, 3) при 30°С: концентрация акриламида – 1, 3 и акриловой кислоты – 2, 4.
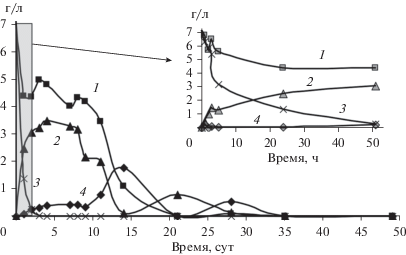
Однако при снижении температуры окружающей среды процесс биотрансформации значительно замедлился. Так, без внесения биомассы амидазосодержащих бактерий деструкция 100 мМ акриламида микробиотой илов при 5°С не была достигнута даже за 2 мес., а при инокуляции илов этими штаммами полная трансформация наблюдалась на 11–12-е сут (рис. 3, 4). При этом акриловая кислота, образующаяся из акриламида, не утилизировалась при внесении биомассы A. faecalis 2 и A. guillouiae 11h, накапливаясь в среде до концентрации 3 г/л. При 16–20°С концентрация акриламида в среде в процессе трансформации посредством микробиоты илов без инокуляции за 2 мес. снижалась лишь вдвое. Внесение биомассы штаммов, обладающих амидазной активностью, позволило достичь полной деструкции акриламида на 4-е сут, хотя полной минерализации акриловой кислоты при температуре 16–20°С не наблюдалось, и кислота накапливалась в среде в концентрации 2 г/л.
Рис. 3.
Биодеградация акриламида посредством микробного сообщества ила притока р. Сюзьвы (1, 4) с инокуляцией A. faecalis 2 (2, 3) при 5°С: концентрация акриламида – 1, 2 и акриловой кислоты – 3, 4.
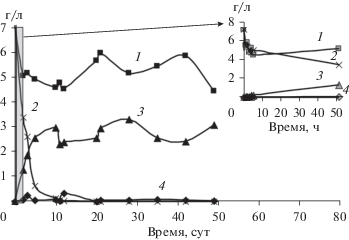
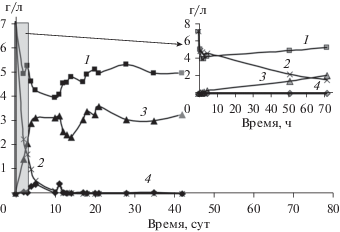
Рис. 4.
Биодеградация акриламида посредством микробного сообщества ила притока р. Данилихи (1, 4) с инокуляцией A. faecalis 2 (2, 3) при 5°С: концентрация акриламида – 1, 2 и акриловой кислоты – 3, 4.
Скорости деградации акриламида при разной температуре в первые 2 сут инкубации представлены в табл. 1. Показано, что начальные скорости деградации этого токсичного вещества посредством микробиоты илов антропогенно загрязненной р. Данилихи и более экологически чистого притока р. Сюзьвы при температуре 30°С значительно различаются. Микробиоценоз ила р. Данилихи трансформирует акриламид в период первых 1–2 сут со скоростью, превышающей таковую микробиоты ила притока р. Сюзьва в 10 раз. Это может быть связано с большей приспособленностью микробного сообщества к высоким нагрузкам загрязняющих веществ. Так, в среднем и нижнем течении р. Данилихи воды имеют качество класса V (по аммонию, общему железу и содержанию кислорода, устойчивому превышению ПДК по меди и марганцу) и оцениваются как экстремально загрязненные [3]. При понижении температуры не наблюдается значительной разницы начальных скоростей трансформации акриламида микробным сообществом илов загрязненной и чистой реки, так как при температуре 5 и 16–20°С ферментативная деградация акриламида автохтонной микробиотой крайне низка. При вычислении U-критерия Манна‒Уитни было определено, что различия скоростей деградации акриламида посредством микробиоты илов р. Данилихи и притока р. Сюзьвы недостоверны (p = 0.724). При вычислении Т-критерия Вилкоксона не было обнаружено значимых различий между скоростями деградации акриламида при 5 и 20°С посредством микробиоты илов как с добавлением биомассы амидазосодержащих бактерий, так и без инокуляции (p = 0.173), но различия скоростей деградации при 30 и 5°С, а также при 30 и 20°С были значимы (p = 0.028).
Таблица 1.
Начальная скорость деградации акриламида посредством микробиоты илов при разнoй температурe
| Ил | Скорость деградации акриламида, мг/ч/г сухого ила |
Скорость деградации акриламида, мг/ч/мг сухой биомассы внесенных бактериальных клеток |
||||
|---|---|---|---|---|---|---|
| 5°С | 16–20°С | 30°С | 5°С | 16–20°С | 30°С | |
| Притока р. Сюзьвы | 0 | 0.018 | 0.090 | – | – | – |
| Притока р. Сюзьвы + A. faecalis 2 | 0.833 | 1.595 | 2.226 | 0.015 | 0.028 | 0.076 |
| Притока р. Сюзьвы + A. guillouiae 11h | 1.295 | 1.184 | 2.604 | 0.158 | 0.144 | 0.625 |
| р. Данилихи | 0.003 | 0.010 | 1.092 | – | – | – |
| р. Данилихи+ A. faecalis 2 | 0.560 | 0.621 | 2.286 | 0.019 | 0.021 | 0.078 |
| р. Данилихи + A. guillouiae 11h | 0.714 | 0.839 | 2.961 | 0.171 | 0.201 | 0.710 |
При расчете скорости деградации акриламида, отнесенной к 1 мг биомассы амидазосодержащих штаммов, было показано, что A. guillouiae 11h в составе микробиоценоза илов трансформирует это загрязняющее вещество в 10 раз быстрее при всех изученных значениях температуры, хотя изначальная амидазная активность штамма была в 2 раза ниже таковой у A. faecalis 2. Это может быть связано с тем, что ацинетобактерии – типичные представители естественных пресных водоемов, и потому данный аллохтонный штамм находился в более благоприятных условиях, чем A. faecalis 2.
Выражение (1) для определения скорости деградации акриламида позволило определить ее величину относительно массы сухого ила или биомассы клеток. Полученные значения ‒ константы и зависят от выбора моментов времени ta и tb, брать которые одинаковыми для сравнения различных вариантов деградации (табл. 1) не корректно. С целью исключения этого недостатка использовали математическое моделирование, применяемое при исследовании кинетики химических реакций [5], биотехнологических процессов [1] и процессов биодеградации лекарственных средств [2, 6, 9].
В качестве математической модели изменения скорости деградации акриламида использовали кинетическое уравнение первого порядка:
с параметром скорости процесса k (ч–1) > 0 и начальным условием x0 = 100% при t = 0. Здесь x – концентрация акриламида в ростовой среде в процентах от начальной; t, ч, – время деградации.Проинтегрировав выражение (2) с приведенным выше начальным условием, получили выражение для кинетической кривой деградации акриламида:
На основе выражения (3) с применением метода наименьших квадратов при обработке экспериментальных данных получили параметр k в зависимости от температуры процесса, применяемых микроорганизмов и типа ила (табл. 2).
Таблица 2.
Скорость деградации акриламида посредством микробиоты илов при разной температуре
| Температура, °С | Параметр скорости деградации акриламида k, ч–1 | |||||
|---|---|---|---|---|---|---|
| ил р. Данилихи | ил р. Данилихи + + A. faecalis 2 | ил р. Данилихи + + A. guillouiae 11h | ил притока р. Сюзьвы | ил притока р. Сюзьвы + + A. faecalis 2 | ил притока р. Сюзьвы + + A. guillouiae 11h | |
| 5 | – | 0.0142 | 0.0204 | – | 0.0157 | 0.0254 |
| 16–20 | – | 0.0260 | 0.0487 | – | 0.0329 | 0.0258 |
| 30 | – | 0.1103 | 0.1491 | – | 0.1390 | 0.1009 |
Как следует из данных табл. 2, наибольшие значения параметра k получены для микробиоты ила из р. Данилихи при внесении биомассы A. guillouiae 11h, что соотносится с данными табл. 1. При инокуляции ила притока р. Сюзьвы четкой зависимости скорости деградации акриламида от вида вносимых бактерий не прослеживается. На рис. 5а, 5б приведены соответствующие кинетические кривые изменения концентрации акриламида при разной температуре деградации.
Рис. 5.
Кинетические кривые деградации акриламида посредством микробного сообщества ила р. Данилихи при внесении биомассы A. guillouiae 11h (а); притока р. Сюзьвы при внесении биомассы A. faecalis 2 (б) при температуре: 5 (1); 16–20 (2); 30°С (3); точками обозначены экспериментальные данные.
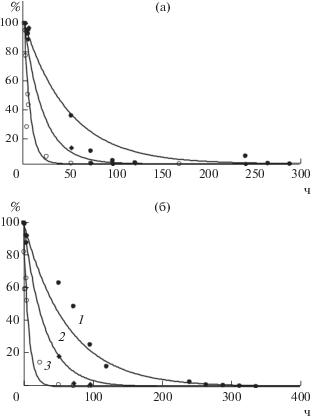
Наблюдается сильная зависимость деградации от температуры. Для микробиоты ила р. Данилихи с внесением A. guillouiae 11h при изменении температуры от 5 до 30°С параметр k скорости деградации акриламида увеличивается в 7.5 раза, для ила притока р. Сюзьвы с A. faecalis 2 – в 8.9 раза. Величины прироста скоростей количественно отличаются от данных табл. 1, однако качественно соответствуют им и объективно отражают переменную скорость процесса деградации: ${v} = {{dx} \mathord{\left/ {\vphantom {{dx} {dt}}} \right. \kern-0em} {dt}}$ – в кинетическом уравнении (2).
Данные табл. 2 аппроксимировали на рассмотренном диапазоне температуры экспоненциальной, согласно известному закону Аррениуса, и квадратичной функциями, что позволило получить достаточно близкие кривые. В результате получили зависимости k(T) – скорости деградации акриламида от температуры, которые для вариантов с большей интенсивностью деградации имеют вид:
для микробиоты ила из р. Данилихи при внесении биомассы A. guillouiae 11h:
(4)
$\begin{gathered} k(T) = 0.0136{\kern 1pt} {\text{exp(}}0.0796T{\text{)}}, \\ k(T) = 0.0250--0.0019T + 0.0002{{T}^{2}}\,\,({{{\text{ч}}}^{{ - 1}}}), \\ \end{gathered} $(5)
$\begin{gathered} k(T) = 0.0094{\kern 1pt} {\text{exp(}}0.0896T{\text{)}}, \\ k(T) = 0.0208--0.0021T + 0.0002{{T}^{2}}\,\,({{{\text{ч}}}^{{ - 1}}}), \\ \end{gathered} $ВЫВОДЫ
Показано, что полная минерализация 100 мМ раствора акриламида микробным сообществом илов как загрязненной, так и чистой реки наблюдается только при температуре 30°С. При снижении температуры до 16–20°С за 2 мес. концентрация акриламида при деградации посредством автохтонного микробиоценоза ила без инокуляции снижается лишь вдвое, а при внесении амидазосодержащих штаммов наблюдается накопление акриловой кислоты как продукта ферментативной трансформации. При 5°С без инокуляции биомассой амидазосодержащих штаммов микробиоценоза илов акриламид не трансформируется. В естественных условиях умеренных широт температура воздуха ≥30°С может наблюдаться лишь непродолжительное время, а в водных средах температура 30°С даже при высокой температуре воздуха обычно не достигается. Встречающиеся сведения о том, что акриламид подвергается частичной биодеградации в воде за 8–12 сут, а в почвах в зависимости от их типа ‒ до 80–94% за 6–14 сут [12], ‒ без уточнения диапазона температуры процесса следует принимать критически, так как скорость микробной деградации зависит от температуры окружающей среды. Показано, что при низкой температуре (5°С) утилизация 100 мМ (7 г/л) акриламида может проходить только при инокуляции биомассой микроорганизмов, которые предварительно подвергнуты селекции для увеличения амидазной активности.
Список литературы
Бирюков В.В. Основы промышленной биотехнологии. М.: КолосС, 2004. 296 с. https://www.studmed.ru/biryukov-vv-osnovy-promyshlennoy-biotehnologii_cc98439a9b4.html
Вихарева Е.В., Селянинов А.А., Данилов Ю.Л., Рудакова И.П., Нечеухина Т.А., Ившина И.Б., Няшин Ю.И. Математическая модель процесса биодеструкции парацетамола как открытой системы // Рос. журн. биомеханики. 2008. Т. 12. № 2. С. 41–54.
Двинских С.А., Китаев А.Б. Экологическое состояние малых рек города Перми // Географ. вестн. 2011. Т. 2(17). С. 32–43.
Демаков В.А., Васильев Д.М., Максимова Ю.Г., Павлова Ю.А., Овечкина Г.В., Максимов А.Ю. Бактерии активного ила биологических очистных сооружений, трансформирующие цианопиридины и амиды пиридинкарбоновых кислот // Микробиология. 2015. Т. 84. № 3. С. 369–378.
Денисов Е.Т. Кинетика гомогенных химических реакций. М.: Высш. шк., 1988. 390 с.
Карпенко Ю.Н., Селянинов А.А., Мухутдинова А.Н., Рычкова М.И., Баранова А.А, Вихарева Е.В., Ившина И.Б. Хроматографическое определение дротаверина гидрохлорида и кинетическое моделирование процесса его биодеструкции в культуральной жидкости R. rhodochrous // Журн. аналит. химии. 2014. Т. 69. № 7. С. 750–755.
Куренков В.Ф., Hartan H.-G., Лобанов Ф.И. Применение полиакриламидных флокулянтов для водоочистки // Химия и компьютерное моделирование. Бутлеровские сообщения. 2002. № 11. С. 31–40.
Минибаев В.В. Исследование и разработка промывочных жидкостей на основе акриловых реагентов многофункционального назначения. Дис. … канд. техн. наук. М.: НЦ НВМТ РАН, 2010.
Селянинов А.А. Вихарева Е.В. Кинетика биодеструкции лекарственных средств – производных фенола, изохинолина и карбоновых кислот // Рос. журн. биомеханики. 2010. Т. 14. № 3. С. 79–91.
Смагин А.В. Теория и практика конструирования почв. М.: Изд-во Московского ун-та, 2012. 544 с.
Buranasilp K., Charoenpanich J. Biodegradation of acrylamide by Enterobacter aerogenes isolated from wastewater in Thailand // J. Environ. Sci. 2011. V. 23. № 3. P. 396–403.
Charoenpanich J. Removal of Acrylamide by Microorganisms // Applied Bioremediation – Active and Passive Approaches. Croatia: InTech Open Sci. Online Publ., 2013. P. 101–121.
Cycoń M., Mrozik A., Piotrowska-Seget Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil: A review // Chemosph. 2017. V. 172. P. 52–71.
European Council Directive 98/83/EC of 3 November 1998 on the quality of water intended for human consumption // Off. J. Eur. Commun. 1998. L330:32.
Festa S., Coppotelli B.M., Morelli I.S. Comparative bioaugmentation with a consortium and a single strain in a phenanthrene-contaminated soil: Impact on the bacterial community and biodegradation // Applied Soil Ecol. 2016. V. 98. P. 8–19.
Jebasingh S.E.J., Lakshmikandan M., Rajesh R.P., Raja P. Biodegradation of acrylamide and purification of acrylamidase from newly isolated bacterium Moraxella osloensis MSU11 // Int. Biodeterior. Biodegrad. 2013. V. 85. P. 120–125.
Lakshmikandan M., Sivaraman K., Raja S.E., Vasanthakumar P., Rajesh R.P., Sowparthani K., Jebasingh S.E.J. Biodegradation of acrylamide by acrylamidase from Stenotrophomonas acidaminiphila MSU12 and analysis of degradation products by MALDI-TOF and HPLC // Int. Biodeterior. Biodegrad. 2014. V. 94. P. 214–221.
Sharma M., Sharma N.N., Bhalla T.C. Amidases: versatile enzymes in nature // Rev. Environ. Sci. Bio/Technol. 2009. V. 8. P. 343–366.
Shen S.-M., Wan T.-J., Hwang H.-Y. Enhancement of degradation of acrylamide coupled with salad oil by Pseudomonas aeruginosa DS-4 using incubation periods // Biocatal. Agric. Biotechnol. 2012. V. 1. № 2. P. 110–114.
Tepe Y. Acrylamide in Surface and Drinking Water // Acrylamide in Food Analysis, Content and Potential Health Effects. Ankara: Elsevier Inc, 2016. P. 275–293.
Wampler D.A., Ensign S.A. Photoheterotrophic metabolism of acrylamide by a newly isolated strain of Rhodopseudomonas palustris // Appl. Environ. Microbiol. 2005. V. 71. № 10. P. 5850–5857.
Дополнительные материалы отсутствуют.


