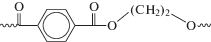Водные ресурсы, 2020, T. 47, № 4, стр. 411-420
Исследование содержания частиц микропластика в воде, донных отложениях и грунтах прибрежной территории Невской губы Финского залива
Ш. Р. Поздняков a, *, Е. В. Иванова a, А. В. Гузева a, Е. П. Шалунова b, К. Д. Мартинсон a, Д. А. Тихонова a
a Институт озероведения РАН
196105 Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: spb.spt@mail.ru
Поступила в редакцию 25.04.2016
После доработки 10.12.2019
Принята к публикации 24.12.2019
Аннотация
Исследовано содержание частиц микропластика (размером от 100 мкм до 5 мм) и их химического состава в воде и грунтах прибрежной территории Невской губы Финского залива. Выявлены преобладающие формы частиц, их размерный диапазон, химический состав полимеров и их количественное содержание в различных средах – в воде, донных отложениях и прибрежных грунтах. Концентрации микропластика в донных отложениях и прибрежных грунтах значительно превышают концентрации в водной толще. Исследованы особенности пространственного распределения частиц микропластика в воде, прибрежных грунтах и донных отложениях Невской губы Финского залива. По мере удаления от г. Санкт-Петербурга и устья Невы вдоль как северного, так и южного побережья наблюдается уменьшение концентраций микропластика на урезе воды. При впадении в Финский залив р. Невы происходит разбавление вод, загрязненных частицами микропластика, и дальнейший их транзит и распределение в соответствии с господствующим гидродинамическим переносом в западном направлении.
ВВЕДЕНИЕ
В настоящее время пластик – один из наиболее востребованных искусственных материалов, широко применяемых во всех сферах потребления. Объемы мирового производства пластика возрастают с каждым годом. Под пластиком в широком смысле слова в данной работе понимаются искусственно синтезированные высокомолекулярные соединения (полимеры), получаемые с помощью реакции полимеризации и поликонденсации из низкомолекулярных веществ, выделяемых из угля, нефти и природного газа. К ним относятся различные виды пластмасс, резин, синтетических тканей. Наиболее распространенные виды пластика – полиэтилен, полипропилен, поливинилхлорид, полиэтилентерефталат [10].
Основная часть пластиковых отходов после использования попадает в окружающую среду, в частности в водные экосистемы. При этом процесс полного разложения пластика в природных условиях может занимать сотни и тысячи лет [6]. Однако пластик легко распадается на более мелкие частицы в широком размерном диапазоне. Частицы размером <5 мм называются микропластиком [4]. В зависимости от происхождения микропластик разделяют на первичный и вторичный [8]. Первичный микропластик – это специально произведенные и добавленные в различную продукцию микрогранулы пластика, применяемые в производстве косметики, чистящих средств и наполнителей [11]. Вторичный микропластик – продукты распада в природной среде крупных фрагментов пластика на микроскопические частицы. Микропластик в окружающей среде присутствует в виде обломков различной формы, первичных микрогранул, волокон.
Основные источники попадания пластика в природную среду – бытовые и промышленные сточные воды. Синтетические волокна отделяются от различных вещей при стирке и разрушении тканей. Другой источник пластиковых волокон – рыболовные сети.
Фрагменты микропластика крайне сложно изъять из окружающей среды, и они становятся потенциально опасными для экосистем. Частицы пластика в водной среде обрастают биопленкой, состоящей из микроорганизмов и гумусовых веществ. Микропластик может сорбировать на поверхности токсичные вещества, включая устойчивые органические загрязнители и тяжелые металлы [20]. Частицы пластика вместе с токсикантами могут попадать в живые организмы, передаваясь по пищевым цепям.
Финский залив – крупнейший водный объект Санкт-Петербурга и Ленинградской области. Он расположен в восточной части Балтийского моря и омывает берега России, Финляндии и Эстонии. Финский залив активно используется в хозяйственных и рекреационных целях. Акватория Финского залива – конечный бассейн стока, куда попадает множество загрязнителей, включая пластиковые частицы, с городскими сточными водами, стоком р. Невы, а также в результате распада на мелкие частицы рыболовных сетей и крупного мусора [1].
Цель данной работы – исследование содержания частиц микропластика на прибрежной территории и мелководной части акватории Невской губы Финского залива.
Задачи работы – анализ концентрации частиц микропластика в воде, донных отложенияx и прибрежных грунтаx, а также исследование химического состава преобладающих типов полимеров на данной территории.
МАТЕРИАЛЫ И МЕТОДЫ
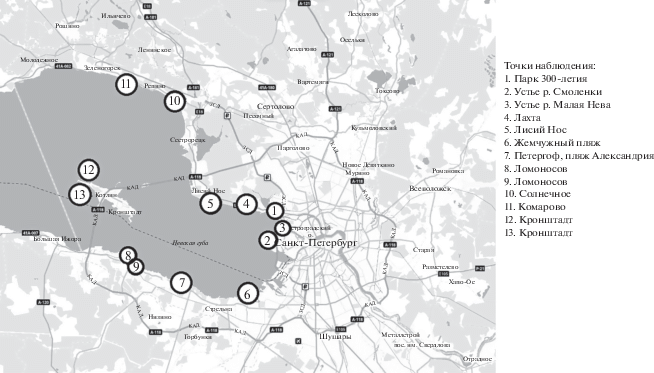
Объекты исследования – вода, прибрежные грунты и донные отложения Невской Губы Финского залива. Пробы были отобраны в 13-ти точках (рис. 1).
Рис. 1.
Картосхема территории отбора проб на побережье восточной части Финского залива. Кружки с числами – точки отбора проб.
Пробы воды поверхностного слоя отбирались при помощи фильтровальной установки в прибрежной зоне на расстоянии ~10 м от уреза воды. Вода фильтровалась через сетку с размером ячейки 100 мкм. Осажденный на сетке материал в дальнейшем исследовался при помощи оптических и спектральных методов.
В точках отбора воды также взяты пробы прибрежных грунтов и донных отложений по методике, разработанной на основе подхода, реализованного в ряде научных исследований [7]. Согласно методике, пробы прибрежных осадков и донных отложений отбирались в ясную погоду в отсутствие объектов и факторов, ограничивающих волновые процессы в зоне контакта морской среды и суши.
На исследуемых участках пляжей были выбраны полигоны протяженностью 100 м вдоль береговой линии.
Для исследования концентрации частиц микропластика в прибрежных грунтах и донных отложениях отбор проб был проведен в трех зонах в пределах одного полигона длиной 100 м (рис. 2):
1) зона заплеска волн – наивысшая отметка максимальной волновой активности, фиксируемая чаще всего по остаткам биогенного и антропогенного материала (сухой тростник, древесные щепки, пластик);
2) линия уреза воды – зона непосредственного контакта кромки воды с сушей;
3) зона донных отложений ниже уреза воды на глубине ~0.5 м.
В каждой зоне проводился отбор проб из пяти точек, распределенных равномерно вдоль всей длины полигона. Таким образом, сформирована усредненная проба для каждой зоны.
В мировой практике аналогичных исследований применялся послойный анализ микропластика в пляжных отложениях. Результаты показали сходные концентрации частиц на глубинах 1–5 см. В связи с этим в данном исследовании глубина отбора проб отложений в береговой зоне составила от 1 до 5 см для всех обследуемых зон прибрежной территории [7].
Для исследования прибрежных грунтов и донных отложений пробы были предварительно подготовлены – микропластик отделен от минерального и органического вещества осадка [19, 22]. В зависимости от вещественного и гранулометрического состава и типа грунта методы выделения частиц микропластика могут несколько различаться. Однако большинство методик зарубежных и российских исследований обязательно включают в себя этапы плотностного разделения составляющих грунта, а также их последующего химического окисления для растворения лабильного органического вещества.
Плотностное разделение проб прибрежных и донных отложений в растворе ZnCl2
Взмучивание и отстаивание проб грунтов в растворах различных солей позволяет отделить более плотные минеральные частицы от частиц пластика, плотность которого в зависимости от типа полимера, а также адсорбированной на его поверхности биопленки варьирует от 0.8 до 1.6 г/см3. Для этой цели чаще всего используют NaCl (1.2), NaBr (1.4) NaI (1.6), ZnCl2 (1.7 г/см3). Наиболее плотные растворы (NaI и ZnCl2) позволяют выделить до 99% полимеров, включая пластик с высокой плотностью.
В данном исследовании 400 г навески воздушно-сухой пробы заливались 55%-м раствором ZnCl2 (1.7 г/см3) в стеклянном стакане, перемешивалось при помощи стеклянной палочки в течение 30 мин, а далее отстаивалось в течение 1 ч. После отстаивания пробы и осаждения тяжелой минеральной фракции оставшаяся жидкость с частицами микропластика и органическим веществом сливалась в стеклянную колбу для последующего растворения лабильного биологического материала (фрагменты живых организмов, гумусовое вещество) в соответствии с методикой, разработанной в Институте Океанологии им. Ширшова РАН [22].
Мокрое перекисное окисление проб прибрежных и донных отложений
Морские и донные отложения содержат от 0.5 до 7.0% биологического материала [9]. Следовательно, возникает необходимость разработки метода разрушения биологических остатков, содержащихся в пробе, без воздействия на частицы микропластика. Для этих целей возможно использование различных реагентов в сочетании с нагреванием раствора: перекись водорода, кислоты, щелочи, энзимы [9].
В данном исследовании использовался широко распространенный метод, рекомендуемый NOOA [16]. Проба заливается 30%-м раствором H2O2 и в присутствии катализатора Fe(II) 0.05 М нагревается на водяной бане до 75°С, а далее кипятится до растворения биологического материала. После растворения лабильного органического вещества раствор фильтруется в стеклянный стакан через фильтр (металлическую сетку) с ячейкой 100 мкм. На фильтре остаются частицы микропластика и устойчивые крупные фрагменты биологического материала, которые удаляются с помощью металлического пинцета.
Сепарация проб в растворе ZnCl2
Для дополнительного очищения микропластика от мешающих анализу частиц проводится центрифугирование пробы в растворе 55% ZnCl2. Супернатант (надосадочная жидкость) снова концентрируется на фильтре с ячейкой 100 мкм. Сконцентрированная на сетке проба анализируется качественно и количественно.
Анализ подготовленных проб воды, прибрежных грунтов и донных отложений проводился в несколько этапов. На первой стадии частицы микропластика предварительно идентифицировались при помощи светового микроскопа. Для визуального анализа частиц микропластика были использованы рекомендации, представленные в [14]. При исследовании проб в световом микроскопе особое внимание уделялось пластиковым волокнам, которые могут иметь сходные с биологическими остатками, например нитевидными водорослями, визуальные характеристики. Основные отличительные черты искусственных полимеров – отсутствие клеточной структуры, в некоторых случаях – неравномерность окраски. Микроскопические обломки пластика зачастую имеют острые неровные края. Однако присутствие на поверхности частиц микропластика биопленки и его частичная деструкция в результате длительного воздействия внешних факторов могут значительно затруднять визуальную идентификацию пластиковых фрагментов. Эта проблема может быть решена при помощи спектральных методов анализа состава вещества.
Для верификации данных и получения информации о химическом составе частиц был подготовлен интегральный образец на основе всех исследуемых проб, отобранных на урезе воды и из донных отложений. При подготовке образца проводилось плотностное отделение и растворение лабильного органического вещества по методике, указанной выше. Пробы отложений с линии заплеска не включались в интегральную пробу по ряду причин, описанных в следующем разделе.
Интегральный образец исследован методами Рамановской и ИК-спектрометрии.
Рамановский спектр образца микропластика получен на приборе “Horiba Jobin-Yvon LabRam HR800”, оснащенном микроскопом (“Olympus BX41”) с лазерами Ar+ с перестраиваемыми длинами волн от 457 до 514 нм, с набором фильтров notch для работы на 488 и 514 нм и мощностью до 50 mW, спектральным разрешением до 1.5 см–1. Этот прибор позволяет исследовать частицы ≥20 мкм. Анализ выполнен на базе Ресурсного центра Геомодель СПбГУ.
ИК-спектры получены при помощи спектрометра ИК-Фурье “Shimadzu IRTracer-100” в спектральном диапазоне от 350 до 4000 см–1 со спектральным разрешением 1 см–1. Перед исследованием образцы были спрессованы в таблетки с использованием кристаллического KBr по методике, описанной в работах [2, 3].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Исследование проб воды, прибрежных и донных отложений при помощи оптического микроскопа позволило предварительно оценить количество частиц микропластика, а также их морфологические характеристики.
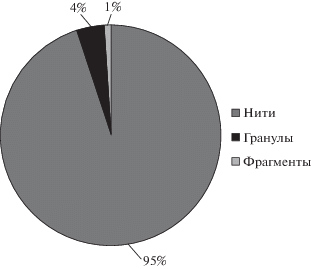
По форме частиц во всех пробах воды и осадков прибрежной зоны преобладают волокна/нити (рис. 3, 4), что также соотносится c исследованиями в других странах [12, 13, 15].
Рис. 3.
Доли (%) частиц микропластика различной формы в воде по результатам исследования проб Невской губы Финского залива.
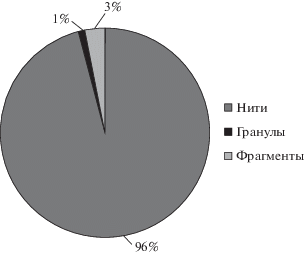
Рис. 4.
Доли (%) частиц микропластика различной формы в донных осадках и прибрежных грунтах по результатам исследования проб Невской губы Финского залива.
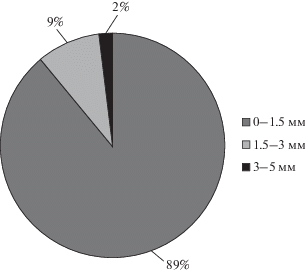
В пробах воды, донных осадков и в прибрежных грунтoв преобладают частицы размером ≤1.5 мм (1500 мкм) (рис. 5). Это также соотносится с другими исследованиями [18, 21]. Процесс разрушения пластика на мельчайшие фрагменты в природной среде ускоряется под влиянием таких факторов, как ультрафиолетовая радиация и ветер [18].
Рис. 5.
Доли (%) частиц микропластика различных размеров по результатам исследования проб воды и осадков прибрежной зоны Невской губы Финского залива.
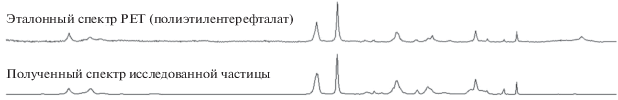
Химический состав фрагментов, предварительно идентифицированных как пластик, проанализирован при помощи спектроскопии Рамановской (рис. 6) [5]. Среди нитевидных фрагментов найдены единичные образцы волос и хлопковых нитей. Однако большинство нитевидных частиц идентифицировано как пластик. На большинстве полученных спектров пластика из исследуемого образца наблюдались полосы поглощения, соответствующие полиэтилентерефталату (рис. 6, 7).
Рис. 6.
Полосы комбинационного рассеяния на полученном спектре, соответствующие колебанию молекулярных связей в полиэтилентерефталате.
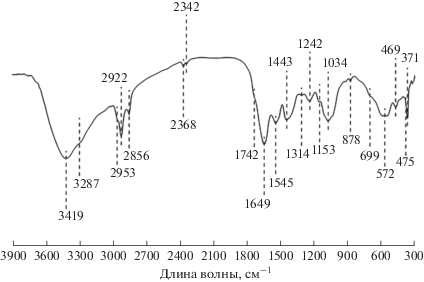
Полученные данные дополнительно верифицированы при помощи методов спектроскопии ИК-Фурье. На полученных спектрах также наблюдались полосы поглощения, соответствующие полиэтилентерефталату (рис. 8) [20].
Наличие дополнительных полос поглощения, относящихся к колебанию молекулярных связей, объясняется особенностями пробоподготовки и невозможностью полностью очистить анализируемый образец от примеси соединений, особенно в условиях пресноводных объектов, содержащих большое количество органического вещества. Существующие на данный момент методики пробоподготовки не позволяют полностью избавиться от биологического материала и хлопковых нитей, не повреждая при этом пластиковые фрагменты.
Полученные результаты количественной оценки показали, что концентрации частиц микропластика в грунтах прибрежной зоны значительно выше, чем в воде. Результаты исследования концентрации частиц микропластика в воде, прибрежных грунтах и донных осадках представлены в табл. 1.
Таблица 1.
Концентрации микропластика в воде, донных осадках и прибрежных грунтах Невской губы Финского залива
| Точка отбора проб | Зона отбора проб | Концентрация частиц на 1 кг | Концентрация частиц на 1 л воды |
|---|---|---|---|
| Парк 300-летия, точка 1 | Зона заплеска | 204 | – |
| Зона уреза воды | 210 | – | |
| Донные отложения | 120 | – | |
| Поверхностный слой воды | – | 3 | |
| Устье р. Смоленки, точка 2 | Зона заплеска | 30 | – |
| Зона уреза воды | 38 | – | |
| Донные отложения | 60 | – | |
| Поверхностный слой воды | – | 1.1 | |
| устье р. Малой Невы, точка 3 | Зона заплеска | 40 | – |
| Зона уреза воды | 20 | – | |
| Донные отложения | 30 | – | |
| Поверхностный слой воды | – | – | |
| Лахта, точка 4 | Зона заплеска | 45 | – |
| Зона уреза воды | 195 | – | |
| Донные отложения | 165 | – | |
| Поверхностный слой воды | – | 2.2 | |
| Лисий Нос, точка 5 | Зона заплеска | 30 | – |
| Зона уреза воды | 70 | – | |
| Донные отложения | 38 | – | |
| Поверхностный слой воды | – | 1.3 | |
| Жемчужный пляж, точка 6 | Зона заплеска | 70 | – |
| Зона уреза воды | 148 | – | |
| Донные отложения | 78 | – | |
| Поверхностный слой воды | – | 1.7 | |
| Петергоф, точка 7 | Зона заплеска | 63 | – |
| Зона уреза воды | 25 | – | |
| Донные отложения | 75 | – | |
| Поверхностный слой воды | – | 4.7 | |
| Ломоносов. точка 8 | Зона заплеска | 33 | – |
| Зона уреза воды | 15 | – | |
| Донные отложения | 40 | – | |
| Поверхностный слой воды | – | 2.8 | |
| Ломоносов. точка 9 | Зона заплеска | 38 | – |
| Зона уреза воды | 18 | – | |
| Донные отложения | 45 | – | |
| Поверхностный слой воды | – | – | |
| Солнечное, точка 10 | Зона заплеска | 83 | – |
| Зона уреза воды | 53 | – | |
| Донные отложения | 58 | – | |
| Поверхностный слой воды | – | – | |
| Комарово, точка 11 | Зона заплеска | – | – |
| Зона уреза воды | – | – | |
| Донные отложения | – | – | |
| Поверхностный слой воды | – | 1.3 | |
| Кронштадт 1, точка 12 | Зона заплеска | – | – |
| Зона уреза воды | – | – | |
| Донные отложения | – | – | |
| Поверхностный слой воды | – | 0.2 | |
| Кронштадт 2, точка 13 | Зона заплеска | – | – |
| Зона уреза воды | – | – | |
| Донные отложения | – | – | |
| Поверхностный слой воды | – | 0.7 |
Донные отложения служат депонирующей средой, в которой происходит осаждение и накопление частиц микропластика, что подтверждают данные исследований [14]. Это происходит в основном за счет нарастания биопленки (микроорганизмов, детрита, гумусовых веществ). Концентрация микропластика в донных отложениях – наиболее стабильный показатель, чем концентрация в поверхностном слое воды и водной толще, и отражает долгосрочные процессы загрязнения.
По мере удаления от г. Санкт-Петербурга и устья Невы вдоль как северного, так и южного побережья происходит уменьшение концентраций микропластика на урезе воды от 336 частиц на литр в районе Парка 300-летия в Приморском районе г. Санкт-Петербурга до 74 частицы на литр в районе Сестрорецка (рис. 9). Очевидно, что сток р. Невы – один из основных источников загрязнения вод Невской губы; при впадении Невы в Финский залив происходит разбавление вод, загрязненных частицами микропластика, и дальнейший их транзит и распределение в соответствии с господствующим гидродинамическим переносом в западном направлении.
Рис. 9.
Распределение микропластика в донных отложениях и прибрежных грунтах по результатам исследования проб Невской губы Финского залива (частицы/литр).
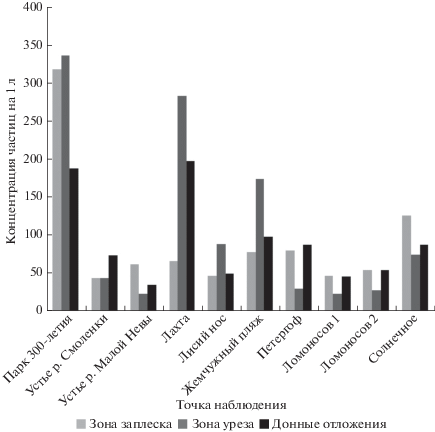
Для донных отложений закономерность уменьшения концентраций микропластика с востока на запад прослеживается только вдоль южного побережья Невской губы, а на севере данная закономерность, вероятно, нарушается наличием локальных источников загрязнения. Так, в районе пос. Солнечного наблюдается увеличение концентраций микропластика в донных отложениях по сравнению с районом Лисьего носа, что может быть объяснено поступлением частиц со стоком р. Сестры, их выносом и постепенным осаждением в непосредственной близости от устья.
По данным о содержании микропластика в прибрежных грунтах, отобранных в зоне заплеска, невозможно проследить таких очевидных тенденций, однако в целом по северному побережью получены более высокие концентрации. Возможно, это связано с преобладанием аккумуляционных типов берегов в северной части залива.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выбор методик пробоотбора и пробоподготовки зависит напрямую от особенностей конкретного водного объекта, егo географического положения, сезона отбора проб и, как следствие, количества биологического материала и взвешенных частиц в воде.
В связи с большим количеством биологического материала, содержащегося в пробах воды, прибрежных грунтах и донных отложениях Невской губы Финского залива, требуются дополнительные этапы лабораторной пробоподготовки. Методика, предложенная в данной работе, не позволяет полностью удалить биологический материал и другие факторы, которые могут искажать данные визуального и спектрального анализа.
Полученные в работе результаты показали, что исследование распределения концентраций частиц микропластика должно проводиться по данным, полученным отдельно для однотипных мест отбора –зоны уреза воды, зоны заплеска волн, проб донных отложений в прибрежной зоне. На данный момент сравнение концентраций микропластика из трех зон в каждой точке в отдельности нецелесообразно из-за множества факторов распределения частиц в этих зонах. Среди этих факторов стоит выделить поступление частиц с поверхностным стоком (смыв с водосборной площади), характер волнения и береговых процессов, определяющих поступление частиц из водной среды в зону заплеска, а также их смыв с поверхности пляжа обратно в водную среду. Определить степень участия каждого из перечисленных факторов в распределении частиц микропластика по зонам в каждой конкретной локации на сегодня невозможно из-за ограниченности да-нных.
В зоне заплеска волн влияние факторов, определяющих концентрации частиц пластика, наиболее неоднородно и определяется погодными условиями, характером волновых процессов, штормами, предшествовавшими моменту отбора проб в береговой зоне. При этом, вероятно, в зоне, где господствуют аккумуляционные береговые процессы, возможны концентрации, повышенные по сравнению с зоной, где развита абразия берегов. Концентрации микропластика на урезе воды характеризуют поступление частиц из поверхностного слоя воды; эти данные в меньшей степени искажаются погодными условиями при соблюдении рекомендаций по отбору проб, предусматривающих проведение отбора в период со слабым ветровым волнением или при штиле.
Основной источник загрязнения вод Невской губы – г. Санкт-Петербург с р. Невой, выносящей частицы микропластика в Финский залив, где они далее распределяются в соответствии с господствующим гидродинамическим атмосферным переносом.
ЗАКЛЮЧЕНИЕ
Проблема загрязнения водных объектов микропластиком – относительно нова и с каждым годом привлекает все больше внимания исследователей. В настоящее время в России эта тема только начинает развиваться. В настоящей работе исследованы воды, донные отложения и прибрежные грунты Невской губы Финского залива. Выявлены преобладающие формы частиц, их размерный диапазон, химический состав полимеров и их количественное содержание.
Список литературы
Еремина Т.Р., Ершова А.А. Исследование проблемы морского мусора в регионе Финского залива // Тр. II Всерос. конф. “Гидрометеорология и экология: достижения и перспективы развития”. 2018. С. 254–256.
Кондрашкова И.С., Мартинсон К.Д., Захарова Н.В., Попков В.И. Особенности формирования и фотокаталитическая активность нанокристаллов HoFeO3, полученных термообработкой продуктов глицин-нитратного горения // Журн. общей химии. 2018. Т. 88. № 12. С. 1943–1950.
Мартинсон К.Д., Черепкова И.А., Соколов В.В. Формирование наночастиц феррита кобальта в условиях глицин-нитратного горения и их магнитные свойства // Физика и химия стекла. 2018. Т. 44. № 1. С. 32–38.
Andrady A.L. Microplastics in the marine environment // Marine Pollution Bull. 2011. V. 62. P. 1596–1605.
Araújo C.F., Nolasco M.M., Ribeiro A.M.P., Ribeiro-Claro P.J.A. Identification of microplastics using Raman spectroscopy: Latest developments and future prospects // Water Res. 2018. V. 142. P. 426–440.
Barnes D.K.A., Galgani F., Thompson R.C., Barlaz M. Accumulation and fragmentation of plastic debris in global environments // Philosophical Transactions of the Royal Society B. 2009. V. 364. № 1526. P. 1985–1998.
Besley A., Vijver M.G., Behrens P., Bosker T. A standardized method for sampling and extraction methods for quantifying microplastics in beach sand // Marine Pollution Bull. 2017. V. 114. № 1. P. 77–83.
Cole M., Lindeque P., Halsband C., Galloway S.C. Microplastics as contaminants in the marine environment: a review // Marine Pollution Bull. 2010. V. 62. P. 2588–2597.
Crichton E.M., Noël M., Gies E.A., Ross P.S. A novel, density-independent and FTIR-compatible approach for the rapid extraction of microplastics from aquatic sediments // Analytical Methods. 2017. № 9. P. 1419–1428.
Geyer R., Jambeck J.R., Law K.L. Production, use, and fate of all plastics ever made // Sci. Advances. 2017. V. 3. № 7. 5 p.
Gregory M.R. Plastic ‘scrubbers’ in hand cleansers: a further (and minor) source for marine pollution identified // Marine Pollution Bull. 1996. V. 32. P. 867–871.
Hammer J., Kraak M.H., Parsons J.R. Plastics in the marine environment: the dark side of a modern gift // Rev. Environ. Contamination and Toxicol. 2012. V. 220. P. 1–44.
Henry B., Laitala K., Klepp I.G. Microfibres from apparel and home textiles: Prospects for including microplastics in environmental sustainability assessment // Sci. Total Environ. 2019. V. 652. P. 483–494.
Hidalgo-Ruz V., Gutow L., Thompson R.C., Thiel M. Microplastics in the marine environment: a review of the methods used for identification and quantification // Environ. Sci. Technol. 2012. V. 46. № 6. P. 3060–3075.
Karlsson T.M., Vethaak A.D., Almroth B.C., Freek A., van Velzen M., Hassellöv M., Leslie H.A. Screening for microplastics in sediment, water, marine invertebrates and fish: Method development and microplastic accumulation // Marine Pollution Bull. 2017. V. 122. P. 403–408.
Masura J., Baker J., Foster G., Arthur C. Laboratory Methods for the Analysis of Microplastics in the Marine Environment: Recommendations for quantifying synthetic particles in waters and sediments. NOAA Technical Memorandum NOS-OR&R-48 // NOAA Marine Debris Program. 2015. 31 p.
Mato Y., Isobe T., Takada H., Kanehiro H., Ohtake C., Kaminuma T. Plastic resin pellets as a transport medium for toxic chemicals in the marine environment // Environ. Sci. Technol. 2001. V. 35. P. 318–324.
Pan Z., Guo H., Chen H., Wang S., Sun X., Zou Q., Zhang Y., Lin H., Cai S., Huang J. Microplastics in the Northwestern Pacific: Abundance, distribution, and characteristics // Sci. Total Environ. 2019. V. 650. P. 1913–1922.
Prata J.C., da Costa J.P., Duarte A.C., Rocha-Santos T. Methods for sampling and detection of microplastics in water and sediment: A critical review // TrAC Trends in Analytical Chem. 2019. V. 110. P. 150–159.
Umamaheswari S., Murali M. FTIR spectroscopy study of fungal degradation of poly (ethylene terephthalate) and polystyrene foam // Chem. Engineering. 2013. V. 64. P. 19 159–19 164.
Zhang H. Transport of microplastics in coastal seas // Estuarine, Coastal and Shelf Sci. 2017. V. 199. P. 74–86.
Zobkov M., Esiukova E. Microplastics in Baltic bottom sediments: Quantification procedures and first results // Marine Pollution Bull. 2017. V. 114. P. 724–732.
Дополнительные материалы отсутствуют.