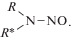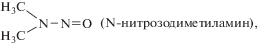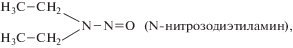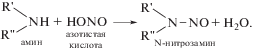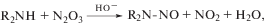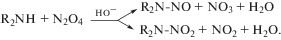Водные ресурсы, 2021, T. 48, № 1, стр. 80-89
Нитрозамины в водных экосистемах: источники, образование, токсичность, экологический риск (обзор) 1. Структура, свойства, источники поступления и образование в водоемах
И. И. Руднева a, *, С. О. Омельченко b, **
a ФИЦ “Институт биологии южных морей им. А.О. Ковалевского РАН
229011 Севастополь, Россия
b ГБОУ дополнительного профессионального образования Республики Крым,
Крымский республиканский институт постдипломного педагогического образования
295000 Симферополь, Россия
* E-mail: svg-41@mail.ru
** E-mail: svet.omelchenko@mail.ru
Поступила в редакцию 22.04.2020
После доработки 13.05.2020
Принята к публикации 09.06.2020
Аннотация
В связи с насыщением природных вод соединениями азота в результате естественных процессов и антропогенной деятельности возникает проблема исследования путей их миграции, трансформации в гидросфере и в гидробионтах. Один из путей трансформации азота в природной среде – образование нитрозаминов – токсических соединений, проявляющих канцерогенные, мутагенные и тератогенные свойства и оказывающих токсическое действие на живые организмы. Основные источники поступления азотсодержащих соединений, предшественников нитрозаминов, в водные объекты – сельскохозяйственные, промышленные и коммунальные сточные воды. Рассмотрены пути синтеза нитрозаминов в водной среде и в организмах, приведены основные методы анализа этих соединений, распространение и трансформация в гидросфере, а также пути снижения их концентрации и современные способы их удаления из водных объектов.
ВВЕДЕНИЕ
Качество воды – результат совокупности природных процессов и хозяйственной деятельности человека, приводящей к антропогенному загрязнению гидросферы. Эрозия почв вызывает помутнение и образование осадков в водных объектах. Трансформация органических загрязнителей связана с потреблением большого количества кислорода, что приводит к резкому, подчас катастрофическому сокращению его в воде, а насыщение водной среды соединениями азота и фосфора провоцирует эвтрофирование. Пестициды, синтетические органические компоненты и тяжелые металлы, содержащиеся в промышленных и сельскохозяйственных сточных водах, а также фармпрепараты, гормоны, средства личной гигиены и продукты их разложения токсичны для биоты и оказывают другое, пока не изученное влияние на экосистемы. Токсины в питьевой воде могут приводить к различным заболеваниям. Помимо этого, увеличение в атмосфере содержания окислов углерода, серы и азота также влияет на физико-химические свойства воды и ее пригодность для использования как в питьевых целях, так и для нормального существования биоты.
Азот – важнейший элемент и лимитирующий фактор водных экосистем, он оказывает существенное влияние на их состояние и функционирование, особенно при производстве первичной продукции [43, 49]. Азот, входящий в состав органических растворенных веществ (РОВ), – активный компонент донных осадков, поскольку 12–72% этого элемента в составе РОВ используют бактерии и микроводоросли [33]; его доступность и миграция играют важную роль в динамических процессах минерализации, иммобилизации, поглощении и абсорбции растениями, на чем основан цикл азота в водных экосистемах [39]. Азот поглощается из РОВ гидробионтами для синтеза многих важных биологических молекул – мочевины, растворимых аминокислот, белков, нуклеиновых и гуминовых кислот и других органических соединений [30]. Соединения азота широко распространены в гидросфере, куда они попадают со сточными водами промышленных и сельскохозяйственных комплексов, предприятий коммунального хозяйства, а также с атмосферными осадками. Изменение содержания азота в водной экосистеме не только влияет на физико-химические свойства воды, донных осадков, структуру и состав гидробионтов [60], но также негативно сказывается на качестве воды, способствует развитию эвтрофирования, что в значительной степени ухудшает здоровье водных обитателей [30, 31, 42, 45] и создает опасность для здоровья человека [38, 58]. Процессы трансформации азота в биосфере оказывают существенное влияние на природную среду и на деятельность людей. В настоящее время в связи с глобальными климатическими изменениями на планете и антропогенной активностью происходят изменения и в определяющих геохимических циклах веществ, включая цикл азота [15].
В связи с этим актуальна еще одна проблема, связанная с избыточными концентрациями азотсодержащих соединений в воде, в результате чего возможно образование различных азотсодержащих соединений с токсичными и иными вредными свойствами. К ним, в частности, относятся нитрозамины (НА), которые отличаются высокой стабильностью, устойчивы к температуре и к свету, могут длительно сохраняться в окружающей среде, не подвергаясь разложению. НА синтезируются в процессе реакций нитрозирования, в результате взаимодействия вторичных и третичных аминов с нитритами и нитратами. Исследование круговорота азота в биосфере и путей образования НА весьма актуально для водной экологии и включает в себя несколько аспектов:
определение источников НА;
изучение процессов образования и трансформации этих соединений в природной среде в целом и в водных объектах в частности;
изучение содержания НА в среде в зависимости от уровня ее эвтрофирования и антропогенного загрязнения;
анализ взаимодействия НА с другими загрязнителями, в том числе “новыми”, к которым относятся фармпрепараты, гормоны, пластик и т.д.;
разработка методов и способов утилизации НА и их удаления из водоемов.
Цель настоящей работы заключалась в анализе путей образования, трансформации и влияния НА на водные экосистемы, роли антропогенных процессов в их распространении в гидросфере, описании методов и способов удаления НА из водных объектов.
СТРУКТУРА И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА НИТРОЗАМИНОВ
К N-нитрозосоединениям (НС) относятся соединения типа:
Общая для НС – только группа N–NO, R – алкильный, арильный или алициклический радикал, а R * может быть представлен эфирными, ароматическими, амидной и другими группами, от которых зависят их специфические химические, физические и биологические свойства [19, 22, 24, 51].
НА – маслянистые жидкости или твердые вещества, слабо растворимые в воде и хорошо растворимые во многих органических растворителях. Среди них есть летучие соединения, которые можно перегнать с водяным паром, на чем основаны методы их выделения и идентификации. НА достаточно стабильные вещества, они не разрушаются растворами щелочей и разбавленных кислот и почти не подвержены действию рассеянного света, что обеспечивает их устойчивость и длительность нахождения в окружающей среде.
Строение и сравнительно легкая подвижность π-электронов в молекулах НА обусловливают их высокую реакционную способность. Они могут протонироваться, образовывать водородные связи со спиртами, фенолами, присоединять некоторые вещества, например галоидные алкилы, создавать комплексы с различными солями. Под влиянием разбавленных минеральных кислот происходит денитрозирование НС, которое ускоряется при повышении их концентрации. Наиболее активно реакция протекает в ледяной уксусной кислоте в присутствии НВr. Расщепление N–N-связи происходит при действии УФ-света или γ-облучения. НС устойчивы к воздействию температуры (200–250°С) и подвергаются пиролизу при 400–500°С. В целом НА – стабильные соединения, которые медленно разлагаются на свету или в водных растворах кислот. Физические свойства N-нитрозаминов зависят от природы замещающих групп. Некоторые из них, например N-нитрозодиметиламин, представляют собой маслянистые жидкости, хорошо растворяющиеся в органических растворителях, другие, например N-нитрозодифениламин, – твердые вещества, практически нерастворимые в воде. Значительно различаются и коэффициенты распределения этих веществ в системе липид/вода. Максимумы УФ-поглощения НА в воде – в области 230–240 и 330–350 нм [2, 7, 19].
Наиболее опасны НА, проявляющие выраженный канцерогенный эффект, следующие [11, 12]:
Синтез НА происходит путем введения нитрозо группы во вторичные амины или амиды нитритом натрия в слабокислой среде, оксидом азота(III), оксидом азота(I), а также реакцией вторичных аминов с нитритом натрия и формальдегидом или хлоралем. НА образуются в результате реакции нитрозирования, в которой в качестве нитрозируемых соединений могут выступать различные моно-, ди- и полиамины и другие азотсодержащие вещества. Быстро и легко нитрозируются вторичные и третичные амины и соединения, содержащие группы (CH3)2N– и (С2Н5)2N–. Нитрозирующими агентами служат производные азотистой кислоты XNO (X-галоген, NO2, NO3, ${\text{ОН}}_{2}^{ + }$, OR), нитрозоний-катион и др. Нитрит-ион и свободная HNO2 в кислой среде превращаются в активные нитрозирующие агенты, а в присутствии галогенводородных кислот – в соответствующие нитрозилгалогениды [19, 25, 26, 37]. В реакции нитрозирования участвуют первичные, третичные и четвертичные амины, но наиболее активно и с наибольшим выходом протекает реакция с вторичными аминами. Нитрозирование происходит в присутствии нитрита натрия, что имеет большое биологическое значение в связи с широким распространением последнего в окружающей среде, где наиболее часто обнаруживаются два представителя этого класса вредных веществ – нитрозодиметиламин и нитрозодиэтиламин. Нитраты при определенных условиях могут восстанавливаться в нитриты, которые в кислой среде дают азотистую кислоту, а она, взаимодействуя с вторичными и третичными аминами, образует канцерогенные нитрозамины [1]:
Следует отметить, что при переработке водных биологических ресурсов и других пищевых продуктов также синтезируются НА, более 100 соединений из которых в зависимости от природы радикала могут проявлять канцерогенное действие. Наиболее часто в пищевых продуктах обнаруживаются нитрозодиметиламин и нитрозодиэтиламин.
Существенный интерес представляет реакция перенитрозирования (транснитрозирования), при которой в качестве нитрозирующих агентов могут выступать различные НС [9]. В результате этой реакции могут образовываться активные канцерогены из соединений, у которых канцерогенное действие отсутствует или выражено слабо. Реакция перенитрозирования может проходить в различных объектах и в организме. Вторичные амины нитрозируются нитратами после их превращения в ${\text{NO}}_{2}^{ - },$ NO2 или NO.
Менее изучено взаимодействие нитрозирующих агентов с первичными аминами, при котором выход НА незначителен. Нитрозированию третичных аминов предшествует стадия расщепления. Третичные амины нитрозируются труднее, чем вторичные, и даже при оптимальных условиях их выход редко достигает 40–50% [32]. Четвертичные аммонийные соединения нитрозируются менее активно, чем третичные амины, реакция протекает при повышенной температуре и высоких концентрациях реагирующих соединений, причем выход НА невелик. За счет реакции нитрозирования многие НС легко синтезируются в природной среде и различных организмах [9]. В качестве нитрозируемых соединений могут выступать различные моно-, ди- и полиамины и другие азотсодержащие вещества. Быстро и легко происходит реакция вторичных и третичных аминов с нитратами и нитритами, особенно с нитратом натрия [19].
Таким образом, образование НА происходит как в природной среде, так и в организмах, в том числе в продуктах питания, получаемых из водных биологических ресурсов, что представляет непосредственную опасность для здоровья людей.
МЕТОДЫ ОПРЕДЕЛЕНИЯ НИТРОЗАМИНОВ В ВОДЕ И В ГИДРОБИОНТАХ
Для определения НА используются различные методы экстракции, разделения и последующего анализа. Выделяют НА из образцов путем вакуумной возгонки или перегонки с паром, экстракцией минеральными маслами, на колонках с цеолитом или твердофазной экстракцией [57, 61]. Один из перспективных методов выделения N-нитрозамнов основан на их неспецифическом взаимодействии с нафионом, в результате чего они концентрируются на поверхности электрода по механизму твердофазной экстракции. Предел обнаружения для большинства N-нитрозаминов составляет 0.3 мкмоль/л, время накопления составляет 30 мин. Указанный электрод может работать и как сенсор при определении N-нитрозаминов в газовой фазе, что позволяет анализировать присутствующие в атмосферном воздухе ультрамикроконцентрации (~0.001 мг/м3) очень токсичного М-нитрозоди-метиламина.
Для идентификации НА применяются следующие физико-химические методы: спектрофотометрия, хроматография, электрохимия и хемилюминесценция.
Спектрофотометрические методы определения можно разделить на 4 группы: нитрование ароматических органических соединений (особенно фенолов); окисление органических соединений; восстановление нитрат-ионов до нитрит-ионов; поглощение нитратов в УФ-области спектра. Получаемые соединения имеют максимум светопоглощения в ближней УФ- и видимой областях спектра. Интенсивность светопоглощения пропорциональна содержанию нитратов в анализируемой пробе [55].
Для определения летучих НА применяются хроматографические методы – газовая и газожидкостная хроматография. Газохроматографический метод определения обладает высокой чувствительностью и достаточной точностью, но его недостаток – влияние сопутствующих веществ на результаты анализа. Наличие галогенидов приводит к занижению результатов определения содержания НА в образцах, а загрязненность серной кислотой нитратами – к их завышению.
Метод газожидкостной хроматографии основан на нитровании органических соединений ароматического ряда – бензола и его производных в присутствии серной кислоты, разделении их с помощью колонки, заполненной специальными сорбентами, испарении и количественном определении нитропроизводных пламенно-ионизационным детектором или детекторами электронного захвата. В настоящее время используются комбинированные методы газохроматографического анализа и масс-спектрометрии с высоким разрешением (ГХМС с программированием температуры и капиллярные (или микронасадочные капиллярные) колонки с высокотемпературными неподвижными жидкими фазами и полярными неподвижными фазами). Для идентификации разных НА разработан метод ион-положительной химической ионизационной масс-спектрометрии, где в качестве газа используется метан или аммоний [61].
Для анализа НА используют флуориметрический метод, основанный на выделении летучих НА путем перегонки с паром; экстракции хлористым метиленом из водного дистиллята; концентрировании экстракта; денитрозировании НА бромистым водородом в уксусной кислоте; алкилировании образовавшихся аминов реактивом КАЭ с получением флуоресцирующих КАЭ-производных, которые затем разделяют методом тонкослойной хроматографии на пластинках с силикагелем. Идентификацию НА проводят при сравнении подвижности в тонком слое силикагеля флуоресцирующих КАЭ-производных из образца с подвижностью соответствующих стандартных производных: диметиламина (КАЭ-ДМА), диэтиламина (КАЭ-ДЭА), дипропиламина (КАЭ-ДПА). В основе полуколичественного определения лежит визуальное сравнение интенсивности флуоресценции пятен КАЭ-производных из образца с интенсивностью флуоресценции пятен стандартных соединений. Для количественного определения их извлекают из сорбента и измеряют флуоресценцию КАЭ-производных на флуориметре [13].
Для определения НА используют также хемилюминесцентный метод, суть которого состоит в выделении летучих НА путем перегонки с паром, экстракции хлористым метиленом НА из водного дистиллята, концентрировании экстракта, разделении смеси методом газожидкостной хроматографии и количественном определении немодифицированных НА с помощью высокоселективного и высокочувствительного хемилюминесцентного детектора. Для идентификации НА применяют разновидность хемилюминесцентного детектора – анализатора термической энергии. Его принцип действия основан на том, что выходящие из хроматографической колонки в токе газа-носителя НА подвергаются каталитическому разложению при повышенной температуре с образованием моноксида азота NO, который с потоком газа-носителя поступает в реакционную камеру, где реагирует с озоном, подаваемым в ту же камеру с потоком воздуха. При этом образуются возбужденные молекулы диоксида азота NO2, теряющие энергию возбуждения в виде квантов красного света, которые выделяются с помощью темно-красных светофильтров и улавливаются фотоумножителем. Чувствительность детектора очень высока, что позволяет определять содержание НА в пробе на уровне сотен пикограммов на килограмм [44].
Наиболее распространенный метод определения НА в воде и водных экстрактах пищевых продуктов – потенциометрический (ионометрический), основанный на измерении потенциала, возникающего на мембране ионоселективного электрода при погружении последнего в раствор, содержащий нитрат-ионы. Метод достаточно прост, хорошо изучен, экспериментально отработан и обеспечен аппаратурой, дает возможность быстро получить результат, в том числе в мутных и окрашенных средах. Чувствительность и избирательность метода зависят от свойств нитратселективного электрода, определяются свойством его мембраны [44].
В последнее время для определения источников поступления НА и их детекции применяют изотопные методы, сорбцию на мембранных микросорбентах с дальнейшей идентификацией известными методами и другие [48]. При этом дальнейшая стратегия разработки методических подходов определения содержания НА направлена на увеличение скорости и повышение чувствительности. Это достигается с помощью комбинирования разных методов, прежде всего хроматографических и масс-спектрометрических. Эффективное применение комбинированных методов позволяет определить содержание НА в объектах исследования от 0.001–5 до 2–100 нг/мл для жидкостей и от 2–50 до 4–100 нг/г для пищевых продуктов. Пределы определения составляют 0.0005–2 нг/мл, 2–5 нг/г – для жидких и биологических субстанций соответственно, время определения составляет 1–1.5 ч [29].
ИСТОЧНИКИ ПОСТУПЛЕНИЯ, ОБРАЗОВАНИЕ И НАКОПЛЕНИЕ НИТРОЗАМИНОВ В ВОДНОЙ СРЕДЕ
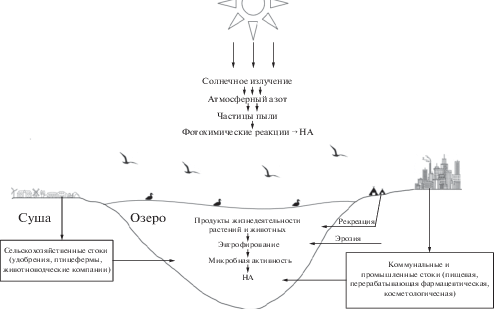
Основными источниками образования нитрозаминов в водной среде являются сточные воды промышленных и коммунальных предприятий, содержащие повышенные концентрации органического и минерального азота, а также поверхностные стоки с сельскохозяйственных угодий после применения минеральных удобрений, овоще- и силосохранилищ, животноводческих комплексов, свалки различных пищевых и растительных отходов [3, 9, 20, 21, 53, 54] (рис. 1). Значительное количество азотсодержащих соединений поступает в окружающую среду со сточными водами различных видов производств, мг/л Nобщ: птицефермы – 10–190, перегонные заводы – 1200, пивоварни – 25–35, предприятия по переработке морепродуктов – 25–405, заводы по производству молочной продукции – 60–310, мясоперерабатывающая промышленность – 90–700, фабрики по изготовлению предметов личной гигиены и фармпрепаратов – 15–130 [50]. Там, где для питьевых целей используются подземные воды с повышенной концентрацией нитратов, хлорирование в целях их дезинфекции может привести к образованию канцерогенных НА. Содержащиеся в атмосфере твердые частицы (пыль, песок, зола, сажа и аэрозоли органической (высокомолекулярные соединения) и неорганической природы адсорбируют на своей поверхности многие опасные соединения, включая НА [4].
В воде НА синтезируются в результате реакций перехода одной формы азота в другую и появления окислов азота. В этих процессах принимают активное участие микроорганизмы, использующие минеральные соединения азота как источник кислорода и образующие при этом в качестве промежуточных продуктов окислы азота, являющиеся предшественниками НА. При разложении биомассы микроводорослей происходит обогащение воды аммиаком, служащим предшественником синтеза НА [10, 11]. Присутствие в водоемах нитратов и нитритов наряду с фосфатами и другими биогенами значительно усиливает процесс эвтрофирования [14], во время которого появляются другие предшественники НА – амины.
Амины интенсивно образуются в почве и вымываются в водоемы, где поглощаются гидробионтами, включая рыб [17]. Образованию аминов способствует интенсивный рост биомассы водорослей, характерный для эвтрофных водоемов. Повышение биологической продуктивности водных объектов приводит к увеличению содержания в них аминов. Водоросли могут служить источником образования канцерогенных НС, так как они способны синтезировать легко нитрозируемые амины при наличии катализаторов нитрозирования среди их метаболитов [19, 21]. Водоросли, как и высшие растения, ассимилируют нитраты из воды и с помощью фермента нитратредуктазы превращают их в нитриты. Обнаружена прямая корреляция между интенсивностью прироста водорослевой массы и концентрацией нитритов в воде. При загрязнении водоемов нитратами (нитритами) водоросли могут синтезировать НС. Предполагают, что в природных условиях в местах ветровых сгонов водорослевых масс при сбраживании органических веществ сестона понижается кислотность воды, что вместе с образованием формальдегида, карбонильных и других соединений создает благоприятные условия для синтеза НС [5, 12, 18, 19, 53, 54]. При этом наиболее часто в объектах окружающей среды встречаются N-нитрозодиметиламин (НДМА) и N-нитрозодиэтиламин (НДЭА), а в отдельных случаях − N-нитрозопирролидин (НПир) и N-нитрозопиперидин (НПип), которые образовались в результате нитрозирования солей аминов [19, 27, 34].
НС могут образовываться в воде в результате не только химических, но и фотохимических процессов. НА легко синтезируются в водных растворах из вторичных аминов и N2O3 в ходе фотолитической реакции [16, 26, 33]:
а НА и N-нитрамины – из вторичных аминов и N2O4:Образование НА под действием солнечного света отмечено в воде с низким содержанием кислорода, поскольку последний ускоряет фотодеградацию НС [28, 38]. При наличии предшественников эта реакция может происходить в естественной среде, а в случае “закисления” водоемов при снижении значений рН отмечено повышение образования НС [61].
В настоящее время предполагают возможность образовании НА из так называемых “новых загрязнителей”, которые попадают в водную среду в результате как природных процессов, так и хозяйственной деятельности человека или их совокупности. Нерегулируемый сброс химических загрязнителей – только малая часть всех поллютантов, которые присутствуют в окружающей среде, но их концентрации, пути миграции и трансформации пока не изучены, что создает дополнительный риск для водных экосистем и человека [23, 56]. На эти вещества обратили внимание в последние 10–15 лет, но многие из них до сих пор не идентифицированы и вряд ли будут определены в ближайшем будущем. Они присутствуют в поверхностных и грунтовых водах, к ним относятся фармпрепараты и средства личной гигиены, микропластик, а также другие компоненты, которые используются в повседневной жизни. Эти вещества разделены на три категории: к первой относятся соединения, которые недавно используются в хозяйственной деятельности людей; ко второй – вещества, длительное время присутствующие в окружающей среде, но только недавно научились их идентифицировать и уделять им повышенное внимание (фармпрепараты); к третьей – известные давно, но только в последние годы проявилось их негативное действие на окружающую среду и биоту (гормоны). Самая главная проблема заключается в том, что информация об этих соединениях в окружающей среде, их поведении и трансформации крайне ограничена, а методы определения далеко не совершенны. В то же время эти поллютанты проявляют биологическую активность и способны накапливаться в биоте и экосистемах, но поскольку пути их миграции и трансформации практически не изучены, то определить их потенциальный риск не представляется возможным.
Таким образом, азотсодержащие соединения играют важную роль в образовании канцерогенных НА, являющихся самой потенциально опасной группой веществ для здоровья не только гидробионтов, но и человека, использующего в пищу водные биологические ресурсы. В связи с этим важное значение имеют методы определения НА как в окружающей среде, так и в гидробионтах, где они могут накапливаться и образовываться в результате переработки.
Как показано выше, НА попадают в окружающую среду из внешних источников природного и антропогенного происхождения и могут синтезироваться в среде и в организмах (рис. 1). НА в воде образуются в результате реакций перехода одной формы азота в другую и появления окислов азота. В этих процессах принимают активное участие микроорганизмы, использующие минеральные соединения азота как источник кислорода и образующие при этом в числе промежуточных продуктов окислы азота, являющиеся предшественниками НА. Другой процесс, приводящий к появлению НА в воде, связан с развитием фитопланктона, содержащего большие количества органического вещества, в том числе нитраты и нитриты. При отмирании фитопланктона образуется значительное количество аммиака, который в результате последующих химических реакций приводит к образованию НА [28]. Под действием солнечного света возможно образование НА в воде с низким содержанием кислорода, поскольку последний ускоряет фотодеградацию нитрозосоединений. Быстрый распад НА происходит под действием УФ-излучения, причем на фотохимическое разложение оказывают влияние содержание кислорода, рН воды, температура, ее минеральный состав, присутствующие микроорганизмы и другие факторы [28, 36, 53]. Наряду с естественными путями деградации НА в гидросфере активно разрабатываются способы и методы их удаления из водной среды.
МЕТОДЫ УДАЛЕНИЯ НИТРОЗАМИНОВ ИЗ ВОДНОЙ СРЕДЫ
Изменение потока поступающих биогенных элементов существенным образом влияет на структуру водного объекта и процессы, происходящие в нем: меняется уровень биопродуктивности, видовой состав биоты, нарушаются трофические связи, соотношение продукции и деструкции [6]. Поскольку основные предшественники НА – азотсодержащие соединения, поступающие в среду в результате как естественных процессов, так и антропогенной деятельности, совершенно очевидно, что для снижения риска образования этих опасных соединений необходимо разрабатывать методы снижения их содержания в водной среде. В настоящее время все стоки, содержащие биогены, можно разделить на три категории в зависимости от концентрации в них этих компонентов [47]:
разбавленные сточные воды, содержащие <40 мг P/л и <0.1 г N/л; в этом случае концентрация биогенов существенно варьирует и извлечение этих компонентов зависит от экономической эффективности способа их утилизации;
концентрированные стоки, в которых содержание фосфора составляет >60 мг P/л и аммония 0.1–5 г N/л; в этом случае они могут быть использованы в качестве удобрений в сельском хозяйствe, а фосфор может быть осажден в виде фосфатов кальция и использоваться в дальнейшем;
концентрированные стоки, содержащие >5 г N/л; для удаления азотсодержащих веществ в этом случае применяются разные физико-химические методы, которые технически и экономически выгодны [50, 58].
Значительная часть НА образуется в водоемах в условиях эвтрофирования, важнейшие методы снижения образования НС в среде делятся на две группы: 1) мероприятия, проводимые на водосборе и направленные на снижение поступления биогенов с суши в водоемы; 2) мероприятия, проводимые непосредственно в водоеме [8]. К первой группе относятся мероприятия по оптимизации сельскохозяйственной активности, контроль за внесением удобрений и гербицидов, строительство очистных сооружений животноводческих комплексов и др. К мероприятиям второй группы, осуществляемым непосредственно в водоеме, относятся перекачка воды, искусственная циркуляция, аэрация, химическое осаждение и инактивация биогенов, известкование, покрытие донных осадков различными материалами, препятствующими развитию макрофитов, дноуглубительные работы и др.
НА образуются в процессе обеззараживания воды (в том числе питьевой) озонированием. Для предотвращения этих процессов используются различные штаммы микроорганизмов, которые способны утилизировать аммиак и тем самым снижать концентрацию предшественников НА [52]. Так, например, бактерии Pseudomonas stutzey, иммобилизованные на полидопаминовых пластинах, при оптимальных условиях могут утилизировать до 28 мг NO3-N за 22 ч [35]. Положительный эффект также получен при использовании микроводорослей Chlorella sorokiniana и Scenedesmus species, иммобилизованных на бусинах альгината натрия. В экспериментальных условиях показано, что при оптимальном режиме эти микроводоросли могут удалять из грунтовых вод до 90% нитратов за 9 и 12 дней соответственно. Обнаружено, что иммобилизованные клетки действуют значительно эффективнее, чем те, которые находились в суспензии. Таким образом, использование иммобилизованных микроорганизмов – эффективный, относительно дешевый, нетоксичный метод утилизации нитросоединений из природных вод [46]. Удаление избыточных количеств биогенов проводят с помощью специальных установок, где они осаждаются [56, 59]. Один из эффективных методов уменьшения концентрации НА в окружающей среде – создание специальных условий, при которых происходит их разложение на менее опасные компоненты, снижение содержания их предшественников, или же изменение условий, при которых происходит их синтез. Эксперименты показали, что один из предшественников НА (НДМА) – метадон, который интенсивно разлагается под действием солнечного света в присутствии NHCl2. Увеличение содержания Cl2/N повышает деградацию метадона, а дальнейшее снижение рН существенно ускоряет эту реакцию. Присутствие нитратов также сокращает деградацию метадона и образование НДМА. Таким образом, образование НДМА увеличивается с увеличением Cl2/N и рН, но снижается в присутствии нитратов [41].
В настоящее время в мире накоплен достаточный опыт по оздоровлению водоемов. Однако поиск и разработка новых эффективных методов снижения концентрации азотсодержащих соединений в природных и сточных водах – важнейшая задача, направленная на предотвращение загрязнения гидросферы. При этом важно оценить экологический риск содержания биогенов в водных объектах и их потенциальную опасность для здоровья экосистемы и человека.
ЗАКЛЮЧЕНИЕ
Трансформация соединений азота, попадающих в среду в результате естественных процессов и антропогенной деятельности, может происходить несколькими путями, в том числе приводить к образованию чрезвычайно опасных соединений – НА, проявляющих токсические, мутагенные, канцерогенные эффекты. В настоящее время водные экосистемы подвергаются активному антропогенному воздействию, способствующему их загрязнению различными ксенобиотиками, в том числе азотсодержащими веществами – предшественниками НА, а также самими НА. Накопление этих соединений в воде изменяет ее физико-химические свойства, а также эволюционно сложившиеся циклы биогенных элементов, в первую очередь азота. Результат этих процессов – появление новых путей трансформации азота, приводящих к накоплению в гидросфере потенциально опасных и токсичных соединений, которые способны передаваться по существующим трофическим цепям с эффектом усиления. Избыточный и неконтролируемый сброс коммунальных, промышленных и сельскохозяйственных сточных вод в водные объекты влечет за собой нарушение естественного баланса веществ в экосистемах и стимулирует накопление в воде предшественников НА, представляющих реальную угрозу здоровью гидробионтов и человека. Дальнейшее изучение путей миграции НА и их взаимодействия с другими загрязнителями, в том числе “новыми”, с учетом изменения климатических факторов в водоемах, различающихся своим генезисом, представляет несомненный интерес и имеет практическое значение, так как регулирование качества воды – важнейшая задача, которая решается между водопользователями, чтобы минимизировать экологический риск для здоровья общества, сохранить водную среду, ее биологические и минеральные ресурсы, рекреационную и эстетическую значимость для общества.
Список литературы
Бандман А.Л., Волкова Н.В., Грехова Т.Д., Гудзовский Г.А. Вредные химические вещества. Неорганические соединения элементов V–VIII групп: Справочное издание / Под ред. В.А. Филова. Л.: Химия, 1989. 592 с.
Вальтер А.И., Касаткина О.А., Петренко А.Е. К методике анализа нитрозаминов в пищевых продуктах // Гигиена и санитария. 1996. № 6. С. 49–50.
Воронин В.М., Литвинов Н.Н., Казачков В.И., Шамарин А.А., Журков В.С. Изучение зависимости канцерогенного эффекта от концентрации N-нитрозодиэтиламин // Вопр. онкологии. 1989. Т. 35. № 6. С. 685–689.
Гичев Ю.П. Загрязнение окружающей среды и здоровье человека. М.; Новосибирск: Центр экологической политики России, 2003. 230 с.
Дмитриенко Н.П., Кишко О., Шандаренко С.Г. О роли ксантиноксидазы в цитотоксическом действии нитратов и нитритов // Укр. биохим. журн. 2001. Т. 73. № 6. С. 113–117.
Драбкина В.Г. Причины и пути деградации водоемов // Теория и практика восстановления внутренних водоемов. СПб.: Лема, 2007. С. 113–120.
Зульфигаров О.С., Юрченко В.В. Канцерогенные N-нитрозамины, токсические свойства, образование, определение // Современные проблемы токсикологии. 2005. № 1. С. 53–57.
Измайлова А.В. Зарубежный опыт восстановления внутренних водоемов (по материалам электронной базы данных “Озера Земли” // Теория и практика восстановления внутренних водоемов. СПб.: Лема, 2007. С. 15–162.
Ильницкий А.П., Юрченко В.А., Жукова Г.Ф., Ермилов В.Б. Оценка степени канцерогенной опасности малых доз нитритов // Вопр. онкологии. 1989. Т. 36. № 7. С. 843–847.
Клоченко П.Д., Михайленко В.М., Шевченко Т.Ф. Влияние N-нитрозаминов на развитие фитопланктона // Гидробиол. журн. 2001. Т. 37. № 4. С. 30–38.
Клоченко П.Д., Сакевич А.И., Усенко О.М., Шевченко Т.Ф. Изменение структуры фитопланктона под воздействием мочевины // Гидробиол. жур. 2000. Т. 36. № 6. С. 62–74.
Костюковский Я.Л., Меламед Д.Б. Канцерогенные N-нитрозамины, образование, свойства, анализ // Успехи химии 1988. Т. 57. № 4. С. 625–655.
Методические указания по методам контроля: Методические указания, УК 4.4.1.011-93 Определение летучих N-нитрозаминов в продовольственном сырье и пищевых продуктах. 1993.
Моисеенко Т.И. Эволюция биогеохимических циклов в современных условиях антропогенных нагрузок: пределы воздействия // Геохимия. 2017. № 10. С. 1–22.
Моисеенко Т.И., Руднева И.И. Глобальное загрязнения и функции азота в гидросфере // ДАН. 2008. Т. 420. № 3. С. 395–400.
Нитраты, нитриты и N-нитрозосоединения. Гигиенические критерии состояния окружающей среды. Женева: ВОЗ, 1981. 118 с.
Омельченко С.О. Сезонная динамика содержания нитрозаминов у некоторых видов черноморских рыб // Агроэкол. журн. 2006. № 1. С. 72–75.
Омельченко С.О. Экотоксикологическая оценка некоторых видов черноморских рыб // Уч. зап. Таврического нац. ун-та. Сер. биология, химия. 2012. Т. 25. № 4. С. 144–149.
Рубенчик Б.Л. Образование канцерогенов из соединений азота. Киев: Наук. думка, 1990. 220 с.
Руднева И.И., Мельникова Е.Б., Кузьминова Н.С., Омельченко С.О., Залевская И.Н., Симчук Г.В. Оценка влияния минеральных соединений азота на донных рыб в бухтах Черного моря // Вод. ресурсы. 2008. Т. 35. № 4. С. 260–267.
Сальникова Л.С. Нитрозамины. М.: Центр международных проектов ГКНТ, 1983. 31 с.
Станкевич С.В., Мактаз Э.Д., Кульбич Т.С. Содержание N-нитрозаминов в водных объектах в связи с антропогенным эвтрофированием // Гигиена населенных мест. 1988. С. 26–31.
Терехова В.А., Руднева И.И., Поромов А.А., Парамонова А.И., Кыдралиева К.А. Распространение и биологические эффекты антибиотиков в водных экосистемах (обзор) // Вода: химия и экология. 2019. № 3–6. С. 92–112.
Тутельян В.А., Лунева Н.В. О механизме острого токсичного действия N-нитрозодиметиламина // Фармакология и токсикология. 1983. № 9. С. 111–114.
Худолей В.В. Роль возраста в канцерогенезе, индуцированном N-нитрозодиметиламином и N-диметилнитрамином у амфибий // Вопр. онкологии. 1981. Т. 27. № 10. С. 67–71.
Худолей В.В., Малавей В.К., Барч Х. Изучение мутагенных свойств канцерогенных N-нитрозаминов in vivo и in vitro. Вопр. онкологии. 1981. Т. 27. № 7. С. 843–847.
Экотоксикологические исследования прибрежной черноморской ихтиофауны в районе Севастополя / Под ред. И.И. Рудневой. М.: ГЕОС, 2016. 360 с.
Abidi S.L., Dawson V.K., Hubley R.C. Potential for nitrosamine formation in seven fishery chemicals // The progressive Fish-Culturist. 1986. № 48. P. 302–302.
Amelin V.G., Bol’shakov D.S. Rapid Identification and Determination of N-Nitrosamines in Food Products by Ultra-High-Performance Liquid Chromatography–High Molecules // J. Analytical Chem. 2019. V. 74. P. 39–46.
Antia N.J., Harrison P.J., Oliveira L., Anita N.J., Harrison P.J., Oliveira L. The role of dissolved organic nitrogen in phytoplankton nutrition, cell biology and ecology // Phycologia. 1991. V. 30. P. 1–89.
Bamba D., Coulibaly M., Robert D. Nitrogen-containing organic compounds: origins, toxicity and conditions of their photocatalytic mineralization over TiO2 // Sci. Total Environ. 2017. V. 580. P. 1489–1504.
Bartsch H., Camus A., Malaveille C. Comparative mutagenicity of N-nitrosamines in a semisolid and a liquid incubation system in the presence of rat or human tissue fractions, Mutation Research // Fundamental and Molecular Mechanisms of Mutagenesis. 1976. V. 37. № 2, 3. P. 149–162.
Berman T., Chava S. Algal Growth on Organic Compounds as Nitrogen Sources // J. Plankton Res. 1999. V. 21. P. 1423–1437.
Bieniarz K., Epler P., Kime D., Sokolowska-Mikolajczyk M., W. Popek W., Mikolajczyk T. Effects of N, N-dimethylnitrosamine (DMNA) on in vitro oocyte maturation and embryonic development of fertilized eggs of carp (Cyprinus carpio L.) kept in eutrophied ponds // J. Appl. Toxicol. 1996. V. 16. P. 153–156.
Boroumand Y., Razmjou A. Mussel inspired bacteriall ddenitrification of water using fractal patterns of polydopamine // J. Water Process Engineering. 2020. V. 33. P. 101–105.
Deane E.E., Woo N.Y. Impact of nitrite exposure on endocrine, osmoregulatory and cytoprotective functions in the marine teleost // Sparus sarba. 2007. V. 32. P. 85–93.
Fong Y.Y. Methods for limiting the content of dimethylnitrosamine in the Chinese marine salt fish // Food Cosmet. Toxicol. Biochem. Pathol (Hong Kong). 1976. V. 14. 2. P. 95–98.
Gebus-Czupyt B., Chmiel S., Trembaczowski A., Pelc A., Halas S. Simultaneous preparation of N2 and CO2 from water nitrates for δ15N and δ18O analysis on the example of the Zemborzycki Reservoir studies // Chemosphere. 2020. V. 248. P. 125–154.
Gomathi Devi L., Girish Kumar S., Mohan Reddy K., Munikrishnappa C. Photo degradation of methyl orange an azo dye by advanced Fenton process using zero valent metallic iron: influence of various reaction parameters and its degradation mechanism // J. Hazard. Mater. 2009. V. 164. № 2–3. P. 45–467.
Holst J., Brackin R., Robinson N. Soluble inorganic and organic nitrogen in two Australian soils under sugarcane cultivation. // Agric. Ecosyst. Environ. 2012. V. 155. P. 16–26.
Hsieh M-Ch., Wei-Po W., Lai L.A., Yu-Chen Lin Y-Ch. Sunlight photolysis mitigates the formation of N-nitrosodimethylamine (NDMA) during the chloramination of methadone // Chem. Engineer. J. 2020. V. 384. P. 123 307.
Hu L., Yu J., Hongmei Luo H., Wang H., Xu P., Zhang Y. Simultaneous recovery of ammonium, potassium and magnesium from produced water by struvite precipitation // Chem. Engineer. J. 2020. V. 382. 123001.
Jensen F.B. Nitrite disrupts multiple physiological functions in aquatic animals // Comp. Biochem. Physiol. Pt A. Mol. Integr. Physiol. 2003. V. 135. № 1. P. 9–24.
Kim O.K., Park Y.B., Lee T.G., Kim I.S., Kang J.H., Jun K.S., Park D.Ch., Kim S.B. Degradation of nitrate as a nitrosamine precursor by brown algae Ecklonia cava // J. Korean Fish. 1996. V. 29. № 6. P. 914–916.
Liu H., Chen Z., Guan Y., Xu S. Role and application of iron in water treatment for nitrogen removal: a review // Chemosph. 2018. V. 204. P. 51–62.
Mollamohammada S., Hassan A.A., Dahab M. Nitrate Removal from Groundwater Using Immobilized Heterotrophic Algae // Water, Air, & Soil Pollution. 2020. V. 231. Article number 26.
Mulder A. The quest for sustainable nitrogen removal technologies // Water Sci. Technol. 2003. V. 48. № 1. P. 67–75.
Naing N.N., Sze Chieh Tan S.Ch., Lee H.K. 16 – Micro-solid-phase extraction // Handbooks in Separation Science. Amsterdam: Elsevier Inc., 2020. P. 443–471.
Nowlin W.H., Evarts J.L., Vanni M.J. Release Rates and Potential Fates of Nitrogen and Phosphorus From Sediments in a Eutrophic Reservoir // Freshw. Biol. 2010. V. 50. P. 301–322.
Pedemonte D.C., Frison N., Tayà C., Ponsa S., Fatone F. Chemical and Biological Processes for Nutrients Removal and Recovery // Waste Management: Concepts, Methodologies, Tools, and Applications. Hershey, Pennsylvania: IGI Global USA, 2020. P. 37–48.
Priya E.R., Ravichandrana S., Gobinatha Th., Tilvib S., Devib P.S. Functional characterization of anti-cancer sphingolipids from the marine crab Dromia dehanni // Chem. Phys. Lipids. 2019. V. 221. P. 73–82.
Qiu Y., Bei E., Wang Y., Wang J., Zhang X., Chen Ch. One representative water supply system in China with nitrosamine concern: Challenges and treatment strategies // J. Environ. Sci. 2020. V. 88. P. 12–20.
Rudneva I.I., Kuzminova N.S., Omelchenko S.O. Trace elements and nitrosamines concentration in Black Sea elasmobranch species // Asian J. Biol. Life Sci. 2012. V. 1. № 1. P. 51– 57.
Rudneva I.I., Melnikova E.B., Omelchenko S.O. Seasonal variations of nitrosamine content in some Black Sea fish species // Turk. J. of Fish. Aquat. Sci. 2008. V. 8. № 2. P. 283– 287.
Singh P., Singhb M.K., Bega Y.R., Nisha G.R. A review on spectroscopic methods for determination of nitrite and nitrate in environmental samples // Talanta. 2019. V. 191. P. 364–381.
Stefanakis A.I., Becker J.A. A Review of Emerging Contaminants in Water: Classification, Sources, and Potential Risks. // Waste Management: Concepts, Methodologies, Tools, and Applications. Hershey, Pennsylvania: IGI Global USA, 2020. P. 26–37.
Verstraete W., Van de Caveyea P., Diamantis V. Maximum use of resources present in domestic ‘‘used water” // Bioresour. Technol. 2009. V. 100. P. 5537–5545.
Wang Z., Zhang B., Borthwick A.G.L., Feng C., Ni J. Utilization of single-chamber microbial fuel cells as renewable power sources for electrochemical degradation of nitrogen-containing organic compounds // Chem. Eng. J. 2015. V. 280. P. 99–105.
Wang Z., Zheng J., Tang J., Wang X., Wu Z. A pilot-scale forward osmosis membrane system for concentrating low-strength municipal wastewater: performance and implications // Sci. Rep. 2016. Article number 21653.
Wood M., Kajimura M., Mommsen T., Waish P. Alkaline tide and nitrogen conservation after feeding in an elas (Squalus acanthias) // J. Exp. Biol. 2005. V. 208. № 14. P. 2693–2705.
Yurchenko V.V., Molder U. Volatile N-Nitrosamines in various fish products. // Food Chem. 2006. V. 96. P. 325–333.
Дополнительные материалы отсутствуют.