Водные ресурсы, 2021, T. 48, № 2, стр. 173-182
Свойства природных вод, определяемые их микроструктурной самоорганизацией
В. И. Данилов-Данильян a, *, О. М. Розенталь a
a Институт водных проблем РАН
119333 Москва, Россия
* E-mail: vidd@iwp.ru
Поступила в редакцию 25.05.2020
После доработки 14.10.2020
Принята к публикации 16.10.2020
Аннотация
Свойства природных вод во многом определяются уникальными характеристиками этой жидкости, однако обычно они учитываются далеко не в полной мере, и полагается адекватным представление о ней как о сплошной среде с инородными микрокомпонентами. Такой подход представляется недостаточным для решения задач управления водными ресурсами и выбора инновационных путей развития водоемких отраслей экономики. Более полное исследование ресурсно-хозяйственных свойств воды требует опоры на молекулярно-динамические модели этой субстанции, наиболее важные из них описаны в работе. Показано, что многие водно-экологические процессы определяются формированием ионно-молекулярных ассоциатов и микроструктурной самоорганизацией, обусловленной специфическими свойствами сетки водородных связей. Статья представляет собой аналитический обзор (с некоторыми теоретико-экспериментальными данными авторов), направленный на лучшее понимание читателями молекулярно-динамических свойств воды при оценивании ряда важных для хозяйственной деятельности характеристик водных ресурсов.
ВВЕДЕНИЕ
Водные ресурсы обладают высокой (и непрерывно растущей) потребительской ценностью и характеризуются многоцелевым использованием. Уникальные свойства природной воды обусловливают ее системообразующую роль в биосфере, гидросфере и техносфере Земли. Часть этих свойств широко известна [1, 7, 12], причем в водохозяйственной практике принято удовлетворяться эмпирическими данными, не вникая в природу явлений и ограничиваясь представлением о воде как о сплошной среде с инородными микрочастицами. Между тем микроструктура этой жидкости проявляется на макроскопическом уровне. Таков механизм образования шестиугольной формы снежинок, в основе которого лежит кристаллическая структура гексагонального льда; то же касается формы ячеек Бенара в слое воды с вертикальным градиентом температуры, вязкоупругих свойств воды, текучей, но упругой при ударных нагрузках [8], эффекта “несмешиваемости” речных потоков [14] и изменения динамики течений в глубинах океана.
Воде свойственны внутримолекулярные ковалентные и межмолекулярные водородные связи, благодаря чему она обладает большой статической диэлектрической проницаемостью и дипольным моментом молекул. Роль этих факторов в формировании свойств водных ресурсов исследована недостаточно. Актуален анализ механизмов формирования свойств природной воды с опорой на ее молекулярно-динамические модели.
Угроза глобального водного кризиса определяет неизбежность структурной перестройки мировой экономики и развития инновационных производств с их повышенными требованиями к режимам водопользования и качеству воды [6]; в таких условиях следование упрощенным эмпирическим представлениям неэффективно. Цель данной обзорно-концептуальной статьи – привлечь внимание гидрологов и специалистов в сфере управления водными ресурсами к явлениям зависимости их макросвойств от микроструктурных свойств природной воды в ее жидком и твердом агрегатном состоянии.
ПРИРОДНАЯ ВОДА КАК ФИЗИКО-ХИМИЧЕСКАЯ СИСТЕМА
Чистой воды в природе практически не существует, поскольку она обладает повышенной растворяющей способностью по отношению к веществам с ионной и полярной связью. Радиус вовлеченных в водную матрицу ионно-молекулярных частиц не превышает 1 нм, а коллоидных – 100 нм. На Земле преобладают океанические воды, включающие в себя практически все химические элементы, хотя более 99% общей массы растворенных веществ составляют ионы К+, Na+, Mg2+, Ca2+, Сl–, ${\text{SO}}_{4}^{{2 - }},{\text{HCO}}_{3}^{ - }$, соотношения которых постоянны во всех океанах, а суммарная концентрация достигает 30–40 г/дм3.
В отличие от океанических вод, воды суши обычно являются разбавленными растворами с концентрацией примеси, относительно редко превышающей 100 мг/дм3. Физико-химические характеристики подобных растворов практически такие же, как у чистой воды, что позволяет пользоваться законом Рауля для давления насыщенного пара, а для добавок электролитов – моделью Дебая–Хюккеля, рассматривающей ион в виде жесткого шарика, окруженного ионной атмосферой. Также и структура природных (пресных) растворов близка к структуре чистой воды, но при повышенном загрязнении постепенно приближается к структуре кристаллогидратов с образованием макромолекул, звенья которых обладают дальним порядком [4, 11, 17].
Предварительное представление о макроскопических характеристиках воды, обусловленных ее молекулярно-динамическими свойствами, удобно анализировать, сравнивая их со свойствами обычного льда Ih-модификации, структура которого хорошо известна (табл. 1) [7, 10]. Из табл. 1 видно, что воде и льду свойственны малая сжимаемость и высокая скорость распространения звука. Первое обстоятельство указывает на единую природу сил межмолекулярного взаимодействия, обеспечивающих близкие значения приведенных величин, а второе – на то, что жидкая и твердая фазы воды обладают сходными упругими свойствами. В то же время целый ряд характеристик этих фаз резко различается, чем и определяются их важные хозяйственные свойства. Таковы следующие:
Таблица 1.
Физико-химические характеристики воды и льда (η, Па с – вязкость; βT, Па–1 – изотермическая сжимаемость (приблизительно равная адиабатической сжимаемости) при 0°С; С, кДж/кг град – теплоемкость при 0°С; U, м/с – скорость звука; σ, Н/м – поверхностное натяжение; D, cм2/с – коэффициент диффузии молекулы воды; ε – статическая диэлектрическая проницаемость при 0°С)
| Фаза | η | βT | С | U | σ | D | ε |
|---|---|---|---|---|---|---|---|
| Жидкая | 10–3 | 46 × 10–11 | 4.2 | 1500 | 0.073 | 10–6 | 88 |
| Твердая | 1013 | 1.2 × 10–10 (7°C)* | 2.1 | 4000 | 0.5** | 10–10 | 97 |
пониженный коэффициент самодиффузии во льду и повышенная на много порядков вязкость этой фазы (поликристаллической);
пониженное значение константы диссоциации молекул воды во льду;
повышенное поверхностное натяжение у льда при том, что и у воды оно больше, чем у любой другой жидкости, кроме ртути (поверхностное натяжение этой абсолютно чистой жидкости настолько велико, что было бы возможно “хождение по ртутям”; наличие же примесей резко снижает поверхностное натяжение).
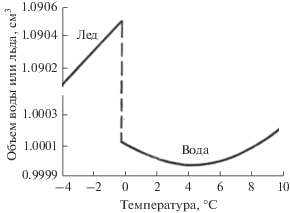
В отличие от других жидкостей, объем жидкой воды меньше, чем объем эквивалентной массы льда. Из рис. 1 [7, 10] видно, что после быстрого расширения нагревающегося льда объем вещества резко уменьшается при плавлении, причем коэффициент объемного расширения в воде – отрицательный, вплоть до 4°С. Последнее обстоятельство играет важную роль в биосфере, так как в результате лед образуется на поверхности водоемов, не позволяя им промерзать до дна и тем самым не давая погибнуть рыбам и многим другим представителям водной фауны в зимнее время.
В целом при плавлении термодинамические свойства воды меняются в разы, в то время как кинетические – на порядки. Так, коэффициент самодиффузии воды на четыре порядка выше, чем льдa, а подвижность протона, напротив, на порядок ниже вследствие более совершенной сетки водородных связей в твердой фазе. Различна и растворимость частиц взвешенных и/или растворенных в воде веществ в конденсированных фазах. Например, максимальная насыщенность воды хлористыми, азотнокислыми и углекислыми солями калия и натрия может достигать 50% по весу, тогда как растворимость любых веществ (кроме фторида аммония NH4F) во льду крайне низкая.
Ясность в вопросе о причинах близости значений таких коэффициентов, как βT, вносит сопоставление теплоты фазовых переходов воды и пара из льда. При равновесных изобарно-изотермических условиях эти показатели равны ~80 и 700 кал/г соответственно. Поскольку они представляют собой произведение температуры фазового перехода на разность энтропий соответствующих фаз, то можно видеть, что затраты энергии на плавление составляют 80/700 ≈ 0.11 от ее затрат на возгонку. Если при возгонке вся запасенная потенциальная энергия переходит в кинетическую, то при плавлении на фазовый переход требуется гораздо меньшая ее доля. Следовательно, в жидкой воде нарушено лишь ~11% водородных связей (поэтому вода обладает высокой теплотой парообразования, что делает ее хорошим энергоносителем), что согласуется с представлениями О.Я. Самойлова [11] о “льдообразной” (частично-каркасной) модели структуры воды с малой долей “некаркасных” молекул. По Л. Полингу, таковы “гидрофобные” молекулы в клатратной структуре [11, 17]; по Г. Фрэнку и В. Вэну, это молекулы, “плавающие” в льдоподобных “мерцающих кластерах”, объединяющих до 100 молекул [9, 10, 17].
Подобные модели опираются на представление о “льдоподобности” структуры жидкой воды. Полученная методом молекулярной динамики оценка молекулярной координации тетраэдрической (льдоподобной) структуры воды, обусловленной sp3-гибридизацией орбиталей кислорода, приведена на рис. 2 [9, 15]. Здесь главный максимум на кривой радиального распределения, отвечающий за первую координационную сферу, расположен на расстоянии 28 нм; второй, размытый – на расстоянии 45 нм; третий, еще более размытый – на расстоянии 70 нм.
Рис. 2.
Кривые радиального распределения атомов кислорода в чистой воде; внизу – схема, поясняющая картину теплового движения молекул путем активационных скачков между их временны́ми положениями равновесия, разделенными потенциальным барьером [8]. По оси абсцисс – расстояние от выбранной частицы (ангстрем), по оси ординат – радиальная функция распределения.
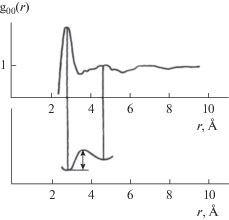
Площади под максимумами на кривой радиального распределения определяются координационными числами молекул, соседних с выбранной. Это число для льда равно 4, для жидкой воды 4.4 и почти не меняется с температурой. Таким образом, большая часть межмолекулярных водородных связей при плавлении льда не разрушается. А повышение координационного числа указывает на прочность сетки этих связей, которые при этом достаточно лабильны. Именно прочность и упругость в сочетании с гибкостью, легкой деформируемостью сетки таких связей [8] обеспечивают целый ряд малоизученных пока макроскопических проявлений молекулярно-динамических свойств воды. При этом подвижность молекул воды осуществляется через дефекты сетки водородных связей. Это позволило предложить модель вращательных переориентаций молекул в жидкой воде как важнейшую стадию подвижности (рис. 3). Здесь подразумевается, что основное количество молекул включено в сетку водородных мостиков, а малая их часть локализована в пустотах каркаса, образованного этой сеткой. Таковы “каркасные” и “полостные” молекулы, интенсивный обмен между которыми обеспечивает молекулярную подвижность в жидкости, – это наглядная, но несколько устаревшая модель, которой, впрочем, вполне достаточно для понимания многих хозяйственно-значимых вопросов водопользования.
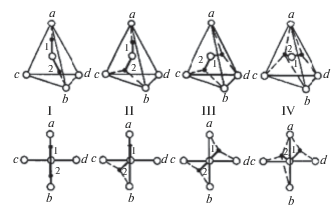
Рис. 3.
Koнформации молекул воды в модели вращательных переориентаций [15]. а, b, с, d – периферийные молекулы; цифры 1, 2 характеризуют направления водородных связей при конформации.
Сопоставление физико-химических показателей конденсированных фаз воды делает более понятыми некоторые значимые для водохозяйственного управления эффекты, перечисленные ниже.
1. Различная реакция воды на один и тот же импульс силы в зависимости от его продолжительности обусловлена лабильностью структуры этой жидкости. При медленном воздействии реакция на приложенную внешнюю силу определяется вязкостью, а единственной упругой реакцией будет сопротивление всестороннему сжатию, которое характеризуется изотермической сжимаемостью. При коротких импульсах структура воды обнаруживает упругие свойства. Тогда ее поведение на макроскопическом уровне описывается как гидравлический удар и выполняется обобщенный закон Гука, где модуль сдвига и модуль сжатия имеют смысл адиабатических модулей при быстром воздействии.
2. Вода склонна к химическим изменениям под влиянием внешних механических воздействий. Таков вызвавший в свое время сенсацию эффект спонтанной генерации перекиси водорода в воде при ее продавливании через капилляр [25]. В рамках изложенных представлений это явление сопровождается переходом иона ОН– в радикал ОН0 с выделением электрона. Известны и другие эффекты механохимической нестабильности воды, проявляющиеся при ее интенсивном перемешивании, фильтровании и т.д. [3]. Всего лишь сильное встряхивание (“динамизация”) приводит к появлению в объеме воды оптической неоднородности, свидетельствующей об образовании пузырьков пара, сутками остающихся в квазиравновесии с жидкой фазой.
3. В слабых водных растворах под воздействием электромагнитного излучения или света появляются биологически активные формы кислорода, азота и углекислого газа [5, 28].
4. В речных потоках происходит изменение форм растворенных в воде металлов [16, 26]; эффект заключается в переходе этих металлов из растворимой в нерастворимую форму под влиянием гидродинамического фактора – сброса воды с плотины. Отмечено, например, что связанный в комплексы кадмий переходит при этом в свободное состояние и, оседая на взвешенные частицы, опускается на дно.
Макроскопически гомогенные водные растворы разнообразных низкомолекулярных веществ неоднородны на нано- и мезоуровне (размер неоднородностей варьирует от ~1 до 102–103 нм) [29]. Это тип “слабого”, но весьма эффективного и самопроизвольного структурирования жидкости, он важен для адекватного описания реакций и других физико-химических процессов [24]. При этом во многих случаях истинными реагирующими частицами в растворах являются не изолированные молекулы, а их супрамолекулярные агрегаты. В частности, обнаружен феномен существования “критических” концентраций и температуры, при которых происходят неожиданные резкие изменения реакционной способности растворенных веществ и результатов химических реакций с их участием.
ВОДОРОДНАЯ СЕТКА КАК ФАКТОР, ОПРЕДЕЛЯЮЩИЙ МАКРОСКОПИЧЕСКИЕ ПРОЯВЛЕНИЯ МОЛЕКУЛЯРНО-ДИНАМИЧЕСКИХ ПРОЦЕССОВ В ПРИРОДНОЙ ВОДЕ
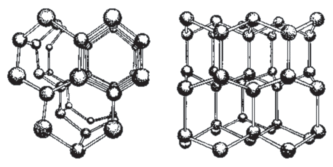
Вода – мономолекулярное соединение, и, если бы не характерные для нее специфические свойства сетки водородных связей, она должна была бы кипеть при +70°C, а замерзать при почти ‒100°C. Этого не происходит именно благодаря способности молекул Н2О к образованию водородных связей. Структура образующейся при этом сетки такова, что в известных 13 кристаллических модификациях льда молекулы участвуют в четырех связях с ближайшими соседями, причем в модификациях Ih, Ic, VII, VIII, Х и XI атомы кислорода соседних молекул расположены в вершинах правильного тетраэдра.
Ih-лед, материковый, плавающий, подземный, моно- и поликристаллический, практически единственный существующий в гидросфере Земли, обладает гексагональной структурой (рис. 4). (Имеется еще незначительное количество метастабильной кубической кристаллической разновидностей так называемого Iс-льда в верхних слоях атмосферы и ромбической низкотемпературной равновесной формы гексагонального Ih-льда с упорядоченным расположением протонов – льда XI, являющегося сегнетоэлектриком в Антарктиде; в целом же известны три аморфных разновидности этого вещества и 18 кристаллических). Здесь молекулы Н2О связаны в слоях центросимметричными водородными связями, а между слоями – зеркальносимметричными.
Рис. 4.
Схема структуры льда I (показаны атомы кислорода и направления водородных связей) в двух проекциях.
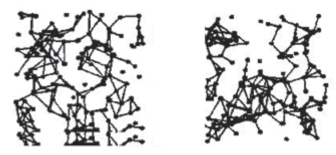
Строение сетки водородных связей в жидкой воде сложнее, поскольку здесь имеют место неупорядоченные структуры. Методы изучения структуры некристаллических систем позволили получить наглядную картину мгновенной локализации молекул в этой жидкости (рис. 5) [4]. Молекулы с более правильным тетраэдрическим окружением объединяются в относительно упорядоченные кластеры, которые чередуются с кластерами из частиц с искаженным окружением. В итоге образуются рыхлые разветвленные сети, пронизывающие всю структуру. Устойчивость такой структуры сравнительно велика, о чем свидетельствует ее способность к глубокому – до –40°С – переохлаждению [10].
Рис. 5.
Пространственная локализация молекул воды с разной тетраэдричностью ближайшего окружения для воды при 301 К. Слева – 20% молекул с окружением, близким к правильному тетраэдру; справа – 20% молекул с наиболее искаженным окружением.
Плавление льда также не моментальное разрушение кристаллической решетки, оно сопровождается нарастающим числом “топологических кластеров” из дефектов “5 + 7” (пяти- и семичленных роев), нарушающих строго четверную молекулярную координацию решетки льда [4]. Этот вывод углубляет представление о механизме таяния льда и может способствовать уточнению методов прогноза половодья на основе наблюдений за микроскопическими проявлениями метастабильного состояния твердой фазы.
Представление о том, что вода – микрогетерогенная жидкость, подтверждается рядом исследований [18, 21]. По данным дифракционных экспериментов, отдельные межмолекулярные связи разрушаются почти в 100 раз быстрее, чем кластеры, объединяющие до 30 молекул. Динамическая неоднородность сопровождается коллективными движениями мезоскопических областей приблизительно в одном направлении (на масштабах, промежуточных между макроскопическим и микроскопическим), как это обнаружено в компьютерных моделях [26].
Сетка Н-связей в воде обеспечивает основные свойства этой жидкости – высокую подвижность частиц при их сильном взаимодействии [8]. Это сочетание кинетических и энергетических факторов определяет свойства межмолекулярных связей. Энергия разрыва такой связи для воды составляет 12–20 кДж/моль [20], что на порядок меньше обычной ковалентной энергии, но больше ван-дер-ваальсовой. При этом обеспечивается упругость межмолекулярной сетки воды, при которой ион водорода (протон) оказывается локализован с равной вероятностью около обоих атомов кислорода на линии водородной связи [8], создавая так называемый “протонный беспорядок”. Последним обстоятельством в значительной степени объясняется большая величина диэлектрической постоянной вещества в широком диапазоне частот электромагнитного поля.
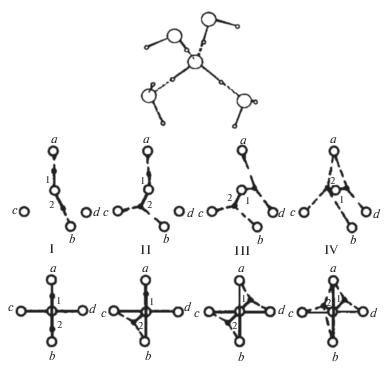
Для оценки роли водородных связей в микроструктурой самоорганизации воды и растворов необходимо учитывать их фуркатность (разделенность), определяющую число водородных связей, которые образует протон одной молекулы с соседними атомами кислорода. Наиболее распространена бифуркатная (перестраиваемая, здесь – трехцентровая) связь (рис. 6), в которой протон одной молекулы воды связан с двумя атомами кислорода двух соседних молекул. “Переключения” бифуркатных связей обеспечивают подвижность (лабильность) сетки водородных связей в жидкости (рис. 7), длина которых и распределение по углам между атомами О…Н соседних молекул и ОН каждой из них (рис. 6) способны изменяться без разрыва. Именно специфика Н-связей обеспечивает кинетическую лабильность этой сетки, возможность обмена местами между ее отдельными структурными фрагментами и большой полиморфизм твердой фазы воды [23].
Рис. 7.
Пентамолекулярная структурная единица воды и возможные конформеры в пентамолекулярной структурной единице [15]. Обозначения те же, что на рис. 3.
Лабильность пространственной сетки Н-связей в сочетании с ее упругостью, стремлением к сохранению первоначальной конфигурации определяет уникальные макроскопические свойства воды. Один из результатов совместного действия указанных свойств – выраженная тенденция к “выталкиванию” частиц примеси из объема воды и к их объединению в местах дефектов сетки. Такова гидрофобная гидратация и гидрофобное взаимодействие, способствующие агрегации неполярных молекул в разбавленных водных растворах [8].
Гидрофобные взаимодействия определяют устойчивость органических веществ в воде и играют огромную роль в гидрохимических процессах. Таковы, в частности, причины активности отходов фармацевтических производств, опасности органических ксенобиотиков для человека и гидробиоты. Подобные процессы непосредственно связаны с влиянием гидрофобных эффектов на биологические структуры, глобулярные белки, протеины, нуклеиновые кислоты, а также биологические мембраны. Также в рамках синергетического подхода, позволяющего преодолеть разрыв между процессами на молекулярно-динамическом и макромасштабном уровне, необходимо принять, что гидрофобность воды значима для разброса ее состава и свойств [14]. Кроме того, требует исследования роль эффекта гидрофобности при коагуляции, флокуляции, обратноосмотической очистке воды и в других процессах ее обработки (переработки) как хозяйственного ресурса.
Основные эффекты гидрофобности растворов, проявляющиеся на макроскопическом уровне, следующие [8]:
большие отрицательные значения энтальпии и энтропии растворения;
минимум молярного парциального объема неэлектролита;
аномально большие избыточные молярные парциальные теплоемкости;
большие положительные отклонения от иде-альности растворов, невыполнение законов Рауля;
максимальное повышение вязкости;
аномальное понижение растворимости малорастворимых веществ;
расслаивание раствора;
мицеллообразование при очень низкой концентрации ПАВ.
ГИДРАТАЦИЯ В РАЗБАВЛЕННЫХ РАСТВОРАХ, МОДЕЛИРУЮЩИХ ПРИРОДНУЮ ВОДУ
Вследствие высокой растворяющей способности воды гидросфера является глобальным аккумулятором химических веществ. В результате взаимодействия воды с породами, почвой огромное количество растворенных веществ оказывается в водных объектах. Много уступая природному вкладу по массе таких веществ, антропогенный вклад превосходит его по разнообразию. По данным CAS (Chemical Abstracts Service), ежегодно синтезируются десятки тысяч новых химических соединений, неизбежно попадающих в природные воды. В результате повышается потребность хозяйственной деятельности в чистой воде, а встречается она все реже из-за воздействия этой деятельности на природные системы. Поэтому повышается значение методов и средств кондиционирования воды, в том числе и для водоотведения с целью предотвращения эвтрофирования водных объектов и других нарушений экологического равновесия. Соответствующие технологии требуют основательных представлений о свойствах водных растворов, об энергетических и структурных изменениях, характеризующих гидратацию частиц взвешенных и/или растворенных в воде веществ.
Молекулярно-кинетический подход к явлению гидратации, предложенный О.Я. Самойловым [11, 20], основан на френкелевском активационном механизме подвижности в жидкости с участием ближайших молекул или без них. Предполагается, что в жидкости происходят колебания молекул в их временны́ х положениях равновесия с частотой 1/τ0 и активированные скачки с периодом $\tau = {{\tau }_{0}}{{е}^{{ - \frac{Е}{{RT}}}}}$ (Е – величина потенциального барьера, разделяющего положения равновесия; R – универсальная газовая постоянная, равная произведению постоянной Больцмана на число Авогадро; Т – абсолютная температура). В координационной оболочке частиц растворенных веществ потенциальный барьер изменяется. Здесь он равен Еi, Ei – E = ΔEi – одна из характеристик молекулярно-кинетической модели гидратации. Соответственно, в растворе ${{\tau }_{i}} = {{\tau }_{0}}{{е}^{{ - \,\,\frac{{{{Е}_{i}}}}{{RT}}}}}$. Если ΔEi > 0 и ${{{{\tau }_{i}}} \mathord{\left/ {\vphantom {{{{\tau }_{i}}} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}$ > 1, то реализуется положительная гидратация, означающая, что подвижность молекул воды вблизи иона уменьшается. Если ΔEi < 0 и ${{{{\tau }_{i}}} \mathord{\left/ {\vphantom {{{{\tau }_{i}}} {{{\tau }_{0}}}}} \right. \kern-0em} {{{\tau }_{0}}}}$ < 1, то молекулы воды вблизи таких ионов более подвижны, чем в объеме воды, – это случай отрицательной гидратации.
Описанный молекулярно-кинетический подход к гидратации подтвержден экспериментально в [11, 20]. Оказалось, в частности, что благодаря отрицательной гидратации продуктов диссоциации азотнокислого калия вязкость водных растворов этого вещества меньше, чем у чистой воды. Также в пользу отрицательной гидратации свидетельствует повышение коэффициента самодиффузии молекул воды в растворах галогенидов (кроме фторидов) калия, рубидия и цезия при нормальных условиях.
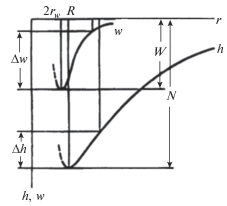
Одно из объяснений явления отрицательной гидратации – предположение об изменении формы (пологости) потенциальной ямы временнóй локализации частиц (рис. 8). Другим объяснением может служить модель трехслойной гидратной оболочки иона, из которых первая связана ионом перманентно, третья приближена к структуре воды, а вторая, промежуточная, обладает переходной структурой, склонной к изменению периода своей подвижности.
Рис. 8.
Схема, предложенная в [11, 19], поясняющая явление отрицательной гидратации. Энергия ион-молекулярного взаимодействия (w, h) зависит от радиуса (r) первой гидратационной оболочки. При этом максимальная глубина потенциальной ямы (W, H) для молекул воды достигается при их “максимальном сближении” с центральным ионом (2rw, R), определяющим энергию “активационного скачка” (Δw, Δh) между временными положениями равновесия молекул, что и определяет их подвижность.
Установлено, что положительной гидратацией обладают ионы Li+ и Na+, отрицательной – К+, Rb+ и Cs+. В целом, наибольшее увеличение подвижности гидратных молекул воды наблюдается при радиусе иона 0.165 нм (таков ион Cs+). Дальнейшее увеличение радиуса начинает играть роль не разрушителя, а стабилизатора структуры воды: включается “эффект препятствия”, и окружающие частицу молекулы воды теряют часть степеней свободы, замедляя движение.
С явлением гидратации связаны процессы распределения и перераспределения частиц взвешенных и/или растворенных в воде веществ, их коллективного или согласованного перемещения в растворах [4, 9]. Многие экспериментальные факты и результаты компьютерного моделирования указывают на то, что в водных растворах наблюдаются корреляции между движениями даже далеко отстоящих друг от друга частиц, сохраняющиеся в течение длительного времени, образование кластеров и цепочек из них.
Эффекты структурирования (в разных случаях – перераспределения, разброса) частиц взвешенных и/или растворенных в воде веществ в природных водах “управляются” как при прямом, так и при опосредованном влиянии сетки водородных связей. Так, в течении Пуазейля наблюдается эффект совокупного смещения броуновских частиц [2]. Такое же перераспределение происходит в результате термофореза – движения частиц примеси из более нагретых областей в более холодные. При малых значениях числа Рейнольдса известен и турбофорез – направленное смещение частиц взвешенных и/или растворенных в воде веществ в сторону снижения интенсивности пульсаций. Термофорез приводит к накоплению частиц в области минимума температуры, а турбофорез, напротив, – к их смещению в зону пульсаций (турбулентности). Впрочем, в условиях преобладающего действия силы стоксова трения возможно сглаживание этих эффектов [22].
Для более полного представления об эффектах перераспределения примеси в потоке воды необходимо также учитывать флуктуации параметров порядка, которые определяют сингулярные вклады колебательного и вращательного молекулярного движения в термодинамические характеристики вещества. Это обнаруживается особенно четко в окрестности фазовых переходов второго рода.
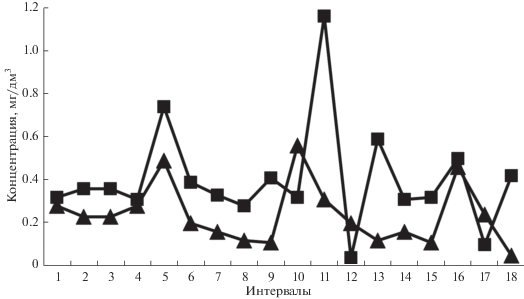
О том, что движение в жидкостях может быть результатом только коллективного или согласованного перемещения многих частиц, свидетельствуют результаты компьютерного моделирования и экспериментальные факты. Так, в реках, даже в отсутствие существенных источников и стоков примеси, наблюдается выраженный разброс концентрации частиц взвешенных и/или растворенных веществ. Из типичного примера, приведенного на рис. 9, видно, что временны́е ряды тесно взаимосвязанных концентраций двух- и трехвалентного железа часто меняются в противоположных направлениях (интервал 04 соответствует августу 2009 г., 11 – марту 2010 г. и др.). Вполне вероятно, что такие различия связаны с разным характером гидратации ионов или образований, включающих две формы железа. Что касается идеи “выравнивания концентрации”, то она справедлива только для неподвижной среды, а в потоках это явление невозможно, что следует из сингулярной природы гидродинамических уравнений [22]. И хотя нет универсальных ответов на вопросы о границах и масштабах применимости геометрии течения и самоорганизации воды в потоке, полезно обращаться к фактам – таким, как на рис. 9, а также приведенным в работе [22].
Рис. 9.
Концентрация трехвалентного (квадраты) и двухвалентного (треугольники) железа в р. Исеть, створ Решетка. Ежемесячные наблюдения за 18 месяцев – от мая 2009 г. (интервал 1) до октября 2010 г. (интервал 18). Часть результатов измерений взята из данных Уральского управления по гидрометеорологии и мониторингу окружающей среды, другая часть – по пробам, отобранным авторами и исследованным в аккредитованной лаборатории ОАО “Акваметрия” при участии Уральского центра стандартизации и метрологии “УРАЛТЕСТ”.
ЗАКЛЮЧЕНИЕ
Описания воды в терминах классической механики сплошной среды и в предположении “пассивности” примесей [13] недостаточно для адекватного моделирования природных водных объектов, для полноценного исследования явлений фильтрации, диффузии и других технологически значимых процессов в воде, обусловливающих ее ресурсно-хозяйственные свойства, для понимания и прогнозирования разброса примеси в речных потоках. Развитие методов водохозяйственного управления и технологий водопользования требует учета следующих свойств пространственной сетки водородных связей воды [8]:
устойчивость – сопротивление воды кратковременным импульсам силы и снижение вязкости в присутствии достаточно больших однозарядных ионов благодаря ее способности передавать возмущения на весь объем;
лабильность – широкое распределение по углам и расстояниям водородной связи без ее разрыва, способность легко образовывать достаточно большие полости (полиморфизм твердой фазы воды также связан c этой особенностью сетки); в жидкости это свойство объясняет явление гидрофобной гидратации нейтральных или слабозаряженных частиц, приводящей к усилению водородных связей между молекулами растворителя;
упругость – стремление сетки к сохранению первоначальной конфигурации, способность выталкивать примеси к местам дефектов сетки и объединять их вместе, уменьшая гидрофобную поверхность и обусловливая микрорасслаивание водного раствора;
отрицательная гидратация, связанная с дефектообразованием в сетке H-связей достаточно больших однозарядных ионов с преимущественно ион-дипольным взаимодействием с молекулами воды.
Система этих свойств определяет процессы микроструктурной самоорганизации в водных растворах, роль которых для формирования ресурсно-хозяйственных особенностей и качества природной воды остается недооцененной. Ниже перечислены обусловленные молекулярно-динамическими свойствами воды ее макроскопические характеристики, значимые для принятия водохозяйственных решений, обработки (подготовки, очистки и пр.) природных, сточных и технологических вод, для охраны и восстановления водных биоресурсов:
теплоемкость при плавлении льда возрастает более чем в два раза;
аномально велика теплота испарения воды (10.5 ккал/моль);
температурные зависимости плотности, теплоемкости, скорости ультразвука, изотермической сжимаемости проходят через экстремум: максимум плотности достигается при 4°С, минимум теплоемкости при постоянном давлении Ср – при 35°С, минимум изотермической сжимаемости – при 46°С;
аномальны зависимости от давления вязкости, диэлектрической проницаемости, коэффициента самодиффузии: с увеличением давления при температуре 0–30°С вязкость проходит через минимум, а коэффициент самодиффузии – через максимум.
Учет молекулярно-динамических свойств воды – одно из важных направлений развития методов водохозяйственного управления, решения целого ряда инновационных водохозяйственных и технологических задач.
Список литературы
Аксенов В.И., Галкин Ю.А., Заслоновский В.Н. и др. Промышленное водоснабжение: учебное пособие. Екатеринбург: УрФУ, 2010. 221 с.
Бетяев С.К. Гидродинамика: проблемы и парадоксы // УФН. 1995. Т. 165. Вып. 3. С. 299–330.
Веселов Ю.С. Эффект накопления перекиси водорода при обратно-осмотическом опреснении морской воды // Химия и технология воды. 1991. Т. 13. № 8. С. 741–745.
Волошин В.П., Желиговская Е.А., Маленков Г.Г. и др. Структуры сеток водородных связей и динамика молекул воды в конденсированных водных системах // Рос. хим. журн. 2001. Т. XLV. № 3. С. 31–37.
Гудков С.В., Иванов В.Е., Карп О.Э. и др. Влияние биологически значимых анионов на образование активных форм кислорода в воде под действием неионизирующих физических факторов // Биофизика. 2014. Т. 59. Вып. 5. С. 862–870.
Данилов-Данильян В.И. Экономические проблемы управления водными ресурсами и водным хозяйством // Избранные труды института водных проблем РАН. Т. 2. М.: Курс, 2017. С. 429–453.
Зацепина Г.Л. Физические свойства и структура воды. М.: Изд-во МГУ, 1998. 185 с.
Родникова М.Н. Об упругости пространственной сетки водородных связей в жидкостях и растворах // Структурная самоорганизация в растворах и на границе фаз. М.: ЛКИ, 2008. С. 151–198.
Родникова М.Н. Особенности растворителей с пространственной сеткой Н-связей // Журн. физ. химии. 1993. Т. 67. № 2. С. 275–280.
Розенталь О.М. Структура и вмерзание в лед гидратационных комплексов ионов // Журн. структурной химии. 1971. Т. 12. № 5. С. 917–919.
Самойлов О.Я. Структура водных растворов электролитов и гидратация ионов. М.: Наука, 1957. 182 с.
Справочник по гидрохимии / Под ред. А.М. Никанорова. Л.: Гидрометеоиздат, 1989. 391 с.
Хубларян М.Г. Водные потоки в различных средах. М.: ГЕОС, 2009. 484 с.
Чашечкин Ю.Д., Розенталь О.М. Физическая природа неоднородности состава речных вод // Докл. РАН. 2019. Т. 484. № 5. С. 83–86.
Чумаевский Н.А., Родникова М.Н. О пространственной сетке водородных связей // Докл. РАН. 1999. Т. 364. № 5. С. 640–649.
Шкинев В.M., Трофимов Д.А., Данилова Т.В. и др. Армированные трековые мембраны в методах оценки качества природной и питьевой воды // Журн. аналит. химии. 2008. Т. 63. № 4. С. 363–370.
Эйзенберг Д., Кауцман В. Структура и свойства воды / Пер. с англ. А.К. Шемелина; под ред. В.В. Богородского. Л.: Гидрометеоиздат, 1975. 280 с.
Anikeenko A.V., Malenkov G.G., Naberukhin Yu.I. Visu-alization of the collective vortex-like motion in liquid argon and water // The J. Chem. Phys. 2018. V. 148. P. 094508–092518.
Belan S., Fouxon I., Falkovich G. Localization-delocalization transitions in turbophoresis of inertial particles // Phys. Rev. Lett. 2014. March. № 112(23).
Buslaeva M.N., Samoilov O.Ya. // The Chemical Physics of Solvation. Pt A. Amsterdam: Elsevir, 1985. P. 391–414.
Cate M.G., Huskens J., Creqo-Calama M. et al. Thermodynamic Stability of Hydrogen-Bonded Nanostructures: A Calorimetric Study // Chemistry – A European J. 2004. V. 10(15). P. 3632–3639.
Chashechkin Yu.D., Rozental O.M. River Flow Structure and Its Effect on Pollutant Distribution // Water Resour. 2019. V. 46. № 6. P. 910–918.
Debenedetti P.G. Supercooled and glassy water // J. Phys. Condens. Matter. 2003. V. 15. P. R1669.
Kononov L.O. Chemical reactivity and solution structure: on the way to a paradigm shift? // RSC Adv. 2015. V. 5. P. 46718–46734.
Lee J.K., Walker K.L., Han H.S. et al. Spontaneous generation of hydrogen peroxide from aqueous microdroplets // Proc. of the Nat. Acad. of Sci. 2019 [Электронный ресурс]. https://www.researchgate.net/publication/335425749_Spontaneous_generation_ of_hydrogen_peroxide_from_aqueous_microdroplets (дата обращения: 19.08.2020)
Osmachko M.P., Morzhukhina S.V. The estimation of Volga River Quality in the Upper Basin // Int. Conf. on Rivers and Civilization. Multidisciplinary Perspectives on Major River Basins. Abstracts. La Crosse, Wisconsin, 2004. P. 131–132.
Pickup J. Environmental safety of halogenated by-products from use of active chlorine. Euro Chlor Science Dossier 15. Brussels, 2010. 210 p.
Scheeler M.W., van Rees W.M., Kedia H. et al. Complete measurement of helicity and its dynamics in vortex tubes // Sci. 2017. V. 357. Iss. 6350. P. 487–491.
Svard M., Devi R., Khamar D. et al. Solute clustering in undersaturated solutions – systematic dependence on time, temperature and concentration // Phys. Chem. Chem. Phys. 2018. V. 20. P. 15 550–15 559.
Дополнительные материалы отсутствуют.