Водные ресурсы, 2021, T. 48, № 2, стр. 213-221
Нитрозамины в водных экосистемах: источники, образование, токсичность, экологический риск (обзор) 2. Содержание в гидробионтах, биологические эффекты и оценка риска
И. И. Руднева a, *, С. О. Омельченко b, **
a ФИЦ Институт биологии южных морей им. А.О. Ковалевского РАН
229011 Севастополь, Россия
b Крымский республиканский институт постдипломного педагогического образования
295000 Симферополь, Россия
* E-mail: svg-41@mail.ru
** E-mail: svet.omelchenko@mail.ru
Поступила в редакцию 22.04.2020
После доработки 13.05.2020
Принята к публикации 09.06.2020
Аннотация
Природные и антропогенные процессы способствуют образованию избыточных концентраций соединений азота в биосфере, которые в результате химических реакций способны приводить к синтезу нитрозаминов. Нитрозамины – токсичные соединения, проявляющие канцерогенные, мутагенные и тератогенные свойства и оказывающие негативное действие на живые организмы. Представлены данные о содержании этих веществ в водных организмах, прежде всего в рыбах, зависимость их накопления в гидробионтах от сезонных факторов, видовых и биологических особенностей рыб, а также от условий среды обитания, включая антропогенную нагрузку. Приведены примеры проявления канцерогенных, мутагенных и токсических свойств нитрозаминов у водных и наземных организмов. Показаны способы и методы оценки экологического риска нитрозаминов в природной среде и в гидробионтах, а также опасность для здоровья человека.
ВВЕДЕНИЕ
Изменение процессов, лежащих в основе важнейших биогеохимических циклов в биосфере, и увеличение содержания в атмосфере окислов углерода, серы и азота оказывает существенное модифицирующее влияние на физико-химические свойства воды и ее пригодность для использования как в питьевых целях, так и для нормального существования гидробионтов. Избыточные концентрации азотсодержащих соединений в гидросфере, обусловленные природными процессами и антропогенной деятельностью, приводят к возникновению таких путей трансформации азота, в результате которых образуются вещества с токсичными свойствами [12]. К ним относятся, в частности, нитрозамины (НА), характеризующиеся высокой химической стабильностью, устойчивостью к температуре и к свету, поэтому не подвергающиеся деградации и сохраняющиеся в окружающей среде в неизменном виде длительное время.
Эти соединения присутствуют в живых организмах вследствие попадания туда с пищей, водой, воздухом, а также они образуются там в результате нитрификации аммонийного азота микроорганизмами кишечника. В настоящее время повышенное внимание к НА обусловлено их выраженными канцерогенными и мутагенными эффектами [3, 42]. Оценка содержания НА в окружающей среде и в организмах важна при контроле качества водных биологических ресурсов и продуктов, которые из них получают [2, 47]. В связи с этим исследование круговорота азота в биосфере и путей образования НА, их накопления и образования в гидробионтах – актуальное направление водной экологии, оно включает в себя несколько аспектов: исследование содержания и путей трансформации НА в живых организмах;
изучение процессов образования и трансформации НА в гидробионтах и передача по пищевым цепям;
анализ содержания НА в различных водных организмах, в том числе употребляемых в пищу человеком, c целью оценки экологического риска и последствий для здоровья;
изучение взаимосвязи между уровнем эвтрофирования среды, экзогенным образованием НА и эндогенным синтезом в гидробионтах;
изучение метаболизма НА в пресных и морских акваториях, а также процессов образования, биотрансформации и их выведения у гидробионтов.
Цель настоящей работы заключалась в анализе путей поступления НА в водные организмы, выявлении зависимости их накопления в гидробионтах от абиотических, биотических и антропогенных факторов и в определении экологического риска для природных процессов и ресурсов, биоты и здоровья человека.
ИССЛЕДОВАНИЕ НИТРОЗАМИНОВ В РЫБАХ ЧЕРНОГО МОРЯ
В организм высших животных и человека нитросоединения (НС) попадают из экзогенных источников (пищи, воды, воздуха) и образуются в результате нитрификации аммонийного азота микроорганизмами кишечника. В настоящее время определение НА в гидробионтах обязательно для оценки их качества и пригодности для пищи человека [17, 24, 29]. Многочисленные исследования, проведенные на разных водных организмах в различных географических районах, показывают существенные вариации содержания НА в биоте. Концентрация этих компонентов в различных видах рыб, отловленных в водоемах Китая, варьировала в пределах 0.01–0.1 мкг/кг массы. При этом пресноводные рыбы содержали меньше НА, чем морские виды [48]. У 145 видов рыб, употребляемых в пищу в Китае, содержание НА колебалось от 0.028 до 4.54 мкг/кг. Рыбы, обитающие в более загрязненных водоемах, имели бóльшие концентрации НА. В тканях сайды, отловленной в водах Аляски, содержание НА составило 0.01 мкг/кг в пересчете на N-нитроздипропиламин. Однако при высушивании рыбы концентрация НА увеличивалось в 15.5 раз, что вызывает определенные опасения для использования этого продукта в качестве пищи в связи с его потенциальной канцерогенной опасностью [45].
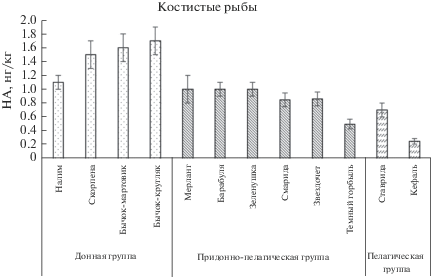
Исследования на черноморских видах рыб позволили установить определенные различия содержания НА в их тканях в зависимости от филогенетического положения (табл. 1), принадлежности рыб к определенной экологической группе (рис. 1), сезонных колебаний и условий существования.
Таблица 1.
Содержание НА в мышечных тканях рыб разных экологических групп, обитающих в Черном море (нг/кг, $\bar {x} \pm S\bar {x}$) [15, 18]
| Виды | НА, пределы содержания | НА, ($\bar {x} \pm S\bar {x}$) |
|---|---|---|
| Костистые рыбы | ||
| Налим | 0.20–2.00 | 1.10 ± 0.10 |
| Скорпена | 0.45–3.00 | 1.50 ± 0.20 |
| Бычок-мартовик | 0.25–2.90 | 1.60 ± 0.20 |
| Бычок-кругляк | 0.2–3.00 | 1.70 ± 0.20 |
| Мерланг | 0.20–2.00 | 1.00 ± 0.20 |
| Барабуля | 0.20–1.70 | 1.00 ± 0.10 |
| Зеленушка | 1.00–1.80 | 1.00 ± 0.10 |
| Смарида | 0.90–1.50 | 0.85 ± 0.10 |
| Звездочет | 0.15–1.30 | 0.86 ± 0.10 |
| Темный горбыль | 0.40–0.60 | 0.50 ± 0.07 |
| Ставрида | 0.20–1.60 | 0.70 ± 0.10 |
| Кефаль | 0.20–0.30 | 0.25 ± 0.04 |
| Хрящевые рыбы | ||
| Катран | 1.50–1.70 | 1.60 ± 0.10 |
| Морской кот | 1.80–1.90 | 1.90 ± 0.40 |
| Морская лисица | 1.90–2.00 | 1.80 ± 0.10 |
Содержание НА в мышечных тканях костистых рыб колеблется от 1.70 (у бычка-кругляка) до 2.50 нг/кг (у кефали), тогда как в тканях хрящевых рыб содержание – 1.50–2.00 нг/кг (табл. 1). Усредненное содержание НА в мышечных тканях хрящевых рыб (xср = 1.80 нг/кг) выше, чем у костистых рыб (xср = 1.00 нг/кг). Самые высокие показатели отмечены у донных хищников – морского кота и морской лисицы [43], что может быть обусловлено специфичным азотистым обменом этих форм, конечный продукт которого – мочевина. Ее концентрация в тканях хрящевых рыб нередко >2% и служит для осморегуляционных целей. Для поддержания осмотического баланса у скатов присутствуют и другие азотсодержащие компоненты с низкой молекулярной массой – триметиламиноксид и бетаин [36]. Таким образом, насыщение тканей хрящевых рыб азотсодержащими компонентами может способствовать вовлечению их в реакции образования НА по специфическим метаболическим путям, присущим эласмобранхиям. Помимо этого, морской кот и морская лисица, в отличие от катрана, являются донным рыбами, которые в наибольшей степени подвержены действию загрязнителей, сконцентрированных в придонных слоях воды, в том числе биогенов и других токсикантов, способствующих образованию НА в организме рыб, что также отмечено и для костистых рыб (рис. 1).
Содержание НА в мышечных тканях костистых рыб имеет четко выраженную зависимость от экологической группы, к которой принадлежит вид (рис. 1), и варьирует в значительных пределах (табл. 1), нг/кг: придонная группа – 0.20–0.30 (xср = 1.30); у придонно-пелагической группы – 0.15–2.00 (xср = 1.00); у пелагических рыб – 0.20–1.60 (xср = 0.60). Таким образом, у придонных видов содержание НА значительно выше, чем у придонно-пелагических и пелагических форм. Пелагические и придонно-пелагические виды способны мигрировать из эвтрофированных сильно загрязненных районов, что снижает вероятность образования НА. Повышенное содержание НА в тканях донных форм может быть вызвано условиями обитания в более загрязненных придонных слоях воды, непосредственно соприкасающихся с грунтами, где аккумулируются загрязнители [20, 21]. Помимо этого, донные формы питаются бентосными беспозвоночными, и накопление НА в их тканях может происходить за счет эффекта концентрирования [46].
В то же время большая вариабельность содержания НА в тканях костистых рыб обусловлена их биологическими и видовыми особенностями (образ жизни, подвижность, спектр питания). В отличие от придонных видов, ведущих малоподвижный образ жизни, концентрация НА в мышечных тканях пелагических и придонно-пелагических рыб заметно ниже, что может быть следствием более интенсивного метаболизма, свойственного активному образу жизни.
Видовые особенности содержания НА у исследуемых рыб могут быть связаны с особенностями трансформации этих соединений в печени рыб, клетки которой очень чувствительны к ним [8, 22]. В этом процессе определенную роль играет и алиментарный фактор, а также состояние гепатоцитов и степень активности монооксигеназ печени. Интоксикация этими соединениями приводит к нарушению функционирования монооксигеназ и к снижению синтеза цитохрома Р-450 как следствие трех взаимосвязанных процессов: включение НА в метаболические пути организма ингибирует активность цитохрома Р-450, угнетает его биосинтез и при взаимодействии с биомолекулами приводит к их повреждению. Они стимулируют перекисное окисление липидов в печени, что усиливает токсический эффект этих канцерогенов [3]. Таким образом, острый токсический эффект НА связан прежде всего с поражением систем детоксикации в клетках печени.
В группе придонных рыб содержание НА имеет близкие и самые высокие значения у бычков и морского ерша, но у звездочета этот показатель в 2 раза ниже. Все исследуемые виды рыб этой группы ведут сходный образ жизни и имеют одинаковый спектр питания, включающий мелкую рыбу, ракообразных и червей. Однако особенность звездочета – его крайне малоподвижный образ жизни, при котором он предпочитает зарываться в песок и длительно поджидать добычу. В этом случае его контакты с загрязненной биогенами водой сокращаются и, таким образом, снижается их поступление в организм рыбы по сравнению с другими представителями этой группы, которые предпочитают держаться на поверхности дна.
Приведенные данные свидетельствуют о том, что образ жизни, степень подвижности и спектр питания рыб могут оказывать существенное влияние на содержание данных канцерогенов в морских рыбах. В то же время накопление НА в тканях рыб и других гидробионтов зависит также от экзогенных факторов, в частности от сезонных изменений среды обитания и антропогенного воздействия на нее.
Учитывая тот факт, что НА и их предшественники – соединения азота – могут образовываться в среде и из нее попадать в организмы, а также синтезироваться в них, особое значение приобретают исследования, направленные на анализ трансформации этих компонентов в среде и в гидробионтах и факторов, влияющих на эти процессы. НА образуются в большом количестве в сильно эвтрофированных водоемах, включая морскую среду, куда поступают хозяйственно-бытовые сточные воды, содержащие в высоких концентрациях биогены. В результате интенсивного развития бактерий, способных синтезировать НА, они накапливаются в среде, в беспозвоночных и по пищевым цепям попадают в организм рыб, где аккумулируются в органах и тканях.
Синтез этих канцерогенов в водоемах имеет определенную цикличность и совпадает с основными процессами трансформации азота в среде, а именно: аммонификация–нитрификация–денитрификация. Появляются промежуточные формы соединений азота, которые вступают в реакцию с аминами с образованием НА. В трансформации соединений азота в воде важную роль играют микроорганизмы, входящие в состав фитопланктона. Динамика и интенсивность этих процессов тесно связаны с сезонностью. Наиболее интенсивное развитие фитопланктона происходит летом, а осенью его численность и биомасса снижаются [9, 40]. Процессы разложения фитопланктона, происходящие в осенний период, сопровождаются насыщением среды соединениями азота, что отразилось на концентрации НА в тканях исследованных черноморских рыб (табл. 2).
Таблица 2.
| Вид | Сезон | |||
|---|---|---|---|---|
| Зима | Весна | Лето | Осень | |
| Придонная группа | ||||
| Налим | 1.70 ± 0.2 | 0.45 ± 0.02 | 0.10 ± 0.01 | 1.80 ± 0.04 |
| Скорпена | 1.80 ± 0.3 | 1.00 ± 0.1 | 0.45 ± 0.04 | 2.90 ± 0.09 |
| Бычок-мартовик | 1.80 ± 0.1 | 0.85 ± 0.1 | 0.31 ± 0.06 | 2.70 ± 0.09 |
| Бычок-кругляк | 1.50 ± 0.1 | 1.20 ± 0.1 | 0.20 ± 0.05 | 2.70 ± 0.20 |
| Придонно-пелагическая группа | ||||
| Мерланг | 1.30 ± 0.1 | 0.70 ± 0.02 | 0.10 ± 0.01 | 1.90 ± 0.07 |
| Барабуля | 1.50 ± 0.1 | 1.00 ± 0.1 | 0.10 ± 0.01 | 1.60 ± 0.20 |
| Зеленушка | 1.60 ± 0.3 | 1.00 ± 0.1 | – | 1.70 ± 0.09 |
| Смарида | 1.30 ± 0.1 | 1.00 ± 0.02 | – | 1.00 ± 0.10 |
| Звездочет | 1.00 ± 0.3 | 0.90 ± 0.09 | 0.15 ± 0.01 | 1.40 ± 0.09 |
| Пелагическая группа | ||||
| Ставрида | 0.75 ± 0.09 | 0.5 ± 0.08 | 0.2 ± 0.04 | 1.5 ± 0.07 |
Содержание НА в них имело выраженную сезонную динамику: в период зима–весна–лето при повышении температуры воды происходило снижение концентрации НА в тканях, но осенью – рост. Содержание НА в организме рыб в значительной степени зависит от температуры, влияющей на уровень метаболизма. С повышением температуры воды скорость биохимических реакций возрастает, что уменьшает возможность накопления НА и способствует их более быстрому выведению из организма. Для холодного времени года установлена противоположная тенденция [16, 23, 43]. Таким образом, динамика содержания этих НА у исследуемых видов рыб, характеризующаяся резким повышением уровня НА осенью и снижением весной–летом, связана с изменением концентрации азотистых соединений в среде и с численностью фитопланктона. Летом при интенсивном развитии фитопланктона происходит утилизация азотистых компонентов микроводорослями [10, 11] и снижается образование НА в среде и в рыбах. Осенью сокращение численности фитопланктона и его отмирание способствуют насыщению воды соединениями азота, трансформация которых в воде приводит к образованию НА и их предшественников. Они попадают в организм и там подвергаются последующему метаболизму с образованием эндогенных НА, концентрация которых в водной среде >0.01 мкг/л представляет реальную угрозу для здоровья рыб [16, 17, 19–21, 39]. В этот же период в тканях рыб обнаружены максимальные концентрации НА.
Помимо этого, для теплого времени года характерна высокая степень насыщения поверхностных вод кислородом, тогда как содержание кислорода в придонном слое снижено. Образование НА под действием солнечного света возможно в воде с низким содержанием кислорода, поскольку последний ускоряет фотодеградацию НС и их распад под действием солнечного УФ-излучения, что также приводит к снижению концентрации этих компонентов как в воде, так и в рыбах.
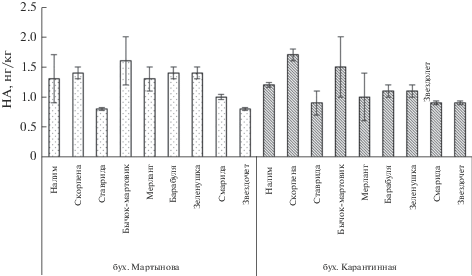
На содержание НА в тканях черноморских рыб влияет также уровень загрязнения среды обитания. Как показали исследования авторов статьи, концентрация НА в мышечных тканях рыб, обитающих в бухтах Карантинной и Мартынова в районе Севастополя с разной степенью антропогенной нагрузки, существенно различалась (рис. 2). Содержание НА у большинства исследованных видов, обитающих в бух. Карантинной, превосходило соответствующие показатели в тканях этих видов в бух. Мартынова, что особенно было выражено у донных и придонно-пелагических форм [13, 16, 23, 25]. Это может зависеть как от степени антропогенной нагрузки, так и от естественных факторов, в частности от географического положения бухт и их водообмена. По данным Государственной инспекции охраны Черного моря [17, 43], уровень содержания NO2 и ${\text{NH}}_{3}^{ + }$-N в бухтах Мартынова и Карантинной был приблизительно одинаков (0.03 и 0.04 мг/л соответственно). Карантинная бухта подвержена хроническому загрязнению, однако имеет постоянный обмен с открытой частью моря; бух. Мартынова изолирована искусственным молом от моря, что способствует снижению водообмена в данной акватории, тогда как в бух. Карантинной застойные явления и эвтрофирование менее выражены.
Таким образом, на содержание НА в мышечных тканях рыб могут влиять сезонные факторы, особенности их биологии, а также уровень загрязнения среды обитания, в частности степень эвтрофирования вод, меняющаяся по сезонам. Хотя содержание НА в тканях массовых видов черноморских рыб, отловленных в прибрежной зоне Севастополя, не превышало ПДК, присутствие этих соединений даже в незначительных количествах может отрицательно повлиять на здоровье как рыб, так и их потребителей, включая человека. Это особенно касается использования в пищу таких промысловых видов, как катран, ставрида, смарида, горбыль и в меньшей степени бычков и морского ерша, которые, однако, содержат наибольшее количество НА.
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ НИТРОЗАМИНОВ
Азотсодержащие соединения играют важную роль в образовании канцерогенных НА – группы соединений, потенциально опасных для здоровья не только гидробионтов, но и человека, использующего в пищу водные биологические ресурсы. В настоящее время выявлено >100 НС, обладающих канцерогенным действием.
Экспериментально доказано, что НА индуцируют злокачественные новообразования у большого числа видов животных, относящихся к разным систематическим группам, и, таким образом, являются политропными канцерогенами. Их видовая бластомогенная активность значительно выше, чем у всех других известных химических канцерогенов. Избирательность бластомогенного действия зависит от химической структуры НА, вида животных, их индивидуальной и генетически обусловленной чувствительности, доз канцерогенов и модифицирующих факторов [1]. Индуцированные новообразования очень разнообразны, многие из них характеризуются высокой степенью злокачественности, инфильтративным ростом, метастазированием и по строению и локализации напоминают опухоли человека [6, 26, 28, 31, 32].
НДМА и НДЭА преимущественно вызывают опухоли у различных видов млекопитающих [24, 33, 35]. Несмотря на значительные видовые различия между теплокровными животными (млекопитающие, птицы) и холоднокровными (рыбами и амфибиями), опухоли, индуцируемые у них НА, нередко сходны по локализации и морфологической структуре. НДЭА и НДМА у всех теплокровных животных вызывают опухоли печени – холангио- и гепатоцеллюлярные карциномы. Гепатоцеллюлярные аденомы и опухоли другой локализации развиваются у аквариумных рыб и амфибий при действии различных НС [1, 6, 24, 27, 33, 35]. Опухоли почек крыс часто образуются из эпителия канальцев коркового слоя. В мочевом пузыре новообразования индуцируются N-нитрозодибутиламином (НДБА). Опухоли органов дыхания, пищевода и пищеварительного тракта появляются под влиянием многих НА. Эти канцерогены поражают нервную и репродуктивную системы [41]. НА проявляют также мутагенную активность, при этом появившиеся мутации наследуются несколькими поколениями [24]. Тем самым НА оказывают губительное воздействие на организмы, способны модифицировать состояние репродуктивной системы и косвенно изменять динамику численности популяций.
В зависимости от типа НС различны механизмы их действия на живой организм. Негативное действие НА особенно проявляется в эндоплазматическом ретикулуме печени, что приводит к утрате каталитических свойств монооксигеназной системы, угнетает белковый синтез на уровне трансляции [5]. НС негативно влияют на функцию гемоглобина, вызывают метгемоглобинемию и аноксию [38]. НА, в частности НДЭА и НДМА, существенно нарушают структуру печени, инициируют дистрофию, некроз паренхимы органа. На более поздних стадиях канцерогенеза возникают доброкачественные аденомы и (или) злокачественные новообразования печени, а также сосудистые опухоли [9]. Наряду с канцерогенным и мутагенным эффектом для них характерен широкий спектр биологического действия, в том числе трансплацентарный эффект, влияние на потомство и т. д. НА токсичны и канцерогенны в присутствии дополнительных ферментных систем, которые всегда имеются в организме теплокровных, а нитрозамиды проявляют эти свойства даже без дополнительной трансформации и поражают в первую очередь кроветворную, лимфоидную, пищеварительную системы. НА на ранних стадиях отравления подавляют иммунитет [8]. Как показано выше, они способны накапливаться в печени и других тканях рыб, что может привести к функциональной недостаточности и к нарушению азотистого обмена. Токсиканты способны нарушать структуру и функции биомолекул, вызывать необратимые изменения ДНК, приводить к патологическим проявлениям и снижению резистентности гидробионтов к изменяющимся условиям среды [7]. N-нитрозометилмочевина и N-нитрозоэтилмочевина влияют на ДНК, что приводит к аномалиям и порокам развития живого организма – недоразвитию конечностей, в ряде случаев к слабому развитию органов. Большинство этих канцерогенов оказывает специфическое действие на определенные органы. При высоких дозах эта специфичность уже не проявляется. Действие частых небольших доз НА более опасно, чем действие одноразовых больших доз.
Таким образом, НА оказывают прямые и косвенные воздействия на водные экосистемы и их обитателей. Учитывая дальнейшее насыщение гидросферы соединениями азота, остро стоит проблема оценки их опасности как для водных экосистем и гидробионтов, так и для здоровья людей, использующих ресурсы водных объектов.
ОЦЕНКА ЭКОЛОГИЧЕСКОГО РИСКА НИТРОЗАМИНОВ
Поскольку НА и их предшественники представляют реальную опасность для здоровья человека и экосистем, для них разработаны специальные нормативы содержания в окружающей среде [14, 30]. Так, ПДКмр2 нитрата аммония в воздухе населенных пунктов составляет 0.008 мг/м3, в воде содержание нитратов не должно превышать 45 мг/дм3, в поступающих стоках в источники водоснабжения в результате хозяйственной деятельности – 10 мг/дм3, в почве – 130 мг/кг [2, 4]. Многообразие возможных путей проникновения их в водные объекты, в том числе используемые в качестве питьевых резервуаров, их хорошая растворимость, высокая стабильность делают воду одним из основных источников поступления НА в организм человека и животных. Эти соединения широко используются в промышленности, они обнаружены и в машинных маслах (до 3%), а также в пищевых продуктах после их переработки, в которых наиболее часто встречаются нитрозодиметиламин и нитрозодиэтиламин. Доказана возможность их синтеза в природных водоемах, а также в организме человека, они распространены практически во всех объектах окружающей среды. С суточным рационом человек получает ~1 мкг НС, с питьевой водой – 0.01 мкг, с вдыхаемым воздухом – 0.3 мкг.
Содержание НА в пищевой продукции – один из важнейших показателей ее безопасности. Установлено, что с увеличением продолжительности хранения концентрация этих канцерогенов в продуктах питания повышается. Так, на 30-е сут хранения наблюдается превышение гигиенических норм содержания НА в мясной варено-копченой продукции на 30–40%. Допустимые уровни – 0.004 мг на 1 кг морепродуктов. При этом концентрация НА в переработанной рыбе зависит от вида, поскольку содержание вторичных и третичных аминов – предшественников НА – существенно варьирует у разных видов, а также зависит от загрязнения морепродуктов нитрат-редуцирующими бактериями Staphilococcus aureus после обработки рыбы при температуре >150°С [47].
Безопасная суточная доза низкомолекулярных НА для человека составляет 10 мкг/сут или 5 мкг/кг в пищевом продукте. Рекомендованная ПДК НС в воде хозяйственно-пищевого назначения – 0.03 мкг/л. Временн${\text{ы}}'$е гигиенические нормативы установлены также для N-нитрозопиперидина [30].
В настоящее время по-прежнему остается актуальной проблема оценки риска для здоровья людей от содержащихся в водной среде соединений азота [37]. Китайскими исследователями проведена работа по изучению влияния содержания нитратов в грунтовых водах из типичных для восточного Китая карстовых источников в сухой и влажный сезоны года [34]. Риск оценивали по потреблению питьевой воды и по влиянию на кожу у четырех групп людей – младенцев (0–6 мес.), детей (7 мес. –17 лет), женщин (18 лет и старше) и мужчин (18 лет и старше). Результаты показали, что более 60% тестируемых образцов воды содержали нитраты в концентрации 10 мг/л, что является стандартом для Китая. Исследования показали следующую последовательность риска для изучаемых групп: младенцы > дети > взрослые женщины > взрослые мужчины. При этом опасность была выше во влажный сезон, чем в сухой, что объясняется бóльшим осаждениeм нитратов во влажное время года. Полученные данные могут быть полезны для разработки менеджмента по водопользованию. Учитывая тот факт, что содержание НА может варьировать в воде и в гидробионтах в течение годового цикла, анализ процессов их образования и накопления в тканях гидробионтов необходим для рационального планирования промысловых мероприятий и добычи водных ресурсов.
ЗАКЛЮЧЕНИЕ
Насыщение водной среды соединениями азота в результате естественных природных процессов и антропогенного загрязнения может приводить к образованию нитрозаминов, представляющих опасность для водных организмов, так как они обладают выраженными токсическими, мутагенными и канцерогенными свойствами. Эти компоненты могут оказывать как прямое негативное влияние на гидробионтов в результате накопления их в организме, последующей интоксикации, канцерогенеза и нарушения жизненных процессов, так и непрямое вследствие ухудшения экологического состояния среды обитания, что делает ее ресурсы непригодными для нормальной жизнедеятельности биоты и использования человеком. В связи с этим возникает проблема контроля этих соединений в воде и биоресурсах, дальнейшее изучение их опасности для гидробионтов, особенно выращиваемых в искусственных условиях аквакультуры, где достаточно велик поток биогенов, обусловленный поступлением обогащенных азотом кормов, фармпрепаратов и продуктов жизнедеятельности организмов. Поскольку аквакультура характеризуется быстрыми темпами развития и экономически выгодна, то в ближайшее время этому вопросу следует уделить особое внимание и прогнозировать риск загрязнения водных объектов биогенами.
Список литературы
Бенеманский В.В., Прусаков В.М., Лещенко М.Е. Изучение бластомогенного действия малых концентраций нитрозодиметиламина, диметиламина и двуокиси азота // Вопр. онкологии. 1981. Т. 27. № 10. С. 56–62.
Вальтер А.И., Касаткина О.А., Петренко А.Е. К методике анализа нитрозаминов в пищевых продуктах // Гигиена и санитария. 1996. № 6. С. 49– 50.
Воронин В.М., Литвинов Н.Н., Казачков В.И, Шамарин А.А., Журков В.С. Изучение зависимости канцерогенного эффекта от концентрации от концентрации N-нитрозодиэтиламин // Вопр. онкологии. 1989. Т. 35. № 6. С. 685–689.
Гершензон В.Е., Смирнова Е.В., Элиас В.В. Информационные технологии в управлении качеством среды обитания. М.: Academia, 2009. 288 с.
Гичев Ю.П. Загрязнение окружающей среды и здоровье человека. М.; Новосибирск: Центр экол. политики России, 2003. 230 с.
Давыдов О.Н., Исаева Н.М., Куровская Л.Я., Базеев Р.Е. Роль токсического загрязнения в опухолеобразовании у рыб // Гидробиол. журн. 2001. Т. 37. № 5. С. 81– 97.
Дмитриенко Н.П., Кишко О., Шандаренко С.Г. О роли квантиноксидазы в цитотоксическом действии нитратов и нитритов // Укр. биохим. журн. 2001. Т. 73. № 6. С. 113–117.
Зульфигаров О.С., Юрченко В.В. Канцерогенные N-нитрозамины, токсические свойства, образование, определение // Современные проблемы токсикологии. 2005. № 1. С. 53–57.
Ильницкий А.П., Юрченко В.А., Жукова Г.Ф., Ермилов В.Б. Оценка степени канцерогенной опасности малых доз нитритов // Вопр. онкологии. 1989. Т. 36. №7. С. 843–847.
Клоченко П.Д., Михайленко В.М., Шевченко Т.Ф. Влияние N-нитрозаминов на развитие фитопланктона // Гидробиол. журн. 2001. Т. 37. № 4. С. 30–38.
Клоченко П.Д., Сакевич А.И., Усенко О.М., Шевченко Т.Ф. Изменение структуры фитопланктона под воздействием мочевины // Гидробиол. журн. 2000. Т. 36. № 6. С. 62–74.
Моисеенко Т.И. Эволюция биогеохимических циклов в современных условиях антропогенных нагрузок: пределы воздействия // Геохимия. 2017. № 10. С. 1–22.
Моисеенко Т.И, Руднева И.И. Глобальное загрязнения и функции азота в гидросфере // ДАН. 2008. Т. 420. № 3. С. 395–400.
Нитраты, нитриты и N-нитрозосоединения. Гигиенические критерии состояния окружающей среды. Женева: ВОЗ, 1981. 118 с.
Омельченко С.О. Cодержание нитрозаминов в некоторых массовых видах черноморских рыб // Агроэкол журн. 2004. № 3. С. 71–73.
Омельченко С.О. Сезонная динамика содержания нитрозаминов у некоторых видов черноморских рыб // Агроэкол. журн. 2006. № 1. С. 72–75.
Омельченко С.О. Состояние азотистого обмена рыб в условиях загрязнения нитрозаминами и токсичными элементами. Автореф. дис. … канд. биол. наук. Одесса: Одесский нац. ун-т, 2009. 25 с.
Омельченко С.О. Экотоксикологическая оценка некоторых видов черноморских рыб. // Уч. зап. Таврического нац. ун-та. Сер. биология, химия. 2012. Т. 25. № 4. С. 144–149.
Омельченко С.О., Залевская И.Н. Влияние микробного загрязнения и содержания нитрозаминов на изменение азотистого обмена в тканях черноморских рыб // Уч. зап. Крымского федерального ун-та. Сер. биология и химия. 2015. Т. 1. № 3. С. 39–48.
Омельченко С.О., Залевская И.Н., Мащева О.Л., Руднева И.И. Сезонные особенности азотистого обмена и содержания нитрозаминов у морского ерша // Экосистемы Крыма, их оптимизация и охрана. 2006. № 16. С. 78–82.
Омельченко С.О., Чеснокова И.И., Залевская И.Н. Особенности азотистого обмена и содержания нитрозаминов в тканях черноморских рыб, относящихся к разным экологическим группам // Уч. зап. Крымского федерального ун-та. Сер. биология и химия. 2016. Т. 2. № 2. С. 47–57.
Рубенчик Б.Л. Образование канцерогенов из соединений азота. Киев: Наук. думка, 1990. 220 с.
Руднева И.И., Мельникова Е.Б., Кузьминова Н.С., Омельченко С.О., Залевская И.Н., Симчук Г.В. Влияние экологических факторов на уровень нитрозаминов у морских рыб // Экол. химия. 2007. Т. 16. № 3. С. 166–175.
Руднева И.И., Мельникова Е.Б., Кузьминова Н.С., Омельченко С.О., Залевская И.Н., Симчук Г.В. Оценка влияния минеральных соединений азота на донных рыб в бухтах Черного моря // Вод. ресурсы. 2008. Т. 35. № 4. С. 260–267.
Руднева И.И., Мельникова Е.Б., Омельченко С.О. Содержание нитрозаминов в массовых видах рыб Черного моря // Рыбное хоз-во Украины. 2006. № 5–6. С. 47–49.
Тутельян В.А., Лунева Н.В. О механизме острого токсичного действия N-нитрозодиметиламина // Фармакология и токсикология. 1983. № 9. С. 111–114.
Худолей В.В. Роль возраста в канцерогенезе, индуцированном N-нитрозодиметиламином и N-диметилнитрамином у амфибий // Вопр. онкологии. 1981. Т. 27. № 10. С. 67–71.
Худолей В.В., Малавей В.К., Барч Х. Изучение мутагенных свойств канцерогенных N-нитрозаминов in vivo и in vitro. Вопр. онкологии. 1981. Т. 27. № 7. С. 843–847.
Экотоксикологические исследования прибрежной черноморской ихтиофауны в районе Севастополя / Под ред. И.И. Рудневой. М.: ГЕОС, 2016. 360 с.
Янышева Н.Я. О методологических вопросах нормирования химических канцерогенных веществ в окружающей среде // Гигиена и санитария. 2003. № 1. С. 54–57.
Barabasz W.E., Rozycki E., Smyk B. The occurrence of carcinogenic nitrosamines in the aquatic environment (fishponds in wetlands) // Acta Hydrobiol. Cracow. 1995. V. 37. P. 23–27.
Bartsch H., Camus A., Malaveille C. Comparative mutagenicity of N-nitrosamines in a semisolid and a liquid incubation system in the presence of rat or human tissue fractions, Mutation Research // Fundam. Mol. Mech. Mutagen. 1976. V. 37 (2–3). P. 149–162.
Bieniarz K., Epler P., Kime D., Sokolowska-Mikolajczyk M., W. Popek W., Mikolajczyk T. Effects of N,N-dimethylnitrosamine (DMNA) on in vitro oocyte maturation and embryonic development of fertilized eggs of carp (Cyprinus carpio L.) kept in eutrophied ponds // J. Appl. Toxicol. 1996. V. 16. P. 153–156.
Gao S., Li C., Jia C., Zhang H., Guan Q., WuX., Wang J., Lv M. Health risk assessment of groundwater nitrate contamination: a case study of a typical karst hydrogeological unit in East China // Environ. Sci. Pollut. Res. 2020. V. 27. 9274–9287.
Goodall M., Kennedy T. Carcinogenicity of dimethylnitramine in the NZR rats and, NZO mice // Cancer Lett. 1976. V. 1. P. 295–298.
Haman K.H., Norton T.M., Thomas A.C., Dove A.D.M., Tseng F. Baseline health parameters and species comparisons among free-ranging Atlantic sharpnose (Rhizoprionodon terraenovae), bonnethead (Sphyrna tiburo} and spiny dogfish (Squalus acanthias) sharks in Georgia, Florida, and Washington, USA // J. Wildlife Diseases. 2012. V. 48. № 2. P. 205–306.
He X., Huang K. Chapter 7. Assessment technologies for hazards/risks of wastewater // High-Risk Pollutants in Wastewater. Amsterdam: Elsevier Inc., 2020. P. 141–157.
Huang J., Xu C.- C., Ridoutt B.G., Wang X.-C., Ren P.-A. Nitrogen and phosphorus losses and eutrophication potential associated with fertilizer application to cropland in China // J. Cleaner Prod. 2017. V. 159. P. 171–179.
Jensen F.B. Nitrite disrupts multiple physiological functions in aquatic animals // Comp. Biochem. Physiol. Pt A. Mol. Integr. Physiol. 2003. V. 135. № 1. P. 9–24.
Kartal B.K., J.G. Kuenen, M.C.M.V. Loosdrecht, Sewage treatment with anammox // Sci. 2010. V. 328. P. 702–703.
Naing N.N., Sze Chieh Tan S.Ch., Lee H.K. 16 – Micro-solid-phase extraction // Handbooks in Separation Science. Amsterdam: Elsevier Inc., 2020. P. 443–471.
Priya E.R., Ravichandrana S., Gobinatha Th., Tilvib S., Devib P.S. Functional characterization of anti-cancer sphingolipids from the marine crab Dromia dehanni // Chem. Phys. Lipids. 2019. V. 221. P. 73–82.
Rudneva I.I., Kuzminova N.S., Omelchenko S.O. Trace elements and nitrosamines concentration in Black Sea elasmobranch species // Asian J. Biol. Life Sci. 2012. V. 1. № 1. P. 51– 57.
Rudneva I.I., Melnikova E.B., Omelchenko S.O. Seasonal variations of nitrosamine content in some Black Sea fish species // Turk. J. of Fish. Aquat. Sci. 2008. V. 8. № 2. P. 283– 287.
Sang N.J., Lee S.J., Shin J.H., Kim J.G. The formation of N-nitrosamine in Alaska Pollack during its drying // J. Korean Fish. Soc. 1997. V. 30. № 5. P. 753–758.
Sole M., Rodriguez S., Papiol V., Maynou F., Cartes J.E. Xenobiotic metabolism markers in marine fish with different trophic strategies and their relationship to ecological variables // Comp. Biochem. Physiol. 2009. V. 149. P. 83–89.
Yurchenko V.V., Molder U. Volatile N-nitrosamines in various fish products. // Food Chem. 2006. V. 96. P. 325–333.
Zou X.N. Volatile N-nitrosamines and their precursors in Chinese salted fish – a possible etiological factor for NPC in China // Int. J. Cancer. 1994. V. 59. № 2. P. 155–158.
Дополнительные материалы отсутствуют.