Водные ресурсы, 2021, T. 48, № 3, стр. 280-289
Опасности и риски рекреационного водопользования: векторы международных исследований. Качество рекреационных сред
И. В. Андреева *
Институт водных и экологических проблем СО РАН
656038 Барнаул, Россия
* E-mail: direction-altai@yandex.ru
Поступила в редакцию 04.05.2020
После доработки 23.05.2020
Принята к публикации 16.10.2020
Аннотация
Обобщены англоязычные научные публикации по вопросам оценки опасностей и рисков в рекреационном водопользовании. Проанализирована международная публикационная активность, показаны магистральные и поисковые направления тематических исследований. Кратко приведены результаты изучения микробного загрязнения воды и песка на пляже, поведения микробных патогенов и их влияния на здоровье посетителей пляжей, опасности цветущих водорослей, солнца, радиации и эстрогенов для отдыхающих. Показаны методы и технологии оценки загрязнений пляжных сред и заболеваемости вследствие купания, а также перспективные направления исследований влияния факторов окружающей среды на поведение загрязнителей и перенос загрязнений в пляжных средах.
ВВЕДЕНИЕ
Рекреационное водопользование – древнейший и многоаспектный феномен, его масштаб резко вырос в ХХI в., но парадигма его пока не сформирована окончательно. Причин тому много: от отсутствия единой идеологии до современных природных и социальных вызовов, актуализующих исследования в области оценки опасностей, рисков и ущербов в разных сферах человеческой деятельности, в том числе в рекреационном водопользовании.
В отечественной науке термин “рекреационное водопользование” впервые сформулирован А.Б. Авакяном с соавторами и обозначает деятельность населения, связанную с отдыхом, спортом и туризмом на акватории и побережье водоемов. В определении подчеркнуто прямое или косвенное влияние такой деятельности на качество воды и экосистемы водных объектов, поэтому рассматривается с позиций рационального использования и охраны водных ресурсов [1].
Современные глобальные события (экономический кризис, изменение климата, природные катастрофы и эпидемии) множат аспекты рекреационного водопользования, требуют новых научных идей и объяснений. Например, с позиции экономической целесообразности и физической безопасности при организации рекреационных зон необходимо осмысление расположения прибрежных рекреационных площадок на контакте литосферы и гидросферы, в условиях высокой динамичности природных процессов, а значит – слабой предсказуемости и опасности. С точки зрения здоровья человека необходимо учитывать, что мировые прибрежные воды становятся пулом опасных микрооганизмов. Фокус на предпочтениях пользователя, которому важна близость водного объекта к месту проживания, увеличивает рекреационную ценность водотоков. Исследования в этих направлениях уже ведутся, что подтверждает ежегодный рост числа доступных публикаций.
Однако, по мнению И.В. Ланцовой [3], с которым нельзя не согласиться, “несмотря на большое количество исследований по рекреационному природопользованию, комплексных работ по геоэкологическим проблемам рекреационного использования водохранилищ в научной литературе практически не представленo”. Этот вывод легко интерполируется на другие типы водных объектов (озера, моря и особенно – реки) и на другие аспекты рекреационного водопользования, например на гидрологическую и геоморфологическую безопасность рекреационных побережий [2].
Отечественные исследования не уникальны в этом отношении. Результаты анализа изученности проблемы по англоязычной литературе говорят о ее международном характере, что затрудняет для исследователей возможность качественных теоретических обобщений. Вместе с тем для разных стран характерны свои национальные особенности исследований и имеются прорывные идеи, которые могут быть полезны мировому научному сообществу для развития новых направлений изучения рекреационного водопользования.
Представленная статья посвящена оценке качества рекреационных сред (вода, песок, донные отложения) и его влияния на здоровье человека. Она вводит в проблему и освещает тематические направления и важнейшие выводы из исследований качества воды и песка на пляже.
МЕТОДИКА ИССЛЕДОВАНИЙ
Для отбора публикаций, посвященных опасностям, рискам и ущербам на рекреационных пляжах, в электронной научной библиотеке “Web of Science” [99] сформулированы три поисковых запроса: Тема 1 = (“beach*” and “hazard*” and “recreation*”); Тема 2 = (“recreational beach*” and “risk*”); Тема 3 = (“beach*” and “damage*” and “recreation*”). Поиск обнаружил 250 статей, датируемых 1991–2019 гг.
Анализ содержания текстов показал четкое разделение исследований по трем магистральным направлениям: 1) качество сред; 2) воздействие рекреационной деятельности на экосистемы и биоту; 3) воздействие природных процессов на рекреационные пляжи и здоровье человека. Кроме того, обнаружено, что запрос с корнем “hazard” соответствует исследованиям и источникам по качеству сред, запрос с корнем “risk” приведет, скорее всего, к источникам по воздействиям, а запрос “damage” с бóльшей вероятностью укажет на статьи по физической безопасности побережий (табл. 1).
Таблица 1.
Поисковые запросы и направления исследований
| Корень поискового запроса | Количество статей в тематических направлениях, ед. | ||
|---|---|---|---|
| качество рекреационной среды и влияние на здоровье человека | воздействия рекреационной деятельности на экосистемы и биоту | воздействия природных сил на рекреационные пляжи и здоровье человека | |
| Опасность (“hazard”) | 81 | 1 | 8 |
| Риск (“risk”) | 7 | 24 | 40 |
| Ущерб (“damage”) | 16 | 20 | 53 |
Изучению качества рекреационных сред посвящено 104 статьи из 57 журналов. В общей сложности 482 автора работают в тематике, но лишь 23 из них имеют по три статьи и больше. Отраслевые результативные специалисты и лидеры по числу цитирований – H. Solo-Gabriele, R. Whitman, J. Griffith и A. Ahmad (табл. 2).
Таблица 2.
Специалисты по оценке качества рекреационных сред
| № | Авторский коллектив | Автор | Страна | Статьи | Общее количество ссылок на статьи, ед. |
|---|---|---|---|---|---|
| 1 | 1 | Solo-Gabriele, Helena M. | США | [32, 75, 76, 78, 88, 91, 92, 98, 100] | 249 |
| 2 | Whitman, Richard L. | » | [51, 69, 72, 88, 92, 100] | 184 | |
| 3 | Harwood, Valerie J. | » | [6, 11, 92, 100] | 172 | |
| 4 | Nevers, Meredith B. | » | [69, 72, 88, 100] | 127 | |
| 5 | Edge, Thomas A. | Канада | [92, 98, 100] | 93 | |
| 6 | Brandao, Joao | Португалия | [88, 92, 100] | 119 | |
| 7 | 2 | Griffith, John F. | США | [21, 38, 39, 59, 93, 105] | 179 |
| 8 | Wade, Timothy J. | » | [21, 70, 71, 105] | 126 | |
| 9 | Schiff, Kenneth C. | » | [21, 38, 93, 105] | 155 | |
| 10 | Weisberg, Stephen B. | » | [21, 38, 105] | 137 | |
| 11 | Arnold, Benjamin F | » | То же | 137 | |
| 12 | Cao, Yiping | Китай | » | 137 | |
| 13 | Colford, John M., Jr. | США | » | 137 | |
| 14 | Boehm, Alexandria B. | » | [13, 14, 104, 105] | 21 | |
| 15 | Haugland, Richard | » | [21, 41, 70] | 131 | |
| 16 | 3 | Ahmad, Asmat | Малайзия | [4, 5, 26, 35, 42, 107] | 16 |
| 17 | Dada, Ayokunle Christopher | Новая Зеландия | [4, 26, 27] | 20 | |
| 18 | Usup, Gires | Малайзия | [4, 5, 26] | 15 | |
| 19 | 4 | Wong, Mark Vee-Meng | Сингапур | [69, 102, 103] | 165 |
| 20 | Rose, J. Barbara | США | То же | 165 | |
| 21 | Phanikumar, Mantha S. | » | [69, 102, 106] | 85 | |
| 22 | 5 | Jiang, Sunny C. | » | [29, 58, 84] | 30 |
| 23 | Lim, Keah-Ying | » | То же | 30 |
Помимо общности авторских интересов видно, что международное сотрудничество весьма ограниченно и состоит во включении одного-двух иностранных коллег в крупные национальные группы. Очевидно, это связано со спецификой изучения влияния параметров рекреационной среды на риски для здоровья в разных странах, в том числе с учетом разных параметров оценки, а также с локальным характером исследований.
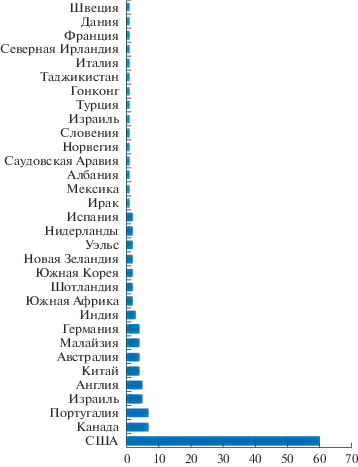
По рассматриваемой теме публикуются авторы из 32 стран. Более половины статей принадлежит исследователям из США, для которых большинство журналов – “домашние” и издаются на родном языке. Статей, написанных россиянами, в тематическом перечне нет (рис. 1), что не умaляет качество отечественных исследований, а лишь демонстрирует степень доступности рейтинговых зарубежных площадок для демонстрации и обсуждения результатов для неамериканских ученых. В этой связи отраслевые национальные издания приобретают значимость банков кондиционных, соответствующих международным тенденциям, но обладающих региональной спецификой результатов для дальнейших дискуссий и теоретических обобщений.
РЕЗУЛЬТАТЫ И ОБОБЩЕНИЕ
Качество рекреационных сред обсуждается в рамках десятка узких тем: микробное загрязнение воды и песка, влияние экологических факторов на персистенцию энтерококков (Enterococcaceae), поведение и влияние других патогенов (Vibrionaceae, Salmonella, Adenoviridae) на здоровье посетителей пляжей, опасность сброса канализационных (сточных) вод на пляжи; микробный риск от распределенных источников, опасность цветущих пресноводных водорослей, методы и технологии оценки загрязнений пляжных сред, фильтрующие системы, влияние солнца, радиации и эстрогенов на здоровье отдыхающих, заболеваемость вследствие купания, влияние факторов окружающей среды на поведение и перенос загрязнений в пляжных средах.
Самая широкая тема – изучение микробного загрязнения, основной показатель которого – фекальные (колиформные) бактерии группы кишечной палочки Escherichia coli. Обитая в кишечнике животных или человека, они способны выживать в окружающей среде, поэтому служат индикатором оценки качества природных вод и включены во все нормативные документы. Наличие Escherichia coli в рекреационных средах создает риск множества опасных заболеваний, поэтому с изучением разных аспектов проблемы и с оценкой фекальных загрязнений связано большинство работ (в общей сложности 57).
Основополагающие вопросы оценки риска заболеваний человека из-за фекального загрязнения в процессе отдыха обобщены в обзорах [4, 14, 48, 61, 70, 71, 80, 98], где показаны концептуальные положения и признанные научные подходы. К оценке качества воды подходят с разных позиций, но чаще всего используют одновременно широкий спектр физико-химических и микробиологических показателей, а результатам придают констатирующий или сравнительный характер. Такие исследования описывают бактериальное загрязнение на водных объектах различного генезиса, но подавляющая часть их посвящена морским пляжам в разных частях мира: в Южной Африке [31], Южной Калифорнии (США) [29, 38, 59, 97], Турции (прол. Дарданеллы) [96], Гренаде (Карибский бассейн) [43], Швеции (Датский эстуарий) [86], Индии [19], Бразилии [84], Испании [64], Южной Корее [49] и на Гавайях [81]. Исследований пресноводных пляжей намного меньше, и посвящены они оз. Мичиган и Великим озерам в США [23, 42, 51]. Вместе с тем на примере пресных вод на территории с умеренным климатом (Великие озера) и морских тропических вод (Пуэрто-Рико) показано, что методы обнаружения энтерококков в водах разного генезиса универсальны [41].
Перечисленные работы практически идентичны, но есть такие, в которых взгляд на проблему нетривиален, что открывает новые исследовательские аспекты. К таким относятся, например, оценка потерь производительности труда в форме отпуска по болезни, вызванной фекальными загрязнениями воды на пляжах [57], а также изучение способности популяции морских мух, населяющих субстрат из гниющих водорослей на естественных отмелях, загрязненный человеческим патогеном, усиливать источник опасности при передаче инфекции посетителям пляжей [73, 94].
Пляжная вода часто контролируется на микробное качество. Однако все больше данных говорит о том, что пляжный песок может содержать вредные для человека микробы часто в концентрациях выше концентрации в воде. Вместе с тем стандарты мониторинга, отбора проб, анализа и управления качеством пляжного песка пока не разработаны [88].
Обнаружению в пляжном песке энтерококков, вызывающих менингит, инфекции мочевыводящих путей и бактериальный эндокардит, а также количественной оценке риска заболевания человека при контакте с песком посвящены исследования на морских субтропических пляжах Мексики [55], Южной Австралии [100] и Новой Зеландии [9], Флориды [17, 21, 32, 75, 76, 91, 101], Северной Каролины [37], Калифорнии [39], Португалии [88], Бразилии [89], Малайзии [26] и Ирана [30]. Подобная оценка на пресноводных пляжах выполнена лишь дважды: на оз. Мичиган [92] и на Великих озерах [12].
В ряде исследований уточняются экологические факторы, влияющие на персистенцию энтерококков. В них установлено, что в благоприятных условиях бактерии в пляжных песках могут не только выживать, но и размножаться, а наибольшую концентрацию они имеют в биопленках песков выше уровня прибоя [105]. Устойчивость кишечной палочки к антибиотикам зависит от степени загрязнения пляжного песка человеческими фекалиями [10]. Наибольшая доля энтерококков в общей популяции, как правило – в толще воды (до 77%) или в донных отложениях (до 95%). Энтерококки в подводной растительности составляют 0–18% общей популяции, хотя имеют самые высокие концентрации на единицу массы резервуара [11].
Одно из направлений работ посвящено золотистому стафилококку (Staphylococcus aureus). Бактерии Staphylococcus aureus сохраняются на кожных покровах и слизистых оболочках верхних дыхательных путей, провоцируют широкий диапазон заболеваний: от кожных инфекций до смертельно опасных пневмонии, менингита, сепсиса. Судя по географии исследований, вопросы обнаружения, динамики и пространственной оценки Staphylococcus aureus наиболее актуальны для теплых морей Малайзии [5, 108], Албании [16] и США [34, 56, 78]. В необычном сравнительном исследовании, выполненном в США, пляжные рекреационные среды сравниваются с поверхностями касания в общественных зданиях [82]. Поведение изолятов Staphylococcus aureus в этих средах ожидаемо различно: доминируют разные штаммы бактерий с разными реакцией на антибиотики и устойчивостью к ним.
Другим патогенам уделено гораздо меньше внимания; в частности, галофильному вибриону из семейства Vibrionaceae, обитающему в соленых водоемах и способному вызвать вспышки острых кишечных инфекций, посвящено всего одно исследование [35], проведенное в малазийских морских водах. Аналогична ситуация с исследованиями сальмонеллы (Salmonella) – возбудителя брюшного тифа, паратифов и других сальмонеллезов [63]; аденовируса (Adenoviridae) – возбудителя конъюнктивита, тонзиллита, отита [104]. Первое из них выполнено в Португалии, второе – на оз. Мичиган.
Тесно связана с предыдущей тема опасности от сброса сточных вод на пляжи и в акватории. Таких исследований много, что говорит об остроте проблемы. Она существует на пляжах Сальвадора, где из-за подводного сброса неочищенных стоков высоки бактериальная активность и риск заражения патогенами человека [87]. На оз. Тахо (Калифорния, США) из-за переноса патогенов от рекреационных пляжей, где происходит телесный контакт рекреантов с водой, до водозаборов питьевой воды зафиксировано проникновение патогенов в систему питьевого водоснабжения [44]. В Португалии обнаружено ухудшение динамики качества воды во время купального сезона из-за влияния городского водного цикла [25]. От быстроты определения фекальных загрязнений зависят превентивные мероприятия, снижающие заболеваемость на пляже. Развитию методов быстрой оценки посвящены исследования, которые оценивают, насколько тот или иной метод полезен для предупреждения об опасности заражения [21, 46]. Однако купающиеся не осознают уровня риска и не придерживаются рекомендаций даже во время запретов на купание [79].
С помощью фекальных индикаторов качество воды на пляжах оценивается во многих прибрежных регионах мира. Однако полезность этого подхода иногда сомнительна, особенно там, где нет очевидных антропогенных источников стоков. Поэтому ряд работ демонстрирует оценку микробного риска от распределенных источников [58], например от фекалий диких птиц: чаек [7, 90], песчаного журавля [60], канадского гуся [45].
Другой источник опасности – цветущие пресноводные водоросли, производящие широкий спектр биологически активных соединений, способных негативно влиять на органы, кожу и иммунную систему [62]. Даже низкие уровни цианотоксинов в питьевых и рекреационных водах способны оказывать хроническое токсическое воздействие, что подтверждено на эмбрионах Danio rerio [85]. Экосистемной ориентацией отличается от предыдущих исследование, выполненное в Болгарии и показавшее рекреационный ущерб от цветения водорослей в Варненском заливе. В нем оценено количество, степень и длительность цветения водорослей, а также готовность посетителей платить за очистку от них пляжей [95].
Обширная группа статей посвящена методам и технологиям оценки. Современный мониторинг качества воды основан на частых отборах проб и культивировании бактерий, что требует много времени и не позволяет быстро принимать решения. Есть очевидная потребность в более быстрых и удобных методах анализа [8], для чего совершенствуется процесс прогнозирования концентраций патогенов. Традиционные регрессионные модели предлагается комбинировать с авторскими: метео-бактериологическими моделями [27, 72, 103], методом нелинейной авторегрессионной сети с экзогенными входами с объясняющими переменными [107], количественной цифровой полимеразной цепной реакцией и цифровой обратной реакцией [18, 66, 93], методом проточной цитометрии вместе с флуоресцентными антителами [50].
Задачи улучшения методов обнаружения вирусов решают исследования, посвященные фильтрующим системам. Свою эффективность подтвердили картриджи с электропозитивными гранулярными средами [47, 65] и мембраны, стимулированные подкислением или добавлением MgCl2 [6]. Среди других концептуальных предложений – метод, позволяющий одновременно фильтровать и концентрировать все классы патогенов из больших объемов воды [36], стохастическая модель количественной оценки микробного риска [77], модель суточной изменчивости энтерококков в зависимости от солнечного и приливного циклов [13], модель гидродинамики зоны прибоя в сочетании с моделью переноса с инактивацией загрязнителя первого порядка [69]. Для поддержки системы принятия решений по пляжам предназначена система мониторинга качества воды, сочетающая в себе модель множественной линейной регрессии для прогноза уровней энтерококков и географическую информационную систему для пространственного отображения состояния пляжа [28].
Специфична группа исследований по солярной тематике. Например, в одном из них морская вода тестируется на наличие стойких соединений из состава солнцезащитных кремов, оказывающих доказанное негативное влияние на клетки и ткани человека и животных [43]. Два исследования связаны с воздействием на отдыхающих ультрафиолета, вызывающего кератит [102] и базальноклеточный рак кожи [67].
Единичные исследования посвящены оценке радиоактивности рекреационных вод [40] и оценке концентрации эстрогенов в речных водах [83]. Такие специфичные исследования актуальны для Индии и Португалии.
Задача оценки заболеваемости вследствие купания поставлена в нескольких работах. Например, связь между загрязнением рекреационных сред и заболеваемостью предлагается определять анкетированием пловцов и оценкой связей между бактериальными маркерами и самостоятельно ими установленными без обращения к врачу болезнями [70]. Частоту заражения среди пловцов и загорающих предлагается рассчитывать с помощью сравнительной оценки показателей сброса загрязненных сточных вод, уровня солнечной радиации и заболеваемости посетителей [106]. В опытах на крысах показана потенциальная способность бактерий, выделенных с морских пляжей, вызывать раневые инфекции. Заболеваемость и смертность животных достоверно коррелировали с количеством фекальных кишечных палочек и обратно пропорциональны солености воды [53].
Последнюю группу составляют мультидисциплинарные исследования влияния факторов окружающей среды на масштабы, направление и интенсивность переноса микробного загрязнения в рекреационных средах. Для определения факторов, наиболее значимых при оценке риска заражения и заболевания пловцов, в качестве переменных для моделей множественной регрессии предлагается использовать направление волн, количество облаков и высоту нижней границы облачности, направление и скорость течения и температуру воды [15, 24, 54], влажность песка и расстояние от зоны прилива [20], направление и скорость вдольбереговых течений и объем оттока воды, разбавляющей загрязнения по сливным канавам [68], количество и интенсивность атмосферных осадков [58, 22, 74, 33 ], глубину и рельеф дна в прибрежной зоне [52].
ЗАКЛЮЧЕНИЕ
Результаты анализа источников, посвященных опасностям и рискам в рекреационном водопользовании, приводят к выводу, что более половины мировых исследований связаны с оценкой микробиологического качества рекреационных вод и риска для здоровья человека при их использовании. Это направление, как наиболее изученное, вряд ли утратит позиции в ближайшие годы; скорее, оно будет развиваться в сторону теоретических обобщений. Вместе с тем растет число и качество исследований других вопросов: 1) исследования песка и донных отложений на наличие патогенов и для сравнения с водной средой; 2) оценка влияния сброса сточных вод в рекреационные среды на заболеваемость отдыхающих; 3) изучение влияния природных факторов на масштабы и поведение загрязнений; 4) теоретические, методические и технологические уточнения оценки загрязнения и рисков, с ним связанных. Остальные направления из перечисленных в статье следует пока рассматривать как поисковые.
Дефицит научных идей по ряду тем, а также специфика российской рекреационной и хозяйственной практики обуславливают целесообразность отечественного научного поиска в направлениях: 1) определение микробиологического качества рекреационных сред на внутриконтинентальных озерах и реках; 2) сравнительные исследования загрязнений на речных и озерных пляжах в разных природных зонах; 3) количественная сравнительная оценка микробного загрязнения от широкого спектра источников – от скоплений водоплавающей птицы и сельскохозяйственных животных до массовых концентраций рекреантов в местах отдыха. Такие исследования необходимы не только науке, но и практике управления прибрежными территориями для пролонгированного обеспечения качества экосистем и улучшения качества жизни населения.
Список литературы
Авакян А.Б., Бойченко В.К., Салтанкин В.П. Рекреационное использование водных объектов Московской области (состояние, проблемы, перспективы) // Вод. ресурсы. 1983. № 6. С. 125–133.
Андреева И.В. Рекреационное водопользование на реках: экосистемная обеспеченность и гидрологическая безопасность // Изв. АО РГО. 2019. № 3. С. 5–16.
Ланцова И.В. Геоэкологическая оценка и рациональное использование рекреационного потенциала береговых зон водохранилищ. Автореф. дис. … докт. геогр. наук. М.: ИВП РАН, 2009. 54 с.
Ahmad A., Dada A., Usup G. Application of multilocus sequence analysis for molecular characterization of enterococci with virulence factors recovered from a tropical recreational beach // Southeast Asian J. Tro-pical Med. Publ. Health. 2014. V. 45. № 3. P. 700–71.
Ahmad A., Zulkifli A., Usup G. Detection of methicillin resistant Staphylococcus aureus (MRSA) isolated from Bagan Lalang recreational beach, Malaysia // Malaysian J. Microbiol. 2016. V. 12. № 2. P. 171–176.
Ahmed W., Harwood V., Gyawali P. et al. Comparison of Concentration Methods for Quantitative Detection of Sewage-Associated Viral Markers in Environmental Waters // Applied Environ. Microbiol. 2014. V. 81. № 6. P. 2042–2049.
Alm E., Daniels-Witt Q., Learman D. et al. Potential for gulls to transport bacteria from human waste sites to beaches // Sci. Total Environ. 2019. V. 615. P. 123–130.
Amini K., Kraatz H. Recent advances and developments in monitoring biological agents in water samples // Rev. Environ. Sci. Biotechnol. 2015. V. 14. № 1. P. 23–48.
Anderson S., Turner S., Lewis G. Enterococci in the New Zealand environment: Implications for water quality monitoring // Water. Sci. Technol. 1997. V. 35. № 11–12. P. 325–331.
Andrade V., Zampieri B., Ballesteros E. et al. Densities and antimicrobial resistance of Escherichia coli isolated from marine waters and beach sands // Environ. Monit. Assess. 2015. V. 187. № 6. P. 342.
Badgley B., Thomas F., Harwood V. Quantifying environmental reservoirs of fecal indicator bacteria associated with sediment and submerged aquatic vegetation // Environ. Microbiol. 2011. V. 13. № 4. P. 932–942.
Bauer L., Alm E. Escherichia coli toxin and attachment genes in sand at Great Lakes recreational beaches // J. Great Lakes Res. 2012. V. 38. № 1. P. 129–133.
Boehm A. Enterococci concentrations in diverse coastal environments exhibit extreme variability // Environ. Sci. Technol. 2007. V. 41. № 24. P. 8227–8232.
Boehm A., Yamahara K., Love D. et al. Covariation and Photoinactivation of Traditional and Novel Indicator Organisms and Human Viruses at a Sewage-Impacted Marine Beach // Environ. Sci. Technol. 2009. V. 43. № 21. P. 8046–8052.
Boer S., Heinemeyer E., Luden K. et al. Temporal and Spatial Distribution Patterns of Potentially Pathogenic Vibrio spp. at Recreational Beaches of the German North Sea // Microbial Ecol. 2013. V. 65. № 4. P. 1052–1067.
Bofe K., Hysko M., Agolli B. Pollution of recreational beaches of Vlora Bay (Albania) assessed by microbiological tests // Acta Biochim. Pol. 2015. V. 62. № 4. P. 659–661.
Bonilla T., Nowosielski K., Cuvelier M. et al. Prevalence and distribution of fecal indicator organisms in South Florida beach sand and preliminary assessment of health effects associated with beach sand exposure // Mar. Pollut. Bull. 2007. V. 54. № 9. P. 1472–1482.
Botes M., de Kwaadstenie M., Cloete T. Application of quantitative PCR for the detection of microorganisms in water // Anal. Bioanal. Chem. 2013. V. 405. № 1. P. 91–108.
Clark A., Turner T., Dorothy K. et al. Health hazards due to pollution of waters along the coast of Visakhapatnam, east coast of India // Ecotoxicol. Environ. Safety. 2003. V. 56. № 3. P. 390–397.
Coakley E., Parris A., Wyman A. et al. Assessment of Enterococcus Levels in Recreational Beach Sand Along the Rhode Island Coast // J. Environ. Health. 2016. V. 78. № 8. P. 12–17.
Colford J., Schiff K., Griffith J. et al. Using rapid indicators for Enterococcus to assess the risk of illness after exposure to urban runoff contaminated marine water // Water Res. 2012. V. 46. № 7. P. 2176–2186.
Cordero L., Norat J., Mattei H. et al. Seasonal variations in the risk of gastrointestinal illness on a tropical recreational beach // J. Water Health. 2012. V. 10. № 4. P. 579–593.
Cornwell E., Goyette J., Sorichetti R. et al. Biological and chemical contaminants as drivers of change in the Great Lakes-St. Lawrence river basin // J. Great Lakes Res. 2015. V. № 41. SI. 1. P. 119–130.
Corsi S., Borchardt M., Carvin R. et al. Human and Bovine Viruses and Bacteria at Three Great Lakes Beaches: Environmental Variable Associations and Health Risk // Environ. Sci. Technol. 2016. V. 50. № 2. P. 987–995.
Costa-Dias S., Machado A., Teixeira C. et al. Urban Estuarine Beaches and Urban Water Cycle Seepage: The Influence of Temporal Scales // Water. 2018. V. 10. № 2. P. 173.
Dada A., Ahmad A., Usup G. et al. Speciation and antimicrobial resistance of Enterococci isolated from recreational beaches in Malaysia // Environ. Monitoring and Fssessment. 2013. V. 185. № 2. P. 1583–1599.
Dada A., Hamilton D. Predictive Models for Determination of E. coli Concentrations at Inland Recreational Beaches // Water Soil pollution. 2016. V. 227. № 9. P. 347.
Deng Z., Namwamba F., Zhang Z. Development of decision support system for managing and using recreational beaches // J. Hidroinformatics. 2014. V. 16. № 2. P. 447–457.
Dickinson G., Lim K., Jiang S. Quantitative Microbial Risk Assessment of Pathogenic Vibrios in Marine Recreational Waters of Southern California // Applied Environ. Microbiol. 2013. V. 79. № 1. P. 294–302.
Ebadi A., Hisoriev H. Physicochemical characterization of sediments from Tajan river basin in the northern Iran // Toxicol. Environ. Chemi. 2018. V. 100. № 5–7. P. 540–549.
Ebomah K., Sibanda T., Adefisoye M. et al. Evaluating Nahoon Beach and Canal Waters in Eastern Cape, South Africa: A Public Health Concern // Polish J. Environ. Studies. 2019. V. 28. № 3. P. 1115–1125.
Enns A., Vogel L., Abdelzaher A. et al. Spatial and temporal variation in indicator microbe sampling is influential in beach management decisions // Water Res. 2012. V. 46. № 7. P. 2237–2246.
Eregno F., Tryland I., Tjomsland T. et al. Quantitative microbial risk assessment combined with hydrodynamic modelling to estimate the public health risk associated with bathing after rainfall events // Sci. Total Environ. 2016. V. 548. P. 270–279.
Esiobu N., Green M., Echeverry A. et al. High numbers of Staphylococcus aureus at three bathing beaches in South Florida // Int. J. Environ. Health Res. 2013. V. 23. № 1. P. 46–57.
Faja O., Abd Sharad A., Younis K. et al. Isolation, detection of virulence genes, antibiotic resistance genes, plasmid profile, and molecular typing among Vibrio parahaemolyticus isolated in Malaysian seawater from recreational beaches and fish // Vet. World. 2019. V. 12. № 7. P. 1140–1149.
Francy D., Stelzer E., Brady A. et al. Comparison of Filters for Concentrating Microbial Indicators and Pathogens in Lake Water Samples // Applied Environ. Microbiol. 2013. V. 79. № 4. P. 1342–1352.
Gast R., Gorrell L., Raubenheimer B. et al. Impact of erosion and accretion on the distribution of enterococci in beach sands // Cont. Shelf Res. 2011. V. 31. № 14. P. 1457–1461.
Griffith J., Weisberg S., Arnold B. et al. Epidemiologic evaluation of multiple alternate microbial water quality monitoring indicators at three California beaches // Water Res. 2016. V. 94. P. 371–381.
Halliday E., Griffith J., Gast R. Use of an exogenous plasmid standard and quantitative PCR to monitor spatial and temporal distribution of Enterococcus spp. in beach sands // Limnol. Oceanogr. Methods. 2010. V. 8. P. 146–154.
Harikrishnan N., Ravisankar R., Chandrasekaran A. et al. Assessment of gamma radiation and associated radiation hazards in coastal sediments of south east coast of Tamilnadu, India with statistical approach // Ecotoxicol. Environ. Saf. 2018. V. 162. P. 521–528.
Haugland R., Siefring S., Lavender J. et al. Influences of sample interference and interference controls on quantification of enterococci fecal indicator bacteria in surface water samples by the qPCR method // Water Res. 2012. V. 46. № 18. P. 5989–6001.
Herzog A., Bhaduri P., Stedtfeld R. et al. Detection and Occurrence of Indicator Organisms and Pathogens // Water Environ. Res. 2010. V. 82. № 10. P. 883–907.
Horricks R., Tabin S., Edwards J. et al. Organic ultraviolet filters in nearshore waters and in the invasive lionfish (Pterois volitans) in Grenada, West Indies // PLoS ONE. 2019. V. 14. № 7. P. e0220280. https://doi.org/10.1371/journal.pone.0220280
Hoyer A., Schladow S., Rueda F. A hydrodynamics-based approach to evaluating the risk of waterborne pathogens entering drinking water intakes in a large, stratified lake // Water Res. 2015. V. 83. P. 227–236.
Hsu T., Rea C., Yu Z. et al. Prevalence and diversity of Shiga toxin genes in Canada geese and water in western Lake Erie Region // J. Great Lakes Res. 2016. V. 42. № 2. P. 476–481.
Hughes B., Beale D., Dennis P. et al. Cross-Comparison of Human Wastewater-Associated Molecular Markers in Relation to Fecal Indicator Bacteria and Enteric Viruses in Recreational Beach Waters // Applied Environ. Microbiol. 2017. V. 83. № 8. P. e00028. https://doi.org/10.1128/AEM.00028
Jin M., Guo X., Wang X. Development of a Novel Filter Cartridge System with Electropositive Granule Media to Concentrate Viruses from Large Volumes of Natural Surface Water // Environ. Sci. Technol. 2014. V. 48. № 12. P. 6947–6956.
Kay D., Bartram J., Pruss A. et al. Derivation of numerical values for the World Health Organization guidelines for recreational waters // Water Res. 2004. V. 38. № 5. P. 1296–1304.
Kim H., Lee J., Hur D. et al. Modeling the Transport and Inactivation of Enterococci in the Swimming Beach // J. Coastal Res. 2011. V. 64. P. 1078–1080.
King D., Brenner K., Rodgers M. A critical evaluation of a flow cytometer used for detecting enterococci in recreational waters // J. Water Health. 2007. V. 5. № 2. P. 295–305.
Kinzelman J., Whitman R., Byappanahalli M. et al. Evaluation of beach grooming techniques on Escherichia coli density in Foreshore Sand at North Beach, Racine, WI // Lake Reservoir Manage. 2003. V. 19. № 4. P. 349–354.
Kleinheinz G., McDermott C., Leewis M. et al. Influence of sampling depth on Escherichia coli concentrations in beach monitoring // Water Res. 2006. V. 40. № 20. P. 3831–3837.
Kuen C., Kutarski P., Brunton M. Contaminated marine wounds – the risk of acquiring acute bacterial-infection from marine recreational beaches // J. Applied Bacteriol. 1992. V. 73. № 5. P. 412–420.
Lee C., Lee C., Marion J. et al. Occurrence of human enteric viruses at freshwater beaches during swimming season and its link to water inflow // Sci. Total Environ. 2014. V. 472. P. 757–766.
Leon-Lopez C., Arreola-Lizarraga J., Padilla-Arredondo G. et al. Temporal variability of enterococci and associated sources at three subtropical recreational beaches // Oceanol. Hidrobiol. Studies. 2014. V. 47. № 4. P. 327–336.
Levin-Edens E., Meschke J., Roberts M. Quantification of Methicillin-Resistant Staphylococcus aureus Strains in Marine and Freshwater Samples by the Most-Probable-Number Method // Applied Environ. Microbiol. 2011. V. 77. № 10. P. 3541–3543.
Li J., Zhang X. Beach Pollution Effects on Health and Productivity in California // Int. J. Environ. Res. Public Health. 2019. V. 16. № 11. P. 1987. https://doi.org/10.3390/ijerph16111987
Lim K., Shao S., Peng J. et al. Evaluation of the dry and wet weather recreational health risks in a semi-enclosed marine embayment in Southern California // Water Res. 2017. V. 111. P. 318–329.
Love D., Rodriguez R., Gibbons C. et al. Human viruses and viral indicators in marine water at two recreational beaches in Southern California, USA // J. Water Health. 2014. V. 12. № 1. P. 136–150.
Lu J., Ryu H., Vogel J. et al. Molecular Detection of Campylobacter spp. and Fecal Indicator Bacteria during the Northern Migration of Sandhill Cranes (Grus canadensis) at the Central Platte River // Applied Environ. Microbiol. 2013. V. 79. № 12. P. 3762–3769.
Maloo A., Fulke A., Mulani N. et al. Pathogenic multiple antimicrobial resistant Escherichia coli serotypes in recreational waters of Mumbai, India: a potential public health risk // Environ. Sci. Pollution Res. 2017. V. 24. № 12. P. 11 504–11 517.
Manganelli M. Blooms of toxic microorganisms in aquatic environments: marine microalgae and freshwater cyanobacteria. A brief review with a particular focus on the Italian situation Diffusion and health effects of toxic marine microalgae and freshwater cyanobacteria in Italy // Rendiconti lincei-scienze fisiche e naturali. 2016. V. 27. № 1. P. 135–143.
Mansilha C., Coelho C., Reinas A. et al. Salmonella: The forgotten pathogen: Health hazards of compliance with European Bathing Water Legislation // Mar. Pol-lut. Bull. 2010. V. 60. № 6. P. 819–826.
Marino F., Martinezmanzanares E., Morinigo M. et al. Applicability of the recreational water-quality standard guidelines // Water Sci. Technol. 1995. V. 31. № 5–6. P. 27–31.
Miao J., Jiang H., Yang Z. et al. Assessment of an electropositive granule media filter for concentrating viruses from large volumes of coastal water // Environ. Sci. – Water Res. Technol. 2019. V. 5. № 2. P. 325–333.
Ming H., Zhu L., Feng J. et al. Risk Assessment of Rotavirus Infection in Surface Seawater from Bohai Bay, China // Hum. Ecol. Risk Assess. 2014. V. 20. № 4. P. 92–940.
Moehrie M. Outdoor sports and skin cancer // Clinics in dermatol. 2008. V. 26. № 1. P. 12–15.
Molina M., Hunter S., Cyterski M. et al. Factors affecting the presence of human-associated and fecal indicator real-time quantitative PCR genetic markers in urban-impacted recreational beaches // Water Res. 2014. V. 64. P. 196–208.
Molloy S., Liu L., Phanikumar M. et al. The presence and near-shore transport of human fecal pollution in Lake Michigan beaches // Oceans. 2005. V. 1–3. P. 1667–1672.
Napier M., Haugland R., Poole C. et al. Exposure to human-associated fecal indicators and self-reported illness among swimmers at recreational beaches: a cohort study // Environ. Health. 2017. V. 16. P. 103.
Napier M., Poole C., Stewar J. et al. Exposure to Human-Associated Chemical Markers of Fecal Contamination and Self-Reported Illness among Swimmers at Recreational Beaches // Environ. Sci. Technol. 2018. V. 52. № 13. P. 7513–7523.
Nevers M., Whitman R. Efficacy of monitoring and empirical predictive modeling at improving public health protection at Chicago beaches // Water Res. 2011. V. 45. № 4. P. 1659–1668.
Park Y., Kim M., Pachepsky Y. et al. Development of a Nowcasting System Using Machine Learning Approaches to Predict Fecal Contamination Levels at Recreational Beaches in Korea // J. Environ. Quality. 2018. V. 47. № 5. P. 1094–1102.
Patz J., Vavrus S., Uejio C. et al. Climate Change and Waterborne Disease Risk in the Great Lakes Region of the US // Am. J. Preventive Med. 2008. V. 35. № 5. P. 451–458.
Phillips M., Solo-Gabriele H., Piggot A. et al. Relationships between sand and water quality at recreational beaches // Water Res. 2011. V. 45. № 20. P. 6763–6769.
Piggot A., Klaus J., Johnson S. et al. Relationship between Enterococcal Levels and Sediment Biofilms at Recreational Beaches in South Florida // Applied Environ. Microbiol. 2012. V. 78. № 17. P. 5973–5982.
Pintar K., Fazil A., Pollari F. et al. A Risk Assessment Model to Evaluate the Role of Fecal Contamination in Recreational Water on the Incidence of Cryptosporidiosis at the Community Level in Ontario // Risk ana-lysis. 2010. V. 30. № 1. P. 49–64.
Plano L., Shibata T., Garza A. et al. Human-Associated Methicillin-Resistant Staphylococcus aureus from a Subtropical Recreational Marine Beach // Microbial Ecol. 2013. V. 65. № 4. P. 1039–1051.
Pratap P., Redman S., Fagen M. et al. Improving water quality communications at beaches: input from stakeholders // J. Water Health. 2013. V. 11. № 4. P. 647–658.
Regueiras A., Saker M., Vasconcelos V. Use of PCR for the early detection of pathogenic bacteria and cyanobacteria in water samples from different urban water sources (Porto, Portugal) // Fresenius Environ. Bull. 2009. V. 18. № 12. P. 2359–2365.
Reynolds K., Roll K., Fujioka R. et al. Incidence of enteroviruses in Mamala Bay, Hawaii using cell culture and direct polymerase chain reaction methodologies // Can. J. Microbiol. 1998. V. 44. № 6. P. 598–604.
Roberts M., Soge O., No D. Comparison of multi-drug resistant environmental methicillin-resistant Staphylococcus aureus isolated from recreational beaches and high touch surfaces in built environments // Front. microbiol. 2013. V. 4. № 74.
Rocha M., Cruzeiro C., Ferreira C. et al. Occurrence of endocrine disruptor compounds in the estuary of the Iberian Douro River and nearby Porto Coast (NW Portugal) // Toxicol. Environ. Chem. 2012. V. 94. № 2. P. 252–261.
Rodrigues V., Rivera I., Lim K. et al. Detection and risk assessment of diarrheagenic E-coli in recreational beaches of Brazil // Mar. Pollut. Bull. 2016. V. 109. № 1. P. 163–170.
Roegner A., Truong L., Weirich C. et al. Combined Danio rerio embryo morbidity, mortality and photomotor response assay: A tool for developmental risk assessment from chronic cyanoHAB exposure // Sci. Total Environ. 2019. V. 697. P. 134 210.https://doi.org/10.1016/j.scitotenv.2019.134210
Roslev P., Bastholm S., Iversen N. Relationship between fecal indicators in sediment and recreational waters in a Danish estuary // Water, Air, Soil Pollut. 2008. V. 194. № 1–4. P. 13–21.
Roth F., Lessa G., Wild C. et al. Impacts of a high-discharge submarine sewage outfall on water quality in the coastal zone of Salvador (Bahia, Brazil) // Mar. Pollut. Bull. 2016. V. 106. № 1–2. P. 43–48.
Sabino R., Rodrigues R., Costa I. et al. Routine screening of harmful microorganisms in beach sands: Implications to public health // Sci. Total Environ. 2014. V. 472. P. 1062–1069.
Sato M., Di Bari M., Lamparelli C. et al. Sanitary quality of sands from marine recreational beaches of Sao Paulo, Brazil // Brazilian J. Microbiol. 2005. V. 36. № 4. P. 321–326.
Schoen M., Ashbolt N. Assessing Pathogen Risk to Swimmers at Non-Sewage Impacted Recreational Beaches // Environ. Sci. Technol. 2010. V. 44. № 7. P. 2286–2291.
Shibata T., Solo-Gabriele H. Quantitative Microbial Risk Assessment of Human Illness from Exposure to Marine Beach Sand // Environ. Sci. Technol. 2012. V. 46. № 5. P. 2799–2805.
Solo-Gabriele H., Harwood V., Kay D. et al. Beach sand and the potential for infectious disease transmission: observations and recommendations // J. Marine Biol. Association United Kindom. 2016. V. 96. № 1. P. 101–120.
Steele J., Blackwood A., Griffith J. et al. Quantification of pathogens and markers of fecal contamination during storm events along popular surfing beaches in San Diego, California // Water Res. 2018. V. 136. P. 137–149.
Swinscoe I., Oliver D., Gilburn A. et al. The seaweed fly (Coelopidae) can facilitate environmental survival and transmission of E-coli 0157 at sandy beaches // J. Environ. Management. 2018. V. 223. P. 275–285.
Taylor T., Longo A. Valuing algal bloom in the Black Sea Coast of Bulgaria: A choice experiments approach // J. Environ. Management. 2010. V. 91. № 10. P. 1963–1971.
Turkmen C., Ayyildiz O., Akbulut M. et al. Microbial Quality in Coastal Waters of Dardanelles in Relation to the Pollution Sources and Transport Pathways // Clean: Soil, Air, Water. 2012. V. 40. № 12. P. 1320–1325.
Vanderburgt C. Dealing with contaminated dredged materials with reference to the Oslo Convention 1972 and the new Paris Convention 1992 // Mar. Pollut. Bull. 1994. V. 29. № 6–12. P. 296–299.
Vogel L., Edge T., O’Carroll D. et al. Evaluation of methods to sample fecal indicator bacteria in foreshore sand and pore water at freshwater beaches // Water Res. 2017. V. 121. P. 204–212.
Web of Science. [Электронный ресурс]. https://clarivate.ru/products/web-of-science (дата обращения: 05.06.2020)
Whiley H., Austin J., da Silva G. et al. Fecal Indicator Bacteria Present in Sand at South Port Beach, South Australia // J. Coastal Res. 2018. V. 34. № 1. P. 215–219.
Whitman R., Harwood V., Edge T. et al. Microbes in beach sands: integrating environment, ecology and public health // Rev. Environ. Sci. Bio-Technol. 2014. V. 13. № 3. P. 329–368.
Willmann G. Ultraviolet Keratitis: From the Pathophysiological Basis to Prevention and Clinical Management // High Altitude Med. Biol. 2015. V. 16. № 4. P. 277–282.
Wong M., Kumar L., Jenkins T. et al. Evaluation of public health risks at recreational beaches in Lake Michigan via detection of enteric viruses and a human-specific bacteriological marker // Water Res. 2009. V. 43. № 4. P. 1137–1149.
Xagoraraki I., Kuo D., Wong K. et al. Occurrence of human adenoviruses at two recreational beaches of the great lakes // Applied Environ. Microbiol. 2007. V. 73. № 24. P. 7874–7881.
Yamahara K., Walters S., Boehm A. Growth of Enterococci in Unaltered, Unseeded Beach Sands Subjected to Tidal Wetting // Applied Environ. Microbiol. 2009. V. 75. № 6. P. 1517–1524.
Yau V., Schiff K., Arnold B. et al. Effect of submarine groundwater discharge on bacterial indicators and swimmer health at Avalon Beach, CA, USA // Water Res. 2014. V. 59. P. 23–36.
Zhang J., Qiu H., Li X. et al. Real-Time Nowcasting of Microbiological Water Quality at Recreational Beaches: A Wavelet and Artificial Neural Network-Based Hybrid Modeling Approach // Environ. Sci. Technol. 2018. V. 52. № 15. P. 8446–8455.
Zulkifli A., Ahmad A. Detection of Methicillin Resistant Staphylococcus aureus (MRSA) from Recreational Beach Using the mecA Gene // AIP Conf. Proc. 2015. V. 1678. № 030011.
Дополнительные материалы отсутствуют.