Водные ресурсы, 2021, T. 48, № 3, стр. 297-306
Влияние технической экосистемы электростанции (г. Владивосток) на фитопланктон Японского моря
А. А. Бегун a, *, **, С. И. Масленников a, b
a Национальный научный центр морской биологии им. А.В. Жирмунского ДО РАН
690041 Владивосток, Россия
b Дальневосточный федеральный университет
10690922 пос. Аякс, Приморского края, о. Русский, Россия
* E-mail: andrejbegun@yandex.ru
** E-mail: 721606@mail.ru
Поступила в редакцию 04.04.2019
После доработки 26.08.2020
Принята к публикации 16.10.2020
Аннотация
Исследована структура фитопланктона Японского моря (зал. Петра Великого), находящегося в зоне влияния техноэкосистемы ВТЭЦ-2 (г. Владивосток) круглогодично в период 2014‒2015 гг. Термальное загрязнение двухступенчатое: в водозаборном ковше температура воды повышается на 2‒3°С по сравнению с фоновыми значениями и непосредственно в системе охлаждения ВТЭЦ-2 – на 10‒12°С. В первом случае отмечено увеличение обилия водорослей и продление летне-осеннего вегетационного сезона фитопланктона на 1.5–2.0 мес. по сравнению с фоновыми участками. После прохождения через систему охлаждения электростанции видовой состав фитопланктона меняется незначительно (коэффициент сходства 0.82), обогащаясь бентосными диатомовыми водорослями (22 вида) из обрастаний водозаборного тоннеля. Различие показателей общей плотности и биомассы микроводорослей до и после прохождения через систему охлаждения электростанции в течение года не превышало одного порядка. Таким образом, техноэкосистема ВТЭЦ-2 оказывает существенное влияние на количественное изменение фитопланктона на этапе длительного, но незначительного теплового воздействия в водозаборном ковше, а также при кратковременном прохождении через систему водоохлаждения.
ВВЕДЕНИЕ
Исследования технических экосистем (техноэкосистем) энергетических станций – важнейший раздел технической гидробиологии, разрабатывающий общие принципы, стратегию и методы гармонизации отношений в системе человек–техноэкосистема–гидробиосфера [15]. Тепловые электростанции – основной источник термального загрязнения водоемов. Влияние термального загрязнения на морскую биоту может иметь самые разные негативные последствия. Так, нагрев природных вод на 4−6°С, а летом иногда всего на 1°С может привести к гибели рядa стенотермных организмов, подавить размножение у многих видов, изменить состав сообществ за счет видов-интродуцентов [10]. Термальное загрязнение приводит к уменьшению вязкости воды, насыщенности водоема кислородом, к интенсивному осадкообразованию, изменению гидродинамики и смещению гидрологических сезонов. Кроме того, оно меняет биоразнообразие водных экосистем из-за влияния биоинвазий [7, 8].
Фитопланктон ‒ один из важнейших компонентов техноэкосистем энергетических станций – оперативный индикатор изменения абиотических условий. Закономерности и особенности трансформации структуры фитопланктонного сообщества под действием повышенной температуры хорошо изучены для наземных водных экосистем, поскольку водные объекты, к которым приурочены ТЭЦ, имеют ограниченные размеры и замкнутую систему охлаждения. В то же время закономерности и особенности трансформации состава и структуры фитопланктона под действием термального загрязнения в водных объектах, имеющих существенно бόльшие размеры (моря и океаны), чем размер техноэкосистемы, и проточную систему охлаждения, на сегодняшний день еще недостаточно изучены.
Имеющиеся сведения о трансформации фитопланктона в условиях морских техноэкосистем относятся преимущественно к тропическим регионам, где отсутствует выраженная сезонность в развитии водорослей [28, 31, 36, 38]. Данных об изменении структуры фитопланктона для регионов умеренных и высоких широт практически нет. Помимо этого, могут проявиться особенности экосистем, связанные с изменением структуры фитопланктона в условиях высокой минерализации, которые отсутствуют в континентальных водоемах.
Уже первые исследования воздействия термального загрязнения от Владивостокской ТЭЦ-2 (ВТЭЦ-2) на техноэкосистему бух. Золотой Рог в 2001–2002 гг. показали, что данный вид воздействия во многом определяет условия существования морской флоры и фауны в умеренных широтах. Выявлены существенные различия в видовом составе, экологии, количественных показателях и сезонной динамике различных групп морской биоты, а также показана роль видов-вселенцев, находящихся на разных стадиях натурализации в условиях химического и термального загрязнения [1, 5, 7].
Непосредственного исследования фитопланктона водного потока на входе в техноэкосистему ВТЭЦ-2 и на выходе из нее не проводилось в силу методических трудностей отбора материала на режимной территории. Настоящее исследование, цель которого – изучение влияния одного из звеньев техноэкосистемы (системы охлаждения) ВТЭЦ-2 на структуру фитопланктона Японского моря в разные сезоны года, позволит выявить особенности теплового загрязнения морских объектов умеренных широт, и его результаты могут стать существенным вкладом в решение фундаментальных гидробиологических задач.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Пробы фитопланктона отбирали с 16.10.2014 по 28.09.2015 2 раза в месяц в водозаборном ковше ВТЭЦ-2 (бух. Сухопутная в зал. Петра Великого Японского моря) и в сбросном канале (рис. 1) батометром Молчанова по стандартной методике [2, 3]. Одновременно с отбором проб фитопланктона измеряли температуру и соленость воды (рис. 2). Подсчет численности клеток наннопланктона проводили в камере объемом 0.05 мл, микропланктона – в камере 1 мл. Биомассу рассчитывали объемным методом, используя оригинальные и литературные [42] данные. Идентификация микроводорослей проведена с использованием светового (“Olympus BX41”, объектив UPLanF1 100×/1/.30, Япония) и сканирующего электронного (“Zeis EVO 40XVP”, Великобритания) микроскопов.
Рис. 1.
а – картосхема района исследования: 1 – водозабор, 2 – сбросной канал; б – схема движения воды в системе охлаждения ВТЭЦ-2: 1 – водозабор, 2 – бетонный тоннель, 3 – система охлаждения; в – схема водозабора и насосной станции: 1 – каменная наброска, 2 – действующий водозабор, 3 – пирс, 4 – старый водозабор, 5 – сбросной канал, 6 – решетки грубой очистки, 7 – насосная станция.
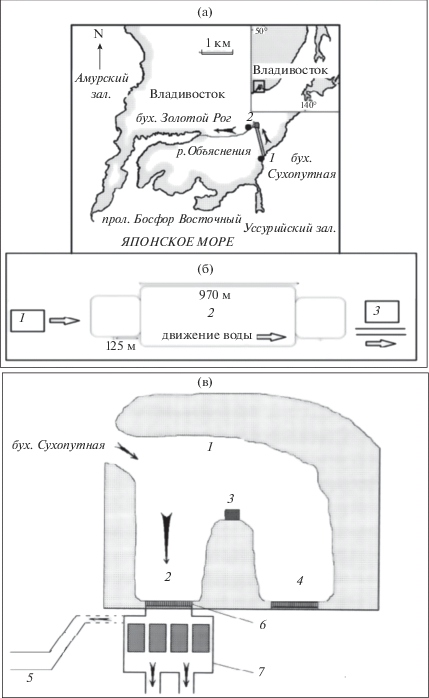
Рис. 2.
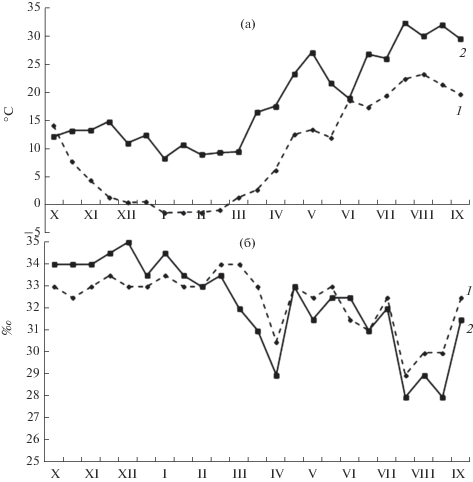
Сезонная динамика температуры (а) и солености (б) воды в техноэкосистеме ВТЭЦ-2, 2014‒2015 гг. 1 – водозаборный ковш, 2 – сбросной канал. Римские цифры – номера месяцев.
Таксоны микроводорослей приведены в соответствии с международным Интернет-ресурсом AlgaeBase в 2019 г. [22]. Сходство состава фитопланктона до и после прохождения через техноэкосистему ВТЭЦ-2 оценивали с использованием коэффициента Серенсена–Чекановского. Диапазоны количественных различий рассчитывали по формуле:
Исследуемая акватория водозаборного ковша электростанции находится в пределах распространения умеренного муссонного климата, где зимой господствует северо-западный муссон, приносящий холодный и сухой воздух с территории Азии. Характерная особенность этого климата – регулярные тайфуны, преобладающие с мая по октябрь и вызывающие сильные штормы, обильные дождевые осадки и туманы [11]. Залив Петра Великого расположен на стыке теплого Цусимского и холодного Приморского течений, и в летнее время отдельные ветви теплого течения проникают далеко в глубь Уссурийского залива [6]. В прибрежной зоне бух. Сухопутной расположен водозаборный ковш ВТЭЦ-2, температура воды в котором колеблется в пределах –1.8–23°С, соленость ‒ 9–34.1‰ [6]. Эта бухта – одна из относительно чистых акваторий в зал. Петра Великого, а ее воды по основным гидрохимическим показателям соответствуют открытым водам Японского моря.
Водозаборный ковш отгорожен от моря каменной насыпью из валунов (рис. 1). Вода на электростанцию подается с помощью насосов. Входные отверстия в тоннели насосной станции защищены решеткой грубой очистки. При работе насосов вода нагревается и сбрасывается в локальную систему охлаждения обратно в водозаборный ковш. В результате вода в нем на 2–3°С выше фоновой, в результате чего в холодный период год от года происходит смещение сроков формирования ледостава в зависимости от погодных условий.
Далее вода подается насосами в тоннели охлаждения электростанции через фильтры, представляющие собой 4 вращающиеся стальные сетки с ячеей диаметром 3 мм. Скорость потока в тоннелях системы охлаждения электростанции составляет 2 м/с [7], цикл прохождения ~2 мин. Вода, температура которой за это время повышается на 5–6°С [5], сбрасывается в р. Объяснения.
В бух. Золотой Рог, куда через р. Объяснения попадают отработанные воды ВТЭЦ-2, соленость колеблется в пределах 23.4‒35.0‰. Максимальная среднемесячная температура воды составляет 23.7°С. В кутовой части бухты температура на 2–7°С выше, чем в мористой части, из-за влияния сбрасываемой подогретой воды. Зимой с момента пуска ВТЭЦ-2 температура воды в бухте не опускается ниже 0°С и бухта не замерзает [7].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В фитопланктоне в водозаборном ковше и сбросном канале ВТЭЦ-2 за период исследования зарегистрировано 172 вида и внутривидовых таксона микроводорослей из семи отделов: Bacillariophyta (119), Dinophyta (33), Ochrophyta (7), Chlorophyta (5), Euglenophyta (4), Cyanophyta (4) и Cryptophyta (2). Общее видовое богатство фитопланктона в течение года было выше в сбросном канале ВТЭЦ-2 (162 вида), чем в водозаборном ковше (133). Коэффициент сходства видового состава микроводорослей до и после прохождения через систему охлаждения ВТЭЦ-2 за период исследования оказался достаточно высоким (0.82). Микроводоросли были представлены планктонными (56%), бенто-планктонными (12%) и бентосными (32%) формами. Преобладали эвригалинные виды, большую часть из которых составляли морские формы (80%).
Анализ сапробиологических характеристик фитопланктона показал, что в техноэкосистеме ВТЭЦ-2 по числу видов преобладали β-мезосапробионты – индикаторы умеренного органического загрязнения вод (35 видов). Однако в летне-осенний период в фитопланктоне присутствовало достаточно большое количество α-ме-зосапробионтов – индикаторов высокого органического загрязнения. Среди них – диатомовые водоросли Halamphora cymbifera (Gregory) Levkov, 2009, Melosira lineata (Dillw.) C. Agardh, 1824, M. moniliformis var. subglobosa (Grun.) Hust., 1927, Tabularia fasciculata (C. Agardh) D.M. Williams et Round, 1986, T. tabulata (Agardh) Snoeijs, 1992 и виды рода Skeletonema.
В сбросном канале ВТЭЦ-2 в течение периода исследования отмечались нехарактерные для фитопланктона бентосные диатомовые водоросли (22 вида), по своей жизненной форме связанные с обитанием на твердом субстрате. Среди них наиболее часто встречались виды: Halamphora coffeiformis (C. Agardh) Levkov, 2009, H. costata (W. Smith) Levkov, 2009, Rhaphoneis nitida (Gregory) Grunow, 1867, Diploneis smithii (Brébisson) Cleve, 1894, Lyrella clavata (Gregory) D.G. Mann, 1990, Licmophora abbreviata C. Agardh, 1831, Fogedia finmarchica (Cleve et Grun.) Witkowski, Metzeltin et Lange-Bertalot, 1997, Petroneis monilifer (Cleve) A.J. Stickle et D.G. Mann, 1990, Cocconeis speciosa Gregory, 1855, С. costata Gregory, 1855 и Diploneis chersonensis (Grunow) Cleve, 1894.
Исследование сезонной динамики фитопланктона показало, что с декабря 2014 г. по январь 2015 г. происходило активное развитие тепловодных микроводорослей, характерных для летне-осеннего периода. В их число входили тропичес-ко-бореальные виды: Dictyocha fibula Ehrenberg 1839 (Ochrophyta), Ditylum brightwellii (T. West) Grunow 1885, Thalassiosira rotula Meunier 1910, Licmophora flabellata (Greville) C. Agardh 1830 и Pleurosigma inflatum Shaldbolt 1853 (Bacillariophyta). Также в этот период в фитопланктоне наблюдалось развитие диатомовой водоросли Rhizosolenia hebetata f. semispina (Hensen) Gran 1908 – тепловодной формы вида-космополита. Со второй половины января в планктонном сообществе началась вегетация холодноводных аркто-бореальных видов диатомовых водорослей зимнего фитопланктона: Chaetoceros debilis Cleve 1894, C. pseudocrinitus Ostenfeld 1901 и Thalassiosira nordenskioeldii Cleve 1873.
Общая плотность фитопланктона в течение года варьировала в пределах 0.006‒1.18 млн кл/л в водозаборном ковше и 0.005–1.07 млн кл/л – в сбросном канале. Биомасса микроводорослей менялась в пределах 0.07–20.00 и 0.02–2.2 г/м3 соответственно (рис. 3). Среднегодовые количественные показатели микроводорослей были выше в водозаборном ковше (плотность – 0.34 млн кл/л, биомасса – 20.3 г/м3), чем в сбросном канале (0.20 млн кл/л и 1.92 г/м3). В водозаборном ковше отмечено два наиболее существенных увеличения плотности – зимнее и осеннее (рис. 3).
Рис. 3.
Сезонная динамика плотности (а) и биомассы (б) фитопланктона в техноэкосистеме ВТЭЦ-2, 2014‒2015 гг. 1 – водозаборный ковш, 2 – сбросной канал. Римские цифры – номера месяцев.
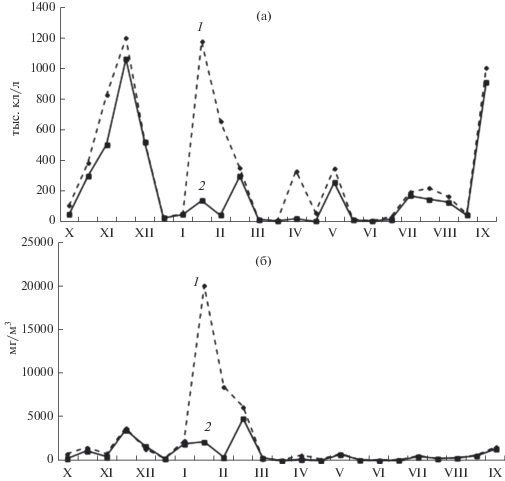
Самым большим за годовой период было зимнее увеличение плотности с двумя пиками – декабрьским (1.3 млн кл/л) и февральским (1.19 млн кл/л). Декабрьский пик плотности, отмеченный при температуре воды 4.2°С и солености 33.5‰, был обусловлен планктонными диатомовыми водорослями Pseudo-nitzschia calliantha Lundh., Moestr. & Hasle 1894 и видами рода Skeletonema. Февральский пик вызывали бенто-планктонные диатомеи M. moniliformis var. subglobosa, Odontella aurita (Lyngb.) C.А. Agardh 1832 и бентосная Tabularia tabulata при температуре воды –1.6°С и солености 33‰. В сбросном канале зимнее увеличение плотности микроводорослей отмечалось также в декабре (1.07 млн кл/л, 14.6°С и 34.5‰) за счет видов, характерных для водозаборного ковша (рис. 3). Осенний, второй по значимости, максимум плотности отмечен одновременно в водозаборном ковше (1.01 млн кл/л) и сбросном канале (0.91 млн кл/л) в сентябре при температуре воды 19.5 и 29.5°С и солености 32.5 и 31.5‰ соответственно в результате развития видов рода Skel-etonema.
Сезонная динамика биомассы фитопланктона в техноэкосистеме ВТЭЦ-2 в целом повторяла динамику плотности, однако максимальные показатели на двух исследуемых участках были зафиксированы в разные месяцы (рис. 3). Так, максимум биомассы для водозаборного ковша отмечен в феврале (20.3 г/м3) и обусловлен крупноклеточными диатомовыми водорослями M. moniliformis var. subglobosa и O. aurita. В сбросном канале наибольшая биомасса зафиксирована в марте (4.9 г/м3) за счет развития вида T. nordenskioeldii.
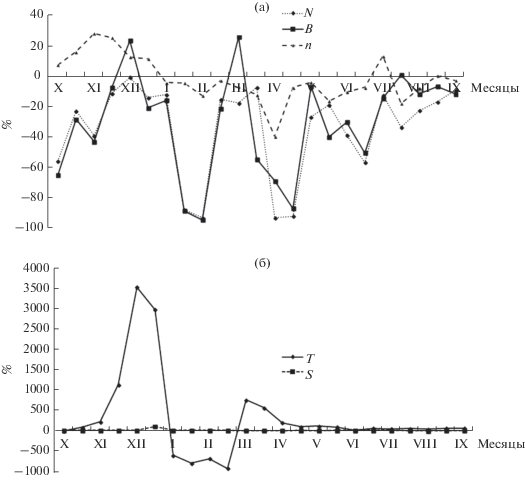
Различие общего числа видов фитопланктона до и после прохождения через техноэкосистему ВТЭЦ-2 варьировало в диапазоне 4.35–66.7% (рис. 4). Диапазоны разницы количественных показателей фитопланктона в течение года варьировали в пределах –1.08…–93.4% для общей плотности и 25.5…–94.9% для биомассы. Температурные различия водных масс были значительно выше (3500…–927%), чем различия солености (6.06…–16.7%). Максимальные разницы температуры воды отмечены во второй половине декабря 2014 г. (3500%) и в первой половине января 2015 г. (2950%), в то время как в теплый период (май–сентябрь 2015 г.) они существенно снизились (1.63–86.9%) (рис. 4). Таким образом, различия количественных показателей фитопланктона до и после прохождения через систему охлаждения ВТЭЦ-2 не обнаруживали зависимости от различий температурных показателей воды. Так, наибольшие различия плотности и биомассы микроводорослей наблюдались как в холодный период года (февраль, –93.4…94.9% соответственно), так и в теплый (май, –92.5 и –87.4%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Круглогодичное исследование фитопланктона в условиях техноэкосистемы ВТЭЦ-2 показало достаточно высокое сходство его видового состава (0.82) до и после прохождения через систему охлаждения. Однако в фитопланктоне, прошедшем через техноэкосистему, в течение всего года отмечались бентосные диатомовые водоросли, не характерные для планктонной флоры прибрежных акваторий [2, 12, 17], но типичные для донных грунтов, эпифитона и перифитона в зал. Петра Великого Японского моря [16], морского прибрежья Японии [25, 35], Китая [29, 43] и Кореи [20, 27]. Появление этой группы микроводорослей в сбросном канале ВТЭЦ-2 во многом обусловлено смывом водорослевых обрастаний с бетонной поверхности водозаборного тоннеля и с эпизоона тихоокеанской мидии Mytilus trossulus Linnaeus и гигантской устрицы Crassostrea gigas (Thunberg), покрывающих стенки тоннеля [7]. Моллюски экскретируют в воду экзометаболиты преимущественно в формах ${\text{PO}}_{4}^{{3 - }}$, ${\text{NH}}_{4}^{ + }$, ${\text{NO}}_{3}^{ - }$ и ${\text{NO}}_{2}^{ - }$, которые ассимилируются прикрепившимися к их створкам микроводорослями, перешедшими в отсутствии света к миксотрофному или гетеротрофному энергообеспечению [33, 34].
Смыв этих микроводорослей в планктон обусловлен высокоскоростным потоком воды и мощными водоворотами и вихрями, созданными в тоннеле высоким гидростатическим давлением [16]. Следует учесть, что в течение года многократно проводились термообработка, механическая очистка от обрастаний и осушка водозаборного тоннеля [7], что также приводило к смыву микроводорослей.
Сравнение видового состава фитопланктона водозаборного ковша и близко расположенной бух. Парис на северо-восточном побережье о. Русский [39], изученного в этот же период, показало высокий уровень сходства (0.78). Отмечено также высокое сходство видового состава фитопланктона водозаборного ковша и других прибрежных акваторий зал. Петра Великого Японского моря (Амурский залив, бух. Рифовая, Миноносок) [12, 17, 18].
Количественные данные по фитопланктону сопоставимы по близлежащим акваториям зал. Петра Великого Японского моря [12, 17, 18] и одного порядка с данными по другим высокопродуктивным акваториям умеренных широт [19, 40]. Массовое развитие диатомовых водорослей рода Skeletonema, отмеченное в техноэкосистеме ВТЭЦ-2 в зимний период 2014−2015 гг., связано, в первую очередь, с термальным загрязнением, в результате которого температура воды в водозаборном ковше в зимний период становится положительной. В то же время, согласно многолетним наблюдениям, в других прибрежных акваториях зал. Петра Великого “цветение” или массовое развитие видов рода Skeletonema регистрировалось только в летне-осенний период [1, 18, 41].
Последствие термального загрязнения акватории водозаборного ковша – продление летне-осеннего вегетационного сезона на 1.5–2.0 мес. и, соответственно, сокращение зимнего сезона. Термальное загрязнение происходит в результате постоянного сброса подогретых вод из трех функционирующих насосов ВТЭЦ-2 после охлаждения. По этой причине с декабря 2014 г. до середины января 2015 г. в акватории водозабора отсутствовал зимний ледостав, так как температура воды была на 2–3°С выше, чем в других близлежащих акваториях, где в эти месяцы она имела отрицательные значения (от –1.1 до –1.8°С) [17, 41]. В середине января 2015 г. после резкого похолодания в акватории водозабора образовался ледяной покров и температура воды достигла отрицательных значений. В планктонном сообществе началась вегетация холодноводных диатомовых водорослей. В других близлежащих акваториях, не испытывающих влияния термального загрязнения, зимний вегетационный сезон фитопланктона наступил уже в ноябре [2, 12, 17].
Продление вегетационного сезона микроводорослей в водозаборном ковше в результате удлинения гидрологического лета отмечалось для техноэкосистем ТЭС и АЭС, расположенных на континентальных водоемах с замкнутой системой охлаждения [13, 15]. Для морских электростанций с системой охлаждения проточного типа, к которым относится ВТЭЦ-2, подобные закономерности не выявлены, поскольку исследования такого профиля проводились на побережье тропических морей (южный Китай, о. Тайвань, Таиланд, Индия, Мексика, Бразилия), где сезонность у микроводорослей не выражена [19, 24, 26, 30, 37].
В результате проведенного исследования показано, что различия количественных показателей фитопланктона до и после прохождения через систему охлаждения ВТЭЦ-2 – существенные, хотя в течение года они были одного порядка (рис. 4). Максимальные различия плотности и биомассы отмечены в наиболее холодный период года, как и максимальные температурные различия, связанные с увеличением производственных мощностей электростанции. Увеличение количественных различий фитопланктона также может быть обусловлено влиянием механических факторов в техноэкосистеме ВТЭЦ-2. К ним относится, в первую очередь, прохождение фитопланктона через техногенные агрегаты электростанции – трубки конденсора, заградительные решетки и вращающиеся сетки, способные задерживать крупные колонии микроводорослей [7], которые вегетируют в наиболее холодный период года в условиях отрицательной температуры воды и устойчивого ледостава на поверхности водозабора. Однако механические факторы, по мнению некоторых специалистов, способны оказывать незначительное влияние на обилие и физиологическое состояние фитопланктона [19, 24].
Другая возможная причина количественных различий фитопланктона – термальное загрязнение воды в системе охлаждения ВТЭЦ-2 в холодное время года в период максимальных производственных мощностей. Так, среднегодовое превышение температуры сбросных вод этой электростанции по отношению к близлежащим акваториям составляет 5–6°С [4]. В то же время, согласно [30, 31], критический для большинства видов микроводорослей диапазон температуры воды, при котором происходит ослабление их фотосинтетической активности и сокращение количественного обилия, составляет 25–35°С.
Анализ опубликованных данных по исследованиям закономерностей видового и количественного развития фитопланктона в условиях техноэкосистем показал, что на сегодняшний день достаточно полно исследованы ТЭС и АЭС, расположенные на континентальных водоемах с системой охлаждения замкнутого типа [26, 28]. В то же время для фитопланктона техноэкосистем морских электростанций с системой охлаждения проточного типа такие закономерности остаются почти неизученными, а имеющиеся данные противоречивы. Так, зарубежными исследователями установлено, что формирование количественных показателей морского фитопланктона в системе охлаждения ТЭС и АЭС определяется в основном термальным загрязнением [19, 24, 26, 37]. В частности, в водоемах-охладителях энергетических станций на участках, подвергающихся значительному обогреву, происходит формирование специфических сообществ микроводорослей, относящихся преимущественно к факультативным термофилам, широко распространенным в термальных источниках. Определяющий фактор формирования таких сообществ – температурный режим, а именно – искусственный подогрев воды.
По данным [28, 36, 38], угнетение развития фитопланктона и его физиологической активности в большей степени связано с хлорированием воды и с ее химической обработкой биоцидами и другими биотическими ингибиторами. Известен также синергетический эффект хлорирования воды и термального стресса [31]. В техноэкосистеме ВТЭЦ-2 такая обработка воды не используется, в результате чего фитопланктон не испытывает химического угнетения фотосинтеза и других физиологических процессов.
ВЫВОДЫ
Впервые исследованы изменения видового состава и количественной структуры фитопланктона под влиянием техноэкосистемы ВТЭЦ-2. Показано, что прохождение фитопланктона через систему охлаждения электростанции не оказывает существенного влияния на изменение его видового состава (коэффициент сходства 0.82), но способствует его обогащению бентосными диатомовыми водорослями (22 вида), попадающими в водный поток из обрастаний водозаборного тоннеля. Под влиянием термального загрязнения в водозаборном ковше ВТЭЦ-2 наблюдается продление летне-осеннего вегетационного сезона фитопланктона на 1.5–2.0 мес. (с ноября до середины января). Различия общей плотности и биомассы микроводорослей до и после прохождения через систему охлаждения электростанции были существенными, однако в течение года были одного порядка.
Таким образом, фитопланктон из водозаборного ковша проходит систему охлаждения ВТЭЦ-2 в составе мощного водного потока и далее поступает в бух. Золотой Рог без значительных изменений видового состава. Однако количественная структура микроводорослей изменяется достаточно существенно на этапе длительного, но незначительного теплового воздействия.
Авторы выражают благодарность ЦКП РК “Морской биобанк” ННЦМБ ДВО РАН, в котором поддерживались культуры микроводорослей.
Список литературы
Бегун А.А. Фитопланктон бухты Золотой Рог и Уссурийского залива (Японское море) в условиях антропогенного загрязнения // Изв. ТИНРО. 2004. Т. 138. С. 330–344.
Бегун А.А., Орлова Т.Ю., Звягинцев А.Ю. Фитопланктон Амурского залива Японского моря в районе г. Владивостока // Альгология. 2003. Т. 13. № 2. С. 204–215.
Бегун А.А., Звягинцев А.Ю., Емельянов А.А. Микроводоросли перифитона в условиях аквариального комплекса Приморского океанариума ДВО РАН (г. Владивостока, о. Русский) // Вода: химия и экология. 2016. № 3. С. 42–52.
Белан Т.А. Особенности обилия и видового состава бентоса в условиях загрязнения: залив Петра Великого, Японское море. Автореф. дис. … канд. биол. наук. Владивосток: ДВНИГМИ, 2001. 24 с.
Белогурова Л.С., Звягинцев А.Ю. Динамика мейо- и макрофауны обрастания в условиях хронического антропогенного загрязнения (бухта Золотой Рог, Японское море) // Изв. ТИНРО. 2006. Т. 144. С. 331–350.
Винокурова Т.Т. О сезонной и краткопериодной изменчивости гидрологических характеристик в заливе Петра Великого // Изв. ТИНРО. 1977. Т. 101. С. 7–12.
Звягинцев А.Ю., Мощенко А.В. Морские техноэкосистемы энергетических станций. Владивосток: Дальнаука, 2010. 343 с.
Звягинцев А.Ю., Ивин В.В., Кашин И.А. и др. Чужеродные виды в Дальневосточном морском государственном морском биосферном заповеднике // Изв. ТИНРО. 2012. Т. 170. С. 60–81.
Корякова М.Д., Никитин В.М., Звягинцев А.Ю., Белогурова Л.С. Влияние загрязненных портовых вод на обрастание и коррозию высоколегированной стали // Биология моря. 2002. Т. 28. № 2. С. 138–142.
Милейковский С.А. Влияние прохождения через системы водяного охлаждения прибрежных электростанций и промышленных предприятий на воспроизводство и продуктивность морского и эстуарного планктона, бентоса и нектона // Обрастание и биокоррозия в водной среде. М.: Наука, 1981. С. 131–137.
Мокиевская В.В. Химическая характеристика водных масс // Основные черты геологии и гидрологии Японского моря. М., 1961. Ч. 2. С. 122–125.
Морозова Т.В., Селина М.С., Орлова Т.Ю. Фитопланктон в районе хозяйства марикультуры бухты Миноносок залива Посьета Японского моря // Биология моря. 2002. Т. 28. № 2. С. 107–112.
Новоселова Т.Н., Протасов А.А. Фитопланктон водоемов-охладителей техно-экосистем атомных и тепловых электростанций (Обзор) // Гидробиол. журн. 2014. Т. 50. № 6. С. 40–59.
Огородникова А.А. Эколого-экономическая оценка воздействия береговых источников загрязнения на природную среду и биоресурсы залива Петра Великого. Владивосток: ТИНРО, 2001. 193 с.
Протасов А.А., Силаева А.А., Ярмошенко Л.П. и др. Гидробиологические исследования техно-экосистемы Запорожской АЭС // Гидробиол. журн. 2013. Т. 49. № 2. С. 78–94.
Рябушко Л.И., Бегун А.А. Диатомовые водоросли микрофитобентоса Японского моря. Т. 1. Севастополь; Симферополь: Н. Орiанда, 2015. 288 с.
Стоник И.В., Орлова Т.Ю. Летне-осенний фитопланктон в Амурском заливе Японского моря // Биология моря. 1998. Т. 24. № 4. С. 205–211.
Шевченко О.Г., Пономарева А.А., Маслеников С.И. Мониторинг фитопланктона на акватории марикультурного хозяйства в бухте Рифовая (зал. Петра Великого Японского моря) // Вопросы рыболовства. 2014. Т. 15. № 3. С. 285–294.
Choi K.H., Kim Y.O., Lee J.B. et al. Thermal impacts of a coal power plant on the plankton in an open coastal water environment // J. Mar. Sci. Technol. 2012. V. 20. P. 187–194.
Degerlund M., Eilertsen H.C. Main species characteristics of phytoplankton spring blooms in NE Atlantic and Arctic waters (68°–80° N) // Estuaries Coasts. 2010. V. 33. P. 242–269.
Du G.Y., Son M., Yun M. et al. Microphytobenthic biomass and species composition in intertidal flats of the Nakdong River estuary, Korea // Estuarine, Coastal Shelf Sci. 2009. V. 82. P. 663–672.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway: Natl. Univ. Ireland, 2015. [Электронный ресурс]. http://www.algaebase.org. (дата обращения: 12.02.2019)
Identifying of marine phytoplankton / Ed. C.R. Tomas. St.-Petersburg, USA: Acad. Press, 1997. 858 p.
Jiang Z.B., Zeng J.N., Chen Q.Z. et al. Dynamic change of phytoplankton cell density after thermal shock and chlorination in a subtropical bay in China // J. Plant Ecol. 2008. V. 32. P. 1386–1396.
Kasim M., Mukai H. Contribution of Benthic and Epiphytic Diatoms to Clam and Oyster Production in the Akkeshi-ko Estuary // J. Oceanogr. 2006. V. 62. P. 267–281.
Lee C.W. The effect of thermal effluent on marine diatoms and bacteria // Malaysian J. Sci. 2003. V. 22. P. 23–27.
Lee S.D., Yun S.M., Park J.S., Lee J.H. Floristic survey of diatom in the three Islands (Baeknyeong, Daecheong, Socheong) from Yellow Sea of Korea // J. Ecol. Environ. 2015. Vl. 38. № 4. P. 563–598.
Liu S., Huang H., Huang L.M. et al. Ecological response of phytoplankton to the operation of Daya Bay nuclear power station // Chinese J. Mar. Environ. Sci. 2006. V. 25. P. 9–12.
Liu J.Y. Checklist of biota of Chinese seas. Beijing: Sci. Press, Acad. Sinica, 2008. 1267 p.
Lo W.T., Hwang J.J., Hsu P.K. et al. Seasonal and spatial distribution of phytoplankton in the waters off nuclear power plants, north of Taiwan // J. Mar. Sci. Technol. 2004. V. 12. P. 372–379.
Ma Z.L., Gao K.S., Li W. et al. Impacts of chlorination and heat shocks on growth, pigments and photosynthesis of Phaeodactylum tricornutum (Bacillariophyceae) // J. Experimental Mar. Biol. Ecol. 2011. V. 397. P. 214–219.
Maestini S.Y., Robert J.-M., Fruguet A. Simultaneous uptake of ammonium and nitrate by oyster-pond algae // Marin. Biol. Lett. 1982. V. 3. № 3. P. 143–153.
Moorthi S., Caron D.A., Gast R.J., Sanders R.W. Mixotrophy: a widespread and important ecological strategy for planktonic and sea-ice nanoflagellates in the Ross Sea, Antarctica // Aquatic Microbial Ecol. 2009. V. 54. P. 269–277.
Mitra A., Flynn K.J., Burkholder M. et al. The role of mixotrophic protists in the biological carbon pump // Biogeosci. 2014. V. 11. P. 995–1005.
Park J., Khim J. S., Ohtsuka T. et al. Diatom assemblages on Nanaura mudflat, Ariake Sea, Japan: with reference to the biogeography of marine benthic diatoms in Northeast Asia // Botanical Studies. 2012. V. 53. P. 105–124.
Poornima E.H., Rajaduraia M., Rao T.S. et al. Impact of thermal discharge from a tropical coastal power plant on phytoplankton // J. Thermal Biol. 2005. V. 30. P. 307–316.
Rajadurai M., Poornima E.H., Narasimhanb S.V. et al. Phytoplankton growth under temperature stress: Laboratory studies using two diatoms from a tropical coastal power station site // J. Thermal Biol. 2005. V. 30. P. 299–305.
Saravanane N., Satpathy K.K., Nair K.V.K., Durairaj G. Preliminary Observations on the Recovery of Tropical Phytoplankton after Entrainment // J. Thermal Biol. 1998. V. 23. № 2. P. 91–97.
Shevchenko O.G., Shulkin V.M., Ponomareva A.A. Phytoplankton and hydrochemical parameters near net pens with beluga whales in a shallow bay of the northwestern Sea of Japan // Thalassas: An Int. J. Mar. Sci. 2017.
Škaloud P., Řezáčová M., Ellegaard M. Spatial distribution of phytoplankton in spring 2004 along a transect in the Eastern part of the North Sea // J. Oceanography. 2006. V. 62. P. 717–729.
Stonik I.V., Orlova T.Yu. Phytoplankton of the coastal waters off Vladivostok city (the north-western part of the East Sea) under eutrophic conditions // Ocean Polar Res. 2002. V. 24. № 4. P. 359–365.
Sun J., Liu D. Geometric models for calculating cell biovolume and surface area for phytoplankton // J. Plankton Res. 2003. № 25. P. 1331–1346.
Zhao L., Sun J., Gao Y. et al. Hippodonia fujiannensis sp. nov. (Bacilariophyceae), a new epipsammic diatom from the low intertidal zone, Fujian province, China // Phytotaxa. 2017. V. 295. № 1. P. 77–85.
Дополнительные материалы отсутствуют.