Водные ресурсы, 2021, T. 48, № 3, стр. 322-333
Экология меромиктических озер России. 1. Прибрежные морские водоемы
Е. Д. Краснова *
Беломорская биологическая станция МГУ им. М.В. Ломоносова, биологический факультет
119234 Москва, Россия
* E-mail: e_d_krasnova@mail.ru
Поступила в редакцию 05.05.2020
После доработки 05.08.2020
Принята к публикации 25.09.2020
Аннотация
На основе анализа научной литературы за период с конца XIX в. по настоящее время, а также собственных исследований автора собраны сведения о меромиктических водоемах на территории России. Перечень включает 54 водных объекта: 31 прибрежный водоем морского происхождения и 22 континентальных водоема, а также Черное море – самый большой меромиктический водоем в мире. Представлен обзор основных экологических особенностей прибрежных водоемов морского происхождения − наиболее многочисленной категории российских меромиктических водоемов.
ВВЕДЕНИЕ
Меромиктические водоемы редки и рассеяны по всему миру. Автор термина австрийский лимнолог Инго Финденег (Ingo Findenegg) [49] ввел его в противоположность голомиктическим, полностью перемешиваемым водоемам, и называл так водоемы с устойчивой вертикальной стратификацией, которая возникает из-за разницы плотности водных слоев и сохраняется на протяжении минимум нескольких лет, а во многих случаях – сотен и даже тысяч лет.
Огромный массив данных о меромиктических водоемах накоплен за рубежом, где проводится инвентаризация, разработана классификация [51, 54, 57, 61]; общепризнано, что все они заслуживают охраны. В России меромиктические водоемы пока не каталогизированы. Первый список меромиктических озер, который опубликован Уолкером и Ликенсом в 1975 г. [64], включает и СССР –на его территории упомянуто 11 водоемов. Шесть из них находится в России: 3 карстовых озера в республике Марий-Эл, по одному во Владимирской области и в Карелии, а также оз. Могильное на о. Кильдин в Баренцевом море. В “Энциклопедии внутренних водоемов”, опубликованной в 2009 г. [61], к этому списку добавлены 2 самых известных водоема Хакасии – Шира и Шунет. В 2012 г. в “Энциклопедии озер и водохранилищ” [52] было указано 28 меромиктических озер во всей Европе и 9 в Азии. Эти числа явно занижены из-за недостатка сведений о российской территории.
В данном обзоре автор собрал доступные в научной литературе сведения о российских меромиктических водоемах. На территории в пределах границ России на 2020 г. выявлено 53 меромиктических водоема (к которым нужно добавить также 54-й − Черное море − самый большой меромиктический водоем в мире, часть акватории которого находится в юрисдикции России). В их числе – 31 прибрежный водоем морского происхождения, 12 карстовых озер, 5 ледниковых, 4 бессточных соленых меромиктических водоема в аридной зоне и искусственный пруд. Из-за большого количества водоемов и публикаций о них обзор разделен на две части: первая посвящена прибрежным морским меромиктическим водоемам, вторая – континентальным.
ОСНОВНЫЕ ОСОБЕННОСТИ МЕРОМИКТИЧЕСКИХ ВОДОЕМОВ И ТЕРМИНОЛОГИЯ
В зависимости от причин различий в плотности слоев меромиктические водоемы делят на эктогенные и эндогенные [51, 61, 64]. В эктогенных меромиксия возникает из-за поступления извне воды с иной соленостью – либо пресной воды в соленый водоем, либо соленой в исходно пресный. Их делят на три типа: I – водоемы с поверхностным поступлением пресных или минерализованных вод, включая континентальный вариант Ia и прибрежный морской – Ib; II – для случаев с поступлением вод, обогащенных органическими или биогенными веществами, что приводит к осаждению органики и повышению минерализации в придонном слое вследствие ее разложения; III – креногенный, где меромиксия возникает из-за поступления подземных минерализованных вод. В эндогенных меромиктических водоемах расслоение водной массы по плотности возникает по внутренним причинам. Это либо небольшие глубокие водоемы, где перемешиванию препятствуют форма котловины озера и окружающий рельеф (IV тип), либо водоемы с аккумуляцией солей в придонном слое за счет вымораживания при ледоставе или иных аналогичных процессов (V тип).
В России самый распространенный вариант меромиктических водоемов – прибрежные морские (табл. 1). Плотностная стратификация в них образуется как результат перекрытия морской воды пресным стоком, что соответствует эктогенным водоемам прибрежного морского типа (Ib).
Таблица 1.
Прибрежные меромиктические водоемы России (гал. – галоклин, хем. − хемоклин)
| Название водоема | Географические координаты | Площадь, га | Максимальная глубина, м | Глубина галоклина/ хемоклина, м | ООПТ |
|---|---|---|---|---|---|
| Черное море | |||||
| Черное море | 44° с.ш., 35° в.д. |
43 640 200 | 2210 | 150–200 | Нет |
| Побережье Баренцева моря | |||||
| оз. Могильное | 69°19′9″ с.ш., 34°20′60″ в.д. | 9.6 | 16.5 | 2.0 (гал.), 8.0–9.0 (хем.) |
Федеральный гидрологический памятник природы “Озеро Могильное” |
| Губа Ивановская, верхний ковш | 68°14′26″ с.ш., 38°47′26″ в.д. | 98 | 20 | 2.0–6.0 (гал.), 12 (хем.) | Государственный комплексный памятник природы “Губа Ивановская” на побережье |
| оз. Сисяярви | 69°38′16″ с.ш., 31°31′54″ в.д. | 67 | 41 | Требует уточнения | Нет |
| Губа Кислая | 69°21′58″ с.ш., 33°4′23″ в.д. | 117 | 36 | 5.0 (гал.), 15 (хем.) |
» |
| Губа Черная на Новой Земле, озеро 4 | 70°40′57″ с.ш., 54°34′4″ в.д. | 0.8 | 3.0 | 2.0 | Новоземельский ядерный полигон, закрыт для посещения |
| Губа Черная
на Новой Земле, озеро 9 |
70°43′29″ с.ш., 54°26′42″ в.д. | 0.8 | 3.0 | 2.0 | То же |
| Губа Черная
на Новой Земле, Второй ковш первой стоянки |
70°40′49″ с.ш., 54°36′16″ в.д. | 208 | 38 | 25 | » |
| Побережье Белого моря | |||||
| оз. Мертвое в губе Долгой (о. Большой Соловецкий) | 65°2′52″ с.ш., 35°45′43″ в.д. | 1.0 | 7.0 | 2.0 | » |
| Губа Канда, Федосеевский плес | 67°5′50″ с.ш., 32°10′34″ в.д. | 157 | 14 | 9–10 м | » |
| оз. Савино-Канозеро | 67°9′35″ с.ш., 32°22′32″ в.д. | 4.7 | 4.4 | 1.0 (гал.), 3.0–4.0 (хем.) |
» |
| Лагуна 1 на оз. Телячем | 67°6′56″ с.ш., 32°18′51″ в.д. | 1.0 | 3.0 | 1.0–2.0 (гал.) | Кандалакшский государственный природный заповедник |
| Лагуна 2 на оз. Телячем | 67°6′54″ с.ш., 32°19′15″ в.д. | 1.8 | 3.4 | 1.0–2.0 (гал.) | То же |
| оз. Большие Хрусломены | 66°43′1″ с.ш., 32°51′34″ в.д. | 75 | 21 | 1.5–2.0 (гал.), 2.75 (хем.) |
Нет |
| оз. Кисло-Сладкое | 66°32′54″ с.ш., 33°8′5″ в.д. | 1.78 | 4.5 | 1.0 (гал.), 2.0–3.5 (хем.) |
Государственный региональный комплексный заказник “Полярный круг” |
| Лагуна на Зеленом мысе | 66°31′50″ с.ш., 33°5′42″ в.д. | 2.0 | 6.5 | 1.0 (гал.), 4.5–5.5 (хем.) |
То же |
| оз. Еловое (Еловый Наволок, 1-е Кумяжье) | 66°28′55″ с.ш., 33°16′49″ в.д. | 5.0 | 5.5 | 1.0 (гал.), 3.0 (хем.) |
» |
| оз. Нижнее Ершовское | 66°28′55″ с.ш., 33°16′49″ в.д. | 8.9 | 2.7 | 2.2–2.5 | » |
| оз. Трёхцветное | 66°35′33″ с.ш., 32°58′43″ в.д. | 3.5 | 7.5 | 2.0 | Нет |
| оз. Вонючее в губе Чупа | 66°17′23″ с.ш., 33°19′52″ в.д. | 15 | 2.2 | 1.0 (гал.), 1.9–2.0 (хем.) |
» |
| Озеро на о. Тонисоар | 66°9′39″ с.ш., 34°13′33″ в.д. | 2.5 | 10 | 1.0 (гал.), 8.0–9.0 м (хем.) |
» |
| оз. Мероламбина | 66°10′1″ с.ш., 34°10′56″ в.д. | 20.5 | 8.0 | 1.0 (гал.) | » |
| Губа Глубокая около о. Соностров | 66°10′3″ с.ш., 34°9′8″ в.д. | 5.0 | 7.7 | 6.0 (хем.) | » |
| Побережье Берингова моря | |||||
| Лагуна Гладковская | 54°44′3″ с.ш., 167°43′26″ в.д. | 16.2 | 8.3 | 3.0–6.0 | Командорский природный биосферный заповедник им. С.В. Маракова |
| Побережье Тихого океана, Камчатский залив | |||||
| оз. Култучное | 56°29′31″ с.ш., 163°0′42″ в.д. | 9900 | 12 | 4.0–8.0 м | Нет |
| оз. Большой Вилюй | 52°49′41″ с.ш., 158°32′53″ в.д. | 8100 | 7.0 | 4.0 | Базовый водоем Вилюйского лососевого рыбоводного завода |
| Побережье Японского моря | |||||
| оз. Духовское | 44°38′54″ с.ш., 136°12′40″ в.д. | 147 | 4.5 | Региональный памятник природы “Духовские озера” | |
| оз. Мраморное | 44°38′0″ с.ш., 136°12′27″ в.д. | 37 | 4.0 | То же | |
| оз. Круглое | 44°36′45″ с.ш., 136°12′43″ в.д. | 27 | 7.8 | 5.0 | » |
| Побережье Охотского моря | |||||
| оз. Тунайча | 46°46′25″ с.ш., 143°10′29″ в.д. | 17 400 | 34 | 15 | Региональный комплексный памятник природы “Озеро Тунайча” |
| оз. Изменчивое | 46°52′17″ с.ш., 143°6′59″ в.д. | 820 | 6.0 | Варьирует | Нет |
| оз. Птичье | 46°24′7″ с.ш., 143°33′28″ в.д. | 3200 | 10 | 0.5–2.0 при открытой и 5.0 при закрытой протоке | » |
Устойчивая неоднородность распределения физико-химических факторов создает вертикальную последовательность экологических ниш. Для верхней водной массы, подверженной сезонной циркуляции, принято название “миксолимнион”; нижний слой с более высокой плотностью, не подверженный циркуляции, называют монимолимнионом. Водные сообщества миксолимниона формируются в тех же условиях, что сообщества голомиктических водоемов того же региона, и сходны с ними по составу (при аналогичном уровне минерализации, трофности и морфологии водоема). В придонной зоне нередко формируется аноксийная (т.е бескислородная) зона, где воспроизводятся условия из далекого прошлого нашей планеты и в массе развиваются микроорганизмы с древними вариантами метаболизма. Вертикальная структура из слоев с преобладанием окислительных и восстановительных условий универсальна не только для разных исторических эпох, но даже для иных планет. По данным НАСА, полученным с марсохода “Curiosity”, марсианский кратер Гейл некогда был меромиктическим озером, которое имело два слоя — верхний аэробный с окисленными соединениями металлов и нижний с восстановленными формами [53].
Анаэробная часть монимолимниона может быть либо эвксинной (этот термин применяют к серовородному варианту аноксии, возникающей из-за бактерий-сульфатредукторов, которые осуществляют сульфатное дыхание – окисляют органику сульфатом с образованием восстановленных соединений серы, в том числе сероводорода), либо ферругинозной (которая поддерживается за счет циклических окислительно-восстановительных преобразований железа). В прибрежных меромиктических водоемах преобладающее значение имеет сульфатредукция.
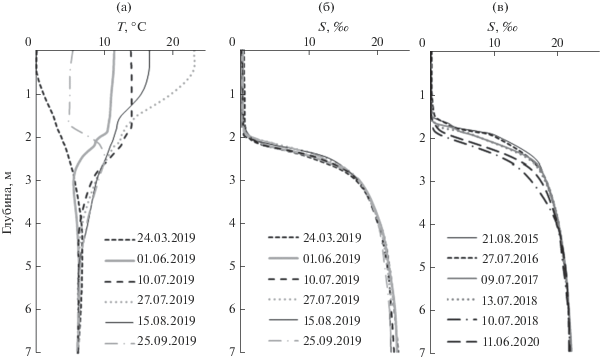
От поверхности ко дну уменьшается изменчивость физико-химических параметров вплоть до постоянства термохалинных характеристик в нижней части монимолимниона. В качестве примера можно привести оз. Трехцветное в зал. Кандалакшском Белого моря (рис. 1). Сезонные колебания температуры (от 0 до 25.1°C) в его пресном поверхностном слое соответствуют климатическим условиям, тогда как в соленом монимолимнионе температура (6.1–6.3°C) практически постоянна и остается такой даже в период ледостава.
Рис. 1.
Изменчивость термохалинных характеристик в прибрежном меромиктическом оз. Трехцветном (Кандалакшский залив Белого моря); вертикальные профили температуры (а) и солености (б) в разные сезоны 2019 г. и в летний период разных лет (в).
Переходную зону между миксолимнионом и монимолимнионом обычно именуют хемоклином [54], который в классическом варианте служит пикноклином (зоной скачка плотности), обусловленным различием концентраций минеральных солей (галоклином), а зачастую также и редокс-зоной (переходом от аэробной зоны к анаэробной). Однако во многих меромиктических водоемах, особенно в прибрежных, которым посвящена данная статья, между галоклином и редокс-зоной есть еще один слой, защищенный от термической циркуляции скачком плотности, но при этом аэрированный за счет активной деятельности фитопланктона, выделяющего кислород в ходе фотосинтеза (рис. 2). Поэтому использование термина “хемоклин” требует определенной осторожности. В данной статье используется этот термин как синоним редокс-зоны, независимо от того, совпадает она с галоклином или нет.
Рис. 2.
Вертикальная зональность меромиктической лагуны на м. Зеленом (Кандалакшский залив Белого моря, 8.07.2018 г.).
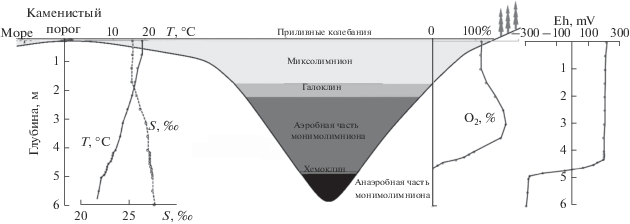
В хемоклине нередко складываются условия для развития аноксигенных фототрофных бактерий, которые используют восстановленные соединения, например сероводород, для древнейшего варианта фотосинтеза, в ходе которого выделяется не кислород, а сера.
ОБЗОР ИЗВЕСТНЫХ ПРИБРЕЖНЫХ МЕРОМИКТИЧЕСКИХ ВОДОЕМОВ РОССИИ
Большинство прибрежных меромиктических озер сосредоточено в районах с поднятием берега. На побережье Баренцева и Белого морей можно найти водоемы на любых стадиях изоляции от моря. Множество таких водоемов найдено в начале XX в. К.М. Дерюгиным, Л.А. Зенкевичем и Е.М. Крепсом на Новой Земле [10, 12, 18], в том числе – в губе Черной, где позднее проводились ядерные испытания. Доступ туда запрещен, но все описанные ими водоемы сохранились.
Озеро Могильное
Самый известный прибрежный меромиктический водоем – реликтовое оз. Могильное на о. Кильдин. Это единственное в России анхиолиновое озеро, т.е. имеющее подземную связь с морем; она осуществляется в глубине через фильтрующую каменистую перемычку. Из меромиктических озер России Могильное имеет самую долгую историю изучения, которая началась в 1887 г., когда в этом, как поначалу считалось, пресноводном озере поймали атлантическую треску. Позднее обнаружили, что под пресным слоем находится соленый, где обитают эти рыбы. Кильдинская треска (Gadus morhua kildinensis) − подвид атлантической трески, эндемик оз. Могильного, занесена в Красную книгу России. За время изоляции она приобрела морфологические и генетические отличия от баренцевоморской популяции [32, 48, 65].
В конце XIX − начале XX вв. озеро было изучено экспедицией К.М. Дерюгина, завершившейся выпуском монографии об этом озере [11]. Вторая монография была посвящена исследованиям бактериального сообщества оз. Могильного, выполненным основоположником морской микробиологии Б.Л.Исаченко [13]. Он обнаружил розовую прослойку на границе аэробной и сероводородной зон и объяснил ее массовым развитием фотосинтезирующих пурпурных серных бактерий, которые используют поступающий снизу сероводород. Еще две монографии подытожили комплексные исследования Мурманского морского биологического института (ММБИ) РАН [35] и Полярного института рыбного хозяйства и океанографии (ПИНРО) [34]. Они указали на постепенное изменение вертикальной структуры озера – в поверхностном слое, прежде пресном, возрастала соленость и, кроме того, поднималась граница распространения сероводорода. Эти изменения не остановились и после прекращения хозяйственной деятельности на водосборе [62]. К концу второго десятилетия XXI в. глубина опресненного слоя уменьшилась с 5 (как в начале XX в.) до 2 м, соленость в нем увеличилась до 5.3–10.7‰, пресноводное планктонное сообщество сменилось на солоноватоводное [63]. Граница анаэробной зоны, которая в конце XIX в. находилась на глубине 14 м, поднялась до 7.9–8.5 м. Теперь сероводород заполняет половину глубины озера, а его концентрация в придонном слое достигла 122–227 мг/л. Катастрофические изменения произошли в донных сообществах – зона обитания бентоса уменьшилась, исчезли двустворчатые моллюски Astarte montagui и колонии сидячих многощетинковых червей Pseudopotamilla reniformis. С прогрессирующим сероводородным заражением связана также смена доминирующего вида бактерий в окрашенном слое. Уже в 1970-х гг. там преобладали не пурпурные, а более строгие анаэробы ‒ зеленые серные бактерии Ch. phaeovibrioides с коричневой окраской [50]. Сравнение интенсивности фотосинтеза фитопланктона в аэробной зоне и аноксигенных фототрофных бактерий на границе распространения сероводорода показало, что у последних она в 4 раза выше. Впоследствии эта закономерность подтвердилась и в других меромиктических водоемах. В 2018–2019 гг. окрашенный слой в оз. Могильном поднялся к 8.5−9 м и был по-прежнему сформирован зелеными серными бактериями.
Осолонение верхнего слоя в оз. Могильном связывают с климатическими изменениями. Анализ данных ближайшей метеостанции “Териберка” за последние 130 лет показал, что летние значения температуры постепенно нарастают, зимы стали мягкими и малоснежными, что приводит к недостатку пресного стока [3]. Однако прогрессирующее сероводородное заражение имеет, по-видимому, другую причину – ослабление водообмена с морем из-за уменьшения проницаемости дамбы.
Фьордовые лагуны в губах Ивановской и Амбарной
Аналогом оз. Могильного считается верхний ковш губы Ивановской на берегу Кольского полуострова. Губа Ивановская — фьордоподобный залив, отделенный от моря узким мелководным горлом и разделенный поперечными порогами на 3 плеса. В верхнем наблюдается устойчивая вертикальная стратификация [1]: поверхностный слой опреснен до 10–14‰, средний горизонт соленый и насыщен кислородом, нижняя водная масса с соленостью 24‰ содержит сероводород. В отличие от оз. Могильного, граница распространения сероводорода здесь в последние 10 лет не менялась.
Хотя, по мнению В.Н. Семенова [41], изучавшего краевые водоемы Кольского полуострова, других аналогов оз. Могильного на Мурмане нет, известен еще один потенциальный аналог, пока слабо изученный в гидрологическом отношении – оз. Сисяярви в куту губы Амбарной [9]. В вершине этой губы есть два изолированных плеса. Нижний, оз. Линьялампи, связан с морем и аэробный до дна, а в верхнем, оз. Сисяярви, циркуляция ослаблена и зарегистрирована устойчивая температурная стратификация. В его придонном слое есть признаки сероводородного заражения, по крайне мере периодического. Гидрохимические исследования там не проводились, но косвенным индикатором аноксийных условий служит высокое обилие сапробионтных полихет Scalibregma inflatum и низкая численность иглокожих, которые обычны в открытой части губы.
Морские ковшовые губы
Еще один вариант водоемов с устойчивой вертикальной стратификацией – морские ковшовые губы, такие как оз. Линьялампи и первые 2 плеса губы Ивановской. Г.С. Гурвич [8] называл ковшами ограниченные отмелями заливы с глубокими ямами и такой же амплитудой приливов, как на внешней акватории. Первой была исследована губа Долгая (Глубокая) на о. Большом Соловецком, связанная двумя узкими проливами с Онежским заливом Белого моря. В конце XIX в. Н.М. Книпович обнаружил в ней арктическую бентофауну с доминированием двустворчатых моллюсков Portlandia arctica (ранее известных как Joldia arctica) на необычно малой для них глубине [14]. Он предположил, что эта губа представляет собой рефугиум реликтовой арктической фауны. Впоследствии аналогичные сообщества были найдены и в других беломорских губах – Бабье море, Лов, Колвица, Палкина [5, 8, 27, 29]. Холодолюбивые формы могут существовать там благодаря вертикальной структуре из двух несмешиваемых слоев: верхнего, который опреснен и прогревается летом, и нижнего соленого – нередко даже летом с температурой ниже нуля. Если в Белом море отрицательная температура начинается с глубины 100 м, то в ковшовых губах – с 15–20 м. Нижний слой обновляется медленнее, чем верхний, и пополняется только зимой [30]. Но анаэробной зоны в беломорских ковшовых губах, как правило, нет; концентрация кислорода в нижней водной массе зачастую даже больше, чем в поверхностной [28]. Ковши могут становиться эвксинными под влиянием антропогенного фактора, например при установке мидиевых плантаций, и крайне редко – естественным путем.
Озера и лагуны на побережье Белого моря
Другой вариант краевых водоемов с устойчивой стратификацией, среди которых много эвксинных, – прибрежные лагуны и озера, отделившиеся от Белого моря в результате простгляциального подъема берега. Их изоляция прогрессирует, поскольку подъем продолжается со скоростью 1–4 мм в год [36, 42]. В Кандалакшском заливе благодаря комплексным исследованиям, организованным на базе Беломорской биостанции МГУ, выявлено более двух десятков водоемов на разных стадиях изоляции [16, 46]. Построенный из них типологический ряд отражает хронологию трансформации экологических сообществ и позволяет реконструировать эволюцию водоема [17, 24]. По данным палеолимнологов, изучавших донные осадки озер на Соловецких островах [42], превращение морского залива в пресное озеро в этом районе занимает несколько столетий. Когда порог, отгораживающий его от моря, поднимается над уровнем малой воды, приливно-отливные колебания в водоеме ослабевают и становятся асимметричными с коротким приливом и долгим отливом. В числе таких водоемов – лагуна на м. Зеленом, озеро на о. Тонисоар и вершина губы Глубокой около о. Соностров [15]. Когда порог поднимaется выше среднего уровня полной воды, забросы морской воды возможны только в сизигию (например, в оз. Кисло-Сладком), по мере дальнейшего поднятия их частота уменьшается до 1‒2 раз в год (в оз. Нижнем Ершовском), потом они происходят с многолетними интервалами (в озерах Еловый Наволок и Трехцветном).
В пределах зоны ветрового перемешивания, ограниченной глубиной 1–2 м, поверхностный слой разбавляется и становится все более пресным. Соответственно солености в нем меняется состав фауны [17, 24]. Под опресненным слоем долгое время сохраняется морская вода. Пока есть водообмен с морем, верхняя часть соленой зоны остается аэробной и служит зоной обитания морского бентоса. Чем реже забросы морской воды, тем ýже соленый аэробный слой и тем меньше зона обитания морских организмов. Биомасса бентоса снижается, число видов сокращается. В конце концов, соленый аэробный слой исчезает вместе со своими обитателями.
Одновременно с этим в донном углублении водоема активируется бактериальная сульфатредукция [58]. Чем сильнее изоляция, тем больше концентрация сероводорода; сульфатно-хлоридное отношение смещается в сторону хлоридов [4].
В хемоклине беломорских прибрежных водоемов обычно возникают цветные прослойки с аноксигенными фототрофными бактериями. Вода в них окрашена в зеленый цвет, если там доминирует зелено-окрашенная форма Ch. phaeovibrioides, или в красноватый, если это коричнево-окрашенная форма [55, 56, 59]. Пурпурные серные бактерии, которые отвечали за розовый слой в оз. Могильном сто лет назад, в беломорских водоемах обычно малочисленны. Хемоклин – самая продуктивная зона в отделяющихся водоемах за счет того, что скорость протекающего в ней аноксигенного фотосинтеза в несколько раз выше, чем у оксигенного фотосинтеза, осуществляемого фитопланктоном в аэробной зоне того же озера [39]. На хемоклин приходится наибольшая интенсивность темновой фиксации СО2 и хемосинтеза, а также сульфатредукции, которая в водоемах без анаэробного слоя воды наиболее активно идет в поверхностном слое осадка. Тонкие биогеохимические процессы на границе аэробной и анаэробной зон и участие в них микроорганизмов представляют особый интерес для науки и пока мало изучены. К примеру, в хемоклине одного из беломорских озер совсем недавно выявлен новый для соленых водоемов бактериальный процесс – фотозависимое окисление метана [38].
Поскольку хемоклин характеризуется резкими вертикальными градиентами, в нем формируется мелкомасштабная последовательность экологических ниш, которая, кроме окрашенной бактериальной прослойки, включает в себя также прилегающий к ней сверху слой из простейших ‒ миксотрофов, способных переключаться с фотосинтеза на потребление готовых органических веществ и обратно. Это могут быть инфузории с фототрофными эндосимбионтами, динофлагелляты с клептопластидами (хлоропластами, позаимствованными у других микроводорослей) или криптофитовые жгутиконосцы, которые могут достигать там численности гиперцветения и сами формируют окрашенный слой [55]. По всей вероятности, они используют бактериальную продукцию. Слой с высокой плотностью одноклеточных организмов обеспечивает пищей зоопланктон, и, таким образом, продукция аноксигенного фотосинтеза передается через них на более высокие трофические уровни к рыбам и беспозвоночным, в сообщество вышележащей аэробной зоны водоема.
Прибрежные водоемы с антропогенной изоляцией
Устойчивая вертикальная стратификация и связанная с ней аноксия в водоемах, отделяющихся от моря, может возникать естественным путем, но быстрее ‒ при вмешательстве человека. У оз. Большие Хрусломены на о. Оленьем в зал. Ковда естественный порог надстроен в конце XX в. с целью опреснения водоема для заправки паровых машин лесозавода [23]. Вместо пресного получился меромиктический водоем с солоноватой водой у поверхности, соленой водой ниже 1.5 м и сульфидной зоной начиная с 3–5 м. В соловецкой губе Долгой к придонной аноксии привело строительство в 1854 г. дамбы, перекрывшей водообмен через один из проливов. Сероводород заметили уже в начале XX в. [45], а в конце XX в. выяснилось, что по сравнению с серединой XIX – началом XX вв. изменился видовой состав бентоса. Исчезло несколько видов, прежде многочисленных: морские ежи Strongilocentrotus pallidus, офиуры Ophiopholis aculeata и плеченогие Hemithyris psittacea [31, 43]. Фрактальное отчленение небольших водоемов происходит также внутри этой губы, и в них тоже наблюдается эвксинная меромиксия, как, например, в оз. Мертвом [40].
Яркий пример антропогенной изоляции − губа Канда в вершине Кандалакшского залива, которую перегородили в двух местах: в 1916 г. железнодорожной дамбой и в конце 1960-х гг. ‒ автомобильной. Воды р. Канды опреснили большую часть губы, но в донных углублениях кое-где сохранилась соленая вода, переработанная сульфатредуцирующими бактериями. Там накапливаются сероводород и метан, а также изменился состав анионов: увеличилась доля хлоридов и карбонатов, уменьшилась – сульфатов. В Федосеевском плесе, который оказался в полной изоляции от моря и соседствует только с пресноводными участками, донная линза соленой воды, по всей вероятности, хранится более ста лет [37].
Природно-технической меромиктической системой стала баренцевоморская губа Кислая − фьорд длиной 3.5 км, где в 1968 г. была построена первая и пока единственная в России приливная электростанция. Сразу после изоляции в вершине губы появились признаки стагнации – верхние 5–7 м стали пресными, глубже 15 м появился сероводород. Прежде водоем не замерзал, но теперь каждую зиму стал покрываться толстым льдом. Все это привело к деградации литоральной фауны и флоры, обеднению планктона и ихтиофауны. После запуска ПЭС водообмен улучшился, однако в дальнейшем изменения в режиме эксплуатации приводили то к полному прекращению водообмена и повторным заморам, то к периодическому улучшению экологической ситуации [25]. Наблюдения за динамикой донных сообществ в этой губе позволили разработать шкалу оценки состояния макрозообентоса при изоляции водоема [47]. Первыми вымирают моллюски-фильтраторы, затем ‒ роющие организмы, впоследствии в массе остаются только личинки хирономид и малощетинковые черви, устойчивые к дефициту кислорода. В дальнейшем исчезают и эти группы, уступая место рачкам-бокоплавам, не зарывающимся в грунт. Наконец, при катастрофическом положении макробентос полностью исчезает. Эти данные уже сегодня позволяют делать обоснованные прогнозы для проектов, связанных с отчленением краевых водоемов при освоении арктического побережья.
Дальневосточные морские лагуны
Множество полуизолированных лагун с разной степенью опреснения, в том числе меромиктических, найдено на восточном берегу Камчатки, на о. Сахалин и на восточном берегу Сихотэ-Алиня [22, 26, 44].
На примере оз. Большой Вилюй на юго-восточном берегу Камчатки изучен один из эффектов, связанных с меромиксией, − заглубленный максимум температуры, который приходится на зону скачка плотности [60]. Крупное по площади (8.1 км2) оз. Большой Вилюй – часть эстуарной системы рек Большой Вилюй и Малый Вилюй, его максимальная глубина ‒ 7 м. В летнее время под пикноклином возникает прогретый слой. С помощью одномерной гидрологической модели “LAKE” определены главные условия появления этого феномена: наличие скачка солености с градиентом, достаточным для предотвращения перемешивания при ночном выхолаживании поверхности, толщина миксолимниона не должна превышать 2 м, он должен быть прозрачным, погода днем ‒ солнечной, без сильных ветров по ночам.
Важная особенность дальневосточных лагун – динамичность. Косы из морских отложений, которые отделяют их от моря, периодически, до нескольких раз в году, при штормах меняют очертания, и лагуны то открываются, то оказываются в полной изоляции. В закрытый период или при сильно ослабленном водообмене с морем в них может устанавливаться меромиктический режим. Эти лагуны представляют собой удобный объект для наблюдений за динамикой биоты при изменениях гидрологических условий.
Култучное озеро, лагуна эстуарного типа в устьевой части р. Камчатки, стало меромиктическим немногим более ста лет назад после заброса в пресный водоем морской воды при цунами в 1923 г. Эволюция экосистемы этого водоема отслежена благодаря материалам экспедиции Ф.П. Рябушинского в начале XX в., которая исследовала водоем еще в пресноводном состоянии [6], данным И.И. Куренкова за 1951–1962 гг. и комплексным исследованиям в 2009–2010 гг. [7]. Они документировали быстрые изменения в экосистеме оз. Култучного и соседнего оз. Нерпичьего, прогресс сероводородного заражения и исчезновение бентоса на значительной части дна.
Другой водоем, где произошли кардинальные изменения после изоляции (они хорошо отслежены), – оз. Тунайча, второе по величине озеро Сахалина, а также отделившееся от него оз. Изменчивое. Исходно пресноводное оз. Тунайча в среднем голоцене соединилось с Охотским морем, а примерно тысячу лет назад после образования косы, отделившей его от моря, превратилось в глубокую лагуну [22]. Регулярное поступление морской воды прекратилось в середине 1970-х гг. после строительства автодорожного моста, и теперь забросы морской воды случаются только при штормовых нагонах. В результате поверхностный слой стал опресняться. Соленость уменьшилась с 6.6 до 2.4–2.6‰, усилился летний прогрев, сезонные колебания температуры достигли придонного слоя. В настоящее время водоем имеет двуслойную структуру с хемоклином на глубине 15 м и сероводородом под ним в концентрации до 300–320 мкг/л.
Все компоненты водной экосистемы оз. Тунайча детально изучены в ходе многолетних комплексных гидробиологических исследований, организованных СахНИРО. Из-за опреснения в его зоопланктоне не стало хищников – морских кладоцер Podon leuckarti и Evadne nordmani, крупные виды сменились на мелкие. Хотя структура сообщества стала проще, суммарная биомасса зоопланктона не уменьшилась [18]. У бентоса общая биомасса возросла в 3 раза за счет распространения солоноватоводного моллюска Corbicula japon-ica, при этом морские виды Potamocorbula amurensis и Macoma balthica оказались на грани исчезновения [19].
Озеро Изменчивое, отделившееся от оз. Тунайча 400–150 лет назад, имеет собственное сообщение с морем через протоку, которая часто перекрывается наносами, а потом снова прорывается. При закрытой протоке поверхностный слой на несколько единиц солености опресняется и лагуна приобретает меромиктический характер. Число видов бентоса при этом уменьшается в несколько раз, усиление прогрева приводит к смене морских холодолюбивых видов на солоноватоводные тепловодные. При восстановлении связи с Охотским морем в озеро снова вселяются холодолюбивые формы и происходит обратная смена сообществ. Наблюдения за динамикой бентоса при закрытии и открытии протоки позволили установить два фундаментальных принципа смены сообществ в лагунных водоемах: тождественность конечного результата при долговременных и быстрых (катастрофических) изменениях и обратимость процессов [20].
Водоем с переменным режимом есть также на северо-восточном берегу о. Беринга ‒ лагуна Гладковская. Разница солености между поверхностным и придонным слоями обеспечивает в ней меромиктический режим вне зависимости от степени открытости протоки. Под галоклином нередко возникает заглубленный максимум температуры, а на глубине 6–7 м, где исчезает кислород и появляется сероводород, зарегистрирован слой с повышенной мутностью из-за бактериальной взвеси. В 1981–1987 гг. эта лагуна стала предметом исследований совместной экспедиции ВНИРО, Камчатского отдела природопользования ТИНРО и Института океанологии РАН. Особый интерес к ней связан с промыслом тихоокеанской мидии Mytilus trossulus, биомасса которой здесь очень высока (3–4 кг/м2), а моллюски по линейным размерам вдвое крупнее, чем в море [33]. Меромиктический характер лагуны и годовая цикличность кислородного режима оказались препятствием для коллекторной марикультуры: из-за весеннего дефицита кислорода в лагуне происходит массовая гибель взрослых мидий [2]. При полном перекрытии протоки поверхностный слой полностью опресняется, а по всей соленой зоне может распространяться сероводород. После одного такого замора донная фауна не восстановилась даже через 5 лет.
ЗАКЛЮЧЕНИЕ
Количество меромиктических водоемов на территории России оказалось значительно больше, чем было указано в предыдущих списках. Одних только прибрежных водоемов морского происхождения описано 31. Для этого типа меромиктических водоемов в полной мере справедливо представление о меромиксии как стадии эволюции водоема [51] в палеолимнологическом аспекте, касающемся медленных изменений, и в небольших промежутках времени.
Для динамичных дальневосточных лагун меромиксия – часто повторяющееся состояние; в каждом цикле изменений линии береговых наносов вертикальная стратификация формируется заново, и соотношения толщин слоев, как и степени опреснения миксолимниона, могут быть разными. В районах с поднятием берега меромиктическая стадия – промежуточный этап на пути водоема от морского залива к финальному пресноводному состоянию. Даже самые стабильные меромиктические водоемы, такие как оз. Могильное, тоже находятся в динамике, хотя и медленной.
Меромиктические водоемы – одно из природных богатств нашей страны. На морском побережье России есть любые варианты стратифицированных водоемов: аэрированные сверху донизу ковшовые губы, заливы на разных стадиях изоляции от моря, лагуны с изменчивым гидрологическим режимом, прибрежные озера с сероводородной зоной естественного происхождения и возникшей антропогенным путем. Анализ научных публикаций показал, что большинство из них пока изучено слабо. Из 31 водоема лишь треть охвачена многолетними комплексными исследованиями. В изысканиях экологической направленности основное внимание уделяется аэробной биоте миксолимниона, которая может представлять хозяйственный интерес. Микробные сообщества анаэробной зоны и хемоклина, которые, по существу, определяют специфику меромиктических водоемов, в большинстве случаев остаются за пределами внимания. Не только гидрохимические работы, но и измерения термохалинных характеристик по всему вертикальному профилю, даже в теплый период года, пока выполнены далеко не во всех водоемах.
Все меромиктические водоемы заслуживают охраны как редкий феномен, в том числе прибрежные морские. Однако лишь шесть из них получили статус гидрологических заказников и памятников природы, и еще 10 находятся в пределах особо охраняемых природных территорий и закрытых зон. Остальные 15 водоемов лишены законодательной охраны. Нет сомнений, что составленный список – далеко не исчерпывающий и будет пополняться. Надеемся, что этот обзор послужит отправной точкой для новых исследований меромиктических водоемов морского происхождения, нацеленных на всестороннее описание этого феномена как единой и своеобразной экологической системы, и будет способствовать их сохранению.
Список литературы
Бобков А.А., Стрелков П.П., Ильина А.Н. Приливная изменчивость океанологических условий сублиторали губы Ивановской // Вестн. СПбГУ. Сер. 7. 2010. Вып. 1. С. 86−98.
Буяновский А.И. Пространственно-временнáя изменчивость размерного состава и особенности эксплуатации популяций промысловых беспозвоночных прибрежной зоны // Тр. ВНИРО. 2005. Т. 144. С. 12−23.
Василенко А.Н., Ефимов В.А., Сазонов А.А., Фролова Н.Л. Новые данные о гидрологии меромиктического озера Могильное (о. Кильдин, Баренцево море) // “География: развитие науки и образования”. Материалы Всерос. науч.-практ. конф. “LXXII Герценовские чтения”. Т. 1. СПб.: Астерион, 2019. С. 273–277.
Васильчук Ю.К., Фролова Н.Л., Краснова Е.Д., Буданцева Н.А., Васильчук А.К., Добрыднева Л.В., Ефимова Л.Е., Терская Е.В., Чижова Ю.Н. Изотопно-геохимический состав воды в меромиктическом озере Трехцветном на беломорском побережье 2016 г. // Вод. ресурсы. 2016. Т. 43. № 5. С. 555–566.
Голиков А.Н., Аверинцев В.Г., Бабков А.И., Меншуткина Т.В., Федяков В.В., Шошина Е.В. Биоценозы губы Палкина Белого моря // Иссл. фауны морей. Т. 29. № 37. Л.: ЗИН РАН, 1982. С. 3–11.
Горин С.Л., Лепская Е.В., Маркевич Г.Н., Анисимова Л.А. Устьевая область реки Камчатки в начале XX века: Гидрологический режим, морфологическое строение, водная биота (по материалам экспедиции Ф.П. Рябушинского) // Иссл. водн. биол. рес. Камчатки и сев-зап. части Тихого океана. 2014. Вып. 32. С. 89−101.
Горин С.Л., Чебанова В.В. Трансформация гидрологического режима и бентофауны озер Нерпичье и Култучное (устьевая область реки Камчатки) в процессе их осолонения // Чтения пам. В.Я. Леванидова. 2011. Вып. 5. С. 119−128.
Гурвич Г.С. Распространение животных на литорали и в сублиторали Бабьего моря // Иссл. морей СССР. 1934 Т. 20. № 2. С. 15–32.
Деарт Ю.В., Переладов М.В., Спиридонов В.А., Антохина Т.И., Ржавский А.В., Бритаев Т.А. Донные сообщества мягких грунтов соленых озер Сисяярви и Линьялампи (Баренцево море) // ДАН. 2018. Т. 478. № 5. С. 608−612.
Дерюгин К.М. Исследования Баренцова и Белого морей и Новой Земли. Архангельск: Архангельское общ-во краеведения, 1925. 44 с.
Дерюгин К.М. Реликтовое озеро Могильное (остров Кильдин в Баренцевом море). Л.: Главнаука, 1925. 112 с.
Зенкевич Л.А. К режиму осолоненных береговых озер южного острова Новой Земли // Рус. гидробиол. журн. 1928. Т. VII. № 8/9. С. 183−187.
Исаченко Б.Л. Исследование над бактериями Северного Ледовитого океана // Тр. Мурманской науч. промысл. экспед. 1906 г. СПб., 1914. 297 с.
Книпович Н. Несколько слов относительно фауны Долгой (Глубокой) губы Соловецкого острова и физико-географических условий // Вестн. естествознания. СПб., 1893. С. 1−13.
Краснова Е.Д., Беляев Б.М., Василенко А.Н., Воронов Д.А., Ефимов В.А., Ефимова Л.Е., Летарова М.А., Мардашова М.В., Мироненко А.А., Фролова Н.Л. Три соленых озера возле о. Соностров: вертикальная стратификация в 2010 и 2017 гг. // Тр. VI Межд. науч.-практ. конф. “Морские исслед. и образование (MARESEDU – 2017)”. М.: ПолиПРЕСС, 2017. С. 682–694.
Краснова Е.Д., Воронов Д.А., Демиденко Н.А., Кокрятская Н.М., Пантюлин А.Н., Рогатых Т.А., Самсонов Т.Е., Фролова Н.Л. Исследования отделяющихся водоемов на побережье Белого моря // “Комплексные исследования Бабьего моря, полу-изолированной беломорской лагуны: геология, гидрология, биота – изменения на фоне трансгрессии берегов”. Тр. Беломорской биостанции МГУ. Т. 12. М.: Т-во науч. изд. КМК, 2016. С. 211–241.
Краснова Е.Д., Мардашова М.В. Как морской залив превращается в озеро // Природа. 2020. № 1. С. 16–27.
Крепс Е.М. Гидрологический очерк Черной губы на Новой Земле и реликтовых озер к ней примыкающих // Иссл. морей СССР. Л.: ГГИ, 1927. Вып. 5. С. 1−80.
Лабай В.С. Водная биота озера Тунайча (южный Сахалин) и условия ее существования. Южно-Сахалинск: СахНИРО, 2016. 240 с.
Лабай В.С. Реакция макрозообентоса лагунного озера Изменчивое (остров Сахалин) на прекращение водообмена с морем // Биол. моря. 2009. Т. 35. № 3. С. 167–174.
Лабай В.С. Эволюция бентоса прибрежных лагун острова Сахалин: причины и следствия // Чтения пам. В.Я. Леванидова. 2011. Вып. 5. С. 265−274.
Лабай В.С., Атаманова И.А., Заварзин Д.С., Мотылькова И.В., Мухаметова О.Н., Никитин В.Д. Естественная история Сахалина и Курильских островов. Водоемы острова Сахалин: от лагун к озерам. Южно-Сахалинск: Сахалинский обл. краеведческий музей, 2014. 208 с.
Лосюк Г.Н., Краснова Е.Д., Кокрятская Н.М., Воронов Д.А. Основные гидрологические параметры озера Большие Хрусломены (Кандалакшский залив Белого моря) // “География: развитие науки и образования”. Материалы конф. “LXXII Герценовские чтения”. Т. 1. СПб.: Астерион, 2019. С. 334−336.
Мардашова М.В., Воронов Д.А., Краснова Е.Д. Характеристика бентосных сообществ отделяющихся водоемов окрестностей ББС МГУ (Кандалакшский залив Белого моря) // Зоол. журн. 2020. Т. 99. № 7. С. 1–20.
Марфенин Н.Н., Малютин О.И., Пантюлин А.Н., Перцова Н.М., Усачев И.Н. Влияние приливных электростанций на окружающую среду. М.: МГУ, 1995. 125 с.
Михайлов В.Н., Горин С.Л. Новые определения, районирование и типизация устьевых областей рек и их частей – эстуариев // Вод. ресурсы. 2012. Т. 39. № 3. С. 243–257.
Наумов А.Д. Донная фауна губы Лов (Белое море, Кандалакшский залив) и ее особенности // Экол. донного населения шельфовой зоны. М.: ИО АН СССР, 1979. С.128−136.
Наумов А.Д. Предварительные соображения о темпах водообмена Бабьего моря // Комплексные исследования Бабьего моря, полуизолированной беломорской лагуны. Геология, гидрология, биота: изменения на фоне трансгрессии берегов. Тр. Беломорской биостанции МГУ. Т. 12. М.: Т-во науч. изд. КМК, 2016. С. 67–73.
Наумов А.Д., Бабков А.И., Федяков В.В. Биоценозы губы Колвица Кандалакшского залива Белого моря // Экол. исслед. донных организмов Белого моря. Л.: ЗИН АН СССР, 1986. С. 91−122.
Наумов А.Д., Биягов К.Л., Савченко О.Н., Аристов Д.А., Усов Н.В. Бентос губы Лов (Кандалакшский залив, Белое море): современные и архивные данные сорокалетней давности // Тр. Зоол. ин-та РАН. 2018. Т. 322. № 3. С. 481–518.
Нинбург Е.А. Долгая губа: изоляция естественная и искусственная // Природа. 1990. № 7. С. 44–49.
Новиков Г.Г., Афанасьев К.И., Рубцова Г.А., Строганов А.Н. О некоторых генетических параметрах кильдинской трески Gadus morhua kildinensis Derugin (Gadidae, Gadiformes) // Вопр. ихтиологии. 2006. Т. 46. № 5. С. 708–710.
Переладов М.В., Сидоров К.С., Буяновский А.И., Черенкова Н.Л. Динамика донных биоценозов лагуны Гладковской о. Медный // Природные ресурсы Командорских островов. Запасы, состояние, вопросы охраны и использования. М.: Изд-во МГУ, 1991. С. 171−185.
Реликтовое озеро Могильное (исследования 1997−2000 гг.). Мурманск: ПИНРО, 2002. 163 с.
Реликтовое озеро Могильное. Л.: Наука, 1975. 250 с.
Романенко Ф.А., Шилова О.С. Послеледниковое поднятие Карельского берега Белого моря по данным радиоуглеродного и диатомового анализов озерно-болотных отложений полуострова Киндо // ДАН. 2012. Т. 442. № 4. С. 544−548.
Саввичев А.С., Демиденко Н.А., Краснова Е.Д., Калмацкая О.В., Харчева А.Н., Иванов М.В. Микробные процессы в губе Канда – меромиктическом водоеме, искусственно отделeнном от Белого моря // ДАН. 2017. Т. 474. № 5. С. 637–641.
Саввичев А.С., Кадников В.В., Каллистова А.Ю., Русанов И.И., Воронов Д.А., Краснова Е.Д., Равин Н.В., Пименов Н.В. Фотозависимое окисление метана – важнейший процесс цикла метана в водной толще полярного озера Большие Хрусломены // Микробиология. 2019. Т. 88. № 3. С. 367−371.
Саввичев А.С., Лунина О.Н., Русанов И.И., Захарова Е.Е., Веслополова Е.Ф., Иванов М.В. Микробиологические и изотопно-геохимические исследования озера Кисло-Сладкое − меромиктического водоема на побережье Кандалакшского залива Белого моря // Микробиология. 2014. Т. 83. С. 191− 203.
Саввичев А.С., Русанов И.И. Озеро Мертвое – меромиктический водоем на острове Соловецкий // “Проблемы мониторинга природной среды Соловецкого архипелага”. Материалы IV Всерос. науч. конф. Архангельск: Ин-т экол. проблем Севера, 2009. С. 57−59.
Семенов В.Н. Типология краевых морских бассейнов умеренной, субарктической и арктической зон гумидного климатического пояса // Биологические ресурсы шельфовых и окраинных морей Советского Союза. М.: Наука, 1990. С. 7−20.
Субетто Д.А., Шевченко В.П., Лудикова А.В, Кузнецов Д.Д., Сапелко Т.В., Лисицын А.П., ВанБиек П., Суот М., Субетто Г.Д. Хронология изоляции озер Соловецкого архипелага и скорости современного озерного осадконакопления // ДАН. Сер. Геол. 2012. Т. 446. № 2. С. 183−190.
Хайтов В.М., Зайчикова А.А., Полоскин А.В., Сказина М.А. Памятник природы — Долгая губа о. Большого Соловецкого: особенности бентосного населения (обзор работ Е.А. Нинбурга и его учеников) // Материалы науч. конф. “Морская биология, геология, океанология – междисциплинарные исслед. на морских стационарах”. М.: Т-во науч. изд. КМК, 2013. С. 311−316.
Чернова Е.Н., Шулькин В.М., Лысенко Е.В., Луценко Т.Н., Болдескул А.Г. Гидрохимические и биогеохимические особенности пресных и солоноватоводных озер восточного Сихотэ-Алиня // Изв. ТИНРО. 2014. Т. 178. С. 157−172.
Чуднов К.П. Глубокая губа и ее особенности // Соловецкие острова. 1926. № 2–3. С. 159‒170.
Шапоренко С.И., Корнеева Г.А., Пантюлин А.Н., Перцова Н.М. Особенности экосистем отшнуровывающихся водоемов Кандалакшского залива Белого моря // Вод. ресурсы. 2005. Т. 32. № 5. С. 517–532.
Шилин М.Б. Кислогубская приливная электростанция: возвращаясь снова и снова // Уч. Зап. Рос. гос. гидрометеорол. ун-та. Науч.-теор. журн. 2009. № 11. С. 101–112.
Andreev V., Strelkov P., Fokin M., Mugue N. Long-term persistence and evolutionary divergence of a marine fish population with a very small effective population size (Kildin cod Gadus morhua kildinensis) // Mar. Biol. 2015. V. 162. P. 979–992.
Findenegg I. Limnologische Untersuchungen im Ka¨rntener Seengebiete. Ein Beitrag zu Kenntnis des Stoffhaushaltes in Alpenseen // Int. Rev. Gesamten. Hydrobiol. Hydrogr. 1935. V. 32. P. 369–423.
Gorlenko V.M., Vainstein M.B., Kachalkin V.I. Microbiological characteristic of lake Mogilnoye // Arch. Hydrobiol. 1978. V. 81. № 4. P. 475−492.
Hakala A. Meromixis as a part of lake evolution – observations and a revised classification of true meromictic lakes in Finland // Boreal Environ. Res. 2004. V. 9. P. 37–53.
Hall K.J., Northcote T.G. Meromictic lakes // Encyclopedia of lakes and reservoirs. Dordrecht: Springer, 2012. P. 519–524.
Hurowitz J.A., Grotzinger J.P., Fischer W.W., McLennan S.M., Milliken R.E., Stein N., Vasavada A.R., Blake D.F., Dehouck E., Eigenbrode J.L., Fairén A.G., Frydenvang J., Gellert R., Grant J.A., Gupta S., Herkenhoff K.E., Ming D.W., Rampe E.B., Schmidt M.E., Siebach K.L., Stack-Morgan K., Sumner D.Y., Wiens R.C. Redox stratification of an ancient lake in Gale crater, Mars // Sci. 2017. V. 356. Iss. 6341. eaah6849. [Электронный ресурс]. https://science.sciencemag.org/content/ 356/6341/eaah6849)
Hutchinson G.E. A contribution to limnology of arid regions // Trans. Connecticut Acad. Arts Sci. 1937. V. 33. P. 47−132.
Krasnova E.D., Kharcheva A.V., Milyutina I.A., Voronov D.A., Patsaeva S.V. Study of microbial communities in redox zone of meromictic lakes isolated from the White Sea using spectral and molecular methods // J. Mar. Biol. Ass. 2015. V. 95. № 8. P. 1579–1590.
Krasnova E., Matorin D., Belevich T., Efimova L., Kharcheva A., Kokryatskaya N., Losyuk G., Todorenko D., Voronov D., Patsaeva S. The characteristic pattern of multiple colored layers in coastal stratified lakes in the process of separation from the White Sea // Chin. J. Ocean. Limn. 2018. V. 6. P. 1–16.
Lewis W.M., Jr. A reviesed classifiction of lakes Based on Mixing // Can. J. Fish. Aquat. Sci. 1983. V. 40. P. 1779−1787.
Losyuk G., Kokryatskaya N., Krasnova E. Formation of hydrogen sulfide in isolated basins at the Karelian of the White Sea coast // EARSeL eProc. 2015. V. 14. P. 49–54.
Savvichev A.S., Babenko V.V., Lunina O.N., Letarova M.A., Boldyreva D.I., Veslopolova E.F., Demidenko N.A., Kokryatskaya N.M., Krasnova E.D., Gaisin V.A., Kostryukova E.S., Gorlenko V.M., Letarov A.V. Sharp water column stratification with an extremely dense microbial population in a small meromictic lake, Trekhtzvetnoe // Environ. Microbiol. 2018. V. 20. № 10. P. 3784−3797.
Stepanenko V.M., Repina I A., Artamonov A.Yu., Gorin S.L., Lykossov V.N., Kulyamin D.V. Mid-depth temperature maximum in an estuarine lake // Environ. Res. Lett. 2018. V. 13. № 3. P. 035006. [Электронный ресурс]. https://iopscience.iop.org/article/10.1088/1748-9326/ aaad75/meta)
Stewart K.M., Walker K.F., Likens G.E. Meromictic lakes // Encyclopedia of inland waters. Oxford: Acad Press, 2009. P. 589–602.
Strelkov P., Shunatova N., Fokin M., Usov N., Fedyuk M., Malavenda S., Lubina O., Poloskin A., Korsun S. Marine Lake Mogilnoe (Kildin Island, the Barents Sea): one hundred years of solitude // Polar Biol. 2014. V. 37. P. 297–310.
Strelkov P., Stogov I., Krasnova E., Movchan E., Polyakova N., Goldin S., Ivanov M., Ivanova T., Malavenda S., Fedyuk M., Shunatova N. Rapid unpredicted changes in the stratification of marine lake Mogilnoe (Kildin island, the Barents Sea) through the early 21st century // Polar Res. 2019. V. 38. № 6. P. 3394–3394.
Walker K.F., Likens G.E. Meromixis and recognized typology of the lake circulation patterns // Verh. Internat. Verein. Limnol. 1975. V. 19. P. 442–458.
Zhivotovsky L.A., Teterina A.A., Mukhina N.V., Stroganov A.N., Rubtsova G.A., Afanasiev K.I. Effects of genetic drift in a small population of Atlantic cod (Gadus morhua kildinensis Derjugin) landlocked in a meromictic lake: genetic variation and conservation measures // Conserv. Genet. 2016. V. 17. P. 229–238.
Дополнительные материалы отсутствуют.


