Водные ресурсы, 2021, T. 48, № 4, стр. 439-450
Гидрохимия Ивано-Арахлейских озер в разные климатические фазы
С. В. Борзенко a, *, И. А. Фёдоров a, И. А. Комогорцева a
a Институт природных ресурсов, экологии и криологии СО РАН
672014 Чита, Россия
* E-mail: svb_64@mail.ru
Поступила в редакцию 02.09.2019
После доработки 12.01.2021
Принята к публикации 21.01.2021
Аннотация
Получены результаты гидрогеохимических исследований Ивано-Арахлейских озер в разные климатические фазы увлажнения территории. Выявлены три группы водоемов – ультрапресные, пресные и солоноватые. Показано, что озерные воды различаются не только минерализацией, но также химическим составом и значением рН. Установлено, что наименее минерализованные воды представлены типом HCO3−Ca, который с ростом солености и рН вод меняется на HCO3−Mg, далее – на HCO3−Na и на последнем этапе – на SO4−Na. Обнаружено, что изменению подвержены в большей степени малые солоноватые и в меньшей степени – более крупные ультрапресные озера. Выделены основные процессы, контролирующие гидрогеохимическое разнообразие озер, среди которых – взаимодействия воды с алюмосиликатной породой, сульфатредукция, окисление сульфидов, а также испарительное концентрирование.
Многочисленными исследованиями озер Центральной части России, Западной Сибири, Прибайкалья и Забайкалья показано, что озерные системы имеют зональную и региональную специфику условий формирования их геохимических параметров [6, 10, 11, 17, 18, 28, 35]. Уникальные географические характеристики этих озер определяют одновременное наличие их высокой экологической ценности и высокой степени уязвимости, особенно в засушливых районах [33]. В результате озера становятся чувствительными индикаторами глобальных изменений, оказывая влияние на жизнь человека. В этом плане не стали исключением и озера Ивано-Арахлейской системы [26]. В последние десятилетия они испытывают большую антропогенную нагрузку, так как активно используются в рекреационных целях [12, 16]. Между тем все озера заселены рыбой и используются в рыбохозяйственном отношении [23], поэтому определение диапазонов и темпов изменения гидрохимических показателей озер имеет важное научное и практическое значение, поскольку при изменении физико-химических показателей среды меняется биологическая составляющая водоемов, состав биогеоценозов и, как следствие, кормовая база ихтиофауны. Кроме того, меняется химический и минералогический состав донных осадков – высокоинформативный материал для палеоклиматических реконструкций [22]. Приведенным перечнем не исчерпываются научные и прикладные проблемы, связанные с динамикой функционирования озер.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
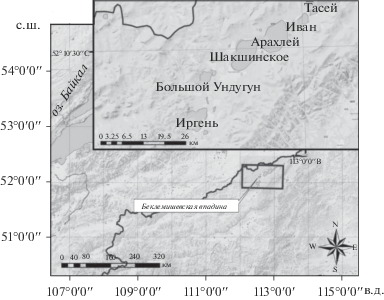
Ивано-Арахлейские озера (рис. 1) локализованы в Беклемишевской тектонической впадине, расположенной между Яблоновым хребтом, который обрамляет ее с ЮВ, и Осиновым хребтом – отрогом хребта Цаган-Хуртей – с СЗ. Впадина протяженностью >100 км представляет собой слабо всхолмленную равнинную местность с абсолютными отметками 950–980 м. Днище впадины сложено осадочными отложениями позднемезозойского и кайнозойского возраста. Ее горное обрамление выполняют магматические и метаморфические породы протерозоя и палеозоя. Большинство водотоков, питающих озера, представлено ручьями, протяженность которых ≤25 км. Озерно-речная система Беклемишевской впадины относится к бассейнам рек Селенги и Лены. Местный водораздел в Беклемишевской впадине проходит между озерами Иван и Арахлей. В ландшафтах преобладают луговые равнины, лесостепи, переходящие вверх по склонам в тайгу.
Климат района исследований умеренно влажный. Количество годовых осадков составляет 350–380 мм, при этом на теплый период приходится большая их часть (280–320 мм). Среднегодовая температура воздуха равна –3.2°С.
В настоящей статье приведены результаты гидрохимических исследований на озерах Ивано-Арахлейской лимнической системы, выполненных с разрывом более чем 20 лет в разные фазы климатического увлажнения территории. Результаты за 1993 г. характеризуют гидрохимический режим озер в фазу нарастания увлажненности. Начало ее приходится на 1982 г. Данные за 2004 и 2012 гг. относятся к фазе аридизации климатических условий, наступившей в 1999 г. [20].
По классификации П.В. Иванова [14], Ивано-Арахлейские озера делятся на средние с площадью поверхности 10.1–100.0 км2 (Арахлей, Шакшинское, Иргень, Иван, Тасей, Большой Ундугун) и очень малые – 0.1–1.0 км2 (Малый Ундугун, Дедулина, Олозойка, Большое Гужирное, Малое Гужирное, Большой Хутэл-Нур, Малый Хутэл-Нур, Сиротинка, Кергенду). Большинство водоемов мелководны (1–5 м), за исключением оз. Арахлей, средняя глубина которого составляет 13.1 м.
Различие морфометрических характеристик обусловливает разный объем воды в озерах, меняющийся от года к году и в течение года из-за изменения общей увлажненности территории и водности самих озер. Во влажные периоды происходит увеличение акваторий озер и разбавление воды, а в засушливые – у многих озер сокращается водная поверхность, происходит концентрирование воды.
Пробы воды для химического анализа отбирались в центральной части озер на глубине 0.3 м, а в наиболее глубоких озерах (Арахлей, Шакшинское, Иргень) – на расстоянии 1 м от зеркала воды до донных отложений. Вода фильтровалась на месте через мембранный фильтр с диаметром пор 0.45 мкм, для определения растворенной фракции металлов вода подкислялась особо чистой концентрированной азотной кислотой. Химический анализ водных проб выполнен по общепринятым методикам. Концентрации кальция Ca и магния Mg определялись методом атомно-абсорбционной спектрометрии в закисно-ацетиленовом пламени на спектрофотометре “SOLAAR 6M”. Для определения концентрации натрия Na и калия K использован метод пламенно-эмиссионной спектрометрии. Потенциометрически с применением ионселективных электродов находились pH, Eh воды, концентрация хлорид-ионов Cl–. Титрование применялось для определения содержания производных угольной кислоты – СО2, ${\text{CO}}_{3}^{ - },$ ${\text{HCO}}_{3}^{ - }.$ Металлы (Fe, Mn, Cu, Pb, Co, Ni и др.) анализировались атомно-абсорбционным методом на “SOLLAR 6М” c электротермическим атомизатором “Zeeman/3030”. Концентрации биогенных элементов – общего фосфора Робщ и кремния Si – определялись колориметрическими методами [19]. Измерение концентрации нитрат-иона ${\text{NO}}_{3}^{ - }$ и нитрит-иона ${\text{NO}}_{2}^{ - }$ выполнены потенциометрическим и колориметрическим методами соответственно [19]. Содержание сульфат-иона ${\text{SO}}_{4}^{{2 - }}$ определялось турбидиметрическим методом. Формы восстановленной серы (сульфидной S2–, элементной S0 и тиосульфатной S0S4+) – по методике, опубликованной в [2].
Погрешности методов измерений концентраций компонентов соответствовали требованиям ГОСТ 27 384-2002 [9].
Донные осадки отбирались дночерпателем Петерсена в центральной части озер. Рентгенофазовый и ренгеноструктурный анализ применялся для исследования пелитовой фракции донных отложений на аппарате ДРОН-3. Термодинамические расчеты равновесия воды с горной породой проведены с использованием программы “Geochemist’s Workbench (GWB 14)” [29]. При насыщении вод относительно какого-либо минерала индекс SI > 0, значения SI < 0 свидетельствуют о неравновесности системы вода – вторичный минерал, в случае SI = 0 достигается равновесие воды с определенным минералом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
По величине минерализации [1] озера Ивано-Арахлейской системы делятся на ультрапресные, пресные и солоноватые типы. К ультрапресным относятся крупные озера Арахлей и Шакшинское, Иван, Тасей, Иргень, Большой Ундугун и несколько малых – Большой Хутел-Нур, Малый Хутел-Нур, Малый Ундугун, Сиротинка (табл. 1).
Таблица 1.
Основные морфологические и физико-химические параметры озер Беклемишевской впадины (F – площадь озера, V – объем воды в озере, здесь и в табл. 2–4 М – минерализация воды, ПО – перманганатная окисляемость, ГВ – гумусовое вещество, прочерк – данные отсутствуют)
| Параметры | оз. Большой Ундугун |
оз. Малый Хутел Нур |
оз. Малый Ундугун |
оз. Иргень | оз. Шакшинское | оз. Тасей | оз. Иван | оз. Большой Хутел-Нур |
оз. Сиротинка | оз. Арахлей | оз. Ульзутуй | оз. Олозойка | оз. Дедулина | оз. Малое Гужирное |
оз. Большое Гужирное |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ультрапресные | пресные | солоноватые | |||||||||||||
| F, км2 | 11.6 | 0.9 | 11.6 | 33.2 | 51.8 | 14.5 | 15.2 | 0.2 | 2.0 | 59.0 | 0.5 | 0.2 | 0.1 | 0.1 | 0.4 |
| V, 103 км3 | 26.0 | 0.90 | 26.0 | 60.0 | 230.0 | 45.0 | 50.0 | 0.20 | 0.5 | 600.0 | 0.6 | 0.2 | 0.1 | 0.1 | 0.2 |
| pH | 7.47 | 7.59 | 8.03 | 8.11 | 8.28 | 8.38 | 8.16 | 8.24 | 8.25 | 8.10 | 8.52 | 8.65 | 9.40 | 8.73 | 8.59 |
| ПО, мгО/дм3 | 21.3 | 8.20 | 11.9 | 8.04 | 10.5 | 18.84 | 12.6 | 10.5 | 4.82 | 12.7 | 11.7 | 20.9 | 34.3 | 21.3 | 35.5 |
| мг/дм3: | |||||||||||||||
| М | 89.5 | 92.7 | 113.7 | 120.8 | 122.9 | 136.9 | 144.2 | 144.6 | 149.3 | 163.6 | 310.9 | 321.2 | 950.7 | 1200 | 4718 |
| ${\text{СО}}_{3}^{{2 - }}$ | 0.6 | <0.3 | 0.9 | <0.3 | <0.3 | <0.3 | <0.3 | <0.3 | 7.8 | <0.3 | 2.8 | 4.0 | 114.0 | 15.4 | 39.0 |
| СО2 | – | – | – | 1.5 | 15.0 | 4.4 | 2.7 | – | – | 4.3 | <0.4 | <0.4 | <0.4 | <0.4 | <0.4 |
| ${\text{HCO}}_{3}^{ - }$ | 45.6 | 38.3 | 75.9 | 68.0 | 74.3 | 79.4 | 78.9 | 77.1 | 94.5 | 119.0 | 185.4 | 195.5 | 317.0 | 622.0 | 421.0 |
| ${\text{SO}}_{4}^{{2 - }}$ | 18.8 | 27.6 | 0.50 | 19.1 | 2.80 | 20.0 | 25.2 | 18.1 | 1.50 | 1.14 | 11.8 | 14.3 | 216.2 | 243.8 | 4350.0 |
| Cl– | 0.7 | 2.6 | 5.1 | 1.1 | 5.2 | 2.3 | 3.2 | 7.6 | 5.6 | 5.1 | 11.2 | 14.1 | 6.3 | 11.2 | 631.0 |
| F– | 0.3 | 0.3 | 0.4 | 0.3 | 0.5 | 0.3 | 0.3 | 0.4 | 0.45 | 0.4 | 1.2 | 1.4 | 0.67 | 2.4 | 2.12 |
| Ca2+ | 13.3 | 9.9 | 16.0 | 17.7 | 15.2 | 19.3 | 19.6 | 19.9 | 18.1 | 9.9 | 25.7 | 21.4 | 17.1 | 60.9 | 81.9 |
| Mg2+ | 4.2 | 5.2 | 6.0 | 5.5 | 6.0 | 5.0 | 6.6 | 7.6 | 10.2 | 9.5 | 15.7 | 16.9 | 14.6 | 25.6 | 107.6 |
| Na+ | 4.0 | 7.2 | 7.5 | 5.3 | 9.2 | 8.6 | 7.6 | 8.4 | 9.7 | 17.1 | 42.9 | 42.5 | 264.2 | 224.6 | 1228 |
| K+ | 1.1 | 1.6 | 2.4 | 1.8 | 2.4 | 1.9 | 2.8 | 3.4 | 2.5 | 1.2 | 6.6 | 12.9 | 0.6 | 9.1 | 30.3 |
| Si | 1.40 | 1.00 | 0.93 | 1.01 | 3.85 | 1.34 | 3.05 | 2.88 | 3.32 | 0.80 | 1.00 | 7.40 | 1.70 | 3.03 | 0.62 |
| Sr | 0.01 | 0.28 | 0.03 | 0.01 | 0.05 | 0.08 | 0.05 | 0.16 | 0.06 | – | 0.18 | 0.90 | 0.01 | 0.01 | 0.37 |
| ${\text{NO}}_{3}^{ - }$ | 2.77 | – | 2.47 | 3.30 | 2.47 | 2.91 | 2.56 | 3.33 | 2.77 | 0.67 | 2.64 | 2.77 | 3.11 | 3.57 | 1.13 |
| ${\text{NO}}_{2}^{ - }$ | 0.03 | 0.02 | 0.03 | 0.01 | 0.02 | 0.03 | 0.04 | 0.02 | 0.01 | 0.01 | 0.03 | 0.03 | 0.03 | 0.02 | 0.03 |
| ${\text{NH}}_{4}^{ + }$ | 0.01 | 0.28 | 0.03 | 0.01 | 0.05 | 0.08 | 0.05 | 0.16 | 0.06 | 0.05 | 0.18 | 0.90 | 0.01 | 0.01 | 0.37 |
| Pобщ | 0.07 | – | 0.05 | 0.07 | 0.07 | 0.05 | 0.06 | 0.06 | 0.05 | 0.12 | 0.05 | 0.10 | 0.16 | 0.09 | 0.14 |
| ГВ | 3.35 | – | 2.07 | 2.82 | 1.93 | 2.55 | 2.96 | 4.38 | 9.92 | 2.13 | 2.10 | 12.76 | 7.70 | 11.49 | 8.17 |
| мкг/дм3: | |||||||||||||||
| S2– | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | <5 | 278.5 |
| S0 | 1220 | <5 | 660 | 150 | 170 | 210 | 1450 | 560 | 270 | 310 | 590 | 160 | 630 | 1140 | 149 |
| S0S4+ | 170 | <5 | 330 | 350 | 20 | 180 | 30 | 1240 | 470 | 590 | 260 | 360 | 110 | 30 | 20.9 |
| Mn | 21.9 | 58.3 | 28.5 | 32.2 | 28.6 | 46.3 | 32.4 | 44.8 | 16.0 | 7.53 | 45.1 | 62.2 | 18.2 | 6.7 | 17.3 |
| Fe | 198.3 | 340.0 | 222.8 | 218.9 | 118.4 | 226.2 | 112.1 | 113.1 | 74.0 | 49.0 | 83.3 | 136.6 | 67.8 | 70.4 | 99.7 |
| Zn | 36.6 | 28.5 | 14.7 | 15.9 | 16.2 | 9.60 | 16.0 | 5.95 | 0.02 | 9.34 | 13.9 | 13.8 | 5.3 | 0.0 | 0.02 |
| Cu | 25.3 | 21.3 | 34.4 | 14.4 | 20.3 | 31.2 | 40.6 | 17.7 | 12.9 | 3.50 | 25.6 | 25.3 | 32.1 | 17.0 | 30.2 |
| Pb | 5.08 | 7.50 | 3.15 | 6.02 | 0.20 | 3.70 | 3.70 | 3.28 | 5.21 | 2.06 | 1.73 | 3.65 | 3.30 | 9.00 | 2.50 |
| Ni | 5.18 | 7.30 | 5.75 | 4.58 | 3.07 | 5.75 | 6.05 | 0.70 | 3.95 | 1.87 | 5.70 | 5.12 | 5.55 | 6.10 | 9.20 |
| Cd | 0.39 | – | 0.70 | 1.23 | 9.25 | 2.58 | 0.20 | 2.24 | 8.60 | 1.34 | 2.53 | 0.52 | 0.35 | – | – |
| Co | 2.25 | 3.20 | 5.90 | 2.87 | 2.40 | 5.35 | 5.40 | 2.80 | 0.52 | 5.26 | 2.98 | 1.51 | 5.75 | 4.30 | 5.70 |
| Al | 73.4 | 69.8 | 70.9 | 41.6 | 64.4 | 40.4 | 24.1 | 50.7 | 46.7 | 31.3 | 68.6 | 39.2 | 58.2 | 6.72 | 3.11 |
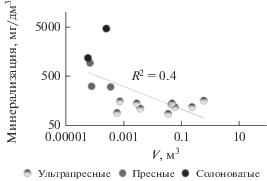
Подавляющая часть (67%) озер относится к ультрапресным водоемам. В целом по всей выборке имеется связь между минерализацией и объемом воды в озере. Для озер c объемом водной массы от 0.0001 до 0.001 км3 минерализация изменяется от 100 до 1000 мг/дм3, а при меньших объемах она может достигать ≥5000 мг/дм3 (риc. 2).
Минерализация воды ультрапресных озер меняется от 89.5 до 163.6 мг/дм3 (среднее 127.8 мг/дм3) с минимумом для оз. Большой Ундугун и максимумом для оз. Арахлей. Значение рН варьирует от 7.5 до 8.4 со средним значением 8.1. В химическом составе среди анионов преобладает ${\text{HCO}}_{3}^{ - },$ а среди катионов – Ca2+, химический состав – HCO3–Сa–Mg (по классификации Щукарева [21]). При достижении минерализации величины 163.0 мг/дм3 доминирующим становится Mg2+, химический состав меняется на HCO3–Mg–Na–Сa. Одновременно растет рН вод. Повышенными концентрациями тяжелых металлов выделяются озера Малый Хутел-Нур (Mn, Fe, Pb, Ni), Большой Ундугун (Zn), Малый Ундугун (Co), Иван (Сu) и Шакшинское (Cd), но при этом их содержания не превышают ПДК [7, 8].
В гидрохимическом режиме водоемов биогенные элементы, как и макро- и микрокомпоненты, – важнейшие элементы, определяющие среду обитания гидробионтов. Присутствие азота связано в основном с разложением фитопланктона и с процессом нитрификации – окислением восстановленных форм азота (аммонийного через нитритный). Фосфор также входит в состав планктонной органики, а его высокое содержание ведет к эвтрофикации водоема, поэтому он, как и многие другие компоненты, относится к лимитирующим элементам. По содержанию биогенных элементов выделяются оз. Арахлей с наиболее высоким содержанием Робщ (0.12 мг/дм3) и оз. Большой Хутел Нур – Nобщ (0.88 мг/дм3), при этом в последнем доминируют формы – ${\text{NO}}_{3}^{ - }$ и ${\text{NH}}_{4}^{ + }.$ В рассматриваемой группе озер не выявлено превышения концентраций биогенных элементов относительно установленных нормативных концентраций.
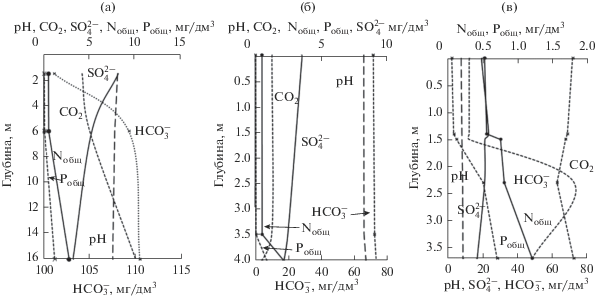
В толще воды различие содержаний макрокомпонентов хорошо прослеживается по наиболее глубоким озерам – Арахлей, Иргень и Тасей. Чаще в глубоководной зоне меняется значение рН, минерализация и содержание CО2, ${\text{HCO}}_{3}^{ - },$ ${\text{SO}}_{4}^{{2 - }},$ при этом с глубиной накапливается ${\text{HCO}}_{3}^{ - },$ а концентрация ${\text{SO}}_{4}^{{2 - }},$ напротив, снижается (рис. 3). Вертикальная изменчивость характерна также для Nобщ и Робщ, количество которых увеличивается от зеркала воды ко дну водоема.
Сезонные изменения основных гидрогеохимических показателей отчетливо проявляются по оз. Арахлей (табл. 2). Относительно высокая минерализация воды отмечается в апреле. В этот период накапливаются ${\text{HCO}}_{3}^{ - },$ Сl–, Na+, Mg2+; напротив, содержание Ca2+, К+, ${\text{SO}}_{4}^{{2 - }}$ и СО2 снижается. С июня по август происходит постепенное снижение минерализации, что обусловлено разбавлением вод менее минерализованными атмосферными осадками и поступающим в озера поверхностным стоком. Во внутригодовых колебаниях содержаний Робщ и различных форм азота отмечается их постепенное увеличение к концу лета и уменьшение в период ледостава.
Таблица 2.
Усредненные рН воды, минерализация, содержание основных компонентов оз. Арахлей в разные месяцы его опробования
| Месяц | pH | СО2 | ${\text{HCO}}_{3}^{ - }$ | ${\text{SO}}_{4}^{2}$ | Cl– | Ca2+ | Mg2+ | Na+ | K + | М | ${\text{NO}}_{3}^{ - }$ | $\begin{array}{*{20}{c}} {{\text{NO}}_{2}^{ - }} \end{array}$ | ${\text{NH}}_{4}^{ + }$ | Poбщ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| мг/дм3 | ||||||||||||||
| Февраль | 8.1 | 2.2 | 104.1 | 1.3 | 3.1 | 13.1 | 6.8 | 10.3 | 1.9 | 143.6 | 0.48 | <0.01 | 0.01 | 0.06 |
| Апрель | 7.8 | 0.8 | 133.0 | 1.2 | 3.7 | 10.8 | 9.4 | 14.8 | 1.3 | 177.0 | 0.50 | <0.01 | 0.01 | 0.08 |
| Июнь | 8.2 | 8.8 | 104.9 | 8.2 | 3.37 | 18.0 | 6.6 | 11.4 | 2.3 | 168.2 | 0.71 | <0.01 | 0.02 | 0.08 |
| Июль | 8.1 | 4.2 | 107.8 | 4.3 | 1.8 | 20.1 | 5.9 | 10.8 | 2.7 | 154.0 | 0.82 | 0.01 | 0.04 | 0.12 |
| Август | 7.5 | 6.7 | 105.2 | 4.3 | 1.41 | 20.2 | 6.2 | 9.9 | 2.5 | 153.3 | 0.88 | 0.02 | 0.06 | 0.15 |
В разные климатические фазы наиболее значительные изменения характерны для ультрапресных озер Большой Хутэл Нур, Иргень и Иван, минерализация которых в засушливый период увеличилась в среднем на 72.8, 42.3 и 31.2 мг/дм3 соответственно. В меньшей степени изменения затронули оз. Тасей, минерализация воды которого выросла всего на 5.7 мг/дм3 (табл. 3).
Таблица 3.
рН, минерализация и содержание основных компонентов (мг/дм3) вод ультрапресных озер в разные годы опробования (озера: 1 – Арахлей, 2 – Иргень, 3 – Шакшинское, 4 – Иван, 5 – Тасей, 6 – Большой Хутел-Нур)
| № | Годы | Химический тип воды | рН | М | СО2 | ${\text{СО}}_{3}^{{2 - }}$ | $\begin{array}{*{20}{l}} {{\text{HCO}}_{3}^{ - }} \end{array}$ | ${\text{SO}}_{4}^{{2 - }}$ | Cl– | Ca2+ | Mg2+ | Na+ | K+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1993 | НСO3–Ca–Mg | 8.6 | 150.1 | <0.4 | 5.3 | 98.0 | 4.4 | 1.9 | 19.1 | 6.2 | 7.9 | 2.9 |
| 2011 | НСO3–Ca–Na–Mg | 8.2 | 159.8 | 4.4 | <0.3 | 116.4 | 1.4 | 3.1 | 15.8 | 6.8 | 15.3 | 1.9 | |
| 2 | 1993 | НСO3–SO4–Ca–Mg | 8.0 | 120.8 | 1.1 | <0.3 | 68.0 | 19.1 | 1.1 | 17.7 | 5.5 | 5.3 | 1.9 |
| 2012 | НСO3–Ca–Na–Mg | 7.6 | 163.13 | 2.6 | <0.3 | 111.0 | 10.3 | 4.5 | 20 | 7.4 | 14.5 | 2.2 | |
| 3 | 1993 | НСO3–SO4–Ca–Mg–Na | 8.3 | 127.3 | 2.4 | <0.3 | 72.3 | 21.1 | 1.1 | 17.3 | 4.9 | 8.1 | 1.9 |
| 2012 | НСO3–Ca–Mg–Na | 7.5 | 156.1 | 5.9 | <0.3 | 105.0 | 3.9 | 3.9 | 18.4 | 6.5 | 9.8 | 2.0 | |
| 4 | 1993 | НСO3–SO4–Ca–Mg | 8.2 | 144.2 | <0.4 | <0.3 | 78.9 | 25.2 | 3.2 | 19.6 | 6.6 | 7.5 | 2.8 |
| 2012 | НСO3–Ca–Na–Mg | 8.1 | 175.37 | 0.9 | <0.3 | 126.0 | 1.5 | 7.1 | 19.6 | 7.0 | 18.4 | 3.4 | |
| 5 | 1993 | НСO3–Ca–Mg–Na | 8.2 | 128.9 | <0.4 | <0.3 | 79.4 | 12.0 | 2.3 | 19.3 | 5.0 | 8.6 | 1.9 |
| 2012 | НСO3–Ca–Na–Mg | 7.2 | 134.6 | 4.4 | <0.3 | 85.4 | 7.2 | 4.0 | 15.2 | 6.5 | 13.0 | 2.9 | |
| 6 | 1993 | НСO3–SO4–Ca–Mg | 7.4 | 131.4 | 4.2 | <0.3 | 49.8 | 49.0 | 0.4 | 49.8 | 29.4 | 17.1 | 3.7 |
| 2004 | НСO3–Ca–Mg | 8.1 | 204.2 | 0.5 | <0.3 | 73.4 | 9.1 | 15.9 | 46.3 | 31.1 | 17.9 | 4.6 |
В целом в этой группе озер за рассматриваемый период минерализация воды увеличилась в среднем на 31.8 мг/дм3. Увеличение минерализации произошло за счет накопления ${\text{HCO}}_{3}^{ - }$ и Cl– среди анионов, Mg2+, Na+ и К+ среди катионов. В то же время содержания ${\text{SO}}_{4}^{{2 - }}$ и Ca2+ снизились. В остальных водоемах, за исключением оз. Хутэл-Нур, увеличилось содержание CO2 и снизилось рН. Изменение в химическом составе привело к смене химического типа вод.
Если в многоводный период в озерах Иргень, Шакшинском, Иван и Большой Хутэл-Нур анионный состав воды представлен ${\text{HCO}}_{3}^{ - }$ и ${\text{SO}}_{4}^{{2 - }}$, то в период снижения водности озер – исключительно ${\text{HCO}}_{3}^{ - }$. Катионный состав чаще смешанный, при этом зачастую рост Na+ опережает рост Mg2+. Среди биогенных элементов в засушливый период отмечается увеличение содержания Nобщ и Робщ [12, 16].
Пресные озера Олозойка, Ульзутуй представлены химическим типом HCO3–Na–Mg–Сa, меняющимся с ростом солености вод в оз. Дедулина на HCO3–SO4–Na. Минерализация в этой группе озер варьирует от 310.9 до 950.7 мг/дм3, среднее 471.1 мг/дм3 (табл. 1). Отсутствие данных по распределению основных физико-химических параметров на разных глубинах озер и в разные сезоны года не позволяет провести сравнительный анализ. Межгодовые изменения гидрохимических параметров наиболее выражены для оз. Дедулина (табл. 4), минерализация воды которого к засушливому периоду выросла на 363 мг/дм3, одновременно увеличились концентрации ${\text{SO}}_{4}^{{2 - }}$, Cl– и Na+, K+, но снизились содержания ${\text{СО}}_{3}^{{2 - }},$ ${\text{HCO}}_{3}^{ - },$ Ca2+ и Mg2+ и значения рН.
Таблица 4.
рН, минерализация, содержание основных компонентов (мг/дм3) вод пресных и солоноватых озер в разные годы опробования (озера: 1 – Ульзутуй, 2 – Олозойка, 3 – Дедулина, 4 – Большое Гужирное)
| № | Годы | Химический тип воды | рН | М | СО2 | ${\text{СО}}_{3}^{{2 - }}$ | ${\text{HCO}}_{3}^{ - }$ | ${\text{SO}}_{4}^{{2 - }}$ | Cl– | Ca2+ | Mg2+ | Na+ | K+ |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 1993 | НСO3–SO4–Ca–Mg–Na | 8.0 | 294.4 | <0.4 | 10.4 | 174.6 | 39.2 | 4.46 | 34.0 | 10.0 | 26.7 | 4.9 |
| 2004 | НСO3–Na–Mg–Ca | 8.0 | 310.9 | <0.4 | <0.3 | 185.4 | 11.8 | 11.2 | 25.7 | 15.7 | 32.9 | 6.6 | |
| 2 | 1993 | НСO3–SO4–Ca–Mg–Na | 8.2 | 361.6 | <0.4 | 12.2 | 205.6 | 55.7 | 6.16 | 45.2 | 13.7 | 26.1 | 8.1 |
| 2004 | НСO3–Na–Mg–Ca | 8.1 | 321.2 | <0.4 | <0.3 | 185.4 | 14.3 | 14.1 | 21.4 | 16.8 | 32.5 | 12.9 | |
| 3 | 1993 | НСO3–Na | 9.4 | 587.8 | <0.4 | 114.0 | 338.4 | 17.4 | 10.7 | 15.7 | 13.4 | 138.1 | 1.3 |
| 2012 | SO4–Cl–НСO3–Na | 8.7 | 950.7 | <0.4 | 45.9 | 317.0 | 317 | 216.2 | 7.1 | 4.6 | 264.2 | 2.6 | |
| 4 | 1993 | НСO3–SO4–Mg–Na–Ca | 9.3 | 1501 | <0.4 | 39.0 | 572.7 | 367.1 | 147.8 | 87.5 | 102.8 | 183.1 | 28.4 |
| 2012 | SO4–Na | 8.6 | 7936 | <0.4 | 8.8 | 421.0 | 4350 | 631.3 | 76.2 | 112.4 | 2272 | 32.2 |
Близкая ситуация складывается и для остальных озер этой группы. Однако в оз. Олозойка снижение концентрации ${\text{SO}}_{4}^{2}$ привело к понижению минерализации в засушливый период. В этой группе озер минерализация в засушливый период по сравнению с многоводным периодом увеличилась в среднем на 113.0 мг/дм3. Рост минерализации в озерах произошел вследствие накопления всех макрокомпонентов, за исключением ${\text{SO}}_{4}^{{2 - }}$.
Солоноватые озера Малое Гужирное и Большое Гужирное – наиболее минерализованные (1200–7936 мг/дм3, среднее 3545 мг/дм3) и щелочные (рН 8.1–8.3, среднее 8.2). Они представлены разными типами вод, в первом случае – HCO3– SO4–Na–Mg; во втором в период “большой воды” – HCO3–SO4–Mg–Na, а в период “малой” – SO4–Na. В оз. Большом Гужирном соленость воды выросла за 26 лет на 6435 мг/дм3. Увеличение минерализации произошло преимущественно за счет накопления ${\text{SO}}_{4}^{{2 - }}$, Cl– и Na+, в то время как содержания ${\text{HCO}}_{3}^{ - }$, Ca2+, Mg2+ существенно снизились.
Содержание биогенных элементов, в частности Nобщ и Робщ, в последних двух группах озер меняется в диапазоне от 0.55 до 1.33 и от 0.05 до 0.16 мг/дм3 соответственно. Относительно высокие их содержания определены в озерах Олозойка и Дедулина, а низкие – в озерах Ульзутуй и Большое Гужирное. В первом для ${\text{NH}}_{4}^{ + }$ установлено почти двукратное превышение относительно ПДК [7, 8]. Отсутствие населенных пунктов на водосборной площади этого водоема исключает возможность отнести этот факт к антропогенному.
Анализ распределения макрокомпонентов показал, что в водах всех выделенных типов с ростом солености вод накапливаются все компоненты, с большей величиной достоверности аппроксимации – Сl–, Na+ и Mg2+ и с меньшей – ${\text{HCO}}_{3}^{ - },$ ${\text{SO}}_{4}^{{2 - }},$ Ca2+ и К+ (рис. 4).
В целом по всей выборке восстановленные формы азота концентрируются преимущественно в более глубоких ультрапресных озерах, а окисленная его форма – в более мелких пресных. Что касается Робщ, то как по средним (0.10 мг/дм3), так и по максимальным (0.16 мг/дм3) оценкам, солоноватые озера в большей степени обогащены этим элементом. В ультрапресных озерах в бóльших количествах накапливаются такие микроэлементы, как Si, Li, Fe, Zn, Pb, Cu, Cd, Mo, Al, Co; в солоноватых – Sr; пресные водоемы отличаются низким содержанием всех микроэлементов.
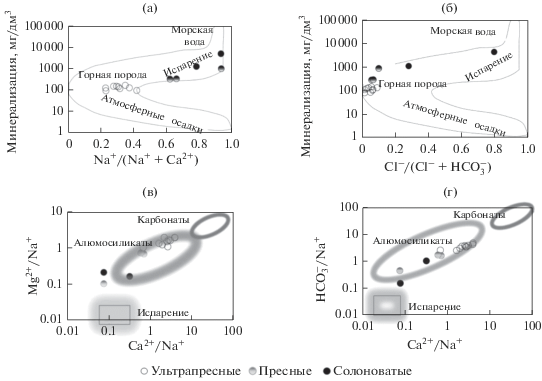
На формирование химических характеристик озерных вод большое влияние оказывают несколько процессов: гидролиз горных пород, испарительная концентрация солей, сопровождающаяся эвапоритовой седиментацией, а также сульфатредукция или, напротив, окисление сульфидов [31]. Модель Гиббса [34] широко используется при изучении гидрохимии поверхностных вод, она позволяет в первом приближении качественно оценить влияние двух первых процессов и выделить очевидные различия контролирующих факторов гидрохимических характеристик озер (рис. 5).
Получается, что для ультрапресных озер основной процесс, контролирующий содержание растворенных веществ, – гидролиз алюмосиликатных пород. Для пресных и солоноватых озер к гидролизу добавляется испарение, причем для последних испарение – доминирующий процесс.
Понятно, что для образования ${\text{НСО}}_{3}^{ - }$ требуется наряду с СО2, как показывает С.Л. Шварцев [27], ион ОН–, источником которого выступает вода, участвующая в реакциях гидролиза алюмосиликатов. Что касается ионов ${\text{SO}}_{4}^{{2 - }}$, то относительно низкие их содержания в озерах чаще объясняются эвапоритовой седиментацией сульфатных минералов (гипс, мирабилит, тенардит и др.) и процессом сульфатредукции [2, 3, 21]. Из-за низких концентраций ${\text{SO}}_{4}^{{2 - }}$ в рассматриваемых водоемах гипсовая стадия минерализации не достигается.
Между тем снижение концентрации ${\text{SO}}_{4}^{{2 - }}$ и рост ${\text{НСО}}_{3}^{ - }$ и СО2 как по глубине водоема, так и в межгодовом разрезе по большинству изученных озер свидетельствует о наличии в них процесса сульфатредукции, протекающего по схеме анаэробного распада [13], окислителем в котором выступает кислород в ${\text{SO}}_{4}^{{2 - }}$, а сам распад, судя по изменению содержания биогенных элементов, проходит в основном в результате деятельности сульфатредуцирующих микроорганизмов:
Поэтому наблюдается рост концентрации производных угольной кислоты, фосфора и восстановленных форм cеры и азота. Действительно, зачастую донные осадки рассматриваемых озер содержат сероводород и имеют черную окраску, которую придает им коллоидный моносульфид железа (гидротроилит), поэтому есть основания считать, что часть восстановленной серы фиксируется в осадках в виде сульфидных минералов. Схематичная оценка минерализации органического вещества дает общие представления о процессе сульфатредукции. В действительности этот процесс более сложный и протекает с образованием многочисленных промежуточных веществ. Авторами статьи определены в озерных водах различные формы восстановленной серы (табл. 1), содержание которых менялось в широких пределах: от отсутствия в водной толще наиболее восстановленной S2– до 1450 и 1240 мкг/л S0 и S0S4+ соответственно.
Сам факт присутствия S0 свидетельствует о наличии процессов окисления сероводорода в водной толще озер. Относительно высокие ее содержания определены в водоемах c повышенной перманганатной окисляемостью (табл. 1). Такая связь указывает на сопряженность широкого спектра биогеохимических процессов, протекающих в озерах. Тиосульфатная сера – промежуточное соединение, образуется как при окислении сероводорода (и/или сульфидов), так и при бактериальном восстановлении ${\text{SO}}_{4}^{{2 - }}$. Xаотичное распределение содержания S0 и S0S4+ (табл. 1) указывает на возможность протекания в озерах разнонаправленных процессов [2].
Очевидно, что в процессе анаэробной минерализации органического вещества образуются различные формы биогенных элементов. При этом соотношения между окисленными и восстановленными формами биогенных элементов определяются множеством факторов: содержанием в воде растворенного кислорода, кинетическими параметрами каждой стадии процесса, наличием органического вещества и ${\text{SO}}_{4}^{{2 - }}$ [30]. Поэтому масштабы таких процессов и доли восстановленных форм биогенных элементов в озерах различны. В придонных слоях глубоководной зоны возможны потери окисленных форм биогенных элементов. Однако в кислородсодержащей толще воды и в литорали озер в динамичной волноприбойной полосе восстановленные соединения могут окисляться и снова поступать в озерный круговорот, в результате чего увеличиваются концентрации окисленных форм азота и серы.
При отсутствии восстановленных донных осадков и непосредственно в кислородсодержащей водной толще процесс минерализации органики происходит по схеме аэробного распада [13]:
Согласно общим представлениям [21, 23, 27], по мере испарения воды до садки гипса ${\text{SO}}_{4}^{{2 - }}$ и Cl– должны концентрироваться в водах приблизительно в равных эквивалентных пропорциях. Однако в солоноватых озерах Малое Гужирное и Большое Гужирное, а также в пресном оз. Дедулина по мере увеличения минерализации воды рост содержания ${\text{SO}}_{4}^{{2 - }}$ существенно опережает рост содержания Cl–. Такое положение свидетельствует о наличии дополнительного источника серы. В качестве такого источника могут выступать сульфиды вмещающих осадочных пород, окисление которых приводит к накоплению в этих озерах сульфатной серы.
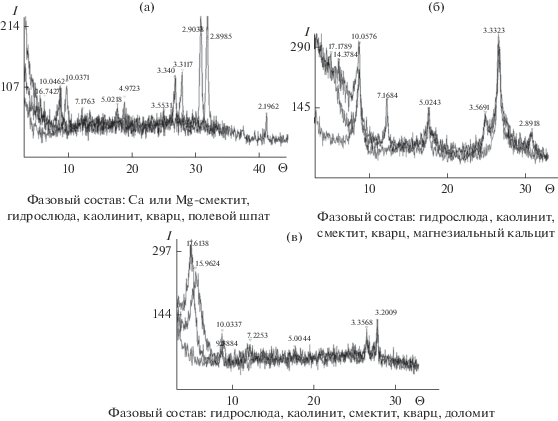
Следующий момент, требующий объяснения, – постепенная смена в катионном составе Ca2+ на Mg2+, а на последующей стадии осолонения – Mg2+ на Na+. Минеральный анализ донных осадков показал, что наряду с обломочным материалом (в основном полевой шпат и кварц) присутствуют Сa−Mg-смектиты и каолинит, а в более минерализованных водоемах к глинам прибавляются магнезиальные кальциты (рис. 6а, 6б), доля которых в общей массе осадков солоноватых озер существенно выше [4].
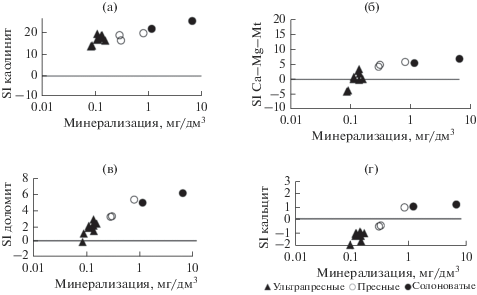
Согласно термодинамическим расчетам, которые выполнены с использованием программы “Geochemist’s Workbench”, все рассматриваемые озерные воды насыщены по отношению к каолиниту, а при минерализации >0.1 г/л достигается равновесие с Ca−Mg-cмектитами и доломитом (рис. 7). С кальцитом равновесны воды при ее минерализации >0.6 г/л. По мнению авторов [5, 32], среди Ca−Mg-карбонатов первыми осаждаются магнезиальные кальциты (содержащие <5% Mg-CO3) и Са-избыточные доломиты. В результате воды становятся более богатыми Mg за счет более полного удаления Ca в твердую фазу.
Рис. 7.
Зависимость минерализации от степени насыщения вод SI по каолиниту (а), Сa−Mg-смектиту (б), доломиту (в) и кальциту (г).
Следующий известный факт состоит в том, что выявлено особое сродство Ca, в отличие от Mg, с гумусовым веществом (ГВ) [15]. В исследуемых озерах содержание ГВ варьирует в широком диапазоне с максимумом в солоноватых и минимумом в ультрапресных водоемах (табл. 1). Для этих металлов характерна общая тенденция увеличения долей гуминового комплекса с ростом содержания ГВ, хотя для Mg она выражена слабее (Mg–ГВ ≤ 8 мол. %, Са–ГВ ≤ 14 мол. % [25]). В существенно больших количествах эти металлы связываются карбонатными ионами (Сa до 77 и Mg до 64 мол. %), доля которых увеличивается с увеличением рН и минерализации вод рассматриваемых озер.
Отсюда следует, что Ca и Mg по мере увеличения значений основных геохимических параметров среды выводятся в донные осадки в виде Ca–Mg-смектитов, Ca–Mg-карбонатов и Ca–Mg–ГВ. Аналогичный вывод можно сделать в отношении К, Si и Al, подвижность которых контролируется преимущественно глинами, поэтому их содержания остаются относительно низкими на всех диапазонах минерализации и рН вод.
Следующий момент, требующий объяснения, – относительно низкие концентрации металлов. В результате сульфатредукции в озерах появляется сероводород, который принципиально меняет характер геохимической среды – из окислительной в восстановительную – и приводит к изменению валентности многих микроэлементов (Fe, Mn, Cu, Co и т.д.), меняя их миграционную способность и, следовательно, способность к концентрированию и связыванию вторичными минералами. В конце концов и они в сероводородной обстановке достигают равновесия с отдельными минералами. Так, Fe связывается гидротроилитом, пиритом, сидеритом, Pb – галенитом, Cu – халькопиритом, Ni – миллеритом и т.д. С ростом содержания в водах карбонатов и сульфатов Sr и Ba связываются стронцианитом, целестином, витеритом и баритом соответственно. Что касается Na, то отсутствие геохимического барьера в виде вторичных минералов позволяет ему постепенно концентрироваться в ряду ультрапресные → пресные → солоноватые озера.
ЗАКЛЮЧЕНИЕ
Проведенные гидрохимические исследования озер Ивано-Арахлейской системы показали, что они различаются морфометрическими характеристиками, рН, минерализацией и химическим составом вод. Ультрапресные озера выделяются среди трех типов низкими минерализацией и рН вод, среди основных анионов превалирует ${\text{НCO}}_{3}^{ - }$, а среди катионов – Ca2+, с ростом солености и рН вод доминирующим становится Mg2+. Менее распространены пресные озера. Они более минерализованные и щелочные, чем предыдущий тип озер. Анионный состав их вод представлен чаще ${\text{НCO}}_{3}^{ - }$ и ${\text{SO}}_{4}^{{2 - }}$, а катионный – смешанным Ca–Mg–Na, меняющимся с ростом минерализации и рН вод на HCO3–Na–Mg–Ca, а при более высокой минерализации на SO4–Cl–НСО3–Na. Еще реже встречаются более щелочные солоноватые озера. Они имеют состав НСО3–SO4–Mg–Na–Са, который с ростом солености вод в “маловодный период” трансформируется в SO4–Na. Причина таких трансформаций – периодическое повышение или снижение объема воды в озерах из-за изменения климатических характеристик.
Меняются и содержания биогенных элементов как по глубине водоемов, так и в сезонном и межгодовом временных интервалах. При этом анаэробная деструкция органики сопровождается уменьшением рН, содержаний ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ и ростом концентраций CO2, ${\text{НCO}}_{3}^{ - }$, Pобщ, S2–, S0, S0S4+ и ${\text{NO}}_{2}^{ - }$, ${\text{NH}}_{4}^{ + }$. При кислородной деструкции накапливаются CO2, ${\text{НCO}}_{3}^{ - }$, Pобщ и ${\text{NO}}_{3}^{ - }$. Доминирование того или иного процесса минерализации органического вещества определяет содержание и направленность трансформации биогенных элементов, обусловливающих в свою очередь биологическую продуктивность водоемов.
Основной источник химических элементов – вмещающие алюмосиликатные породы, гидролиз которых наряду с испарительным концентрированием (преимущественно для солоноватых озер) способствует росту содержаний подвижных элементов. В то же время процесс формирования вторичных минералов ограничивает концентрирование в водах многих макро- и микроэлементов, а в сероводородной обстановке – многих поливалентных металлов. В этой связи трансформация химического состава воды – следствие изменения термодинамических равновесий и, как результат, это находит отражение в минеральном составе донных осадков, давая надежную основу для сравнительных оценок современной нестабильности климата в этом секторе Северо-Восточной Азии.
Список литературы
Алекин О.А. Основы гидрохимии. Л.: Гидрометеоиздат, 1970. 443 с.
Борзенко С.В. Основные особенности формирования химического состава вод минеральных озер Читино-Ингодинской впадины (Восточное Забайкалье) // Изв. РАН. Сер. географическая. 2014. № 4. С. 95–101.
Борзенко С.В. Основные условия формирования химического состава вод соленых и солоноватых озер Восточного Забайкалья // Геохимия. 2020. Т. 65. № 12. С. 1212–1230.
Борзенко С.В. Замана Л.В., Восстановленные формы серы в рапе содового озера Доронинское (Восточное Забайкалье) // Геохимия. 2011. Т. 49. № 3. С. 268–277.
Гаськова О.Л., Склярова О.А. Влияние природных органических кислот на отношение Mg/Са в донных осадках высокоминерализованных озер // Геология и геофизика. 2013. Т. 54. № 6. С. 829—840.
Гаськова О.Л., Страховенко В.Д., Овдина Е.А. Состав рассолов и минеральная зональность донных отложений содовых озер Кулундинской степи (Западная Сибирь) // Геология и геофизика. 2017. Т. 58. № 10. С. 1514–1527.
ГН 2.1.5.1315-03 Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. М.: Минздрав России, 2003. С изм. 3.07.2017. 154 с.
ГН 2.1.5.2280-07 Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2008. Дополнения и изменения № 1 к ГН 2.1.5.1315-03. 11 с.
ГОСТ 27 384-2002 Вода. Нормы погрешности измерений показателей состава и свойств. М.: Стандартинформ, 2010. 6 с.
Дину М.И. Геохимические особенности распределения элементов по формам существования в озерах европейской территории России и Западной Сибири // Геохимия. 2018. № 10. С. 988–997.
Замана Л.В., Борзенко С.В. Гидрохимический режим соленых озер Юго-Восточного Забайкалья // География и природ. ресурсы. 2010. № 4. С. 100–107.
Ивано-Арахлейский заказник: природно-ресурсный потенциал территории / Отв. ред. В.П. Горлачев. Чита: Поиск, 2002. 232 с.
Иванов М.В. Эволюция глобального биогеохимического цикла. М.: Наука, 1989. 200 р.
Иванов П.В. Классификация озер мира по величине и по их средней глубине // Бюл. ЛГУ. 1948. № 20. С. 29–36.
Иванова М.Е., Морковкин Г.Г., Тайлашев Д.А. Исследование процессов выноса Са2+ и Mg2+ из верхних почвенных горизонтов черноземов выщелоченных луговой степи Алтайского края под влиянием длительного использования в составе пахотных угодий // Агроэкология. 2007. № 1 (27). С. 13–15.
Итигилова М.Ц., Пронин Н.М., Юргенсон Г.А., Птицын А.Б., Калугин И.А., Дарьин А.В., Решетова С.А., Обязов В.А., Помазкова Н.В., Цыбекмитова Г.Ц., Михеев И.Е., Фалейчик Л.М., Замана Л.В., Субботина В.Н., Корякина Е.А., Куклин А.П., Матафонов П.В., Ташлыкова Н.А., Базарова Б.Б., Соколов А.В. Ивано-Арахлейские озера на рубеже веков (состояние и динамика). Новосибирск: Изд-во СО РАН, 2013. 337 с.
Леонова Г.А., Богуш А.А., Бобров В.А., Бычинский В.А., Трофимова Л.В., Маликов Ю.И. Эколого-геохимическая оценка соляных озер Алтайского края // География и природные ресурсы. 2007. № 1. С. 51–59.
Моисеенко Т.И., Дину М.И., Гашкина Н.А., Кремлева Т.А. Формы нахождения металлов в природных водах в зависимости от их химического состава // Вод. ресурсы. 2013. Т. 40. № 4. С. 375–385. https://doi.org/10.7868/S0321059613040093
Новиков Ю.В., Ласточкина К.О., Болдина З.Н. Методы исследования качества воды водоемов / Под ред. А.П. Шицковой. М.: Медицина, 1990. 400 с.
Обязов В.А. Изменение температуры воздуха и увлажненности территории Забайкалья и приграничных районов Китая // Материалы конф. “Природоохранное сотрудничество Читинской области (РФ) и Автономного района Внутренняя Монголия (Китай) в трансграничных экологических районах”. Чита, 2007. С. 247–250.
Посохов Е.В. Общая гидрогеохимия. Л.: Недра, 1975. 208 с.
Птицын А.Б., Чу Г., Дарьин А.В., Замана Л.В., Калугин И.А., Решетова С.А. Скорость седиментогенеза в озере Арахлей (Центральное Ззабайкалье) по радиогеохимическим и палинологическим данным // Геология и геофизика. 2014. Т. 55. № 3. С. 473–480.
Пьянов А.И., Павлов Д.С., Брагин Н.В., Стрижова Т.А., Михеев И.Е. Результаты исследования пространственного распределения рыб в озерах Арахлей и Кенон (Читинская область) // Вопр. ихтиологии. 1995. Т. 35. № 5. С. 678–686.
Сонненфелд П. Рассолы и эвапориты. М.: Мир, 1988. 480 с.
Фёдоров И.А., Таскина Л.В. Гумусовые кислоты и их миграционные формы в водах озер Восточного Забайкалья // Химия в интересах устойчивого развития. 2020. Т. 28. № 5. С. 515–526.
Цыбекмитова Г.Ц., Фалейчик Л.М., Михеев И.Е. Антропогенная нагрузка на водосборный бассейн Ивано-Арахлейских озер (Восточное Забайкалье) // Вода: химия и экология. 2013. Т. 2. № 56. С. 3–11.
Шварцев С.Л. Гидрогеохимия зоны гипергенеза // Геохимия. 2000. Т. 28. № 2. С. 260–276.
Шварцев С.Л., Колпакова М.Н., Исупов В.П., Владимиров А.Г., Ариунбилэг С. Геохимия и формирование состава соленых озер Западной Монголии // Геохимия. 2014. № 5. С. 432–449. https://doi.org/10.7868/S0016752514030078
Bethke C., Yeakel S. The Geochemist’s Workbench Release 11 – GWB Essentials Guide. Champaign, IL: Aqueous Solutions LLC, 2016. 175 p.
Borzenko S.V., Kolpakova M.N., Shvartsev S.L., Isupov V.P. Biogeochemical conversion of sulfur species in saline lakes of steppe Altai // J. Oceanol. Limnol. 2018. V. 36. № 3. P. 676–686.
Borzenko S.V., Shvartsev S.L. Chemical composition of salt lakes in East Transbaikalia (Russia) // Applied Geochem. 2019. V. 103 P. 72–84.
Eugster H.P., Hardie L.A. Saline lakes // Lakes: che-mistry, geology, physics / Ed. A. Lerman. N. Y.: Springer-Verlag, 1978. P. 237–293.
Fei Zhang, Zhangdong Jin, Jimin Yu, Yunkai Zhou, Ling Zhou. Hydrogeochemical processes between surface and groundwaters on the northeastern Chinese Loess Plateau: Implications for water chemistry and environmental evolutions in semi-arid regions // J. Geochem. Exploration. 2015. № 159. P. 115–128.
Gibbs R.J. Mechanisms controlling world water che-mistry // Sci. 1970. № 170. P. 1088–1090.
Moiseenko T.I., Gashkina N.A., Dinu M.I., Kremleva T.A., Khoroshavin V.Y. Aquatic geohemistry of small lakes: effects of environment changes // J. Geochem. Exploration. 2013. № 13. P. 1031.
Дополнительные материалы отсутствуют.