Водные ресурсы, 2021, T. 48, № 5, стр. 556-567
Летучие органические соединения в устьевых областях малых рек Татарского пролива в период ледостава
Л. А. Гаретова a, *, Н. К. Фишер a, **, А. М. Кошельков b
a Институт водных и экологических проблем ДВО РАН
680000 Хабаровск, Россия
b Институт горного дела ДВО РАН
680000 Хабаровск, Россия
* E-mail: micro@ivep.as.khb.ru
** E-mail: fisher@ivep.as.khb.ru
Поступила в редакцию 19.05.2020
После доработки 27.10.2020
Принята к публикации 21.01.2021
Аннотация
Проведено исследование распределения летучих органических соединений в воде и донных отложениях эстуариев малых приливных рек. В период ледостава вода характеризовалась высоким содержанием органических веществ: в пресных водах – от 4.2 до 29.2, в осолоненных водах – от 12.2 до 80.4, в морской воде – 404 мг/л. В донных отложениях содержание органического углерода менялось от <0.10 до 15.4%, количество углеводородов варьировало от 0.01 до 1.43 мг/г. В подледной речной воде содержание летучих органических соединений в основном было ниже нормативов, установленных для водоемов рыбохозяйственного значения. В воде и донных отложениях солоноводных участков преобладали продукты спиртового, ацетонобутилового и метанового брожения. Концентрация метанола в осолоненной озерной воде достигалa 13.76 мг/дм3. Для подледного периода характерно выравнивание концентраций летучих органических соединений между донными отложениями и водной средой за счет отсутствия поверхностного стока, процессов испарения и приливо-отливного переноса.
ВВЕДЕНИЕ
Актуальность исследования устьевых областей рек обусловлена их биогеохимической барьерной функцией на границе смешения морских и речных вод [12, 26, 30]. В последние годы усилился интерес к малым эстуарным системам [36, 39, 40, 45], поскольку именно малые реки составляют основную массу водотоков во всех климатических зонах, а их функционирование пока слабо изучено. Последнее особенно касается устьевых областей малых рек дальневосточного побережья, антропогенный пресс на которые постоянно усиливается за счет расширения и строительства морских угольных и нефтяных терминалов, железнодорожных и автомобильных подъездных путей, других коммуникаций, затрагивающих водосборные площади малых рек [16].
В юго-западный район Татарского пролива впадает множество средних и малых рек, стекающих с восточного склона Сихотэ-Алиня. Практически все водотоки бассейна Татарского пролива имеют высшую рыбохозяйственную категорию, поскольку являются местами нереста тихоокеанских лососей. Современный облик устьевых областей многих из них начал формироваться в 1940-е гг. в период строительства железной дороги Комсомольск-на-Амуре–Совгавань. Железнодорожная магистраль, опоясывая побережье, затронула устья многих малых рек (Мучке, Ая, Токи, Большая Дюанка и Малая Дюанка и др.). Прокладка мостов через устья рек сопровождалась сужением внешних участков эстуариев, что привело к образованию полузамкнутых лагун или приустьевых озер. Следствие таких морфологических изменений – наблюдаемое в настоящее время обмеление эстуариев малых рек, которое влечет за собой утрату нерестовых угодий для дальневосточных лососей и других объектов ихтиофауны и гидробионтов.
В зонах смешения морских и континентальных вод происходит аккумуляция разнородного минерального и биогенного материала (остатков растительных и животных организмов терригенного и морского происхождения), а также антропогенных загрязняющих веществ [8, 36, 46], что делает их донные отложения (ДО) источником вторичного загрязнения морской среды [30, 43, 45], в том числе за счет образования летучих органических соединений (ЛОС) [25, 37]. Кроме поступления ЛОС в природные воды от антропогенных источников (сточные воды промышленных предприятий, разливы нефти и нефтепродуктов, сток с городских территорий) [35, 38], в прибрежных зонах они могут в значительном количестве продуцироваться морской растительностью и фитопланктоном [27, 28, 48], а также образовываться в результате их микробиологической деструкции [31, 44]. Такие соединения, как ацетон, ацетальдегид и формальдегид, могут образовываться в результате фотохимических реакций хромофорных ОВ, в частности гуминовых веществ [29].
Исследование ЛОС необходимо для определения источников, свойств, пространственного распространения и масштабов проникновения поллютантов в водную экосистему. При этом необходимо учитывать, что распространение антропогенных углеводородов и их производных происходит на существующем в природе устойчивом биогеохимическом фоне [8, 17].
Поскольку в настоящее время ПДК загрязняющих веществ в ДО не установлены, ориентировочно оценить уровень загрязнения ДО в водоемах, подвергающихся влиянию хозяйственной деятельности, можно путем сопоставления концентраций загрязняющих веществ в ДО с их фоновым содержанием в данном районе. Очевидно, что наиболее объективными критериями оценки были бы концентрации ЛОС, установленные до начала активной хозяйственной деятельности на рассматриваемом водном объекте. Однако такие данные, как правило, отсутствуют и уже не могут быть получены, поскольку водосборные площади малых рек бассейна Татарского пролива в течение многих лет активно и многопланово используются, что, безусловно, сказывается на химическом составе ДО. Один из подходов к разделению (дифференциации) внутриводоемных процессов образования и трансформации ОВ, формирующих природные (фоновые) уровни ЛОС и антропогенного воздействия на устьевые области рек, на взгляд авторов статьи, – исследование состояния водного объекта в период ледостава. В период открытой воды устьевые области малых рек подвержены морским приливам. Градиентные величины солености и дальность проникновения морских вод в русла рек зависят от морфолого-гидрологических особенностей водотоков, приливо-отливных и сгонно-нагонных явлений. В период ледостава морское влияние на устья рек практически исключается за счет образования наледей и промерзания мелководных малых рек. Также в этот период отсутствует влияние поверхностного стока загрязняющих веществ, атмосферного переноса и осадков, действие которых возобновляется при таянии льда. Решающую роль в формировании состава ЛОС в период ледостава приобретают внутриводоемные процессы трансформации ОВ, которые могут сильно отличаться от процессов, происходящих в летний период [32, 34, 47].
Цель работы – исследование качественного состава и содержания ЛОС в воде и ДО устьевых областей малых рек бассейна Татарского пролива в период ледостава. Обсуждается разнообразие (качественный состав) и количество ЛОС (содержание суммарных и индивидуальных компонентов).
ОБЪЕКТЫ И МЕТОДЫ
Малые реки Мучке, Токи, Ая и Малая Дюанка впадают в Татарский пролив в районе пгт Ванино Хабаровского края, образуя в устьевых областях развитые лиманные участки (рис. 1).
Рис. 1.
Картосхема района исследования. 1 – станции отбора проб воды, 2 – станции отбора проб ДО, 3 – автомобильная дорога, 4 – железная дорога, 5 – полигон твердых коммунальных отходов, 6 – нефтехранилище.
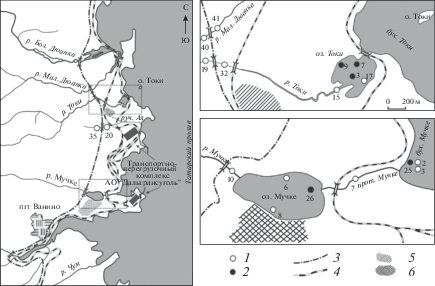
Река Малая Дюанка протяженностью 21 км имеет ширину русла 6 м, среднюю глубину 0.5 м. Малая река (ручей) Ая имеет протяженность 6 км, ширину в среднем 1.0 м, глубину 0.3–0.5 м [22].
Протяженность р. Токи составляет 16.6 км, ширина русла колеблется от 0.8 до 1.2 м, в приустьевой части достигает 3.0–3.5 м, глубина 1.5 м. В одноименную бухту река впадает через солоноватоводное оз. Токи, которое представляет собой полузамкнутую лагуну, сообщающуюся с морем короткой (~30 м) протокой шириной 12 м. Озеро Токи имеет площадь водного зеркала ~0.25 км2 и выпуклый рельеф дна, глубина в период открытой воды 0.3–1.5 м, зимой бóльшая (75%) часть озера промерзает до дна.
Протяженность р. Мучке составляет 35 км, ширина 5–7 м, максимальная глубина до 1.5 м. Озеро Мучке расположено в 1.1 км выше устья р. Мучке, которая протекает через озеро, впадая в водоем с З. С восточной стороны озеро соединяется через протоку с бух. Мучке. Озеро расположено в распадке, со склонов которого в весенний период происходит сброс в водоем талых вод. Средняя глубина озера составляет 3 м, площадь зеркала водоема 0.59 км2.
Становление льда на реках, озерах и в бухтах происходит в начале ноября, вскрытие ото льда наблюдается в конце апреля – начале мая.
Территория водосборов рек подвержена антропогенному преобразованию. На водосборе р. Токи находится полигон твердых коммунальных отходов пгт Ванино. На южном берегу оз. Мучке находится нефтехранилище, на юго-западном побережье бух. Мучке расположен транспортно-перегрузочный комплекс АО “Дальтрансуголь”. Кроме этого, на северо-западном побережье бух. Мучке идет строительство еще одного терминала по транспортировке угля. Водосборы рек Токи и Мучке затронуты строительством подъездных железнодорожных и автомобильных путей.
Работы проводили в феврале–марте 2019 г. В период исследования толщина льда на реках и озерах составляла 1.0–1.1 м, в бух. Мучке ~60 см. Пробы воды для анализов отбирали из лунок после бурения толщи льда, глубина отбора 0–0.1 м. Бóльшая часть оз. Токи промерзает до дна, поэтому была отобрана только одна проба воды в стоковом желобе озера (ст. 17). Из-за значительной толщины льда ДО отбирали только на мелководных участках. Для отбора проб ДО (толщина слоя 0–10 см) использовали пробоотборник “Burkle”. Физико-химические параметры воды и водной вытяжки из ДО (соленость, удельная электропроводность (УЭП), рН) определяли при помощи комбинированного измерителя “Seven Multi S-47k”, “Mettler-Toledo” (Швейцария). Водную вытяжку готовили в соотношении 1 : 5 (10 г воздушно-сухой навески ДО и 50 мл дистиллированной воды) [2].
Содержание Сорг в воде определяли на анализаторе общего органического углерода “Total Organic Carbon” (“Shimadzu”, Япония). В ДО Сорг определяли фотометрическим методом после окисления осадка ОВ сульфохромной смесью [4].
Определение содержания углеводородов (УВ) в ДО выполняли по методике из [18]. Фракцию УВ выделяли экстракцией четыреххлористым углеродом, очищали от сопутствующих полярных соединений на колонке с оксидом алюминия 2-й степени активности по Брокману. Измерения концентрации УВ проводили на концентратомере “КН-2М” (“Сибэкоприбо”, Россия).
ЛОС в воде и ДО определяли методом парофазного анализа в сочетании с газовой хроматографией на хроматографе “Кристалл-5000.1”, детектор пламенно-ионизационный, капиллярная колонка “HP FAP” 50 м × 0.32 мм × 0.32 мкм в режиме от 50 до 200°С [19, 20]. Анализы выполняли в ЦКП “Межрегиональный центр экологического мониторинга гидроузлов” при ИВЭП ДВО РАН (аналитик Г.М. Филиппова). Для определения содержания ЛОС в ДО навеску нативных образцов в количестве 10 г помещали во флакон объемом 20 см3, закупоривали крышкой с тефлоновой прокладкой, выдерживали 30 мин при 90°С. Затем шприцем брали 1 см3 паровой вазы и вводили в детектор хроматографа. Количественное содержание анализируемых веществ в воде и ДО определяли по градуировочным зависимостям с учетом относительных факторов отклика к близкому по времени удерживания.
Микробиологические посевы воды и ДО проводили согласно общепринятым в водной микробиологии методам [10]. Общую численность гетеротрофных бактерий (ГБ) определяли на рыбопептонном агаре (РПА), разбавленном в 10 раз; численность сапрофитных бактерий (СБ) – на стандартном РПА. Численность нефтеокисляющих бактерий (НОБ) выявляли на среде Раймонда с нефтью. Результаты подсчета выражали в численности колониеобразующих единиц (КОЕ) микроорганизмов в 1 мл воды или 1 см3 грунта.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Вода
В период исследования глубина подледной воды в руслах рек была ≤0.25 м (табл. 1). В оз. Мучке глубины варьировали от 0.3 до 1.5 м. Большая часть акватории оз. Токи промерзает до дна, поэтому отобрана только одна проба воды на ст. 17, заложенной в стоковом желобе озера у правого берега (рис. 1). Температура пресных вод была +4 …+ 5°С, осолоненные воды озер имели температуру ≤+4°С. Минимальная температура воды в период отбора проб в бух. Мучке была −0.1°С.
Таблица 1.
Физико-химическая характеристика водной среды устьевых областей малых рек Татарского пролива в период ледостава (УЭП – удельная электропроводность, S – соленость)
| № станции | Место отбора | Глубина, м | Сорг, мг/дм3 | УЭП, μS/см | рН | S, епс |
|---|---|---|---|---|---|---|
| 40 | р. Малая Дюанка, выше моста | 0.18 | 4.6 | 69.4 | 7.06 | 0.0 |
| 41 | р. Малая Дюанка, ниже моста | 0.24 | 2.1 | 70 | 7.16 | 0.0 |
| 19 | р. Токи, выше моста | 0.1 | 15.3 | 96.9 | 6.61 | 0.0 |
| 32 | р. Токи, ниже моста | 0.1 | 14.6 | 132 | 7.34 | 0.0 |
| 15 | р. Токи выше озера | 0.1 | 10.4 | 1.9 × 103 | 6.61 | 0.93 |
| 17 | оз. Токи, правый берег | 0.1 | 6.1 | 12.0 × 103 | 6.59 | 6.81 |
| 35 | р. Ая, выше моста | 0.1 | 9.9 | 80.6 | 6.29 | 0.0 |
| 20 | р. Ая, ниже моста | 0.1 | 14.5 | 139 | 7.11 | 0.0 |
| 10 | р. Мучке, выше озера | 0.25 | 14.6 | 289 | 7.12 | 0.05 |
| 6 | оз. Мучке, левый берег | 0.5 | 40.2 | 12.7 × 103 | 8.12 | 7.92 |
| 8 | оз. Мучке, правый берег | 0.3 | 32.2 | 12.8 × 103 | 8.92 | 7.28 |
| 7 | прот. Мучке | 1.5 | 22.7 | 125.1 × 103 | 7.25 | 7.30 |
| 2 | бух. Мучке | 3.5 | 202.0 | 50.8 × 103 | 7.74 | 32.93 |
| 3 | То же | 3.8 | 143.4 | 50.5 × 103 | 7.67 | 32.95 |
Подледная вода существенно отличалась по ряду показателей: УЭП менялась в пределах 69.4‒125.1 mS/см и зависела от солености (r 2 = = 0.998) и содержания Сорг (r 2 = 0.989). Cоленость тесно связана с содержанием Сорг (r 2 = 0.908), что, вероятнее всего, обусловлено влиянием обогащенных ОВ соленых вод.
В период открытой воды, завися от гидрологического режима моря и реки, соленые воды более чем на 2 км заходят с приливами в устья малых рек на побережье Татарского пролива [7, 24]. В период речного половодья горизонтальный градиент солености в оз. Токи менялся от 0 до 18, в межень ‒ от 0.29 до 31.2 епс [7]. Мелководность озера (глубина 0.3‒0.7 м) способствует промерзанию воды и снижению ее циркуляции в обоих направлениях. В стоковом желобе оз. Токи (ст. 17) соленость воды составляла 6.81 епс.
В оз. Мучке соленость воды между правым и левым берегом была распределена относительно равномерно и соответственно составляла 7.28 и 7.92 епс, такая же соленость отмечена в воде протоки. Для летнего периода максимальные величины градиента солености по акватории оз. Мучке составляли 0.26–6.33 епс [7]. Вероятно, при отсутствии влияния приливов соленость вод оз. Мучке в период ледостава обеспечивается за счет питания солеными грунтовыми водами.
Максимальное содержание Сорг выявлено в двух пробах воды, отобранных в прибрежной части бух. Мучке, минимальное (2.1 мг/дм3) – в одной из проб воды р. Малая Дюанка. рН водной среды – от 6.29 до 8.92 при максимальных значениях в оз. Мучке.
Содержание Сорг по солоноводным станциям (15, 17) устьевой области р. Токи составляло в среднем 8.25 мг/дм3 и по сравнению с пресноводными станциями (19 и 32) снижалось почти в 2 раза (табл. 1). По станциям реки и оз. Мучке концентрация Сорг варьировала от 14.6 до 40.2 мг/дм3 при максимальном содержании на ст. 6 и в среднем составляла 18.4 мг/дм3, что более чем в 2 раза выше по сравнению с водой эстуария р. Токи. Такая вариабельность содержания ОВ связана с тем, что участки пересечения русел рек автомобильной дорогой еще сохраняют черты горных рек – преобладание галечных грунтов, слабое развитие водной растительности (эпилитонные водоросли) в зимний период. В нижнем течении рек Мучке и Токи (ст. 10 и 15 соответственно) увеличение содержания ОВ в воде обусловлено преобладанием песчано-илистых грунтов, способных аккумулировать аллохтонное и автохтонное ОВ.
Распределение Сорг в устьевых образованиях рек Токи и Мучке имело особенности: по мере увеличения солености от пресноводной части к бух. Мучке отмечалось увеличение содержания Сорг. В оз. Токи, напротив, при увеличении солености содержание Сорг снижалось (рис. 2а, 2б). Вероятно, существенное увеличение содержания Сорг в воде в бух. Мучке по сравнению с речными и озерными водами обусловлено воздействием хозяйственно-бытовых стоков с плавсредств, швартующихся на причалах угольного терминала, расположенного в бух. Мучке. В оз. Токи обратная зависимость содержания Сорг от солености может быть связана с седиментационными процессами при увеличении солености.
Рис. 2.
Распределение органического углерода 1 и солености 2 в воде устьевых областей рек Мучке (а) и Токи (б) в период ледостава.
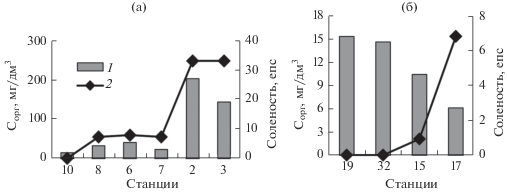
Общепринятый коэффициент пересчета содержания Сорг в концентрации органического вещества – 2 [1]. Таким образом, концентрации ОВ в водной среде рек варьируют от 4.2 до 29.2, в воде озер от 12.2 до 80.4 мг/дм3, в бух. Мучке концентрация достигает 404 мг/дм3. Такие высокие концентрации ОВ в период ледостава, вероятнее всего, обусловлены его неполной деградацией в толще воды. Процессы деструкции ОВ в основном осуществляют микробные сообщества, развитие которых в период ледостава ограничивается температурой ≤5°С в исследованных водных объектах, а окисление ОВ до конечных продуктов (СО2 и Н2О) лимитировалось недостатком кислорода в подледной воде.
Известно, что устьевые области рек и приустьевые морские воды – зоны геохимических барьеров, где происходит смена форм миграции различных веществ, в том числе органических (по теории А.П. Лисицына, из-за изменения солености) [12]. Ключевая роль в деструкции поступающих неорганических и органических веществ принадлежит микроорганизмам. В таких зонах увеличиваются численность и активность бактерий, меняется структура микробных сообществ [5, 23].
В табл. 2 представлены данные по составу микробных сообществ подледной воды исследованных водных объектов. Численность аэробных гетеротрофных бактерий (ГБ) в воде рек варьировала от 7.4 до 56 тыс. КОЕ/мл и была одного порядка с таковой в холодноводных горных реках Сихотэ-Алиня в период открытой воды [6]. Исключение составляет проба воды из р. Ая, где численность данной группы была почти на порядок выше, чем в других водотоках. Здесь же выявлена максимальная численность СБ, в остальных водотоках показатели численности данной группы были близкими и составляли 6.9–7.3 тыс. КОЕ/мл. Микробные сообщества воды малых рек оказались хорошо адаптированными к утилизации углеводородных субстратов – на среде с нефтью в качестве единственного источника углерода численность бактерий была одного порядка с численностью СБ, утилизирующих легкодоступные ОВ. Доля НОБ – потенциальных деструкторов широкого спектра углеводородных субстратов [23, 37, 41] в сообществе гетеротрофов – варьировала от 3.5 до 17%.
Таблица 2.
Численность микроорганизмов в воде малых рек бассейна Татарского пролива в период ледостава (прочерк – нет данных)
| № станции | Место отбора | Численность микроорганизмов, КОЕ/мл | ГБ/СБ | НОБ/ГБ, % | ||
|---|---|---|---|---|---|---|
| СБ | ГБ | НОБ | ||||
| 40 | р. Малая Дюанка, выше моста | 7.0 × 103 | 4.9 × 104 | 5.4 × 103 | 7.0 | 10.9 |
| 41 | р. Малая Дюанка, ниже моста | 6.9 × 103 | 3.6 × 104 | 4.8 × 103 | 5.2 | 13.4 |
| 19 | р. Токи, выше моста | 6.9 × 103 | 4.7 × 104 | 5.6 × 103 | 6.9 | 11.9 |
| 32 | р. Токи, ниже моста | 7.3 × 103 | 5.5 × 104 | 6.0 × 103 | 7.6 | 10.8 |
| 35 | р. Ая, выше моста | 2.4 × 104 | 2.0 × 105 | 6.7 × 103 | 8.4 | 3.3 |
| 20 | р. Ая, ниже моста | 7.3 × 103 | 5.6 × 104 | 9.5 × 103 | 7.6 | 17.0 |
| 10 | р. Мучке, выше озера | 4.2 × 102 | 7.4 × 103 | 2.7 × 102 | 17.5 | 3.5 |
| 6 | оз. Мучке, левый берег | 0.8 × 102 | 3.3 × 103 | 0.03 × 102 | 4.2 | 1.0 |
| 8 | оз. Мучке, правый берег | 0.9 × 102 | – | 0.1 × 102 | – | – |
| 7 | протока Мучке | 8.7 × 102 | 2.4 × 103 | 2.6 × 102 | 2.8 | 10.5 |
| 2 | бух. Мучке | 0.7 × 102 | 1.2 × 102 | 0.1 × 102 | 1.6 | 8.6 |
| 3 | То же | 0.3 × 102 | 0.4 × 102 | – | 1.3 | – |
Численность бактерий по станциям эстуария р. Мучке снижалась от речного участка к морскому, достигая минимума в воде бух. Мучке (до десятков КОЕ/мл). Аналогичные результаты получены при исследовании бактериопланктонных сообществ Амурского лимана [9]. При температуре воды 4°С в лимане минимальные показатели численности всех эколого-трофических групп бактерий отмечены в водах с максимальной соленостью. Соотношение численности ГБ/СБ характеризует уровень трофности водного объекта. Самый высокий уровень трофности отмечен для бух. Мучке (ГБ/СБ составляет 1.3–1.6), что согласуется с высоким содержанием ОВ в воде бухты. Численность НОБ в воде была невысокой и не превышала сотен КОЕ/мл. Их доля в сообществе гетеротрофов составляла от 1 до 10%.
В табл. 3 представлены данные по содержанию ЛОС в воде малых рек Татарского пролива в период ледостава. В исследованных пробах воды обнаружены соединения различных классов: одноатомные спирты алифатического строения – метанол, бутанол, изопропанол; эфиры уксусной кислоты – этилацетат, метилацетат, бутилацетат; альдегиды – ацетальдегид; кетоны – ацетон. Наиболее растворимы в воде ацетальдегид, ацетон, метанол. Слаборастворимые соединения – этилацетат, бутилацетат – обнаруживались в малых количествах. Эти компоненты в природе зачастую являются продуктами микробного синтеза как конечного, так и промежуточного окисления. Бутанол и ацетон – продукты ацетоно-бутилового брожения. Метанол образуется в процессе метанового брожения органических веществ с последующим гидроксилированием метана. Данные процессы трансформации метана могут осуществлять многие представители метанотрофных бактерий [15], в частности бактерии сем. Methylocystaceae и Proteobacteria [14]. При этом установлено, что процессы метаногенеза и биодеструкции метана более интенсивно протекают в водной толще и ДО барьерных зон река–море по сравнению с морскими акваториями [11, 46].
Таблица 3.
Содержание ЛОС в воде малых рек в период ледостава (прочерк – не обнаружено)
| Компоненты, мг/дм3 |
р. Дюанка, ст. 40 | р. Токи, ст. 19 | р. Ая, ст. 35 | р. Мучке, ст. 10 | ПДКрх, мг/дм3 [21] | Класс опасности |
|---|---|---|---|---|---|---|
| Ацетальдегид | – | 0.020 | – | – | 0.250 | 4 |
| Ацетон | 0.030 | 0.020 | 0.060 | 0.022 | 0.050 | 3 |
| Бензол | – | – | 0.001 | – | 0.500 | 4 |
| Бутанол | – | 0.010 | 0.010 | – | 0.003 | 4 |
| Бутилацетат | 0.002 | – | 0.003 | 0.008 | 0.300 | 4 |
| Гексан | – | 0.770 | 0.020 | – | 0.500 | 3 |
| Изопропилбензол | 0.010 | 0.001 | 0.001 | 0.050 | 1.400 | 4 |
| Метанол | 0.070 | 0.160 | 0.700 | 0.144 | 0.100 | 4 |
| м-Ксилол | 0.020 | 0.002 | 0.001 | 0.092 | – | 3 |
| о-Ксилол | 0.001 | 0.001 | 0.001 | 0.001 | 0.050 | 3 |
| п-Ксилол | – | 0.004 | – | – | 0.005 | 3 |
| Толуол | 0.001 | 0.001 | 0.001 | 0.001 | 0.500 | 3 |
| Этилацетат | – | – | 0.010 | – | 0.200 | 4 |
| Этилбензол | – | 0.002 | 0.002 | – | 0.001 | 3 |
| Сумма ЛОС | 0.134 | 0.991 | 0.81 | 0.318 |
Среди веществ антропогенного генезиса, сопутствующих нефтяному загрязнению, в речной воде обнаружены гексан, толуол, бензол. Гексан в достаточно высоких концентрациях (0.770 мг/дм3) выявлен только в воде р. Токи. Следовые количества толуола присутствовали во всех водотоках, а бензола – только в воде р. Ая. Из продуктов микробиологического брожения наиболее распространенным был метанол, его содержание в воде рек варьировало существенно – от 0.07 до 0.70 мг/дм3 при максимальном превышении (7 ПДК) в воде р. Ая. Содержание ацетона было ниже ПДК и составляло 0.020–0.060 мг/дм3.
В табл. 4 представлены данные по содержанию ЛОС в воде приустьевой части р. Токи в период ледостава. В подледной воде оз. Токи (ст. 17) концентрация гексана была значительно ниже таковой в речной воде и составляла 0.005 мг/дм3. В озерной воде отмечался значительный (в 42.5 раз) рост концентрации ацетальдегида (0.85 мг/дм3), обнаруживался бутилацетат – продукт маслянокислого брожения, в 5 раз по сравнению с пресной водой увеличивалась концентрация изопропилбензола, что свидетельствует об активизации процессов трансформации углеводородных субстратов в условиях увеличения солености. Вместе с тем превышения рыбохозяйственных нормативов в воде эстуария р. Токи не выявлено, за исключением ацетальдегида, концентрация которого в воде оз. Токи составляла 3.4 ПДК.
Таблица 4.
Содержание ЛОС в воде эстуария р. Токи в период ледостава (прочерк – не обнаружено)
| Компоненты, мг/дм3 | Станции отбора проб | ||
|---|---|---|---|
| 32 | 15 | 17 | |
| Ацетальдегид | 0.010 | – | 0.850 |
| Ацетон | 0.040 | 0.050 | 0.010 |
| Бутанол | 0.010 | – | – |
| Бутилацетат | – | – | 0.003 |
| Гексан | 0.030 | 0.001 | 0.005 |
| Изопропилбензол | – | 0.002 | 0.010 |
| Метанол | – | 0.130 | – |
| м-Ксилол | 0.001 | 0.006 | 0.020 |
| о-Ксилол | 0.001 | 0.006 | 0.001 |
| п-Ксилол | – | 0.002 | – |
| Толуол | 0.140 | 0.001 | 0.001 |
| Этилацетат | 0.200 | – | – |
| Этилбензол | – | 0.003 | – |
| ∑ЛОС | 0.432 | 0.201 | 0.900 |
Пространственное распределение ЛОС в эстуарии р. Мучке было неравномерным (табл. 5). Наименьшее разнообразие компонентов и их низкие концентрации наблюдались в воде левобережной части оз. Мучке. Здесь концентрации выявленных ЛОС существенно не отличались от таковых в речной воде (ст. 10), за исключением гексана, который обнаруживался в концентрации 0.062 мг/дм3 только у левого берега озера. Наибольшим разнообразием компонентов отличалась вода, отобранная в правобережной части оз. Мучке, прилегающей к территории нефтехранилища. Здесь выявлены самые высокие концентрации продуктов спиртового и маслянокислого брожения этилацетата, метанола, изопропанола, бутанола и изобутанола, бутилацетата. Так, превышение рыбохозяйственных нормативов составило по изопропанолу 180 ПДК, по метанолу 137 ПДК, по бутанолу 80 ПДК, по этилацетату 5.4 ПДК. Среди углеводородов в концентрациях ≤ ПДК присутствовали бензол и толуол. Содержание о-ксилола было на уровне 12.6 ПДК, п‑ксилола – 4.2 ПДК, что свидетельствует об антропогенном нефтяном загрязнении водной среды. Загрязнение нефтепродуктами вод озера может происходить за счет грунтовых вод, дренирующих близлежащую территорию нефтехранилища и подпитывающих озеро в зимний период.
Таблица 5.
Содержание ЛОС в воде эстуария р. Мучке в период ледостава (прочерк – не обнаружено)
| Компоненты, мг/дм3 | оз. Мучке, левый берег | оз. Мучке, правый берег | прот. Мучке | бух. Мучке |
|---|---|---|---|---|
| ст. 6 | ст. 8 | ст. 7 | ст. 2 | |
| Ацетальдегид | – | – | 0.033 | 0.038 |
| Ацетон | 0.024 | 0.059 | 0.070 | 0.015 |
| Бензол | – | 0.347 | 0.069 | – |
| Бутанол | – | 0.240 | 0.081 | – |
| Бутилацетат | – | 0.349 | 0.033 | – |
| Гексан | 0.062 | – | – | – |
| Изобутанол | – | 0.830 | 0.145 | – |
| Изопропанол | – | 1.804 | – | – |
| Изопропилбензол | 0.001 | 0.083 | 0.023 | 0.212 |
| Метанол | 0.120 | 13.760 | 4.754 | 0.250 |
| Метилацетат | – | 0.115 | – | – |
| м-Ксилол | – | 0.059 | 0.037 | – |
| о-Ксилол | 0.008 | 0.628 | 0.057 | 0.002 |
| п-Ксилол | – | 0.021 | 0.013 | – |
| Толуол | 0.268 | 0.214 | 0.059 | 0.002 |
| Этилацетат | – | 1.066 | 0.155 | 0.012 |
| Этилбензол | – | 0.026 | 0.025 | – |
| Сумма ЛОС | 0.483 | 19.601 | 5.554 | 0.531 |
В воде протоки, соединяющей озеро с бухтой, содержание указанных компонентов снижается: этилацетата – на порядок, метанола – в 3, бензола – в 5, толуола – в 4.5, а бутилацетата – в 10 раз по сравнению с водой правобережной части оз. Мучке.
В воде бух. Мучке содержание большинства компонентов, присутствующих в правобережной части озера, отсутствовало или было ниже ПДК.
Донные отложения
ДО озер значительно разнообразны (табл. 6). В период ледостава практически вся акватория мелководного оз. Токи, в отличие от оз. Мучке, промерзает до дна, водная фаза между льдом и ДО отсутствует, поэтому исключается миграция веществ из ДО.
Таблица 6.
Физико-химическая характеристика ДО эстуариев рек Токи и Мучке
| № станции | Место отбора | Описание грунта | Сорг, % | УВ, мг/дм3 | УЭП, μS/см | рН | S, епс |
|---|---|---|---|---|---|---|---|
| 3 | оз. Токи, центр | Черный ил с включениями растительных остатков | 15.4 | 0.768 | 5.6 × 103 | 5.33 | 3.0 |
| 9 | оз. Токи, левый берег | Черный песчанистый ил пастообразной консистенции | 6.7 | 1.430 | 6.5 × 103 | 5.16 | 3.55 |
| 7 | На выходе из оз. Токи | Илистый песок черного цвета | 2.4 | 0.010 | 9.6 × 103 | 3.68 | 5.33 |
| 26 | На выходе из оз. Мучке |
Серый мелкий песок | 0.1 | 0.022 | 328 | 6.21 | 0.08 |
| 25 | бух. Мучке | То же | <0.1 | 0.010 | 3.4 × 103 | 5.81 | 1.76 |
Содержание Сорг зависело от типа осадков и варьировало от 0.1 до 15.4% при максимальном содержании в илах центральной части оз. Токи и минимальном – в песках бух. Мучке. Относительно высокое (30.8%) содержание ОВ при использовании коэффициента 2 в осадках оз. Токи объясняется неполной деградацией морского растительного материала, привнесенного приливными течениями и штормами в период открытой воды и аккумулированного в ДО.
Содержание УВ также значительно варьировало в зависимости от типа ДО: максимальное содержание УВ выявлено в песчанистом иле левобережной части оз. Токи на ст. 9, минимальное – в илистом песке нa ст. 7. Величина рН водной вытяжки ДО варьировала от 3.68 до 5.81, т.е. среда кислая, что характерно для восстановительных условий в ДО. Соленость водной вытяжки варьировала от 0.08 епс в осадках оз. Мучке до 5.33 епс в оз. Токи. Минимальная величина УЭП – у вытяжки из ДО оз. Мучке с самыми низкими соленостью и содержанием ОВ.
Численность (КОЭ/см3) культивируемых аэробных ГБ в осадках варьировала от десятков до сотен тысяч (табл. 7). Максимальные ее показатели выявлены в ДО оз. Мучке; в ДО оз. Токи, независимо от типа ДО, численность ГБ была 33.3 тыс. КОЭ/см3. Доля НОБ в сообществе гетеротрофов составляла от 6 до 51%, а их численность была на уровне таковой у группы СБ, что указывает на достаточно высокий потенциал микробного сообщества к деструкции УВ. Известно, что даже в холодноводных морях Арктики и Антарктики отмечается высокое разнообразие микробных популяций, способных к деструкции широкого спектра углеводородных соединений [42, 49].
Таблица 7.
Численность микроорганизмов в ДО эстуариев рек Токи и Мучке (прочерк – не определяли)
| № станции | Место отбора | Численность микроорганизмов, КОЕ/см3 | ГБ/СБ | НОБ/ГБ, % | ||
|---|---|---|---|---|---|---|
| СБ | ГБ | НОБ | ||||
| 3 | оз. Токи, центр | 1.7 × 104 | 3.3 × 104 | 2.0 × 103 | 2.0 | 6.0 |
| 9 | оз. Токи, левый берег | 1.3 × 104 | 3.3 × 104 | 3.0 × 103 | 2.5 | 9.0 |
| 7 | На выходе из оз. Токи | 1.7 × 104 | 3.3 × 104 | 1.7 × 104 | 2.0 | 51.0 |
| 26 | На выходе из оз. Мучке | 5.7 × 104 | 3.2 × 105 | 2.3 × 104 | 5.5 | 7.2 |
| 25 | бух. Мучке | 5.0 × 102 | – | 3.3 × 102 | – | – |
Суммарное содержание ЛОС и их состав в ДО озер Токи и Мучке различно. Так, в ДО оз. Токи доминировали ЛОС преимущественно природного происхождения (метанол, ацетальдегид). В ДО оз. Мучке (ст. 26) количественно преобладали ЛОС антропогенного происхождения – бензол, толуол, этилбензол, ксилолы, гексан, изобутанол, изопропилбензол (табл. 8). Эти соединения фиксировались и в водной среде у правого берега оз. Мучке, и в протоке (табл. 5), что говорит о вкладе нефтехранилища в загрязнение вод и ДО прилегающей акватории.
Таблица 8.
Содержание ЛОС в ДО эстуариев рек Токи и Мучке (прочерк – не обнаружено)
| Компоненты, мг/дм3 | р. Токи | р. Мучке | |||
|---|---|---|---|---|---|
| 3 | 7 | 9 | 25 | 26 | |
| Ацетальдегид | 0.450 | 0.400 | 0.640 | 0.012 | 0.031 |
| Ацетон | 0.080 | 0.120 | 0.260 | 0.035 | – |
| Бензол | – | 0.001 | – | – | 0.017 |
| Бутанол | – | 0.050 | – | 0.133 | – |
| Бутилацетат | – | 0.020 | – | 0.096 | 0.059 |
| Гексан | 0.040 | – | 0.015 | 0.172 | 0.151 |
| Изобутанол | – | – | – | – | 0.224 |
| Изопропилбензол | 0.006 | – | – | 0.005 | 0.203 |
| Метанол | 0.320 | 0.500 | 0.360 | 0.785 | 1.497 |
| м-Ксилол | 0.020 | – | 0.002 | 0.010 | 0.012 |
| о-Ксилол | 0.002 | 0.001 | 0.004 | 0.002 | 0.011 |
| п-Ксилол | – | – | – | – | 0.020 |
| Толуол | 0.002 | 0.002 | 0.001 | 0.004 | 0.054 |
| Этилацетат | – | 0.010 | 0.003 | 0.044 | – |
| Этилбензол | – | – | – | 0.024 | |
| Сумма ЛОС | 0.920 | 1.104 | 1.285 | 1.298 | 2.303 |
Содержание в ДО водорастворимых компонентов существенно не отличалось от такового в воде, а концентрации отдельных веществ были даже ниже, чем в воде (табл. 5, 8). Так, в ДО оз. Мучке содержание метанола было почти на порядок ниже, чем в равном объеме воды. Наиболее растворимые в воде идентифицированные ароматические углеводороды – ксилолы – были обнаружены в ДО в количествах ≤0.004 мг/дм3. Относительно хорошо растворимые в воде бензол и толуол, а также эфиры этилацетат и бутилацетат обнаруживались в отдельных случаях и в умеренных концентрациях (≤0.1 мг/дм 3). Это может свидетельствовать об интенсивном выносе всех легкорастворимых компонентов из ДО в водную среду.
Поскольку подавляющее большинство идентифицированных в ДО соединений – вещества нерастворимые или слаборастворимые в воде, можно сделать вывод о том, что в ДО и в воде они присутствуют в составе нефтяных микропленок или эмульсий и, соответственно, мигрировать между грунтовыми водами, ДО и водами озер будут именно в виде водных эмульсий, а не истинных растворов [3]. Это также подтверждается идентичностью качественного состава летучих соединений воды и ДО.
Рассматривая изменение относительного содержания отдельных групп ЛОС в воде и ДО различных участков устьевых областей малых рек, следует отметить, что связь между содержанием Сорг, УВ, а также качественным и количественным составом идентифицированных ЛОС не прослеживалась. Можно также предположить, что заметный вклад в накопление ЛОС как промежуточных продуктов биодеструкции на озерных участках могут вносить запасы ОВ, которые в восстановительных условиях способствуют связыванию и консервации УВ в ДО. Трансформация УВ в ДО в подледный период, вероятнее всего, протекает в условиях соокисления с легкодоступным ОВ эстуариев. В первую очередь, микробиологической трансформации подвергаются углеводороды линейного строения – н-алканы, в том числе метан. Микроорганизмы, обладающие способностью к их трансформации, достаточно широко распространены в эстуарных экосисистемах. Так, у двух из семи штаммов, изолированных из ДО эстуариев Карского моря, были детектированы гены алкангидроксилазы, ответственные за деградацию широкого спектра алканов [13]. Относительно высокое содержание метанола в воде и ДО указывает на активно протекающие процессы окисления метана. Известно, что некоторые микроорганизмы способны окислять метан в экстремальных условиях низкой температуры и при низких значениях рН, характерных для восстановительных условий [33].
ВЫВОДЫ
Состав и содержание органических веществ в воде и ДО устьевых участков приливных рек в период ледостава определяется внутриводоемными процессами. Преобладающий источник ЛОС – автохтонное и аллохтонное ОВ, аккумулированное в ДО приустьевых озер в период вегетации, на это указывает количественное доминирование в составе ЛОС продуктов микробиологической трансформации растительного материала.
Влияние загрязнения оз. Мучке нефтепродуктами проявляется в расширении спектра идентифицированных ингредиентов и увеличении их концентраций в воде и ДО по сравнению с оз. Токи.
Распределение компонентов между водной средой и ДО в малых эстуариях относительно равномерно за счет отсутствия в период ледостава процессов испарения и выноса приливо-отливными течениями.
Использование данных по содержанию ЛОС в воде и ДО в период ледостава в качестве фоновых может быть альтернативой применяемой в настоящее время оценке состояния водных объектов путем сопоставления имеющихся концентраций с фоновым содержанием загрязняющих веществ в данном районе.
Авторы выражают благодарность Г.М Филипповой (Межрегиональный центр экологического мониторинга гидроузлов при ИВЭП ДВО РАН) и С.И. Левшиной (ИВЭП ДВО РАН) за помощь в выполнении анализов.
Список литературы
Агатова А.И., Аржанова Н.В., Лапина Н.М., Торгунова Н.И., Красюков Д.В. Пространственно-временнáя изменчивость органического вещества в прибрежных экосистемах Кавказского шельфа Черного моря // Океанология. 2005. Т. 45. № 4. С. 670‒677.
Аринушкина Е.В. Руководство по химическому анализу почв. М.: МГУ, 1962. 491 с.
Баженова О.К., Бурмин Ю.К., Соколов Б.А., Хаин В.Е. Геология и геохимия нефти и газа. М.: МГУ, 2004. С. 144‒181.
Бельчикова Н.П. Определение гумуса почвы по методу И.В. Тюрина // Агрохимические методы исследования почв. М.: Наука, 1975. С. 56‒62.
Виноградов М.Е., Шушкина Э.А. Функционирование планктонных сообществ эпинелагиали океана. М.: Наука, 1987. 240 с.
Гаретова Л.А. Эколого-микробиологическая оценка лососевых рек Хабаровского края // Изв. ТИНРО. 2009. Т. 157. С. 175‒181.
Гаретова Л.А., Левшина С.И., Фишер Н.К., Сиротский С.Е., Шестеркин В.П. Распределение органического вещества, фитопигментов и гетеротрофных бактерий вдоль градиента солености в эстуариях малых рек бассейна Татарского пролива // Изв. ТИНРО. 2016. Т. 184. С. 219‒235.
Гаретова Л.А., Фишер Н.К., Климин М.А. Источники органического вещества в донных отложениях эстуариев малых рек бассейна Татарского пролива // Биология внутренних вод. 2020. № 3. С. 211–221.
Каретникова Е.А. Гаретова Л.А. Пространственно-временное распределение бактериопланктона и бактериобентоса в Амурском лимане и прилегающих морских акваториях // Океанология. 2015. Т. 55. № 5. С. 776–786.
Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 228 с.
Леин А.Ю., Пименов Н.В., Русанов И.И., Павлова Г.А., Саввичев А.С., Верховская З.И. Цикл метана в Баренцевом море // Литология и полез. ископаемые. 2008. № 5. С. 455‒479.
Лисицын А.П. Маргинальный фильтр океанов // Океанология. 1994. Т. 34. № 5. С. 735–747.
Мамаева Е.В., Галачьянц Ю.П., Хабудаев К.В., Петрова Д.П., Погодаева Т.В., Ходжер Т.В., Земская Т.И. Метагеномный анализ микробных сообществ донных осадков шельфа Карского моря и Енисейского залива // Микробиология. 2016. Т. 85. № 2. С. 187–198.
Мамаева Е.В., Суслова М.Ю., Погодаева Т.В., Парфенова В.В., Земская Т.И. Микробное некультивируемое сообщество осадков Гыданской губы и Енисейского залива Карского моря // Океанология. 2014.Т. 54. № 3. С. 338–348.
Намсараев Б.Б., Русанов И.И., Мицкевич И.Н., Веслополова Е.Ф., Большаков А.М., Егоров А.В. Бактериальное окисление метана в эстуарии реки Енисей и Карском море // Океанология. 1995. Т. 35. № 1. С. 88–93.
Никаноров А.М., Брызгало В.А. Антропогенная нагрузка на устьевые области рек Дальнего Востока в современных условиях // Вода: химия и экология. 2012. № 2. С. 11–17.
Одинцова Т.А. Разработка технологии идентификации и мониторинга нефтяных загрязнений. Автореф. дис. … канд. техн. наук. Пермь: Горный ин-т УрО РАН, 2010. 21 с.
ПНД Ф 16.1:2.2.22-98. Методика выполнения измерений массовой доли нефтепродуктов в минеральных, органогенных, органно-минеральных почвах и донных отложениях методом ИК-спектрометрии. М., 2005. 21 с.
ПНДФ 14.1:2:4.201-03. Методика выполнения измерений массовой концентрации ацетона и метанола в пробах питьевых, природных и сточных вод газохроматографическим методом. М., 2003. 17 с.
ПНДФ 14.1:2:4.57-96. Методика выполнения измерений массовых концентраций ароматических углеводородов в питьевых, природных и сточных водах газохроматографическим методом. М., 2011. 18 с.
Приказ министерства сельского хозяйства РФ от 13 декабря 2016 года № 552 “Об утверждении нормативов качества воды водных объектов рыбохозяйственного значения, в том числе нормативов предельно допустимых концентраций вредных веществ в водах водных объектов рыбохозяйственного значения”.
Ресурсы поверхностных вод СССР. Т. 18. Дальний Восток. Вып. 3. Приморье. Л.: Гидрометоиздат, 1972. 627 с.
Суслова М.Ю., Липко И.А., Мамаева Е.В., Парфенова В.В. Разнообразие культивируемых бактерий, выделенных из водной толщи и донных осадков шельфа Карского моря // Микробиология. 2012. Т. 81. № 4. С. 524–531.
Форина Ю.А., Шестеркин В.П. Особенности гидрохимического состава пресных вод восточного макросклона Северного Сихотэ-Алиня // География и природ. ресурсы. 2010. № 3. С. 81–87.
Astrahan P. Monocyclic aromatic hydrocarbons (phthalates and BTEX) and aliphatic components in the SE Mediterranean costal Sea-surface microlayer (SML): Origins and phase distribution analysis // Mar. Chem. 2018. V. 205. P. 56–69.
Barbier E.B., Hacker S.D., Kennedy C., Koch E.W., Stier A.C., Silliman B.R. The value of estuarine and coastal ecosystem services // Ecol. monographs. 2011. V. 81. Iss. 2. P. 169–193.
Bravo-Linares C.M., Mudge S.M. Analysis of volatile organic compounds (VOCs) in sediments using in situ SPME sampling // J. Environ. Monit. 2007. V. 9. Iss. 5. P. 411–418.
Bravo-Linares C.M., Mudge S.M. Temporal trends and identification of the sources of volatile organic compounds in coastal seawater // J. Environ. Monit. 2009. V. 11. Iss. 3. P. 628‒641.
Bruyn W.J., Clark C.D., Pagel L., Takahara C. Photoproduction of formaldehyde, acetaldehyde and acetone from chromophoric dissolved organic matter in coastal and estuarine waters // J. Photochem. Photobiol., A. Chem. 2011. V. 226. Iss. 1. P. 16‒22.
Callaway R., Grenfell S., Lonborg Ch. Small estuaries: Ecology, environmental drivers and management challenger // Estuar. Coast. Shelf Sci. 2014. V. 150. P. 193–195.
Cao B., Nagarajan K., Loh K. Biodegradation of aromatic compounds: current status and opportunities for biomolecular approaches // Appl. Microbiol. Biotechnol. 2009. V. 85. Iss. 2. P. 207–228.
Coble A.A., Marcarelli A.M., Kane E.S., Toczydlowski D., Stottlemyer R. Temporal patterns of dissolved organic matter biodegradability are similar across three rivers of varying size // J. Geophys. Res.: Biogeosci. 2016. V. 121. Iss. 6. P. 1617–1631.
Dunfield P.F., Yuryev A., Senin P., Smirnova A.V., Stott M.B., Hou S., Ly B., Saw J.H., Zhou Z., Ren Y., Wang J., Mountain B.W., Crowe M.A., Weatherby T.M., Bodelier P.L.E., Liesack W., Feng L., Wang L., Alam M. Methane oxidation by an extremely acidophilic bacterium of the phylum Verrucomicrobia // Nature. 2007. V. 450. P. 879–882.
Giudice A.L., Bruni V., Domenico M.D., Michaud L. Psychrophiles ‒ cold-adapted hydrocarbon-degrading microorganisms // Handbook of hydrocarbon and lipid microbiology / Ed. Timmis K.N. Pondicherry: SPI-Publishing, 2010. P. 1897–1921.
Ifelebuegu A.O., Ukpebor J.E., Ahukannah A.U., Nnadi E.O., Theophilus S.C. Environmental effects of crude oil spill on the physicochemical and hydrobiological characteristics of the Nun River, Niger Delta // Environ. Monit. Assess. 2017. V. 189. Article number 173.
Jickells T.D., Andrews J.E., Parkes D.J., Suratman S., Aziz A.A., Hee Y.Y. Nutrient transport through estuaries: the importance of the estuarine geography // Estuar. Coast. Shelf Sci. 2014. V. 150. P. 215–229.
König G., Brunda M., Puxbaum H., Hewitt C.N., Duckham S.C., Rudolph J. Relative contribution of oxygenated hydrocarbons to the total biogenic VOC emissions of selected mid-European agricultural and natural plant species // Atmos. Environ. 1995. V. 29. Iss. 8. P. 861–874.
Lin C., Nguyen K.A., Vu C.T., Senoro D., Villanueva M.C. Contamination levels and potential sources of organic pollution in an Asian river // Water Sci. Technol. 2017. V. 76. Iss. 9. P. 2434–2444.
Little S., Spencer K.L., Schuttelaars H.M., Millward G.E., Elliott M.E. Unbounded boundaries and baselines: estuaries and coastal seas in rapidly changing world // Estuar. Coast. Shelf Sci. 2017. V. 198. P. 311–319.
Magoro M.L., Perissinotto R., Wooldridge T.H., Whitfield A.K. Micro-estuaries and micro-outlets as incipient estuarine systems – Does size and coastal connectivity count? // Sci. Total Environ. 2020. V. 703. 134707.
Pérez-Pantoja D., González B., Pieper D.H. Aerobic degradation of aromatic hydrocarbons // Handbook of hydrocarbon and lipid microbiology / Ed. K.N. Timmis. Pondicherry: SPI-Publishing, 2010. P. 799–837.
Perreault N.N., Andersen D.T., Pollard W.H., Greer C.W., Whyte L.G. Characterization of the prokaryotic diversity in cold saline perennial springs of the Canadian high Arctic // Appl. Environ. Microbiol. 2007. V. 73. P. 1532–1543.
Pye K., Blott S.J. The geomorphology of British estuaries: the effects of geological controls, antectdent conditions and human activities // Estuar. Coast. Shelf Sci. 2014. V. 150. P. 196–214.
Roebuck J.A., Avery G.B., Felix J.D., Kieber R.J., Mead R.N., Skrabal S.A. Biogeochemistry of ethanol and acetaldehyde in freshwater sediments // Aquat. Geochem. 2016. V. 22. Iss. 3. P. 177–195.
Statham P.J. Nutrients in estuaries – An overview and the potential impacts of climate change // Sci. Total Environ. 2012. V. 434. P. 213–227.
Upstill-Goddard R.C., Barnes J. Methane emissions from UK estuaries: re-evaluating the estuarine source of tropospheric methane from Europe // Mar. Chem. 2016. V. 180. P. 14–23.
Vergeynst L., Wegeberg S., Aamand J., Lassen P., Go-sewinkel U., Fritt-Rasmussen J., Gustavson K., Mosbech A. Biodegradation of marine oil spills in the Arctic with a Greenland perspective // Sci. Total Environ. 2018. V. 626. P. 1243–1258.
Yu Y.-J., Li C.-Y., Shen W., Wang Z., Xu P.-Q., Yu H.-X. Volatile compounds released by microalgae-water phase from Taihu Lake in China // Harmful Algae. 2019. V. 84. P. 56–63.
Zeng Y., Zou Y., Chen B., Grebmeier J.M., Li H., Yu Y., Zheng T. Polar biology phylogenetic diversity of sediment bacteria in the northern Bering Sea // Polar. Biol. 2011. V. 34. P. 907–919.
Дополнительные материалы отсутствуют.


