Водные ресурсы, 2022, T. 49, № 1, стр. 66-76
Структура и продукционный потенциал летнего фитопланктона озера Байкал в современный период
Н. А. Бондаренко a, И. И. Русанов b, С. М. Черницына a, *, О. В. Шубенкова a, А. С. Захаренко a, Т. В. Погодаева a, Н. В. Пименов b, Т. И. Земская a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: sveta@lin.irk.ru
Поступила в редакцию 22.12.2020
После доработки 22.06.2021
Принята к публикации 27.07.2021
- EDN: BFIISS
- DOI: 10.31857/S0321059622010059
Аннотация
Проведено исследование структуры и продукционных показателей фитопланктона (биомасса, интенсивность фотосинтеза, содержание хлорофилла а, ассимиляционные числа) в прибрежной и пелагической зонах южной и центральной котловин оз. Байкал в летний период 2018 г. Основными продуцентами прибрежной зоны были нанопланктонные фитофлагелляты, развитию которых способствовали высокие концентрации растворенного органического вещества. В реках и приустьевых акваториях озера максимальная концентрация растворенного органического вещества достигла 12.95 мг л–1 и отмечена у юго-западного берега, в пелагиали – в центральной части Малого Моря – от 2.26 до 3.18 мг л–1. На пелагических станциях были выше количественные показатели фитопикопланктона. Содержание хлорофилла в фитопланктоне большинства станций не превышало значений, приводимых ранее для летнего фитопланктона озера (от 0.1 до 4 мкг л–1), а средняя скорость фотосинтеза в поверхностном слое озера была равна 26.3 ± 8.7 мкг С л–1 сут–1 и превышала значения 18.5 ± 5.9 мкг С л–1 сут–1, опубликованные для летнего фитопланктона южной и центральной котловин Байкала, развивающегося на той же глубине. Высокие продукционные характеристики обеспечены как дополнительным притоком питательных веществ, так и вегетацией мелких форм микроводорослей.
ВВЕДЕНИЕ
В настоящее время в результате климатических изменений и высокой антропогенной нагрузки в гидросфере происходят значительные перестройки, приводящие к отрицательным последствиям для водных экосистем. Усиливающаяся проблема – эвтрофикация морских и пресноводных водоемов под влиянием процесса обогащения вод биогенными элементами, что приводит к увеличению первичной продукции в экосистемах [15, 20, 27, 41, 44]. Климатические колебания также вызывают изменения как структуры водных сообществ, так и обилия биоты [13, 15, 34, 35, 38, 43–45]. В связи с высокой экологической пластичностью и скоростью размножения индикаторами этих изменений служат в первую очередь водоросли [44].
В последние годы в донных сообществах прибрежной зоны оз. Байкал зарегистрирован кризис, обусловленный прогрессирующей эвтрофикацией [40, 48]. Выявлены структурные перестройки и в весеннем фитопланктоне прибрежной зоны озера, которые выразились в снижении роли крупноклеточных диатомовых водорослей байкальского комплекса и в увеличении обилия мелких широко распространенных диатомей и нанопланктонных жгутиковых [2, 3]. Авторы соотнесли их как с антропогенным, так и с климатическим влиянием. Изучение пелагического планктона в весенний период 1990–2016 гг. показало, что структурные изменения произошли не только в литоральной зоне, но и по всей акватории озера и не только в фитопланктоне, но и во всем микропланктоне [30]. Отмечено доминирование мелкоразмерных видов в фитопланктоне, мелких и миксотрофных олиготрих – среди инфузорий; появились мелкоклеточные окрашенные и бесцветные жгутиковые, ранее не регистрируемые в озере. Анализ состояния пелагического фитопланктона озера за период 1977–2003 гг. показал, что изменения, связанные с глобальным потеплением, произошли и в летнем сообществе первичных продуцентов [34, 35, 38]. Температура поверхностного слоя воды увеличилась на 2.0°С, а содержание хлорофилла – на 46%. Однако, как считают авторы [34, 35, 38], признаки эвтрофирования во всех трех котловинах озера не отмечены, изменения затронули только южную котловину. Исследование позднелетнего фитопланктона за период 1994–2013 гг. выявило несколько иную картину: ни в одном из районов озера не обнаружено отчетливых трендов повышения среднегодовой температуры воды [14]. Для большинства лет температура воды не отличалась от средней многолетней. В открытых районах Байкала на протяжении двух последних десятилетий не обнаружено значимого повышения численности позднелетнего фитопланктона. Поэтому, как считают авторы, состояние фитопланктона в период позднего лета можно оценить как стабильное, однако отмечаются признаки повышения трофности вод у западного побережья Южного Байкала.
Анализ структуры и функционирования подледного фитопланктона оз. Байкал на современном этапе проведен авторами настоящей статьи ранее в [3, 31, 32]. Выяснено, что у населенных пунктов доступность легкоминерализуемых органических веществ антропогенного происхождения, поступающих в воды озера с притоками, способствовала интенсивному размножению нанопланктонных жгутиконосцев. Высокий продукционный потенциал фитофлагеллят позволял накапливаться значительной биомассе, что приводило к эвтрофированию прибрежной зоны и может служить источником для увеличения первичной продукции (ПП) пелагиали озера [3], поскольку в приустьевых акваториях таких рек происходит изменение продукционного потенциала микробиоценозов и снижение их роли как “биологического фильтра” [8]. Задачей данного исследования был анализ современного состояния летнего фитопланктона оз. Байкал как в прибрежной зоне, так и в его пелагиали.
МАТЕРИАЛЫ И МЕТОДЫ
Описание станций отбора проб
Данное исследование – часть комплексных работ, проведенных 12–21 июля 2018 г. в южной и центральной котловинах оз. Байкал, а также в прол. Малое Море. Изучение структуры и функциональных характеристик фитопланктона проводили на 12 станциях (рис. 1), 7 – в мелководной зоне озера: 6 – в районах рек Переемная (ПЕ), Большая Осиновка (БО), Солзан (СО, восточный берег), Крестовка (КР), Большая Черемшаная (БЧ), Голоустная (ГО, западный берег). Ст. 7 находилась в зал. Мухор (Малое Море, МХ). В районах рек пробы отбирали в трех точках: в реке, в устье притока и на расстоянии 50–200 м от устья по направлению к центру озера, на глубинах 0, 2 м и в придонном слое. В пелагической зоне находились станции: 1 – напротив г. Байкальск (БК) над глубиной 380 м; 2 – в зал. Лиственничном (ЛИ) над глубиной ~600 м; 3 – в районе метанового сипа Бабушкин (ББ) над глубиной 40 м; 4 – в районе Академического хребта (АХ); 5 – в центре Малого Моря вблизи п. Хужир (ММ). На пелагических станциях обследовался трофогенный слой (0–25 м), где пробы отбирали на глубинах 0, 2, 5, 10, 15 и 25 м.
Измерение рН проводили с помощью pH-метра 3310 (“WTW”, Германия). Концентрацию кислорода измеряли методом Винклера. Определение биогенных элементов проводили общепринятыми в гидрохимии пресных вод фотометрическими методами [24, 49]. Содержание растворенного органического углерода (РОУ) определяли методом каталитического высокотемпературного окисления образцов при 850°С с последующим определением СО2 с помощью ИК-детектора на высокотемпературном анализаторе углерода “Vario TOC cube” (“Elementar Analysensysteme GmbH”, Германия).
Пробы фитопланктона объемом 1000 мл фиксировали раствором Утермеля, концентрировали методом седиментации. При обработке материала применяли традиционные в гидробиологии методы [10]. Концентрат просматривали в тройной повторности в камере Нажотта объемом 0.1 мл в световом микроскопе “Peraval”. При увеличении микроскопа ×720 учитывали и идентифицировали сетной фитопланктон (размер клеток >20 мкм) и нанопланктон (размер от 2 до 20 мкм). Биомассу водорослей определяли с учетом индивидуальных объемов их клеток [16]. Определение водорослей проводили по [6, 7, 17, 26, 39, 46]. Названия водорослей приведены согласно современной классификации [33].
Пикофитопланктон (размер клеток <2 мкм) учитывали в пробах, фиксированных глутаровым альдегидом до 2%-й конечной концентрации. 10–15 мл образцов фильтровали через поликарбонатные фильтры “Millipore” с диаметром пор 0.45 мкм. Для эпифлуоресцентной микроскопии фильтры подсушивали на воздухе, помещали на каплю иммерсионного масла под покровное стекло и исследовали при увеличении ×1000 в микроскопе “Axio Imager” (“Zeiss”), снабженном ртутной лампой “HBO 100W” и камерой “AxioCam Cameras”. Эукариотический пикопланктон учитывали по автофлуоресценции хлорофилла (красное свечение) при наблюдении под синим фильтром (длина волны 480 нм). Цианобактерии идентифицировали по автофлуоресценции дополнительных фотосинтетических пигментов фикобилинов при наблюдении под зеленым фильтром (длина волны 540 нм).
Скорость ПП определяли радиоизотопным методом с добавлением NaH14CO3. Воду наливали из батометров в склянки объемом 100 мл (предварительно промыв водой пробы) под пробку с помощью силиконовой трубки без турбулентности. Все склянки при отборе были затемнены. На каждом горизонте использовали две прозрачные и две темные склянки, покрытые алюминиевой фольгой. Темные склянки были контролем для светлых склянок. После отбора в затемненном помещении во все склянки добавляли по 100 мкл стерильного раствора NaH14CO3 (специфическая активность 58 мКи моль–1, 4 мкКи на пробу, “American Radiolabeled Chemicals Inc.”). Затем снимали общие затемняющие чехлы и для каждой светлой склянки использовали индивидуальный чехол, калиброванный по степени пропускания фотосинтетически активной радиации, соответствующей освещенности на горизонте отбора пробы. Склянки инкубировали в проточном аквариуме на палубе судна от 4 до 6 ч. По завершении экспозиции содержимое флаконов фиксировали 1 мл 0.05 н HCl. Дальнейшую обработку проб проводили по методике, подробно описанной ранее в [3, 8].
Содержание хлорофилла a определяли согласно методике SCOR-UNESCO (1964 г.). Пробы концентрировали на мембранные фильтры (“Владисарт”) с размером пор 0.45 мкм. Объем профильтрованных проб варьировал от 1400 до 2060 мл. Экстракцию хлорофилла проводили 90%-м ацетоном с добавлением MgCO3. Измерения выполняли на спектрофотометре “Cintra 20” (“GBC Scientific Equipment”, Австралия).
Для статистической обработки применяли метод главных компонент с нормализацией и центрированием данных, который выполнен и визуализирован с использованием пакетов “vegan” и “ggfortify” в среде “R” [37], и метод корреляционного анализа Пирсона в рамках приложения “ExStatR” (совместное использование “Microsoft Excel” и программы статистической обработки “R”) [19]. При оценке численности фитопикопланктона и сравнении интенсивности фотосинтеза использованы средние значения выборок со стандартной ошибкой.
РЕЗУЛЬТАТЫ
Гидрохимическая характеристика станций пробоотбора
Вода притоков, приустьевых акваторий и пелагической части озера в момент исследования характеризовалась как нейтральная или щелочная (рН в пределах 7.03–8.55) и только в устье р. Переемной и в зоне ее влияния – слабокислая (6.75–6.78). Концентрация кислорода была высокой (10.23–14.40 мг л–1), минимальные концентрации (9.02–9.87 мг л–1) зарегистрированы в р. Переемной, в ее приустьевой акватории и в р. Солзан. Содержание растворенного органического вещества (РОВ) в реках и приустьевых акваториях юго-восточной части озера менялось от 1.37 до 2.53 мг л–1, в юго-западной было выше – от 2.09 до 12.95 мг л–1. Концентрации РОВ в пелагиали на станции метанового сипа Бабушкин колебались от 2.04 до 2.22, в центральной части Малого Моря от 2.26 до 3.18, а в зал. Лиственничном от 1.96 до 2.44 мг л–1. Содержание биогенных элементов ${\text{РО}}_{4}^{{3 - }},$ ${\text{NH}}_{4}^{ + },$ ${\text{NO}}_{2}^{ - },$ ${\text{NO}}_{3}^{ - }$ в реках и приустьевых акваториях юго-восточной части озера менялось в пределах 0.001–0.006, 0.002–0.005, 0.001–0.006 и 0.42–0.95 мг л–1 соответственно. Концентрации на станциях у юго-западного берега были намного выше: 0.011–0.122, 0.002–0.039, 0.001–0.113 и 0.05–5.32 мг л–1, а в пелагиали составили 0.002–0.038, 0.002–0.009, 0.000–0.002 и 0.02–0.53 мг л–1 соответственно. Максимальные концентрации ${\text{РО}}_{4}^{{3 - }},$ ${\text{NH}}_{4}^{ + },$ ${\text{NO}}_{2}^{ - },$ ${\text{NO}}_{3}^{ - }$ найдены в р. Большая Черемшаная и в ее устье: 0.099–0.122, 0.031–0.039, 0.017–0.113, 5.07–5.32 мг л–1 соответственно.
Пикофитопланктон
В пелагиали в период исследования фитопикопланктон был представлен видами родов Synechococcus Sauv. и Synechocystis Nag. Их численность достигала от 1.44 ± 0.07 до 218 ± 2.31 млн кл. л–1 и от 0.58 ± 0.13 до 4.02 ± 0.43 млн кл. л–1 соответственно. Биомасса фитопикопланктона была высокой и на некоторых станциях превышала биомассу сетного фитопланктона и нанофитопланктона (табл. 1). В воде рек и в акваториях, подверженных влиянию притоков с юго-западного берега, пикофитопланктон единичен, а в прибрежной зоне у рек юго-восточного берега его биомасса значительна – 300–1213 мкг л–1.
Таблица 1.
Количественные характеристики микроводорослей в реках и в акватории оз. Байкал, июнь 2018 г. (здесь БМ – включение углерода бикарбоната в биомассу; РОУ – включение углерода бикарбоната в растворенный органический углерод)
| Станция | Точка отбора | Первичная продукция, мкг С л–1 сут–1 |
Биомасса
фитопланктона, мкг л–1 |
Биомасса фитопико- планктона, мкг л–1 |
Содержание хлорофилла, мкг л–1 |
САЧ | ||
|---|---|---|---|---|---|---|---|---|
| БМ | РОУ | общая | ||||||
| р. Большая Черемшанка | Река | 31.6 | 26.3 | 57.9 | 777.0 | 0 | 2.79 | 20.7 |
| Устье | 51.7 | 57.4 | 109 | 871.7 | 0 | 3.30 | 33.1 | |
| 0 м | 10.5 | 12.1 | 22.6 | 109.3 | 16.6 | 1.27 | 17.7 | |
| 2 м | 27.9 | 19.6 | 47.5 | 211.8 | 26.4 | 1.26 | 37.7 | |
| 5 м | 6.1 | 3.9 | 10.0 | 99.8 | 35.2 | 1.11 | 8.9 | |
| р. Крестовка | Река | 24.3 | 20.1 | 44.4 | 418.3 | 0 | 0.88 | 50.4 |
| Устье | 68.4 | 56.7 | 125 | 665.0 | 25.4 | 3.55 | 35.2 | |
| 0 м | 21.3 | 20.6 | 41.9 | 30.0 | 24.9 | 0.92 | 45.5 | |
| 2 м | 51.5 | 40.8 | 92.3 | 264.6 | 18.6 | 1.44 | 64.1 | |
| 5 м | 28.0 | 25.9 | 53.9 | 156.8 | 20.4 | 1.60 | 33.7 | |
| зал. Лиственничный | 0 м | 18.4 | 18.6 | 37.0 | 35.7 | 10.5 | 0.59 | 62.7 |
| 2 м | 13.2 | 11.0 | 24.2 | 29.0 | 4.9 | 0.53 | 45.6 | |
| 5 м | 8.6 | 9.9 | 18.5 | 18.1 | 15.1 | 0.47 | 39.3 | |
| 10 м | 6.4 | 7.9 | 14.3 | 16.0 | 8.3 | 0.49 | 29.3 | |
| 15 м | 2.1 | 4.8 | 6.9 | 32.8 | 31.3 | 0.47 | 14.6 | |
| 25 м | 0.4 | 0.9 | 1.3 | 25.5 | 7.2 | 0.47 | 2.7 | |
| р. Голоустная | Река | 16.6 | 11.7 | 28.3 | 61.0 | 0 | 1.28 | 22.1 |
| Устье | 19.0 | 10.4 | 29.4 | 437.0 | 0 | 1.46 | 20.2 | |
| 0 м | 8.0 | 11.5 | 19.5 | 323.0 | 8.8 | 1.31 | 14.9 | |
| 2 м | 13.0 | 6.4 | 19.4 | 190.0 | 32.7 | 0.93 | 20.8 | |
| 5 м | 14.4 | 14.9 | 29.3 | 131.0 | 38.1 | 1.11 | 26.4 | |
| Академический Хребет | 0 м | 12.9 | 14.2 | 27.1 | 109.0 | |||
| зал. Мухор, Малое Море | 0 м | 30.8 | 25.7 | 56.5 | 179.2 | 118.0 | 0.56 | 100.9 |
| Малое Море, центр | 0 м | 25.0 | 20.2 | 45.2 | 256.5 | 82.1 | 0.46 | 98.3 |
| 2 м | 25.9 | 29.2 | 55.1 | 126.0 | 197.8 | 0.40 | 137.8 | |
| 5 м | 24.9 | 20.6 | 45.5 | 189.2 | 212.4 | 0.73 | 62.2 | |
| 10 м | 24.0 | 21.2 | 45.2 | 116.0 | 166.5 | 0.97 | 46.6 | |
| 15 м | 12.6 | 13.3 | 25.9 | 193.0 | 139.5 | 0.94 | 27.6 | |
| 25 м | 2.2 | 3.5 | 5.7 | 127.5 | 53.5 | 0.68 | 8.4 | |
| р. Переемная | Река | 5.8 | 6.6 | 12.4 | 60.0 | 0 | 0.37 | 33.6 |
| Устье | 8.2 | 9.4 | 17.6 | 49.0 | 0 | 0.22 | 79.8 | |
| 0 м | 16.1 | 18.4 | 34.5 | 54.0 | 5.8 | 0.28 | 123.3 | |
| 2 м | 18.6 | 17.0 | 35.6 | 67.0 | 0 | 0.45 | 79.2 | |
| р. Осиновка | Река | 6.5 | 11.4 | 17.9 | 225.0 | 0 | 0.87 | 20.6 |
| Устье | 8.0 | 11.2 | 19.2 | 250.0 | 0 | 1.04 | 18.5 | |
| 0 м | 54.3 | 37.8 | 92.1 | 112.7 | 528.5 | 0.64 | 143.8 | |
| 2 м | 58.1 | 39.6 | 97.7 | 83.1 | 299.9 | 1.37 | 71.3 | |
| 3.5 м | 46.8 | 61.5 | 108 | 111.6 | 372.7 | 1.37 | 79.1 | |
| р. Солзан | Река | 3.02 | 3.22 | 6.24 | 121.0 | 9.3 | 0.34 | 18.4 |
| Устье | 1.14 | 1.49 | 2.63 | 25.0 | 5.4 | 0.31 | 8.5 | |
| 0 м | 33.8 | 21.2 | 55.0 | 91.7 | 1213.2 | 0.77 | 71.4 | |
| 2 м | 30.8 | 36.3 | 67.1 | 63.5 | 399.5 | 1.11 | 60.4 | |
| 4.5 м | 12.4 | 13.2 | 25.6 | 75.0 | 194.9 | 1.01 | 25.4 | |
| г. Бабушкин | 0 м | 57.3 | 34.8 | 92.1 | 324.0 | 554.2 | 2.44 | 37.7 |
| 2 м | 40.0 | 33.7 | 73.7 | 149.1 | 746.3 | 2.37 | 31.1 | |
| 5 м | 31.7 | 50.6 | 82.3 | 216.6 | 495.3 | 2.32 | 35.4 | |
| 10 м | 5.6 | 7.6 | 13.2 | 330.9 | 417.1 | 2.49 | 5.3 | |
| 15 м | 1.11 | 3.19 | 4.3 | 132.4 | 532.6 | 2.57 | 1.7 | |
| 25 м | 0.72 | 1.82 | 2.54 | 261.0 | 442.8 | 2.69 | 0.9 | |
| г. Байкальск | 0 м | 22.1 | 26.7 | 48.8 | 104.0 | 553.9 | 0.98 | 49.8 |
| 2 м | 29.6 | 25.9 | 55.5 | 92.0 | 634.9 | 0.98 | 56.6 | |
| 5 м | 41.4 | 36.7 | 78.1 | 124.0 | 834.9 | 2.76 | 28.3 | |
| 10 м | 14.6 | 12.8 | 27.4 | 37.3 | 591.8 | 1.36 | 20.1 | |
| 15 м | 2.21 | 3.92 | 6.13 | 63.0 | 355.6 | 1.43 | 4.3 | |
| 25 м | 4.6 | 8.4 | 13.0 | 92.0 | 29.7 | 0.29 | 44.7 | |
Структура фитопланктона
Доминантами сетного фитопланктона пелагических станций были два вида зеленых водорослей – Monoraphidium contortum (Thur.) Komarkova-Legnerova и M. pseudomirabile Hindak (табл. 2), численность которых в слое воды 0–25 м колебалась в пределах 17.5–420 тыс. кл. л–1. Нанопланктон на всех станциях был представлен криптофитовым Rhodomonas pusilla (Bachm.) Javorn. (табл. 2) – 11.7–365 тыс. кл. л–1, а в Малом Море и у юго-восточного берега была обильной гаптофитовая Chrysochromulina parva Lackey, максимальные концентрации которой достигали 240–277 тыс. кл. л–1. Наибольшие биомассы фитопланктона отмечены в пелагиали против г. Бабушкина и в Малом Море (табл. 1), минимальные – в зал. Лиственничном.
Таблица 2.
Доминирующие виды фитопланктона (объем клеток 100–500 мкм3; исключение – Navicula, Synedra, Gomphonema и Diatoma mesodon –1000–4000 мкм3)
| Исследованные станции | Доминирующие виды | |
|---|---|---|
| нанопланктон | сетной планктон | |
| Реки юго-западного берега | Chlamydomonas spp. Rhodomonas pusilla |
Diatoma mesodon Fragilaria vaucheriae Nitzschia spp. Gomphonema spp. Cymbella spp. |
| Пелагическая, юго-западный берег | Rh. pusilla | Monoraphidium contortum M. pseudomirabile |
| Прибрежные, юго-западный берег | Chlamydomonas spp. Rh. pusilla Chrysochromulina parva |
M. contortum M. pseudomirabile |
| Реки, юго-восточный берег | Rh. pusilla Glenodinium spp. |
Navicula spp. Synedra spp. Gomphonema spp. D. mesodon |
| Пелагические, юго-восточный берег | Rh. pusilla Ch. parva |
M. contortum M. pseudomirabile |
| Прибрежные, юго-восточный берег | Ch. parva Rh. pusilla Glenodinium spp. |
M. contortum M. pseudomirabile |
| Прибрежная, Малое Море | Chlamydomonas spp. Dolichospermum spp. |
M. contortum M. pseudomirabile |
| Пелагическая, Малое Море | Ch. parva Rh. pusilla |
M. contortum M. pseudomirabile |
| Пелагическая, центральная котловина | Rh. pusilla Ch. parva |
M. contortum M. pseudomirabile |
В реках основу фитопланктона составляли крупные формы бентосных диатомовых водорослей родов Gomphonema Ehr., Cymbella Ag., Rhapa-lodia O. Müll., Synedra Ehr., Hannaea Patrick, Nitzschia Hass., Fragilaria Lyngb., а также Diatoma mesodon Ehr. (Grun.). В р. Голоустной вместе с диатомовыми присутствовало незначительное количество цианопрокариот родов Pseudoanabaena Lauterborn, Lyngbia Ag., Dolichospermum Ralfs ex Bornet et Flahault, численность которых возрастала к устью притока, где доминировали представители рода Dolichospermum. Здесь же в планктоне отмечены нити донной водоросли Spirogyra Link.
С водами притоков в прибрежную зону поступали нанопланктонные жгутиковые родов Cryptomonas Ehr. из криптофитовых и Chlamydomonas Ehr. из зеленых – показатели загрязнения воды легкорастворимой органикой.
Максимальное число видов в реках – 18–21, в устьях и приустьевых акваториях – до 27, минимальное количество выявлено на пелагических станциях – 11–14. Самые высокие биомассы отмечены в реках Большая Черемшаная и Крестовке, минимальные в р. Переемной (табл. 1).
Интенсивность первичной продукции
Диапазон изменений величин суммарной интенсивности фотосинтеза составил от 1.27 мкг С/л–1 сут–1 на нижней границе фотослоя в зал. Лиственничном до 125 мкг С/л–1 сут–1 в устье р. Крестовки. Обращает на себя внимание закономерность распределения величин ПП для юго-восточной и юго-западной частей оз. Байкал (табл. 1). В юго-западной части максимальные значения ПП детектированы в реках и их устьях, а в приустьевой акватории озера активность фитопланктона существенно ниже. Напротив, в юго-восточной части озера минимальные величины зафиксированы в реках и устьях. Для пелагических станций максимальные величины ПП детектированы в районе метанового сипа Бабушкин, а минимальные – в зал. Лиственничном.
В процессе фотосинтеза от 26 до 65% углерода бикарбоната включалось в биомассу (БМ) фитопланктона и 35–74% ассимилировалось в РОУ. Эти крайние диапазоны изменений единичные. Вне зависимости от акватории и интенсивности ПП диапазон включения углерода бикарбоната в биомассу БМ и РОУ составил в среднем 46–51 и 49–54% соответственно.
Концентрация хлорофилла a
В планктоне на большинстве станций концентрация хлорофилла a была невысокой (табл. 1) и только на станциях в устьях Крестовки и Большой Черемшаной содержание пигмента было выше – от 3.30 до 3.55 мкг л–1. Значительные величины отмечены и для станции в районе метанового сипа Бабушкин: 2.32–2.69 мкг л–1 в слое воды 0–25 м.
Суточные ассимиляционные числа
Повышенные суточные ассимиляционные числа (САЧ) отмечены в слое воды 0–5 м и с глубиной снижались (табл. 1). Максимальные показатели – на станциях в Малом Море и в приустьевых акваториях рек Переемной и Большая Осиновка (от 100.9 до 143.8), минимальные – в реках и их устьях (18.4–50.4).
Корреляционный анализ
С помощью метода главных компонент с нормализацией и центрированием данных построили диаграммы сопряженности биомассы сетного фитопланктона и нанофитопланктона, фитопикопланктона и общей биомассы фитопланктона с продукционными показателями всех планктонных микроводорослей и некоторыми химическими параметрами (рис. 2).
Рис. 2.
Диаграмма рассеяния точек в пространстве первых двух главных компонент, построенная на основе химического состава, концентраций биогенных элементов и биомассы всех составляющих фитопланктона (сетного, нано- и пикопланктона) в исследуемых образцах. Стрелками отображены векторы, направленные по градиентам изменения исследуемых показателей в образцах.
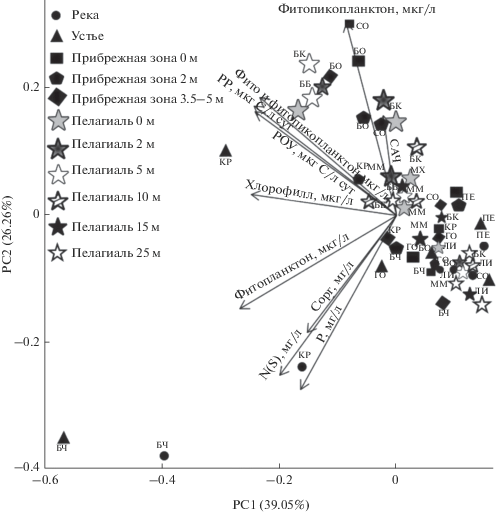
На рис. 2 видно различие связей между исследуемыми компонентами на разных станциях. Анализ данных показал, что исследуемые параметры на станциях в р. Большая Черемшаная и в ее устье, а также в р. Крестовке образуют отдельный кластер, связанный с биомассой сетного фитопланктона, биогенными элементами и органическим углеродом. К вектору биомассы фитопикопланктона тесно примыкают показатели пелагических станций в районе городов Байкальска и Бабушкина, а также в Малом Море, где пикопланктон был основным продуцентом. Большинство прибрежных станций расположено в одном кластере, примыкающем к общей биомассе фитопланктона. Достоверная положительная корреляция выявлена между скоростью фотосинтеза и концентрацией РОУ (r = 0.98, p < 0.05, n = 53), а также между биомассой сетного фитопланктона и концентрациями биогенных элементов (r = 0.57 для фосфора, r = 0.69 для азота, p < 0.05). Достоверных связей между биомассой фитопикопланктона и концентрациями биогенных элементов (r от –0.25 до 0.36, p > 0.05) не найдено.
ОБСУЖДЕНИЕ
Проведенные исследования показали, что самые богатые участки как по видовому составу, так и по биомассе фитопланктона – устья рек. Отсюда в акваторию озера поступают и новые виды. Ситуация с поступлением новых представителей родов Cryptomonas и Chlamydomonas проанализирована авторами статьи ранее в [3]. В прибрежной зоне у р. Переемной видовой состав фитопланктона озера пополняется диатомеей Aulacoseira subarctica (O. Müll.) Haworth – типичным представителем горных озер Прибайкалья [3]. Установлено, что не только видовое богатство, но и другие показатели фитопланктона, такие как биомасса, ПП, содержание хлорофилла, были высокими на станциях, расположенных в устьях малых притоков оз. Байкал, подвергающихся активной антропогенной нагрузке. Здесь же отмечены максимальные концентрации РОВ и биогенных элементов. Основной вклад в биомассу на этих устьевых станциях принадлежал крупным формам диатомей и колониальным цианопрокариотам, а фитонанопланктон и фитопикопланктон имели подчиненное значение. В прибрежной зоне озера наиболее функционально активными были доминирующие здесь нанопланктонные фитофлагелляты, о чем свидетельствуют высокие значения САЧ (табл. 1). Если в подледный период жгутиконосцы в основном были представлены криптофитовыми рода Cryptomonas, то летом доминантами были криптофитовая водоросль Rhodomonas pusilla и гаптофитовая Chrysochromulina parva.
На большинстве пелагических станций летом 2018 г. основным продуцентом органического вещества был фототрофный пикопланктон (табл. 1). Количественные показатели фототрофного пикопланктона были значительными в пелагиали Малого Моря и у восточного берега оз. Байкал, где не отмечено высоких концентраций биогенных элементов и РОВ. Вклад в биомассу нано- и сетного фитопланктона здесь был менее значим, и только в пелагиали зал. Лиственничного их биомасса выше. В воде рек на юго-западном берегу озера и в акваториях, подверженных их влиянию, пикофитопланктон единичен.
Ранее установлено [1], что в оз. Байкал летом в фотосинтетическом процессе принимали участие первичные продуценты трех категорий: в первую очередь пикопланктонные водоросли (до 70–85% синтезированного органического вещества); нанопланктон (до 30%); роль сетного планктона летом была минимальной (≤15% общей величины первичной продукции).
Конец июля и август – время максимального развития в пелагиали Байкала фототрофного пикопланктона [1, 5, 21, 22, 28, 29], численность которого иногда достигала нескольких миллиардов в 1 л. Прозрачность воды по белому диску в это время снижалась до 3.5–5.0 м. В прибрежной зоне, наоборот, фототрофный пикопланктон летом был менее развит. Численность его бывает на порядок меньше, чем в пелагиали [22, 29]. Следовательно, в озере, как и прежде, в продукционном процессе участвуют первичные продуценты трех категорий, значение которых по акватории изменчиво. Перестройки затронули размерную и таксономическую структуру фитопланктона как прибрежной зоны, так и пелагиали: по сравнению с XX в. [1, 2] резко возросла концентрация нанопланктонных фитофлагеллят.
В настоящее время фитофлагелляты стали доминировать в летнем планктоне многих водных экосистем: в Великих Американских озерах [27, 42], Онежском [20] и Ладожском [15] озерах, водохранилищах Волги [13]. Авторы связывают эти изменения как с увеличением биогенной нагрузки, так и с климатическими перестройками.
В июле 2018 г. интенсивность ПП была существенно выше, чем в подледный период того же года [3], что указывает на активное метаболическое состояние фитопланктона во всех исследованных акваториях. Необходимо отметить, что в подледный период при значительно более низких величинах фотосинтеза и менее благоприятных внешних условиях распределение долей углерода в БМ и РОУ было сходным [3]. Летом максимальные ПП в юго-западной части озера отмечены в реках и их устьях, а в юго-восточной, напротив, была минимальная фотосинтетическая активность в сравнении с приустьевой зоной. Такая же закономерность фотосинтетической активности была отмечена и в подледный период 2018 г. [3]. Интенсивный фотосинтез зарегистрирован у западного берега в устьях исследованных рек (Большая Черемшанка, Крестовка). Эти величины выше значений, приводимых для летнего фитопланктона ранее, – 90 мкг С л–1 сут–1 [1]. Здесь, как в зимний период [3], фотосинтез стимулируется стоками от населенных пунктов. В юго-восточной части озера максимальные величины фотосинтеза найдены в пелагиали напротив г. Бабушкина, а также в прибрежных акваториях рек Солзан и Большая Осиновка. Здесь отмечено поступление подземных вод с повышенными концентрациями некоторых ионов (сульфата, нитрата, нитрита) за счет влияния стоков из карт шлам-лигнина, оставшихся после закрытия Байкальского ЦБК [8].
Характеризуя вертикальное распределение скорости фотосинтеза, необходимо отметить, что своеобразие пелагиали Байкала заключается в большой мощности трофогенного слоя. Благодаря высокой прозрачности воды и интенсивному поступлению солнечной радиации он достигает 25–30 м, иногда больше [5]. В июле 2018 г. на станциях в прибрежной зоне озера максимальная скорость фотосинтеза отмечена для глубин 2–5 м. Для пелагиали был характерен неравномерный вертикальный профиль активности фотосинтеза: высокие показатели наблюдались в верхних слоях (0–5 м), с глубиной резко снижались, на 25 м составляли 3–27% от величин на поверхности. На некоторых станциях в поверхностном слое происходило фотоингибирование процесса, поэтому максимальная интенсивность ПП детектирована в подповерхностных (2–5 м) горизонтах. Это распространенное в озерах и морях явление ранее отмечалось для оз. Байкал и другими авторами [1, 5, 9].
На пелагических станциях резкое снижение ПП регистрировалось уже с глубины 5 м (табл. 1). Такое вертикальное распределение скорости фотосинтеза на Байкале обычно наблюдалось, как и в исследуемом случае, в моменты интенсивной вегетации пикопланктонных водорослей [1, 5]. В это время часто наблюдался так называемый “эффект самозатенения” [47], когда доступ света к водорослям, обитающим в более глубоких слоях воды, ограничен и максимальные показатели фотосинтеза регистрировались на поверхности или в подповерхностном слое, далее фиксировался резкий спад фотосинтетической активности. Пространственные различия также тесно связаны со степенью развития фитопланктона и особенностями биологии доминирующих в нем форм, в частности – с их требованиями к свету, а также с физиологическим состоянием популяций водорослей [1]. При массовом развитии жгутиковых форм водорослей, что было выявлено и в июле 2018 г., максимумы фотосинтеза отмечают на больших глубинах (5–15 м). Эти организмы активно перемещаются в поиске оптимальных для себя условий. Аналогичное смещение максимальных величин фотосинтеза на некоторую глубину летом в условиях интенсивной солнечной радиации при массовом развитии жгутиковых водорослей описано для многих озер, в том числе для Уиндермир [36], Плещеево [23], разнотипных озер Карельского перешейка [25].
По данным настоящего исследования, средняя скорость фотосинтеза на исследованных в июле 2018 г. озерных станциях в поверхностном слое (0 м) была равна 26.3 ± 8.7 мкг С л–1 сут–1 (n = 12) и превышала 18.5 ± 5.9 мкг С л–1 сут–1 (n = 9), что опубликовано ранее для летнего фитопланктона южной и центральной котловин Байкала [4], развивающегося на той же глубине.
Содержание хлорофилла в фитопланктоне на большинстве станций не превышало значений, приводимых другими авторами для летнего фитопланктона озера: 1–2 [4], 1.3 [12], 0.6 мкг л–1 при колебании в пределах 0.1–4 [9], 0.6 [11], 0.82–1.2 мкг л–1 [38]. Превышающие концентрации найдены только в местах значительной антропогенной нагрузки: в устьях рек Большая Черемшанка и Крестовки, а также на станции у г. Бабушкина.
САЧ озерного фитопланктона в верхних горизонтах воды достаточно высоки (табл. 1), что свидетельствует о высокой фотосинтетической активности мелкоклеточных первичных продуцентов открытого Байкала. Преобладающие в реках крупные формы диатомовых водорослей малоактивны. Это еще раз доказывает хорошо известный факт, что мелкие формы водорослей обладают высоким фотосинтетическим потенциалом [4, 18, 44]. В летний период XX в. в планктоне Байкала не отмечалось массового развития фитофлагеллят, поэтому полученные в настоящем исследовании значения САЧ фитопланктона озера превышают приводимые ранее [4] – от 2.5 до 10.0.
ЗАКЛЮЧЕНИЕ
Анализ результатов комплексного исследования фитопланктона в прибрежной зоне и пелагиали южной и средней котловин оз. Байкал, а также полученных в июле 2018 г. и опубликованных ранее, позволил выявить некоторые закономерности. Показано, что продукционная активность фитопланктона (скорость фотосинтеза, суточные ассимиляционные числа) на большинстве станций была достаточно высокой по сравнению с аналогичными величинами, приводимыми для Байкала ранее [1, 4, 9]. Показатели значительной активности у юго-западного берега отмечены в местах впадения притоков, подвергающихся существенной антропогенной нагрузке. Здесь высокие количественные характеристики в первую очередь были обеспечены дополнительным поступлением биогенных элементов и РОВ. У юго-восточного берега, напротив, максимальные показатели зарегистрированы на озерных станциях, где скорость фотосинтеза поддерживалась не только дополнительным поступлением биогенных элементов, но и вегетацией пикопланктонных форм водорослей.
Кроме того, работы, проведенные в летний период, подтверждают установленный для зимнего фитопланктона Байкала [3] факт, что основной фактор, стимулирующий рост жгутиконосцев в акваториях озера у притоков, подвергающихся активной антропогенной нагрузке, – доступность легкоминерализуемых органических веществ. Дополнительным источником может служить также РОВ, образующееся как при функциональной активности (прижизненные выделения), так и при разложении макроводорослей и цианобактерий, интенсивно развивающихся на дне мелководных участков оз. Байкал [48].
Список литературы
Бондаренко Н.А., Гусельникова Н.Е. Продукция фитопланктона Южного Байкала // Изв. СО АН СССР. 1989. Вып. 1. С. 77–80.
Бондаренко Н.А., Логачева Н.Ф. Структурные изменения в фитопланктоне прибрежной зоны озера Байкал // Гидробиол. журн. 2016. № 6. С. 17–26.
Бондаренко Н.А., Русанов И.И., Черницына С.М., Шубенкова О.В., Пименов Н.В., Земская Т.И. Функционирование микроводорослей подледного планктона и ледовой нтерстициали в прибрежной зоне озера Байкал // Микробиология. 2020. Т. 89. № 3. С. 344–355.
Бульон В.В. Первичная продукция планктона внутренних водоемов. Л.: Наука, 1983. 149 с.
Вотинцев К.К., Мещерякова А.И., Поповская Г.И. Круговорот органического вещества в озере Байкал. Новосибирск: Наука, 1975. 190 с.
Голлербах М.М., Косинская Е.К., Полянский В.И. Определитель пресноводных водорослей СССР. Вып. 2. Синезеленые водоросли. М.: Наука, 1953. 652 с.
Забелина М.М., Киселев И.А., Прошкина-Лавренко А.И., Шешукова В.С. Определитель пресноводных водорослей СССР. Вып. 4. Диатомовые водоросли. М.: Сов. наука, 1951. 399 с.
Земская Т.И., Захаренко А.С., Русанов И.И., Букин С.В., Погодаева Т.В., Нецветаева О.Г., Иванов В.Г., Штыкова Ю.Р., Пименов Н.В. Экология приустьевых акваторий малых рек Южного Байкала по данным химических и микробиологических исследований в весенний период // Микробиология. 2019. Т. 88. № 6. С. 673–684.
Изместьева Л.Р., Кожова О.М. Структура и сукцессии фитопланктона // Долгосрочное прогнозирование состояния экосистем. Новосибирск: Наука, 1988. С. 97–129.
Киселев И.А. Методы исследования планктона // Жизнь пресных вод. М., Л., 1956. Т. 4. Ч. 1. С. 140–416.
Кожова О.М. Проблемы нормы и патологии экосистемы Байкала // Современные проблемы региональной и прикладной гидрохимии. Л., 1987. С. 78–95.
Колпакова В.А., Мещерякова А.И., Вотинцев К.К. Особенности сезонной динамики хлорофилла а, первичной продукции и биогенных элементов в оз. Байкал // Гидробиол. журн. 1988. Т. 24. № 1. С. 3–8.
Корнева Л.Г., Соловьева В.В., Макарова О.С., Гречухина Н.Г., Тарасова Н.Г. Распределение фитопланктона в волжских водохранилищах летом 2015 г. // Тр. ИБВВ РАН. 2018. Вып. 82. № 85. С. 2–27.
Кращук Л.С., Шимараева С.В., Зилов Е.А. Пространственно-временные изменения фитопланктона в оз. Байкал в период позднего лета. 1. Температура воды и численность фитопланктона // Биология внутрен. вод. 2020. № 1. С. 27–37.
Курашов Е.А., Барбашова М.А., Дудакова Д.С., Капустина Л.Л., Митрукова Г.Г., Русанов К.Г., Алёшина Д.Г., Иофина И.В., Протопопова Е.В., Родионова Н.В., Трифонова М.С. Экосистема Ладожского озера: современное состояние и тенденции ее изменения в конце 20-начале 21 веков // Биосфера. 2018. Т. 10. № 2. С. 65–121.
Макарова И.В., Пичкилы Л.О. К некоторым вопросам методики вычисления биомассы фитопланктона // Ботанический журн. 1970. Т. 55. № 10. С. 1488–1494.
Матвiенко О.М., Литвиненко Р.М. Визначник прiсноводных водоростей Украiнськоi РСР. III. Частина 2. Пiрофитовi водоростi . Pyrrophyta. Киiв: Наук. думка, 1977. 385 с.
Минеева Н.М., Щур Л.А., Бондаренко Н.А. Функционирование фитопланктона крупных пресноводных систем при разной обеспеченности ресурсами // Гидробиол. журн. 2012. № 3. С. 21–33.
Новаковский А.Б. Взаимодействие Excel и статистического пакета R для обработки данных в экологии // Вестн. ИБ Коми НЦ УрО РАН. 2016. № 3 (197). С. 26–33.
Онежское озеро. Экологические проблемы. Петрозаводск: КарНЦ РАН, 1999. 293 с.
Поповская Г.И. Фитопланктон Байкала и его многолетние изменения (1958–1990 гг). Автореф. дис. … докт. биол. наук. Новосибирск, 1991. 32 с.
Поповская Г.И., Белых О.И. Этапы изучения автотрофного пикопланктона озера Байкал // Гидробиол. журн. 2003. № 6. С. 12–24.
Пырина И.Л., Сигарева Л.Е., Дзюбан А.Н. Первичная продукция // Экосистема озера Плещеево. Л.: Гидрометеоиздат, 1989. С. 114–122.
Руководство по химическому анализу поверхностных вод суши. Л.: Гидрометеоиздат, 1977. 534 с.
Трифонова И.С. Экология и сукцессия озерного фитопланктона. Л.: Наука, 1990. 180 с.
Царенко П.М. Краткий определитель хлорококковых водорослей Украинской ССР. Киев: Наук. думка, 1990. 208 с.
Barbiero R.P., Tuchman M.L. Long-term dreissenid impacts on water clarity in Lakes Erie // J. Great Lakes Res. 2004. V. 30. № 4. P. 2111–2125.
Belykh O.I., Sorokovikova E.G. Autotrophic picoplankton in Lake Baikal: Abundance, dynamics, and distribution // Aquat. Ecosyst. Health Manag. 2003. № 6. P. 251–261.
Belykh O.I., Sorokovikova E.G., Saphonova T.A., Tikhonova I.V. Autotrophic picoplankton of Lake Baikal: composition, abundance and structure // Hydrobiologia. 2006. V. 568. № 1. P. 9–17.
Bondarenko N.A., Ozersky T., Obolkina L.A., Tikhonova I.V., Sorokovikova E.G., Sakirko M.V., Potapov S.A., Blinov V.V., Zhdanov A.A., Belykh O.I. Recent changes in the spring microplankton of Lake Baikal // Limnologica. 2019. V. 75. P. 19–29.
Bondarenko N.A., Vorobyova S.S., Zhuchenko N.A., Golobokova L.P. Current state of phytoplankton in the littoral area of Lake Baikal, spring 2017 // J. Great Lakes Res. 2020. V. 46. P. 17–28.
Bukin Yu.S., Bondarenko N.A., Rusanov I.I., Pimenov N.V., Bukin S.V., Pogodaeva T.V., Chernitsyna S.M., Shubenkova O.V., Ivanov V.G., Zakharenko A.S., Zemskaya T.I. Interconnection of bacterial and phytoplanktonic communities with hydrochemical parameters from ice and under-ice water in coastal zone of Lake Baikal // Sci. Rep. 2020. № 10. P. 1–12.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication. Galway // National Univ. Ireland. 2020. [Электронный ресурс]. http://www.algaebase.org; (дата обращения: 25.11.2020)
Hampton S.E., Izmest’eva L.R., Moore M.V., Katz S.L., Dennis B., Silow E.A. Sixty years of environmental change in the world’s largest freshwater lake – Lake Baikal, Siberia // Glob. Change Biol. 2008. V. 14. № 8. 1947–1958.
Hampton S.E., McGowan S., Ozersky T., Virdis S.G., Thuy Vu.T., Spanbauer T.L., Kraemer B.M., Swann G., Mackay A.W., Powers S.M., Meyer M.F., Labou S.G., O’Reilly C.M., DiCarlo M., Galloway A.W.E., Fritz S.C. Recent ecological change in ancient lakes // Limnol. Oceanogr. 2018. V. 63. P. 2277–2304.
Heaney S.I., Talling J.F. Dynamic aspects of dinoflagellate distribution patterns in a small productive lake // J. Ecol. 1980. V. 68. P. 75–94.
https://cran.r-project.org/
Izmest'eva L.R., Moore M.V., Hampton S.E., Ferwerda C.J., Gray D.K., Woo K.H., Pislegina H.V., Krashchuk L.S., Shimaraeva S.V., Silow E.A. Lake-wide physical and biological trends associated with warming in Lake Baikal // J. Great Lakes Res. 2016. V. 42. P. 6–17.
Komárek J., Anagnostidis K. Cyanoprokaryota. 1. Chlroococcales. Süßwasserflora von Mitteleuropa Spektrum. Berlin: Akad. Verl., 1998. V. 19. 548 p.
Kravtsova L.S., Izhboldina L.A., Khanaev I.V., Pomazkina G.V., Rodionova E.V., Domysheva V.M., Sakirko M.V., Tomberg I.V., Kostornova T.Y., Kravchenko O.S., Kupchinsky A.B. Nearshore benthic blooms of filamentous green algae in Lake Baikal // J. Great Lakes Res. 2014. V. 40. P. 441–448.
Malkin S.Y., Sorichetti R., Wiklund J., Hecky R.E. Seasonal abundance, community composition, and silicon concentration of diatoms epiphytic on Cladophora glomerata // J. Great Lakes Res. 2009. V. 35. P. 199–205.
Munawar M., Fitzpatrick M., Niblock H., Kling H., Rozon R., Lorimer J. Phytoplankton ecology of culturally eutrophic embayment: Hamilton Harbour, Lake Ontario // Aquat. Ecosyst. Health Manage. 2017. V. 20 (3) P. 201–229.
Revie E.D., Sgro G.V., Estepp L.R., Bramburger A.J., Shaw Chraibi V.L., Pillsbury R.W., Cai M., Dave A. Climate warning and changes in Cyclotella sensu lato in the Laurentian Great Lakes // Limnol. Oceanogr. 2017. V. 62. P. 768–783.
Reynolds C.S. Ecology of phytoplankton // Cambridge Univ. Press. 2006. 535 p.
Rühland K., Paterson A.M., Smol J.O. Hemispheric-scale patterns of climate-related shifts in planktonic diatoms from North American and European lakes // Global Change Biol. 2008. V. 14. P. 2740–2754.
Starmach K. Chrysophyceae und Haptophyceae. Jena: VEB Gustav Fischer Verlag, 1985. 515 p.
Talling J.F. Self-shading effects in natural populations of a planktonic diatom // Wetter. Leben. 1960. № 12. P. 235–242.
Timoshkin O.A., Samsonov D.P., Yamamuro M., Moore M.V., Belykh O.I., Malnik V.V., Sakirko M.V., Shirokaya A.A., Bondarenko N.A., Domysheva V.M., Fedorova G.A., Kochetkov A.I., Kuzmin A.V., Lukhnev A.G., Medvezhonkova O.V., Nepokrytykh A.V., Pasynkova E.M., Poberezhnaya A.E., Potapskaya N.V., Rozhkova N.A., Sheveleva N.G., Tikhonova I.V., Timoshkina E.M., Tomberg I.V., Volkova E.A., Zaitseva E.P., Zvereva Yu.M., Kupchinsky A.B., Bukshuk N.A. Rapid ecological change in the coastal zone of Lake Baikal (East Siberia): Is the site of the world’s greatest freshwater biodiversity in danger? // J. Great Lakes Res. 2016. V. 42. P. 487–497.
Wetzel R.G., Likens G.E. Limnological Analyses. N. Y.: Springer-Verlag, 1991. 391 p.
Дополнительные материалы отсутствуют.



