Водные ресурсы, 2022, T. 49, № 2, стр. 238-248
Проблема регуляции токсигенного цветения пресноводных водоемов
В. А. Румянцев a, b, *, В. Н. Рыбакин a, **, И. В. Рудский a, О. А. Павлова a, Л. Л. Капустина a, Г. Г. Митрукова a, А. Н. Коровин a
a Институт озероведения РАН, Санкт-Петербургский федеральный исследовательский центр РАН
196105 Санкт-Петербург, Россия
b Санкт-Петербургский научный центр РАН
199034 Санкт-Петербург, Россия
* E-mail: office@spbrc.nw.ru
** E-mail: ilras@spcras.ru
Поступила в редакцию 24.04.2021
После доработки 18.08.2021
Принята к публикации 25.08.2021
- EDN: FRVKOX
- DOI: 10.31857/S0321059622020134
Аннотация
Приведены данные лабораторных исследований действия ультразвука малой интенсивности на доминирующие на Северо-Западе России токсигенные цианобактерии вида синехоцистис (Synechocystis sp.), вызывающих “цетение” источников питьевого водоснабжения и представляющие серьезную опасность для здоровья населения городов и жителей сельской местности. Результаты показали, что ультразвуковое облучение – стресс для цианобактерий. Впервые установлено, что в состоянии стресса они одновременно запускают два механизма метаболизма: 1) увеличения толщины стенок клеток и слизистого чехла для повышения стрессоустойчивости; 2) биосинтеза токсинов для борьбы с внешним воздействием. Оба механизма энергозатратны, и через 2–3 недели наступает период истощения запасов и отмирание клеток. Полученные результаты лабораторных и экспериментальных исследований на водоемах открывают реальную возможность регуляции токсигенного цианобактериального “цветения” пресноводных водоемов с помощью ультразвукового облучения малой интенсивности.
К одной из острейших глобальных проблем современности относится “цветение” воды – следствие процесса антропогенного эвтрофирования водных объектов, вызванного бесконтрольным поступлением в них избыточного количества биогенных элементов, прежде всего фосфора и азота, со сточными водами промышленных, сельскохозяйственных, коммунально-бытовых и иных предприятий. Это приводит к резкому увеличению продуцирования водными экосистемами органического вещества и к массовому “цветению” водных объектов, в котором доминирующую роль играют развивающиеся в геометрической прогрессии цианобактерии. Попадание последних в места водозаборов, их налипание на стенках и решетках приводит к забиванию входных устройств и к вынужденной остановке работы муниципальных сооружений водоподготовки, тепловых и атомных электростанций, гидротехнических и промышленных предприятий и т.д. Отмирающие цианобактерии в огромных объемах оседают на дно водных объектов, что в периоды их разложения нередко приводит к образованию заморных зон и массовой гибели рыб. Еще большее беспокойство и социальные последствия вызывают характерное для многих цианобактерий продуцирование в процессе жизнедеятельности токсинов и выделение их в водную среду. Известны такие опасные токсины цианобактерий, как микроцистин, нодулярин, анатоксин и другие, которые по механизму воздействия на человека делятся ВОЗ на три группы: блокираторы фосфаты, нейротоксины и цитотоксины [21]. Последствия употребления воды “цветущих” водоемов в питьевых целях – падеж домашнего скота и других животных, отравление людей нередко с летальным исходом – впервые зафиксированы в начале ХХ в. и по месту их установления получили название “гаффской” и “юксовской” болезни.
Сегодня достоверно установлено, что цианобактериальное “цветение” воды сопровождается гибелью биотического комплекса самоочищения водоемов и неминуемым крахом безопасного питьевого водоснабжения и рекреации: диагностируются острые и хронические отравления токсинами цианобактерий, происходит распространение холерного вибриона, вирусов полиомиелита и эпидемических гастроэнтеритов [4, 16]. Для подтверждения сказанного приведем два примера последствий “цветения” воды, вызванного токсигенными цианобактериями. Летом 2014 г. из-за обнаруженного микроцистина в водопроводной воде из оз. Эри (одного из системы пяти Великих американских озер) жители 400-тысячного г. Толедо штата Огайо остались без питьевой воды и были вынуждены перейти на привозное водоснабжение. Чтобы не допустить дальнейшего развития экологической катастрофы, властям Толедо пришлось израсходовать ~4 млн долл. на химическую обработку воды озера. В Российской Федерации очень популярное среди туристов оз. Котокель (спутник Байкала) в 2008 г. было закрыто для посещения Роспотребнадзором по Республике Бурятии из-за обнаруженной в нем токсичности воды. Было зафиксировано более 20 случаев отравления людей и гибель одного из них из-за употребления ими в пищу рыбы, зараженной цианотоксинами, которые сложно устранить как термической обработкой, так и длительным хранением при минусовой температуре [7].
Принимая во внимание тяжесть экономических и социальных последствий, в развитых странах массовые проявления цианобактериального “цветения” водоемов с выделением в воду токсичных веществ рассматривается как национальная проблема. В некоторых странах (Швеция, Англия, Финляндия, Норвегия и др.) созданы государственные службы мониторинга массового развития цианобактерий и научные центры по их изучению и методам борьбы с ними. Сегодня имеется много различных синтетических альгицидов, химическое действие которых останавливает развитие цианобактерий. Вместе с тем они представляют угрозу для других биологических сообществ в водоеме, поэтому на практике их использование очень ограничено и требуется обязательный контроль со стороны природоохранных служб. Весьма интересными представляются начатые в последнее время работы по созданию биологических методов борьбы с цианобактериями. Предполагается возможность удерживания массового развития цианобактерий в водоеме путем распространения в нем эффективных видов гидробионтов-антогонистов в конкурентной борьбе за пищевые ресурсы и экологические ниши, а также специфических бактериофагов беспозвоночных животных – потребителей цианобактерий.
Несмотря на большое число предложенных методов борьбы с цианобактериальным “цветением” воды и имеющиеся положительные результаты, ставить вопрос об универсальном методе пока преждевременно, если, конечно, он вообще возможен. В обозримой перспективе, по мнению авторов настоящей статьи, можно рассчитывать лишь на создание эффективного комбинированного подхода, включающего в себя для конкретного водного объекта определенный набор экологичных методов различной природы: физической, химической, биологической, биохимической и т.д. В этом направлении сегодня ведутся комплексные исследования в Институте озероведения РАН Санкт-Петербургского Федерального исследовательского центра РАН (ИНОЗ РАН – СПб ФИЦ РАН), которые с учетом сложных механизмов перестройки метаболизма и физиологии цианобактерий под влиянием внешних факторов осуществляются как на естественных водных объектах, так и в лабораторных условиях. С некоторыми результатами выполненных работ можно ознакомиться в [9–11]. Комбинированный подход подразумевает выполнение двух условий: минимальное воздействие на экосистему в целом и максимально допустимое при соблюдении первого условия подавление развития цианобактерий, прежде всего токсикогенных.
С точки зрения авторов статьи, наиболее целесообразно использовать ультразвук малой интенсивности с частотой >20 кГц, который в настоящее время признается большинством специалистов наиболее перспективным и “экологически чистым”, в качестве одного из элементов разрабатываемого комбинированного подхода к решению проблемы цианобактериального “цветения” пресноводных объектов.
Уже более 20 лет в различных странах мира применяются ультразвуковые устройства, среди которых основные и наиболее известные следующие: “Aquanet” (фирма “Thomas-Electronics”, Бельгия), “MPC Buoy, XXL” (фирма “LG Sound”, Нидерланды), серия “SS” (фирма “Sonic Solutions”, США), серия “ES”, “PVSystem” (фирма “Envirosonic”, Великобритания) и др. Одновременно с разработкой новых устройств на водных объектах проводятся исследования механизмов воздействия ультразвука различной интенсивности на клетки цианобактерий разных видов, сапрофитных микроорганизмов и колиморфных бактерий [5, 6, 9, 10, 20, 21].
Сегодня принято считать, что цианобактерии, находясь вблизи источника ультразвукового облучения, подавляются путем разрушения клеточной мембраны [17], на средних расстояниях от источника разрушаются вакуоли цианобактерий, а расположенные далеко от источника погибают от вызванного им стресса. Понятие “стресс” здесь обобщено, под ним имеются в виду различные механизмы, включая отделение клеточной стенки от клеточной мембраны цианобактерий, сбой в регуляции генов, нарушения в функционировании фотосинтетической системы [10].
Несмотря на достигнутые серьезные успехи в практическом использовании ультразвука в борьбе с цианобактериальным “цветением” водоемов, остается много нерешенных фундаментальных вопросов, без ответа на которые нельзя обеспечить получение стабильных результатов. Сказанное прежде всего относится к поведению токсигенных цианобактерий, что вполне закономерно в силу невозможности выяснения механизмов воздействия на них ультразвука при осуществлении исследований непосредственно на водных объектах.
Кроме “традиционных” работ на водоемах, впервые развернуты специальные исследования воздействия ультразвука на токсигенные цианобактерии в лабораторных условиях. Отправной точкой для них стали проведенные ранее натурные и лабораторные эксперименты с цианобактериями, представленные в [10]. В данной статье представлены результаты исследований ультразвукового воздействия на токсигенные цианобактерии одного из доминирующих на СЗ Российской Федерации вида – Synechocysctis sp. В опытах использованы искусственно поддерживаемые в лабораторных условиях чистые культуры цианобактерий, культивируемые в 100%-й среде Громова № 6. Экспериментальная культура выращивалась при однократном заселении емкостей с готовой средой инициальным количеством исходной культуры. Из расчета на 1 л готовой суспензии питательная среда создавалась из 900 мл 5%-й среды Громова № 6 и 5 мл культуры Synechocysctis sp., выращенной в 100%-й среде Громова № 6, с доведением полученной смеси дистиллированной водой до 1 л. Штамм Synechocystis sp. представляет собой одноклеточные бактерии – иногда агрегирующие, которые достаточно равномерно распределяются по объему экспериментального цилиндра. Это позволило отбирать репрезентативные пробы для микроскопии, люминесцентной микроскопии и спектрофотометрии, которые применяли в экспериментах в качестве методов контроля [12].
Эксперименты проводились на специально созданной программируемой установке с десятью каналами с ультразвуковыми излучателями и одним контрольным каналом без излучателя. Диапазон частот f изменяли в пределах от 40 до 300 кГц, интенсивность акустического сигнала задавали на излучателе напряжением U от 1 до 4 Вольт (В). Для контрольного канала f = 0 и U = 0. Для ультразвукового облучения использовались излучатели АД-20 производства Концерна “Океанприбор”, которые размещались под дном экспериментальных стеклянных цилиндров. С целью улучшения прохождения ультразвуковых колебаний в среду в месте контакта с цилиндрами на излучатели наносилась консистентная смазка и они были зафиксированы и отделены от стола звукопоглощающим материалом, а для исключения электромагнитных наводок были закрыты фольгой. Для генерации сигнала использовались специально разработанные программируемые генераторы. Пространственное распределение и величина звукового давления, создаваемого ультразвуковыми колебаниями, оценивалась с помощью гидрофона, откалиброванного в диапазоне 20–200 кГц. Для освещения суспензий цианобактерий на экспериментальном столе был установлен специальный светильник с использованием люминесцентных ламп “Hagen Sun Glo”, спектр излучения которых близок к солнечному. Светильник обеспечивал равномерный световой поток и освещенность в 260 Лм на боковой поверхности экспериментальных цилиндров, интенсивность которого контролировали с помощью люксметра “Mastech MS 6610”. В зависимости от эксперимента использовалась продолжительность светового дня 12 или 18 ч, а период темноты — соответственно 12 или 6 ч. В эксперименте создавали и поддерживали условия, близкие к оптимальным для их роста в природной среде: по концентрации растворенных минеральных веществ и температуре воздуха в диапазоне 22–26°С.
Оценка концентраций клеток во всех экспериментальных емкостях проводилась посредством измерения оптического поглощения суспензии цианобактерий на однолучевом сканирующем спектрофотометре “Shimadzu UV-mini 1240” (спектральный диапазон прибора 190–1100 nm) по отработанной ранее методике. Показатель оптического поглощения суспензии цианобактерий имеет очень высокую корреляцию с концентрацией клеток, подсчитанной с помощью микроскопирования, что отмечено также в работах [1, 2, 8].
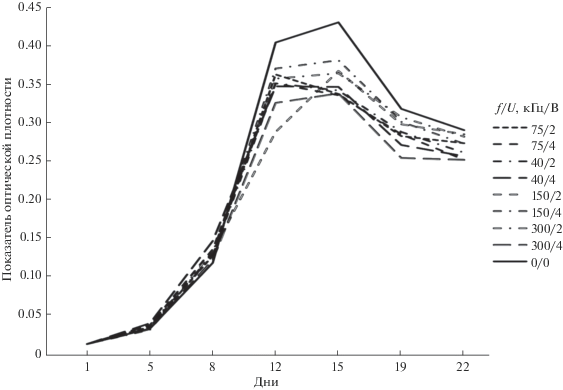
На рис. 1 представлено изменение показателя оптического поглощения в ходе 22-дневного эксперимента при разных параметрах ультразвукового излучения. Можно видеть достаточно идентичный ход величин показателя поглощения, независимо от параметров ультразвука, – резко выраженный рост в первые 12 дней, непродолжительная стабилизация и последующее снижение. При этом для контрольной емкости с полным отсутствием ультразвукового облучения наблюдаются заметно более высокие значения показателя оптического поглощения на этапах стабилизации и падения. Учитывая отмеченную выше корреляцию показателя поглощения с концентрацией клеток цианобактерий, можно заключить, что концентрация клеток в экспериментальных емкостях под воздействием ультразвука начинает снижаться примерно с 12-го по 15-й день облучения.
Рис. 1.
Изменения показателя оптического поглощения в ходе 22-дневного эксперимента при различных параметрах ультразвукового облучения f/U.
При этом подвергаемые ультразвуковому воздействию клетки цианобактерий начинали активно оседать на дно стеклянных емкостей, покрывая его различным по высоте слоем прямо над расположенными и работающими под ними ультразвуковыми излучателями. Вполне естественно предположить, что потеря клетками плавучести связана с повреждением культур, наличием в них истощенных, отмирающих и мертвых клеток. Чтобы убедиться в правильности этого предположения, осуществлена люминесцентная микроскопия жизнеспособности клеток.
Благодаря явлению автофлуоресценции у цианобактерий с помощью флуоресцентного микроскопа МИКМЕД-2.16 проведен учет количества живых и мертвых клеток цианобактерий в контрольной и экспериментальных емкостях. Известно, что живые клетки цианобактерий с разной степенью физиологической активности светятся под микроскопом различными оттенками красного цвета: от ярко-красного до бледно-розового и оранжевого, тогда как у мертвых клеток свечения оливково-зеленого цвета. Влияние ультразвука на состояние токсигенных цианобактерий Synechocystis sp. в ходе эксперимента при параметрах f/U показано в табл. 1. В качестве начального состояния приняты характеристики цианобактерий в первый день эксперимента: состояние клеток – ярко-красные, почти все делящиеся, мертвых клеток – 1.2%.
Таблица 1.
Изменения состояния клеток в ходе опыта, полученные с помощью флуоресцентной микроскопии
| Частота/напряжение | % мертвых клеток | Состояние клеток |
|---|---|---|
| 8-й день эксперимента | ||
| Контроль | 2.2 | Клетки ярко-красные в небольших скоплениях. Физиологическое состояние культуры хорошее |
| 150/2 | 0.5 | Клетки ярко-красные с зеленоватым центром. В скоплениях. Физиологическое состояние культуры хорошее |
| 300/4 | 2.3 | Большинство клеток розовые с зеленым центром. Встречаются темно-красные, старые клетки. Культура угнетена |
| 15 день эксперимента | ||
| Контроль | 8.0 | Клетки темно-красные, некоторые клетки розовые с зеленым центром. Культура старая, с ослабленной жизненной активностью |
| 150/2 | 5.5 | Клетки темно-красные в скоплениях. Культура старая, отмирающая, с ослабленной жизненной активностью |
| 300/4 | 4.9 | Большинство клеток очень темные, почти невидимые. Клеток очень мало. Культура старая, клетки отмирают |
| 22 день эксперимента | ||
| Контроль | 7.9 | 80% клеток – темно-красные, остальные – ярко-красные. Клетки в скоплениях, есть бактерии. Культура старая с ослабленной жизненной активностью |
| 150/2 | 42.3 | Половина клеток очень темные, половина розово-красные. Клетки в небольших скоплениях. Культура в стационарной фазе, начинается отмирание клеток |
| 300/4 | 33 | Клетки очень темные (99%), в скоплениях по 2–3 клетки. Очень много бактерий. Умирающая культура |
По представленным данным можно видеть, что воздействие ультразвука на цианобактерии ускоряет естественный процесс старения и отмирания клеток. Некоторые расхождения в показателях объясняются низкой точностью их определения при малых объемах проб, отбираемых из цилиндров.
Из литературных источников известно, что цианобактерии вида Synechocysctis sp. обладают слаборазвитым, но достаточно заметным слизистым чехлом, состоящим преимущественно из экзосахаридов и экзопротеинов и напрямую связанным с функциональными особенностями всех внеклеточных структур. Ранее было показано, что клеточная стенка и слизистый чехол у цианобактерий развиваются и становятся более толстыми в случаях солевого стресса (хлорид натрия), воздействия тяжелых металлов (кобальт, кадмий) и недостатка биогенов (железо) [15]. Это свидетельствует о большом влиянии или, как отмечается в работах микробиологов, об управляемости слизистым чехлом цианобактерий факторами внешней среды [13–15]. Есть основания предполагать возможность изменения толщины чехла и под воздействием ультразвукового облучения. В этом случае толщина слизистого чехла может в дальнейшем стать удобной характеристикой степени стресса цианобактерий, вызванного действием на них ультразвука малой интенсивности.
Для проверки высказанного предположения о влиянии акустического поля на рост толщины слизистого чехла в 1-й и 22-й день эксперимента из контрольного и экспериментальных цилиндров были отобраны пробы. С помощью микроскопа МИКМЕД-2.16 с увеличением, кратным 100, после предварительного подкрашивания тушью были сделаны и откадрированы по единому протоколу фотоснимки (рис. 2).
Рис. 2.
Микрофотографии клеток цианобактерий Synechocysctis sp. после акустического облучения: а – f = 75 кГц, U = 2 В; б – f = 75 кГц, U = 4 В.

Ореол более светлого тона, чем фон среды вмещающей клетки, соответствует слою слизи. Измерение толщины слоя слизи проводили на границе клетки по фотографиям. Изменения толщины слизистого чехла, покрывающего клетки цианобактерий Synechocysctis sp., для некоторых параметров ультразвукового облучения приведены на рис. 3.
Рис. 3.
Изменения относительной толщины слоя слизи L на оболочках клеток в зависимости от частоты и интенсивности ультразвукового сигнала.
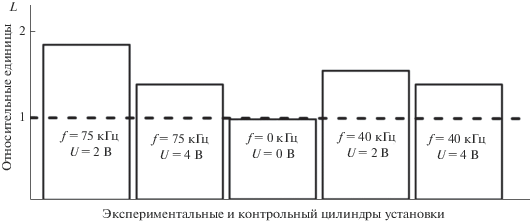
Можно видеть, что толщина слизистого чехла – наименьшая у цианобактерий в контрольном цилиндре при отсутствии ультразвукового облучения. Данные, полученные для экспериментальных цилиндров, подтвердили высказанное предположение о воздействии ультразвука на клеточную стенку цианобактерий Synechocysctis sp., которое приводит к дополнительной выработке слизи и увеличению толщины слизистого чехла. Они служат достаточно убедительным основанием для признания того, что воздействие ультразвука малой интенсивности на токсигенные цианобактерии Synechocysctis sp. – серьезный стресс для них. Для повышения стрессоустойчивости в качестве ответной реакции на ультразвук цианобактерии увеличивают толщину стенок клеток и слизистого чехла, для чего запускают механизм биосинтеза экзосахаридов и экзопротеинов.
Для токсикогенных цианобактерий один из наиболее важных моментов жизнедеятельности – биосинтез токсинов. Из результатов предыдущего эксперимента предварительно формируется представление о том, что отмеченный рост толщины стенок клеток и слизистого чехла затрудняет обмен в системе клетка–среда и, следовательно, препятствует росту и развитию клеток, как в нормальных условиях. По крайней мере можно ожидать, что рост толщины должен негативно сказаться на биосинтезе клетками токсинов и на их выведении в водную среду. В то же время есть две работы по микробиологии, не относящиеся к ультразвуковому облучению, в которых отмечено повышение корреляции токсичности клеток токсикогенных цианобактерий с утолщением слизистого чехла [13, 14]. Чтобы опровергнуть или подтвердить высказанное предположение, был проведен эксперимент с определением токсичности воды в цилиндрах при воздействии на цианобактерии Synechocysctis sp. ультразвукового облучения. Так как в данном случае прежде всего интересовал сам факт наличия или отсутствия биосинтеза токсинов, а не их виды, то для констатации токсичности воды использовали широко применяемый в водной токсикологии метод биоиндикации с помощью дафний Daphnia magna [3], в котором уровень токсичности определяется относительным количеством погибших организмов. Сводные данные по токсичности проб воды в экспериментальных цилиндрах для различных частоты и интенсивности ультразвукового облучения представлены в табл. 2.
Таблица 2.
Результаты определения токсичности проб на основе использования Daphnia magna
| Параметры ультразвука, кГц/В | Доля гибели дафний, % | ||
|---|---|---|---|
| 8-й день | 15-й день | 22-й день | |
| 75/1 | 70 | 10 | 20 |
| 75/2 | 90 | 50 | 0 |
| 75/4 | 60 | 20 | 0 |
| 0/0 | 80 | 50 | 50 |
| 40/2 | 30 | 70 | 0 |
| 40/4 | 90 | 70 | 30 |
| 150/2 | 70 | 30 | 0 |
| 150/4 | 20 | 30 | 10 |
| 300/1 | 20 | 10 | 10 |
| 300/2 | 80 | 40 | 0 |
| 300/4 | 80 | 0 | 0 |
Представленные в табл. 2 данные позволяют отметить несколько важных моментов при ультразвуковом стрессе у цианобактерий. Большая доля погибающих дафний на первом этапе эксперимента свидетельствует о том, что токсигенные цианобактерии для защиты от ультразвукового облучения одновременно с ростом толщины слизистого чехла запускают второй механизм – биосинтез токсинов и их выделение в водную среду. Этот механизм наиболее отчетливо проявляется в течение примерно двух недель, а затем доля погибающих дафний падает. Это свидетельствует о снижении и полном прекращении биосинтеза токсинов, несмотря на продолжающееся ультразвуковое облучение. Объяснение этого фактa авторами настоящей статьи состоит в следующем. Стрессовое состояние цианобактерий под воздействием ультразвука приводит к резкой активизации механизмов метаболизма, так как возникает необходимость дополнительного синтеза экзополисахаридов и экзопротеинов для роста слизистого чехла, а также белков с целью обновления разрушаемых акустической вибрацией внеклеточных белковых структур. Для цианобактерий это связано с большими энергетическими затратами. К серьезным энергетическим потерям приводит и биосинтез клетками токсинов, которые токсигенные цианобактерии используют при жизни в наиболее опасные для их существования моменты. Энергозатратность цианобактерий на одновременный запуск и поддержание двух механизмов повышения стрессоустойчивости – непомерно высокая плата для них, она негативно сказывается на продуктивности клеток и их жизнеспособности. Через некоторое время накопленный и невосполнимый в условиях стресса энергетический запас у токсигенных цианобактерий истощается и наступает фаза отмирания и гибели клеток.
Лабораторные эксперименты проведены для одного вида токсигенных цианобактерий – из доминирующих в водоемах на СЗ РФ. Результаты микробиологических работ общего характера дают основания полагать, что при рассмотрении других видов выводы останутся прежними, а соотношения параметров ультразвука и скорой реакции цианобактерий могут измениться. Для понимания возможностей ультразвука как средства регуляции “цветения” токсигенных цианобактерий на водоемах дополним полученные в лабораторных условиях данные материалами экспериментальных работ, выполненных с нетоксигенными цианобактериями непосредственно на водных объектах.
В работе [18] в результате обобщения натурных экспериментов отмечено, что продолжительность периода от начала воздействия ультразвукового облучения до появления заметного улучшения экологического состояния в каждом конкретном водоеме зависит от его индивидуальных морфометрических, физико-химических и экологических параметров. К ним относятся размер и глубина водоема, температура и освещенность поверхности воды, мутность воды и время водообмена, содержание биогенных веществ, особенно фосфатов и нитратов, присутствующие в водоеме типы водорослей, характер донных отложений и т. д. Так, например, при использовании ультразвуковых устройств фирмы “Sonic Solutions” первые позитивные изменения в его экологическом состоянии могут быть замечены в течении двух недель после их установки. В период от 6 до 12 недель устройство будет подавлять развитие цианобактерий, прорастающих из спор. После 12 недель работы устройств ультразвуковое воздействие на водоем позволит дальше поддерживать его очищенным от цианобактерий.
В отношении устройств фирмы “Sonic Solutions” также установлено, что по мере удаления от объектов воздействия эффективность подавления различных типов водорослей и биопленок неодинакова. Так, например, оценка максимальной удаленности области подавления биопленок устройством “SS600” составляет 104, зеленых водорослей 250, цианобактерий 693 м. Опираясь на эти данные, можно говорить как о различии механизмов воздействия ультразвука на указанные организмы, так и о едином механизме воздействия, но разной устойчивости организмов к ультразвуку.
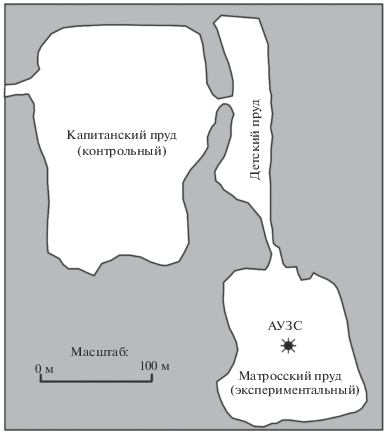
Отмеченные выше выявленные закономерности, хотя и установлены с использованием одного типа ультразвуковых устройств, но, несомненно, имеют общий характер. Учитывая это, при постановке на водных объектах натурных экспериментов с применением ультразвука силами ИНОЗ РАН каждый раз считалось необходимым применение комплексного подхода. Ниже приведены результаты работ в июне–августе 2016 г. на двух мелководных ландшафтных прудах Московского парка Победы в Санкт-Петербурге: Капитанском (165 × 130 м) и Матросском (116 × 95 м) со средними глубинами 2.5–3.0 м, объединенных между собой узким Детским прудом (рис. 4). Проведенные ранее исследования прудов выявили схожесть не только морфометрических, но и гидрологических, гидрохимических их характеристик и донных отложений, а также сопоставимость уровней развития эвтотрофных сообществ фитопланктона, микрофитобентоса и высшей водной растительности. В результате исследований были определены: видовой состав водорослей и цианобактерий, количественные показатели (численность, биомасса), содержание растительных пигментов (хлорофилл a (Хл a)) в воде, рассчитаны индексы, характеризующие состояние планктонных сообществ. Трофический статус обоих водоемов характеризовался как мезотрофный по фитопланктону и слабоэвтрофный по содержанию Хл a; по гидрохимическим показателям их трофический статус оценивается как эвтрофный.
В результате эксперимента в июне–августе 2016 г. установлено, что содержание фитопланктона в экспериментальном Матросском пруду в период исследований менялось от 0.55 до 11.32, в среднем 4.80 мг/л; содержание Хл a – от 7/33 до 37/70, в среднем 13.33 мкг/л (рис. 5), что соответствует слабоэвтрофной стадии [9]. Численность водорослей составляла 7–209 млн, в среднем 90 млн кл/л. Максимальные значения биомассы отмечались в середине августа и были обусловлены массовым развитием жгутиковых форм из отделов Dinophyta, Cryptophyta и Euglenophyta.
Рис. 5.
Динамика биомассы фитопланктона (В фито), биомассы L. redekei (В Limnothrix) и содержание Хл а в экспериментальном и контрольном прудах, июнь–август 2016 г.

В контрольном Капитанском пруду в 2016 г. биомасса водорослей составляла 1.85–8.75, в среднем 5.24 мг/л, концентрация хлорофилла Хл a в воде – 4.94–17.91, в среднем 11.74 мкг/л. Численность фитопланктона колебалась от 75 до 297 млн, в среднем 170 млн кл/л. Основное значение имели цианобактерии, определявшие 81% средней за сезон биомассы. Состав массовых видов не отличался от такового в Матросском пруду, лидирующим видом была Limnothrix redekei (до 75% общей биомассы и до 98% общей численности). Роль других групп была незначительной.
В 2016 г. на Матросском пруду была установлена автономная ультразвуковая станция, разработанная в ИНОЗ РАН совместно с ОАО “Концерн “ОКЕАНПРИБОР”, которая позволила в течение всего вегетационного периода развития водорослей воздействовать на них ультразвуком. Для расширения диапазона возможностей использования установки на различных водоемах в ней был задействован оригинальный керамический излучатель, который, в отличие от задействованных в устройствах других разработчиков, имел круговую диаграмму направленности и обеспечивал как непрерывный, так и импульсный режим ультразвукового излучения на выходе в форме синуса, цилиндра или треугольника с частотами от 20 до 300 кГц. Это позволяет выбирать форму и частоту воздействия индивидуально для каждого объекта, оставляя нетронутыми остальные биотические сообщества.
В результате проведенного в июне–августе ультразвукового облучения на экспериментальном Матросском пруду наблюдалось двукратное снижение средней численности планктонных водорослей, в том числе Limnothrix redekei – в 1.82 раза. В контроле на Капитанском пруду отмечено незначительное возрастание (в среднем на 10%) суммарной биомассы фитопланктона, при этом уровень развития цианобактерий в экспериментальном пруду был в среднем в 2.1 раза ниже. Преобладание в альгоценозах цианобактерий определило резкое снижение видового разнообразия в обоих водоемах. Наиболее заметные различия сообществ фитопланктона экспериментального и контрольного водоемов зарегистрированы в середине августа, когда в экспериментальном пруду концентрация цианобактерий снизилась почти в 10 раз по сравнению с контрольным прудом. Наблюдалось постепенное уменьшение количества в планктоне в первую очередь нитчатых форм из родов Limnothrix и Aphanizomenon – типичных возбудителей “цветения” в водоемах на СЗ России во время наблюдений. Вклад Cyanophyceae в общую биомассу в Матросском пруду снизился с 78–90% в июле до 3% в середине августа (рис. 5). Со второй половины лета в водоеме возрастало количество подвижных форм, обладающих миксотрофным типом питания, из отделов Dinophyta, Euglenophyta, Cryptophyta.
Таким образом, результаты биологических исследований показали, что численность и биомасса доминирующих видов цианобактерий родов Limnothrix и Aphanizomenon после завершения работ на экспериментальном Матросском пруду была почти в 10 раз ниже, чем на контрольном – Капитанском. Что касается остальных присутствующих в прудах видов гидробионтов, за исключением одного, то на обоих прудах расхождение показателей было в пределах ошибок измерений. Есть основание утверждать, что ультразвук не оказывал какого-либо заметного влияния на эти проанализированные виды. По существу, это означает, что показана реальная возможность регуляции явления цианобактериального “цветения” воды при условии сохранения видового разнообразия на водоеме. Важно также отметить очень интересный факт, заключающийся в том, что ультразвуковое воздействие приводит к замене цианобактерий на другие виды водорослей. Таким образом, ультразвук избирательно воздействовал на определенные виды водорослей, регулируя цианобактериальное “цветение” водоемов, это – альтернатива биологическим методам.
Возвращаясь к токсигенным цианобактериям, отметим, что в силу выявленных у них особенностей реакции на стресс они менее устойчивы к воздействию ультразвука по сравнению c нетоксигенными цианобактериями. Поэтому к ним полностью применимы все заключения, сделанные в ходе экспериментальных работ с последними на водоемах.
ВЫВОДЫ
Результаты выполненной работы в целом не только представляют научный интерес, но и крайне важны с практической точки зрения. Они впервые свидетельствуют о том, что появилась реальная возможность с помощью ультразвука малой интенсивности существенно снижать негативное влияние токсигенных цианобактерий на экологическую обстановку на водоемах и качество их воды. Снижение негативного влияния цианобактерий происходит за счет многостороннего воздействия ультразвука, включая прекращение выделения в воду токсинов токсигенными цианобактериями, а также ослабление их усилий в борьбе за экологические ниши и пищевые ресурсы с нетоксичными и менее продуктивными видами гидробионтов-антагонистов. Положительное следствие последнего обстоятельства заключается в снижении рисков забивания цианобактериями входных водозаборных устройств, а также в уменьшении на дне объема отмерших цианобактерий, при деструкции которых в водоемах возникают зоны замора с гибелью рыбы.
Авторы выражают свою благодарность всем коллегам, принимавшим участие в данной работе.
Список литературы
Волошко Л.Н., Пиневич А.В. Разнообразие токсинов цианобактерий // Астраханский вестн. экол. образования. 2014. № 1 (27). С. 68–80.
Гладышев М.И., Колмаков В.И., Кравчук Е.С., Калачева Г.С., Колмакова А.А., Грибовская И.В., Москвичева А.В., Трусова М.Ю., Жиленков М.Д., Махутова О.Н. Прорастание акинет цианобактерий из донных отложений в эксперименте в водах “цветущего” и “нецветущего” водоемов // Докл. РАН. 2001. Т. 378. № 1. С. 134–137.
Загребин А.О., Румянцев В.А., Тонкопий В.Д. Использование методов биотестирования и биоидентификации ксенобиотиков для оценки состояния водных экосистем // Общество. Среда. Развитие. 2014. № 1. С. 157–160
Калинникова Т.Б., Гайнутдинов М.Х., Шагидуллин Р.Р. Цианотоксины – потенциальная опасность для пресноводных экосистем и здоровья человека // Рос. журн. приклад. экологии. 2017. № 2. С. 3–19.
Киселев Е.Ю., Румянцев В.А., Рыбакин В.Н. Применение ультразвукового излучения низкой интенсивности для борьбы с “цветением” воды в водоемах. Механизмы воздействия на водоросли // Уч. зап. РГГМУ. 2014. № 34. С. 115–122.
Киселев Е.Ю., Румянцев В.А., Рыбакин В.Н. Применение ультразвукового излучения низкой интенсивности для борьбы с “цветением” воды в водоемах. Эффективность воздействия на водоросли и другие организмы // Уч. зап. РГГМУ. 2014. № 37. С. 222–230.
Лудупова Е.Ю., Сергеева Л.А., Гыргешкинова Н.Г., Олоева Э.В., Бадмаева В.Я., Будашеева А.Б. Случай возникновения гафской болезни (алиментарно-токсической пароксизмальной миоглобинурии) в Республике Бурятия в селах Прибайкальского района, расположенных у озера Котокель // Бюлл. ВСНЦ СО РАМН. 2009. № 3 (67). С. 92–94.
Румянцев В.А., Крюков Л.Н. Супрамолекулярные регуляторы цветения водоемов // Вестн. РАН. 2012. Т. 82. № 6. С. 552–557.
Румянцев В.А., Крюков Л.Н., Рыбакин В.Н., Киселев Е.Ю. Проблема “цветения” сине-зеленых водорослей и пути ее решения / Под ред. Ж.И. Алферова, О.В. Белого, Г.В. Двас, Е.А. Ивановой // Перспективные направления развития науки в Петербурге. СПб.: Изд-во ИП Пермяков С.А., 2015. С. 277–294.
Румянцев В.А., Поздняков Ш.Р., Рыбакин В.Н., Григорьева Н.Ю., Рудский И.В., Киселев Е.Ю., Коровин А.Н. Многопрофильные натурные и лабораторные эксперименты по оценке работоспособности и экологической безопасности ультразвука при регуляции цветения цианобактерий // Уч. зап. РГГМУ. 2017. № 46. С. 118–133.
Румянцев В.А., Рыбакин В.Н. Результаты лабораторных и натурных исследований применения ультразвука малой мощности для регулирования цветения цианобактерий на водоемах // Материалы Международ. науч.-практ. конф., посвященной памяти А.Н. Антипова “Географические основы и экологические принципы региональной политики природопользования”. Иркутск: ИГ СО РАН, 2019. С. 587–589.
Сиделев С.И., Голоколенова Т.Б., Чернова Е.Н., Русских Я.В. Анализ фитопланктона Цимлянского водохранилища (Россия) на наличие цианобактериальных гепато- и нейротоксинов // Микробиология. 2015. Т. 84. № 6. С. 732–742.
Allen R., Rittmann B.E., Curtiss R. Axenic Biofilm Formation and Aggregation by Synechocystis sp. Strain PCC 6803 Are Induced by Changes in Nutrient Concentration and Require Cell Surface Structures // Applied Environ. Microbiol. 2019. V. 85(7). P. 1–18.
Kehr J.-C., Dittmann E. Biosynthesis and Function of Extracellular Glycans in Cyanobacteria // Life. March 2015. V. 5. P. 164–180. www.mdpi.com/journal/life
Fisher M.L., Allen R., Luo Y., Curtiss R. Export of Extracellular Polysaccharides Modulates Adherence of the Cyanobacterium Synechocystis // PloS One. 2013. V. 8. e74514. P. 1–10. www.plosone.org
Hrouzek P., Kapuscik A., Voracova K., Paichlova J., Kopecky J., Vacek J., Kosina P., Voloshko L., Ventura S. Cytotoxicity evaluation of large cyanobacterial strain set using selected human and murine in vitro cell models // Ecotoxicol. Environ. Safety. 2016. V. 124. P. 177–185.
http://www.thomas-electronics.be
Oyib D.H. Water treatment by means of ultrasound // Everything about Water. 2013. February 09. P. 58–62.
Purcell D. Control of Algal Growth in Reservoirs with Ultrasound // PhD Thesis. Cranfield univ. Centre for water sci. Department of sustainable systems. School applied sci. 2009. December. P. 227.
Tekile A., Kim I., Lee J.-Y. 2200 kHz Sonication of Mixed-Algae Suspension from a Eutrophic Lake: The Effect on the Caution vs. Outbreak Bloom Alert Levels // Water. 2017. V. 9. № 12. P. 915.
World Health Organization. Guidelines for safe recreational water environments. V. 1. Coastal and fresh waters. Chapter 8. Algae and Cyanobacteria In Fresh Water. 2003. P. 136–158.
Дополнительные материалы отсутствуют.
Инструменты
Водные ресурсы