Водные ресурсы, 2023, T. 50, № 2, стр. 193-202
Пространственно-временны́е вариации ихтиоценов реки Бельбек
Е. П. Карпова a, *, С. В. Статкевич a, Э. Р. Аблязов a
a Федеральный исследовательский центр “Институт биологии южных морей
им. А.О. Ковалевского РАН”
299011 Севастополь, Россия
* E-mail: karpova_jey@mail.ru
Поступила в редакцию 13.12.2021
После доработки 26.10.2022
Принята к публикации 30.10.2022
- EDN: INAOSJ
- DOI: 10.31857/S0321059623020104
Аннотация
Представлены результаты изучения видового состава, разнообразия и динамики ихтиоценозов среднего течения р. Бельбек – одной из малых рек Крымского п-ова, активно используемой для устранения дефицита водоснабжения последних лет. В настоящее время река подвергается значительному антропогенному воздействию. Прослежены тренды изменения структуры рыбного населения по мере хозяйственного освоения реки и выявлены основные формы негативного экологического воздействия. Отмечено, что на коротком временнóм промежутке произошли ухудшение структуры водных сообществ и резкое снижение разнообразия. Наблюдаются также уменьшение численности и деформация популяционной структуры аборигенных видов рыб – крымской шемаи Alburnus mentoides, крымского усача Barbus tauricus, крымского пескаря Gobio krymensis. Показанo определяющее влияние гидростроительных и гидротехнических мероприятий на деструктивные процессы в водных экосистемах.
ВВЕДЕНИЕ
Проблема стабильного снабжения пресной водой и организации земледелия в Крыму всегда была достаточно острой ввиду недостаточного влагообеспечения большей части его территории. Кроме того, на протяжении последних десятилетий в южных регионах России наблюдается усиление аридизации, выражающееся в росте частоты и интенсивности весенне-летних засух [6]. В связи с этим состояние биоты малых рек – основы гидрографической сети полуострова – чрезвычайно важный показатель, так как экологическая емкость, или максимальная техногенная нагрузка, которую экосистемы способны выдержать, для таких рек весьма невелика.
Из многочисленных характеристик водотоков следует выделить такой показатель, как состояние их экологического благополучия, нарушение которого приводит к негативным последствиям. Решение проблем рационального использования ограниченных водных ресурсов в современных условиях требует разработки адекватных мер по сохранению биоразнообразия водотоков, так как это один из важнейших факторов сохранения качества их вод и способность их к самоочищению. Анализ закономерностей формирования биоразнообразия рек горного типа усложнен высотной зональностью и большим количеством факторов, в том числе антропогенного характера, трудно поддающихся количественной оценке.
Одна из основных рек Крыма – Бельбек, входящая в группу рек юго-западного макросклона Крымских гор. Длина русла реки – 55 км, площадь водосборного бассейна – 505 км2, это наиболее многоводная река Крыма [20].
Верховья Бельбека – на северо-западных склонах Главной гряды Крымских гор. Река начинается у с. Счастливого слиянием горных водотоков Манаготра и Биюк-Узенбаш, начало которого – мощный карстовый источник. Реки, составляющие верховья Бельбека, – горные потоки с узкими руслами, большим падением, крутыми высокими берегами. Самый полноводный приток Бельбека – р. Коккозка (длина 18 км), который образуется от слияния двух речек: Аузун-Узень и Сары-Су. Долина правого притока Аузун-Узень представляет собой гигантскую расселину, известную как Большой Каньон Крыма. Аузун-Узень принимает с левого берега воды родника Пания – одного из крупнейших карстовых источников Крыма со средним многолетним расходом 370 л/с [18]. В верховьях Бельбека в 1964 г. был построен комплекс гидротехнических сооружений, включающий в себя водохранилища Счастливое-1 на р. Биюк-Узенбаш, Счастливое-2 на р. Манаготра и Ключевское на руч. Карстовом. Самое большое из трех водохранилищ – Счастливое-2 объемом 11.8 млн м3 и максимальной глубиной 53 м. У с. Счастливого находится северный портал гидротоннеля длиной 7216 м, по которому вода из водохранилищ поступает в Ялту [15].
У с. Голубинка русло Бельбека, пересекая продольную долину между Главной и Внутренней горными грядами, значительно расширяется (до 40–50 м). В среднем и нижнем своем течении (от пос. Куйбышево до устья) р. Бельбек течет со значительно меньшими, чем в верховьях, уклонами, по широкой V-образной долине.
При приближении к морю долина реки постепенно расширяется. В нижнем течении Бельбек прорезает мощные глинистые наносы; река имеет здесь незначительный уклон. Впадает река в Черное море у с. Любимовка.
В настоящее время Бельбек – источник водоснабжения значительного количества населенных пунктов и сельскохозяйственных предприятий. В связи с прекращением подачи днепровской воды нагрузка на все крымские реки значительно возросла, происходит изъятие больших объемов воды, причем зачастую несанкционированно, что затрудняет возможность учета. Поэтому реакция экосистемы – единственный и наиболее представительный способ оценки степени негативных воздействий. Один из главных показателей стабильности экосистемы – биоразнообразие различных групп организмов, обусловливающее ее изменчивость и устойчивость по отношению к колебаниям факторов среды [9]. Основные критерии при этом – показатели альфа-разнообразия сообществ, а также состояние популяций видов-индикаторов, наиболее остро реагирующих на изменения среды [17, 23, 24]. Применение индексов биоразнообразия, которые отличаются относительной простотой расчета и универсальностью, возможно к разным таксономическим группам, однако в горных реках с обедненными фито- и зоопланктонными сообществами наиболее удобный объект – сообщества рыб.
Связность различных элементов среды обитания в широком пространственно-временнóм контексте определяет итоговые реакции рыб: на индивидуальном уровне – показатели роста; на уровне популяции – ее половозрастную структуру, смертность и т. д.; на уровне сообществ – показатели относительного и абсолютного обилия, разнообразия, встречаемости. При этом следует учитывать, что для рыбных сообществ малых горных рек характерно достаточно малое разнообразие, отражающее ограниченность местообитаний и гидрологический режим [22].
В соответствии с этими закономерностями статус ихтиофауны – важный датчик состояния окружающей среды различных масштабов и хороший инструмент мониторинга [10, 25]. Структура сообществ рыб, в частности относительное обилие (доли всех видов в сообществах по численности или биомассе), дает информацию об общем уровне сохранности или деградации экосистемы. Характер локального распределения ихтиофауны, структура популяций, сезонность и характеристики роста могут указывать на качество и степень воздействия экологических факторов более мелкого масштаба.
Цель исследования – оценка современного состояния и трендов изменения структуры сообществ рыб р. Бельбек при увеличении антропогенного воздействия на водоток.
МАТЕРИАЛ И МЕТОДЫ
Регулярные исследования ихтиофауны в р. Бельбек были начаты в 2007 г. Они проводились на пяти идентичных по биотопическим характеристикам станциях в среднем течении реки в районе сел Дальнего (ст. 1), Верхнесадового (ст. 2), Красный Мак (ст. 3), Куйбышево (ст. 4), Аромат (ст. 5) (рис. 1). Первые три станции расположены ниже внутренней гряды крымских гор, две последние – выше. Сбор проб проводили в 2007–2009, 2015, 2017, 2018 и в 2021 гг. Эпизодические качественные исследования видового состава таксоценов проводились на других участках русла выше и ниже по течению, а также в устьевой части и лентических водоемах бассейна реки.
Рис. 1.
Река Бельбек с притоками и станции отбора проб (обозначены черными маркерами) на гидрографической схеме Крыма.

Для сбора ихтиологических проб в русле реки применяли метод гона. Для этого при помощи мальковой волокуши из хамсароса с шагом ячеи 6 мм либо сака из того же материала, имеющего входное отверстие полукруглой формы размером 1.6 × 0.8 м и площадь 1 м2, и заграждения из мелкоячейного хамсароса отгораживался участок русла реки протяженностью ~50 м. Рыбы с этого участка сгонялись в орудие лова с 3–5-кратной повторностью. При этом максимально вылавливалось все рыбное население от сеголетков до старших возрастных групп. Аналогичным образом обловы повторяли на 3–5 участках в районе станции сбора проб, удаленных друг от друга на 100–300 м. Для уточнения видового состава рыб также проводили качественные сборы при помощи ручных сачков, вентерей, крючковых снастей и ставных жаберных сетей с ячеей от 12 до 30 мм.
Исследования проводили в меженный период с июня по октябрь включительно. После вылова в лабораторных условиях проводили видовую идентификацию рыб [1, 4, 5], промеры и взвешивание всех экземпляров [11]. Видовые названия приводятся по [8]. Всего биологический анализ выполнен для 3916 экземпляров рыб.
В период 2007–2018 гг. анализ показателей видового сходства и разнообразия проводили для всех станций в среднем течении (ст. 1–5) совместно ввиду отсутствия существенных различий видового состава, количественных показателей и характеристик окружающей среды в водотоке. В 2021 г. сравнение проводили также для различных географических локаций из-за значительного изменения факторов воздействия на разных станциях. Таким образом, в анализе рассмотрено в общей сложности 12 выборок. Для определения степени видового сходства ихтиофаун разных участков русла в разные временны́е периоды применен коэффициент Серенсена–Чекановского. Для количественной оценки различий между выборками на основе показателей обилия каждой из них использовали меру несходства Брея–Кертиса. Показатели альфа-разнообразия оценивали с применением индекса видового разнообразия Шеннона H, индекса видового богатства Маргалефа D, индекса выровненности Пиелу E и индекса доминирования Симпсона C [26]. Критерием доминирования была доля вида в уловах [14], % общей численности улова: редкий вид – <0.1, малочисленный – 0.1–1.0, обычный – 1.1–5.0, субдоминантный – 5.1–10.0, доминантный – >10, супердоминантный – >50%. При сравнительном анализе рассматривали три временны́х периода: 2007–2009, 2015–2018 гг., 2021 г., – что связано со степенью воздействия на водоток в ходе осуществления мероприятий по водообеспечению Крыма. Первый период отличался высокой стабильностью и относительно небольшими объемами водозабора, во втором происходило постепенное их увеличение, а в 2021 г. в районе с. Дальнего был построен и введен в эксплуатацию Бельбекский водозабор – крупное гидротехническое сооружение для водоснабжения г. Севастополя. Кроме того, для увеличения заполнения Бельбекского водозабора была проведена расчистка русла в районе с. Аромат, в ходе которой были полностью уничтожены донные, береговые и прибрежные биоценозы (рис. 2).
РЕЗУЛЬТАТЫ
В ходе исследований в составе ихтиофауны р. Бельбек было отмечено всего 26 видов рыб (табл. 1).
Таблица 1.
Видовой состав рыб в бассейне р. Бельбек (1 – устье реки, 2 – среднее течение, 3 – верхнее течение, 4 – пруды и водохранилища бассейна реки)
| Вид | 1 | 2 | 3 | 4 | |
|---|---|---|---|---|---|
| 1 | Карась серебряный Carassius gibelio (Bloch, 1782) | + | + | + | |
| 2 | Карп, сазан Cyprinus carpio Linnaeus, 1758 | + | + | ||
| 3 | Усач крымский Barbus tauricus Kessler, 1877 | + | + | + | |
| 4 | Толстолобик белый Hypophthalmichthys molitrix (Valenciennes, 1844) | + | |||
| 5 | Толстолобик пестрый Hypophthalmichthys nobilis (Richardson, 1845) | + | |||
| 6 | Пескарь крымский Gobio krymensis Bănărescu & Nalbant, 1973 | + | + | + | |
| 7 | Чебачок амурский Pseudorasbora parva (Temminck et Schlegel, 1846) | + | |||
| 8 | Голавль Squalius cephalus (Linnaeus, 1758) | + | + | + | |
| 9 | Быстрянка южная Alburnoides fasciatus (Nordmann, 1840) | + | + | ||
| 10 | Шемая крымская Alburnus mentoides Kessler, 1859 | + | |||
| 11 | Верховка Leucaspius delineatus Heckel, 1843 | + | |||
| 12 | Плотва Rutilus rutilus (Linnaeus, 1758) | + | |||
| 13 | Голец усатый Barbatulabarbatula (Linnaeus, 1758) | + | + | ||
| 14 | Форель ручьевая Salmo trutta labrax Linnaeus, 1758 | + | |||
| 15 | Щука Esox lucius Linnaeus, 1758 | + | + | + | |
| 16 | Кефаль сингиль Chelon auratus (Risso, 1810) | + | |||
| 17 | Кефаль пиленгас Planiliza haematocheilus (Temminck & Schlegel, 1845) | + | |||
| 18 | Кефаль лобан Mugil cephalus Linnaeus, 1758 | + | |||
| 19 | Хольбрукская гамбузия Gambusia holbrooki Girard, 1859 | + | + | ||
| 20 | Колюшка трехиглая Gasterosteus aculeatus Linnaeus, 1758 | + | |||
| 21 | Солнечный окунь Lepomis gibbosus (Linnaeus, 1758) | + | + | ||
| 22 | Ерш обыкновенный Gymnocephalus cernuus (Linnaeus, 1758) | + | |||
| 23 | Окунь речной Perca fluviatilis Linnaeus, 1758 | + | |||
| 24 | Судак Sander lucioperca (Linnaeus, 1758) | + | |||
| 25 | Бычок песочник Neogobius fluviatilis (Pallas, 1814) | + | |||
| 26 | Бычок трубконосый Proterorhinus semilunaris (Heckel, 1837) | + | |||
| Всего | 13 | 10 | 6 | 12 |
Наибольшее количество (13) видов наблюдалось в устьевой части. Из них к аборигенным пресноводным относились всего 3 (голавль, крымский пескарь и усач, последний встречался единично). Также морские рыбы (три вида кефалей) заходили в устье реки на нагул и были факультативными для этого участка. Шесть видов (серебряный карась, амурский чебачок, щука, гамбузия, бычки песочник и трубконосый) относятся к чужеродным для рек юго-западного Крыма, все они, кроме щуки, были весьма многочисленны на данном участке.
Вторым районом по разнообразию видов были лентические водоемы бассейна реки, при этом все обнаруженные в них виды были намеренно или случайно интродуцированными.
Аборигенная фауна максимальное развитие имела в среднем течении реки. Из чужеродных видов здесь единично (в количестве 1–2 особей) отмечены серебряный карась, карп, щука и солнечный окунь. Ниже внутренней гряды Крымских гор в составе сообществ присутствовала шемая крымская, выше по течению этот вид уступал место ручьевой форели, которая оставалась единственным видом выше 500–600 м над уровнем моря.
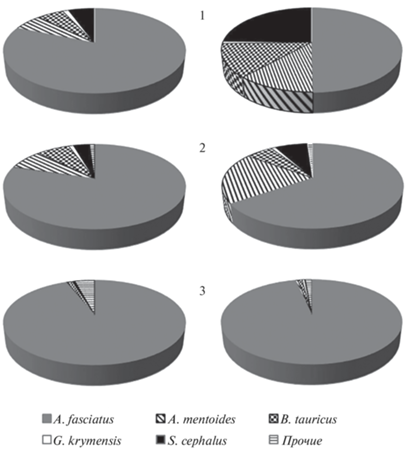
На протяжении ~25 км в среднем течении реки, очень однородного по своим биотопическим характеристикам, таксономический состав и структура ихтиоценозов были во многом идентичны. Стабильным супердоминантом была южная быстрянка (табл. 2), доля которой составляла в среднем >80%, что характерно для горных рек юго-западного Крыма [22]. В доминирующий комплекс эпизодически входили также крымская шемая (2008–2009 гг., район с. Верхнесадовое; 2015 г., район с. Красный Мак), крымский усач (2009 г., район с. Верхнесадовое; 2018 г., район с. Аромат) и голавль (2009 г., район с. Верхнесадовое). Крымский пескарь и усач в отдельных случаях также входили в состав субдоминантов (6.2–6.6%), но чаще все эти виды были обычными или малочисленными (0.3–4.6%).
Таблица 2.
Структура рыбных сообществ по численности и биомассе в среднем течении р. Бельбек
| Вид | Минимум | Максимум | Среднее | |||
|---|---|---|---|---|---|---|
| 2007–2009 гг. | 2015–2018 гг. | 2021 г. | 2007–2021 гг. | |||
| Численность, % | ||||||
| A. fasciatus | 43.5 | 100.0 | 81.3 | 79.8 | 94.0 | 85.0 |
| A. mentoides | 0 | 55.1 | 6.3 | 7.7 | 0.2 | 4.7 |
| B. tauricus | 0 | 14.4 | 5.6 | 6.9 | 1.1 | 4.5 |
| G. krymensis | 0 | 6.2 | 1.3 | 1.0 | 0.2 | 0.8 |
| S. cephalus | 0 | 19.8 | 5.6 | 3.4 | 0.4 | 3.1 |
| Прочие | 0 | 5.9 | 0 | 1.0 | 4.2 | 1.7 |
| Масса, % | ||||||
| A. fasciatus | 17.3 | 100.0 | 49.8 | 65.4 | 96.6 | 70.6 |
| A. mentoides | 0 | 65.5 | 11.9 | 19.8 | 0.5 | 10.7 |
| B. tauricus | 0 | 37.1 | 12.8 | 5.8 | 0.9 | 6.5 |
| G. krymensis | 0 | 8.7 | 0.9 | 1.0 | 0.5 | 0.8 |
| S. cephalus | 0 | 48.2 | 24.7 | 7.0 | 0.2 | 10.6 |
| Прочие | 0 | 9.6 | 0 | 1.1 | 1.3 | 0.8 |
Среди прочих видов, доля которых была невелика и значительно варьировала, отмечались как чужеродные виды (солнечный окунь, серебряный карась, карп), так и усатый голец, статус которого в р. Бельбек неясен. С одной стороны, вид относится к аборигенным для рек северо-восточного макросклона крымских гор; с другой – в реках юго-западного макросклона (Черная, Бельбек, Кача, Альма), отделенных водоразделом, ранее он не отмечался, и локальная популяция в р. Бельбек была обнаружена лишь в конце 1990-х гг. [3]. Однако и среди вселенцев, распространявшихся в реках в основном с рыбопосадочным материалом из прудов, никогда не наблюдался столь реофильный вид.
На дендрограмме, построенной с применением ординационного анализа, на основе относительного обилия видов из общего кластера выделялись выборки (№ 2–4, 7) с более высокими показателями альфа-разнообразия (рис. 3), т. е. максимальными для исследуемых выборок значениями индексов Шеннона–Уивера, видового богатства, доминирования и выровненности, что наблюдалось эпизодически при снижении обилия и доминирования южной быстрянки. Причиной этого было образование нерестовых или нагульных скоплений таких видов, как шемая, голавль и усач. В частности, одно из таких скоплений шемаи наблюдалось в районе стока вод из мелководного эвтрофированного пруда в русло реки.
Рис. 3.
Дендрограмма сходства рыбного населения в разные периоды и на разных станциях: 1 – 2007 г.; 2 – 2008 г.; 3 – 2009 г.; 4 – 2015 г.; 5 – 2016 г.; 6 – 2017 г.; 7 – 2018 г.; 8 – 2021 г. (ст. 1); 9 – 2021 г. (ст. 2); 10 – 2021 г. (ст. 3); 11 – 2021 г. (ст. 4); 12 – 2021 г. (ст. 5).
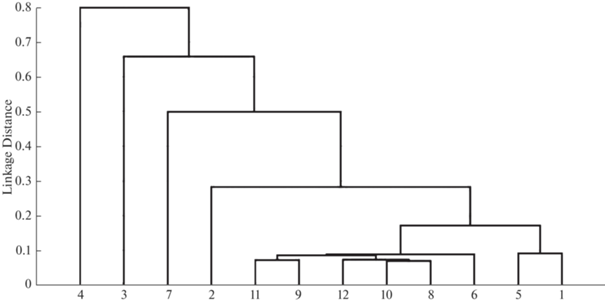
Однако в целом, видовое богатство и разнообразие в сообществах рыб было чрезвычайно низким (табл. 3) даже по сравнению с аналогичными показателями прочих горных рек Крыма и Кавказа [10, 22]. Сообщества рыб реки на протяжении всего периода исследований характеризовались высокой степенью доминирования С и малой выровненностью Е. Доминирование южной быстрянки в целом обычно для крымских рек [22], как и большое число видов не может считаться критерием благополучного состояния ихтиоценозов ввиду того, что оно обусловлено значительным количеством чужеродных представителей ихтиофауны. Однако после 2015 г. наблюдается явная тенденция ухудшения всех показателей как в среднем течении в целом, так и на отдельных станциях (2021 г.). Критическая ситуация наблюдалась в 2021 г. в нижней части среднего течения (табл. 3), где рыбные сообщества практически полностью отсутствовали.
Таблица 3.
Значения индексов Серенсена−Чекановского (выше диагонали, выделенной серым цветом), Брея–Кертиса (ниже диагонали), показателей разнообразия в разные временны́е периоды и на разных станциях исследования (1 – 2007 г.; 2 – 2008 г.; 3 – 2009 г.; 4 – 2015 г.; 5 – 2016 г.; 6 – 2017 г.; 7 – 2018 г.; 8 – 2021 г. (ст. 1); 9 – 2021 г. (ст. 2); 10 – 2021 г. (ст. 3); 11 – 2021 г. (ст. 4); 12 – 2021 г. (ст. 5))
| Локалитет | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |
| 1 | 0.9 | 1.0 | 0.8 | 0.9 | 0.8 | 0.8 | 0.3 | 0.7 | 0.8 | 0.7 | 0.5 | |
| 2 | 0.7 | 0.9 | 0.6 | 0.8 | 0.6 | 0.7 | 0.4 | 0.5 | 0.9 | 0.8 | 0.6 | |
| 3 | 0.6 | 0.3 | 0.8 | 0.9 | 0.8 | 0.8 | 0.3 | 0.7 | 0.8 | 0.7 | 0.5 | |
| 4 | 0.8 | 0.4 | 0.2 | 0.7 | 0.7 | 0.8 | 0.5 | 0.6 | 0.7 | 0.3 | 0.3 | |
| 5 | 0.1 | 0.7 | 0.6 | 0.7 | 0.7 | 0.7 | 0.3 | 0.6 | 0.7 | 0.6 | 0.4 | |
| 6 | 0.9 | 0.5 | 0.7 | 0.6 | 0.9 | 0.8 | 0.5 | 0.9 | 0.7 | 0.9 | 0.7 | |
| 7 | 0.5 | 0.4 | 0.4 | 0.7 | 0.8 | 0.7 | 0.3 | 0.9 | 0.5 | 0.9 | 0.8 | |
| 8 | 1.0 | 0.7 | 0.8 | 0.8 | 1.0 | 0.4 | 0.9 | 0.4 | 0.5 | 0.4 | 0.5 | |
| 9 | 0.7 | 0.3 | 0.3 | 0.6 | 0.7 | 0.5 | 0.3 | 0.7 | 0.4 | 0.8 | 0.9 | |
| 10 | 0.6 | 0.3 | 0.4 | 0.6 | 0.6 | 0.6 | 0.2 | 0.8 | 0.2 | 0.6 | 0.7 | |
| 11 | 0.7 | 0.2 | 0.4 | 0.6 | 0.7 | 0.6 | 0.3 | 0.7 | 0.1 | 0.2 | 0.9 | |
| 12 | 0.2 | 0.7 | 0.7 | 0.8 | 0.2 | 0.9 | 0.5 | 0.9 | 0.6 | 0.6 | 0.6 | |
| Показатели разнообразия | ||||||||||||
| D | 0.68 | 0.72 | 0.85 | 0.47 | 0.85 | 0.66 | 0.83 | – | 0.71 | 0.45 | 0.71 | 0.35 |
| H | 0.38 | 0.8 | 1.29 | 0.75 | 0.59 | 0.38 | 0.68 | – | 0.43 | 0.18 | 0.27 | 0.24 |
| C | 0.16 | 0.41 | 0.67 | 0.51 | 0.26 | 0.18 | 0.33 | – | 0.19 | 0.07 | 0.14 | 0.11 |
| E | 0.07 | 0.19 | 0.27 | 0.18 | 0.1 | 0.12 | 0.14 | – | 0.1 | 0.04 | 0.06 | 0.04 |
В период 2007–2009 гг. наблюдалось значительное видовое сходство ихтиоценозов (табл. 3), свидетельствующее о стабильности их состояния; в дальнейшем высокий уровень сходства наблюдался значительно реже. Количественные вариации, напротив, были постоянными, что нашло отражение в большой изменчивости индекса Брея–Кертиса. Очевидно, в русле происходит постоянное перераспределение группировок рыб, зачастую связанное с гидрологической ситуацией, в первую очередь – с прохождением паводков или с обмелением в результате как сезонных и климатических воздействий, так и интенсивного водозабора, причем выделить природную и антропогенную составляющие этого процесса не представляется возможным.
При сравнении структуры ихтиоценозов трех временны́х периодов (рис. 4) с применением критерия хи-квадрат между первым и вторым выявлены достоверные различия (p < 0.05) относительной доли видов по массе, что было обусловлено снижением количества старших возрастных групп и преобладанием мелких особей для всех видов, кроме быстрянки и голавля. Еще более значительно различались ихтиоценозы в 2021 г. В этот период резко снизились численность и биомасса всех видов, кроме быстрянки.
ОБСУЖДЕНИЕ
Аборигенная ихтиофауна р. Бельбек наиболее бедная среди всех рек юго-западного Крыма, в первой трети ХХ в. здесь было отмечено всего 4 вида рыб – быстрянка, усач, голавль и ручьевая форель [19]. В ходе освоения реки ее экосистема подвергалась ряду антропогенных воздействий, в результате чего таксономический состав пополнился значительным количеством видов, и к 2020 г. их число возросло более чем в 6 раз. Гидростроительство (укрепление берегов, строительство гидроузлов, мостов и т. д.) в значительной степени нарушило естественные гидрологические характеристики рек. Создание плотин гидроузлов приводит к увеличению площади лентических участков со слабым течением и зарослями водной растительности, более благоприятных для чужеродных лимнофильных видов, чем для аборигенных. Популяции населяющих крымские реки гидробионтов формировались в горной и предгорной зонах в условиях изоляции и влияния таких гидрологических факторов среды, как большие скорости течения, низкая температура воды, нестабильный водный режим. В результате здесь образовались уникальные реофильные биоценозы, отличающиеся высокой чувствительностью к изменениям условий окружающей среды и не выдерживающие конкуренции в новых для них условиях [12]. Зарыбление лентических водоемов, расположенных в бассейне реки, особенно проводимое без ихтиологического контроля, стало причиной попадания в водоток чужеродных видов – карпа, серебряного карася, амурского чебачка, гамбузии, солнечного окуня и двух видов бычков. Однако следует отметить, что в русле реки эти виды не задерживаются, их местообитание – устьевая часть и лентические водоемы бассейна, где также отмечены два вида толстолобиков, верховка, плотва, окунь, ерш и судак. Некоторые из этих видов, такие как солнечный окунь и амурский чебачок, – весьма агрессивные по отношению к другим рыбам, а прочие составляют пищевую конкуренцию аборигенам и хозяйственно ценным видам. Популяции этих рыб в настоящее время населяют пруды и водохранилища, но при снижении водности реки, зарегулировании и появлении в русле заводей и плесов со слабым течением они охотно перемещаются в русло, как это произошло в других реках Крыма [21, 22].
Плотины гидроузлов могут быть серьезным препятствием для миграций рыб вдоль русла. Через несколько месяцев после начала эксплуатации гидроузла Бельбекского водозабора в реке ниже плотины рыбное население отсутствовало практически полностью, наблюдалось лишь незначительное количество сеголетков быстрянки. Индекс Серенсена–Чекановского – сходства с рыбным населением – в 2017 г. для этого же участка составлял всего 0.28, а с прочими станциями варьировал от 0.25 до 0.5, что свидетельствует о коренной перестройке рыбного сообщества. Необходимое для его восстановления время пока трудно оценить.
Интенсивный водозабор, приводящий к обмелению и даже пересыханию отдельных участков рек, особенно актуализировался в связи с прекращением подачи днепровских вод через Северо-Крымский канал. Наблюдается устойчивая негативная тенденция уменьшения речного стока малых рек с небольшой площадью водосборного бассейна [2, 16]. Следует отметить, что длительный период покрытие дефицита осуществлялось за счет увеличения объемов подачи днепровской воды на большую часть полуострова. В настоящее время значительное количество локальных водозаборов, в том числе несанкционированных, имеется на каждой из крымских рек, и работают они на полную мощность. Дополнительную экологическую нагрузку создает загрязнение рек, прежде всего коммунальными стоками [7]. Кроме того, браконьерство, широко распространенное многие годы, включает в себя как локальное использование незаконных орудий лова и вылов охраняемых видов, так и тотальное варварское истребление фауны с использованием электролова или химических реагентов.
Провести суммарный количественный учет всех воздействий – невыполнимая задача, особенно потому, что весьма велико количество нелегальных скрытно проводимых акций. Однако по отклику экосистемы можно делать выводы о наличии этих негативных воздействий и об их масштабе. Так, хотя в структуре рыбного населения за период с 2007 по 2018 г. не наблюдалось заметных колебаний численности видов, сдвиг биомассы в сторону преобладания одного доминанта (быстрянки) свидетельствует о нарушении возрастной структуры популяций шемаи, голавля и крымского усача.
При строительстве гидросооружений и выемке грунта, как для местного строительства, так и в целях расчистки русла, неоднократно происходило нарушение морфологии и целостности водных биотопов, приводящее к разрушению нерестилищ целого ряда аборигенных видов – крымского усача, шемаи крымской и крымского пескаря.
До недавнего времени наилучшими характеристиками разнообразия отличались сообщества верхней части среднего течения (ст. 5), что, очевидно, было связано с такими причинами, как весьма стабильная гидрологическая ситуация благодаря впадению полноводного притока Коккозка и слабое поступление коммунальных и сельскохозяйственных стоков, благодаря которым воды реки в нижней части в настоящее время относятся к категории загрязненных и грязных (4–5 класс), согласно “Схеме комплексного использования и охраны водных объектов Республики Крым” [13].
Однако именно этот район в 2021 г. подвергся разрушительному воздействию при реализации гидромелиоративных мероприятий, из-за чего его потенциал биоразнообразия, возможно, частично или значительно утрачен. Степень деградации сообществ этого участка могут показать только дальнейшие исследования.
ЗАКЛЮЧЕНИЕ
В водных сообществах р. Бельбек после достаточно длительного периода стабильности наблюдается тренд снижения показателей разнообразия и выявлены статистически достоверные изменения в структуре доминирования за счет снижения обилия аборигенных крымского усача, шемаи и пескаря и элиминации старших возрастных групп этих видов. В сложившихся экологических условиях единственный вид-супердоминант – южная быстрянка, наиболее эврибионтный представитель ихтиофауны.
Произошедшие изменения в основном связаны с гидростроительными и гидротехническими мероприятиями, направленными на создание и функционирование водозабора, призванного снизить дефицит водообеспечения, связанный с прекращением работы Северо-Крымского канала.
Проведенный анализ показал, что оценка динамики показателей альфа-разнообразия сообществ – высоко информативный метод для выявления чрезмерных экологических воздействий на экосистемы малых рек. На основе полученных данных представляется необходимой организация природоохранных территорий в районах с наиболее сохранившимися природными биотопами, а также иные подходы к проведению гидротехнических работ для сохранения биоразнообразия и самовосстановительного потенциала малых рек Крыма.
Список литературы
Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.; Л.: Изд-во АН СССР, 1948. Ч. 1. С. 3–464; 1949. Ч. 2. С. 465–934; 1949. Ч. 3. С. 935–1381.
Богуцкая Е.М., Косицкий А.Г., Айбулатов Д.Н., Гречушникова М.Г. Средний многолетний сток рек юго-западной чаcти Крымского полуострова // Вод. хоз-во России: проблемы, технологии, управление. 2020. № 2. С. 37–51. https://doi.org/10.35567/1999-4508-2020-2-3
Болтачев А.Р., Игнатьев С.М., Колесникова Е.А., Неврова Е. Л. Проблемы сохранения биоразнообразия рек Севастопольского региона (на примере реки Бельбек) // Акватория и берега Севастополя: экосистемные процессы и услуги обществу. Севастополь: Аквавита, 1999. Ч. 2. С. 247–257.
Веселов Е.А. Определитель пресноводных рыб фауны СССР. М.: Просвещение, 1977. 238 с.
Делямуре С.Л. Рыбы пресных водоемов. Симферополь: Крым, 1964. 70 с.
Золотокрылин А.Н., Титкова Т.Б., Черенкова Е.А. Вековые изменения засушливости юга Европейской России в весенне-летний период // Деградация земель и опустынивание: проблемы устойчивого природопользования и адаптации. Материалы международ. науч.-практ. конф. М.: МАКС Пресс, 2020. С. 148–152. https://doi.org/10.29003/m1697.978-5-317-06490-7/ 148-152
Иванютин Н.М., Подовалова С.В. Загрязнение водных объектов Крыма сточными водами // Экология и строительство. 2018. № 1. С. 4–8. https://doi.org/10.33075/2220-5861-2018-3-140-146
Карпова Е.П., Болтачев А.Р. Рыбы внутренних водоемов Крымского полуострова. Симферополь: Бизнес-Информ, 2012. 240 с.
Одум Ю. Экология. М.: Мир, 1986. 26 с.
Пашков А.Н., Решетников С.И. Сравнительная оценка состояния зообентосных и рыбных сообществ малых рек черноморского побережья северо-западного Кавказа // Изв. Самарского НЦ РАН. 2009. Т. 11. № 1–2. С. 119–123.
Правдин И.Ф. Руководство по изучению рыб (преимущественно пресноводных) / Под ред. П.А. Дрягина, В.В. Покровского. М.: Пищевая пром-сть, 1966. 376 с.
Решетников С.И., Пашков А.Н. Экосистемы малых рек Черноморского побережья Северо-Западного Кавказа. Краснодар: Биотех-Юг, 2009. 152 с.
Схема комплексного использования и охраны водных объектов бассейнов рек Республики Крым. Кн. 1. Общая характеристика речных бассейнов, расположенных на территории Республики Крым. 2016. 175 с. https://gkvod.rk.gov.ru/ru/structure/698
Терещенко В.Г., Надиров С.Н. Формирование структуры рыбного населения предгорного водохранилища // Вопросы ихтиологии. 1996. Т. 36. № 2. С. 169–178.
Тимченко З.В. Гидрография и гидрология рек Крыма. Симферополь: ДОЛЯ, 2010. 260 с.
Трансформация структуры водного баланса в Крыму в ХХ веке – начале XXI века и ее оптимизация / Под ред. В.А. Бокова. Симферополь: Крымский НЦ, 2011. 227 с.
Уиттекер Р. Сообщества и экосистемы. М.: Прогресс, 1980. 327 с.
Устойчивый Крым. Водные ресурсы. Симферополь: Таврида, 2003. 413 с.
Цееб Я.Я. Предварительные итоги изучения ихтиофауны Крымских речек // Тр. Крымского НИИ. 1929. Т. 2. Вып. 2. С. 112–123.
Шутов Ю.И. Воды Крыма: Научно-популярный очерк. Симферополь: Таврия, 1979. 96 с.
Karpova E.P. Alien species of fish in fresh-water ichthyofauna of the Crimea // Rus. J. Biol. Invasions. 2016. V. 7. № 4. P. 340–350. https://doi.org/10.1134/S2075111716040044
Karpova E.P. Dynamics of the Structure and Diversity of Fish Communities in Mountain Rivers of the Crimea Based on the Example of the Alma River // Rus. J. Ecol. 2020. V. 51. Iss. 2. P. 166–173. https://doi.org/10.1134/S106741362002006X
Nguyen N.T.H., Soto A.J., Kontonatsios G., Batista-Navarro R., Ananiadou S. Constructing a biodiversity terminological inventory // PLoS One. 2017. V. 12. 23 p. https://doi.org/10.1371/journal.pone.0175277
Ricotta C., Bacaro G., Moretti M.A. New Measure of Functional Evenness and Some of Its Properties // PLoS One. 2014. V. 9. Iss. 8. 6 p. https://doi.org/10.1371/journal.pone.0104060
Schiemer F. Fish as indicators for the assessment of the ecological integrity of large rivers // Hydrobiologia. 2000. V. 422. P. 271–278. https://doi.org/10.1023/A:1017086703551
Smith E.P., Belle van G. Nonparametric estimation of species richness // Biometrics. 1984. V. 40. № 1. P. 119–129. https://doi.org/10.2307/2530750
Дополнительные материалы отсутствуют.