Химия высоких энергий, 2019, T. 53, № 1, стр. 7-14
Фотохимические свойства супрамолекулярной ковалентно-связанной диады на основе 8-окси-2-стирилхинолина
М. Ф. Будыка a, *, Т. Н. Гавришова a, В. М. Ли a, С. А. Дозморов a, b
a Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка, просп. Академика Семенова, 1, Россия
b Факультет фундаментальной физико-химической инженерии МГУ им. Ломоносова,
Москва, Россия
* E-mail: budyka@icp.ac.ru
Поступила в редакцию 29.06.2018
После доработки 30.08.2018
Принята к публикации 24.08.2018
Аннотация
Исследованы спектральные и фотохимические свойства бифотохромной диады, в которой два стирилхинолиновых (SQ) фотохрома соединены между собой декаметиленовой мостиковой группой. По данным стационарной спектроскопии, в основном (S0) состоянии отсутствует существенное взаимодействие между SQ-группами в диаде. Под действием света в диаде протекают две обратимые конкурентные реакции – транс-цис фотоизомеризация SQ-фотохрома и внутримолекулярное [2+2]фотоциклоприсоединение между двумя SQ-фотохромами, что свидетельствует о промежуточном образовании эксимера. Сравнение с модельными исследованиями и ранее полученными результатами позволяет предположить, что образованию эксимера способствует ковалентное связывание SQ-фотохромов декаметиленовой цепочкой, в то время как π-стэкинг между двумя SQ-фотохромами, по-видимому, не играет существенной роли.
Бифотохромные диады являются удобными объектами для исследования характера межфотохромных взаимодействий, поскольку, изменяя структуру фотохромов и связывающей их мостиковой группы, можно управлять электронными и стерическими эффектами в диаде [1–5]. Ранее нами было показано, что бихромофорная диада PQ10PQ, в которой фрагменты E-2-[(2-(пирен-1-ил)этенил]хинолина (PQ) соединены между собой диоксидекаметиленовой мостиковой группой, вступает в реакцию транс-цис-фотоизомеризации, а также в реакцию [2+2]фотоциклоприсоединения (ФЦП) с образованием соответствующего тетразамещенного циклобутана [6]. Реакция ФЦП может протекать только в эксимере, образующемся в возбужденном состоянии между двумя фотохромными группами при их сближении в пространстве. Мы предположили, что такому сближению в диаде PQ10PQ может способствовать, во-первых, π‑cтэкинг взаимодействие двух PQ групп, во-вторых, ковалентное связывание этих групп.
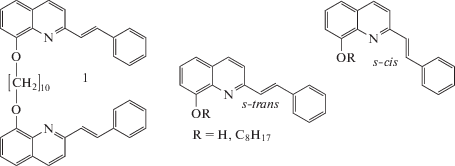
Для проверки этих предположений, в настоящей работе исследована сходная по структуре бифотохромная бис-стирилхинолиновая (SQ) диада SQ10SQ (1), в которой, по сравнению с PQ10PQ, пиреновые ядра фотохромов заменены на фенильные группы. Для выявления влияния ковалентного связывания фотохромов, исследовано монохромофорное модельное соединение 8-октилокси-2-стирилхинолин (8Oct2SQ). Диада 1 синтезирована в форме EE изомера, а модель 8Oct2SQ – в форме транс-(E)-изомера. На схеме 1 приведены структуры диады и модельного соединения, для которого показаны s-транс- и s-цис-конформеры. Очевидно, что SQ-фотохром, по сравнению с PQ-фотохромом, менее склонен к π-стэкингу вследствие существенно меньшего размера π-системы (18 и 28 π-электронов в SQ- и PQ-фотохроме соответственно). В случае важного вклада этого фактора в реакцию ФЦП, можно ожидать ингибирования этой реакции в диаде 1.
Схема 1. Структура EE изомера диады 1 и транс-изомеров модельных соединений, 8-октилокси-(R=C8H17, 8Oct2SQ) и 8-гидрокси-(R=H, 8HOSQ) 2-стирилхинолина. Показаны два s-конформера по связи между хинолиновым ядром и этиленовой группой.
Исследование показало, что диада 1 под действием света вступает как в реакцию транс-цис-фотоизомеризации, так и ФЦП, в то время как модельный 8Oct2SQ подвергается только реакции фотоизомеризации. Учитывая этот факт, а также аналогию в фотохимических свойствах двух близких по строению диад, SQ10SQ и PQ10PQ, можно сделать вывод, что π-стэкинг взаимодействие, по-видимому, играет менее важную роль в реакции ФЦП, чем ковалентное связывание хромофорных фрагментов полиметиленовой цепочкой.
Отметим, что в бис-стирилхинолиновой диаде, в которой SQ-фотохромы связаны триметиленовой мостиковой группой, прикрепленной к стирильному фрагменту, протекала только реакция фотоизомеризации [7], а в диаде с такими же SQ-фотохромами, но с о-ксилиленовой мостиковой группой, вследствие предорганизующего действия последней, наблюдались обе реакции – и фотоизомеризация, и ФЦП [8].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Модельный 8Oct2SQ и диаду 1 синтезировали по реакции конденсации 8-октил-2-метилхинолина и 1,10-бис[2-метил(хинолин-8-ил)окси]декана с бензальдегидом в уксусном ангидриде, подробная методика синтеза будет опубликована. Электронные спектры поглощения записаны на спектрофотометре “Specord M-400”. Все исследования выполнены при комнатной температуре в воздушно-насыщенных растворах в этаноле в кварцевых кюветах с длиной оптического пути l = = 1 см. Масс-спектры зарегистрированы на хромато-масс-спектрометре фирмы “Shimadzu” “LC-20 Prominence” с электро-распылительной ионизацией (ESI-MS).
В качестве источника УФ света использовали ртутную лампу ДРШ-500, спектральную линию 365 нм выделяли набором стеклянных фильтров, а также светодиоды LED-316 (λmax = 316 нм, FWHM = 11 нм) и LED-370 (λmax = 370 нм, FWHM = 14 нм), интенсивность действующего света (1–60) × 10–10 Эйнштейн см–2 с–1 (измерена ферриоксалатным актинометром). Ошибка измерения квантовых выходов фотоизомеризации 20%.
Квантово-химические расчеты соединений в основном (S0) состоянии проводили методом функционала плотности с использованием гибридного функционала B3LYP с базисом 6-31G*, пакет программ GAUSSIAN-09 [9]. Структуры соединений рассчитаны с полной оптимизацией геометрии. Оптимизированные структуры соответствовали минимуму на поверхности потенциальной энергии, поскольку в колебательном спектре отсутствовали мнимые частоты. Спектры поглощения рассчитывали методом TDDFT в приближении изолированной молекулы.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Спектральные свойства
На рис. 1 показаны экспериментальные спектры поглощения диады 1 (EE изомер, спектр 1) и транс-изомера 8Oct2SQ (спектр 2). Оба соединения имеют длинноволновую полосу поглощения (ДВПП) с λmax = 391 нм, молярный показатель поглощения (МПП) ε = 4.24 × 104 М–1 см–1 для диады и 2.23 × 104 М–1 см–1 для модели. Вторая полоса в области 290–300 нм имеет слегка разрешенную структуру с двумя максимумами и в полтора раза большую интенсивность. В целом, спектр диады, практически, является удвоенным спектром модельного соединения, что свидетельствует об отсутствии существенного взаимодействия между двумя фотохромными группами в диаде 1. В спектре цис-изомера 8Oct2SQ (спектр 3), рассчитанном по методу Фишера (см. ниже), обе полосы претерпевают гипсохромный и гипохромный сдвиги.
Сравнение спектра транс-8Oct2SQ с незамещенным [10] и замещенным в стирильном фрагменте [7] SQ, показывает, что введение алкокси-заместителя в положение 8 хинолинового ядра приводит к существенному изменению формы спектра поглощения и относительной интенсивности полос. Для выяснения природы переходов в 8Oct2SQ были проведены квантово-химические расчеты методом TDDFT.
Для упрощения, при расчетах модельного соединения октилоксигруппу в положении 8 хинолинового ядра заменили на гидроксигруппу (E‑8HOSQ, схема 1). Как и для незамещенного SQ, для E-8HOSQ возможны s-цис и s-транс конформеры, связанные с квазисвободным вращением вокруг связи между этиленовой группой и хинолиновым ядром (схема 1). Расчет показывает, что s-цис конформер на 0.8 ккал/моль стабильнее, чем с s-транс конформер, что соответствует аналогичным данным для незамещенного SQ [11].
Следует отметить, что для исследуемых 8-замещенных SQ возможна также конформационная изомерия по связи RО–С, связанная с эндо- (в сторону атома азота) или экзо- (в сторону от атома азота) ориентацией заместителя у атома кислорода. По данным B3LYP/6-31G*, в случае модельного E-8HOSQ, расчет предсказывает, что эндо-конформер стабильнее соответствующего экзо-конформера на 8.6 ккал/моль за счет внутримолекулярной водородной связи между атомом азота хинолина и атомом водорода гидроксигруппы, расстояние между этими атомами в пятичленном псевдоцикле составляет 2.06 Å, что меньше суммы ван-дер-ваальсовых радиусов (1.2 Å для H и 1.55 Å для N) [12]. Для октил-производного E-8OctOSQ такая стабилизация невозможна, кроме того, объемная октильная группа способна создавать стерические препятствия в эндо-конформере. Поэтому расчеты геометрического и электронного строения, а также спектров поглощения проводились для s-цис и s-транс конформеров экзо-конформера E-8HOSQ в приближении изолированной молекулы.
В качестве примера, на рис. 2 показана структура граничных молекулярных орбиталей (МО) для s-цис конформера E-8HOSQ: высшей занятой МО (ВЗМО), низшей вакантной МО (НВМО), и близких к ним орбиталей. Видно, что ВЗМО, НВМО и соседние с ними орбитали делокализованы по всей π-системе с заметным вкладом атомной орбитали (АО) атома кислорода. Важно отметить, что ВЗМО имеет связывающий характер по центральной двойной связи этиленовой группы, а НВМО – разрыхляющий характер по этой связи. Поэтому возбуждение с переходом электрона ВЗМО → НВМО приводит к разрыхлению π-связи этиленовой группы и создает предпосылки для изомеризации двойной связи. Вторая после ВЗМО орбиталь (Н –2, рис. 2) в значительной степени представляет собой несвя-зывающую АО, локализованную на атоме азота (n-орбиталь). Аналогичную структуру граничных орбиталей имеет s-транс конформер E-8HOSQ.
Рис. 1.
Спектры поглощения в этаноле: 1 – диада 1, 2 – транс-изомер 8Oct2SQ, 3 – цис-изомер 8Oct2SQ (см. текст).
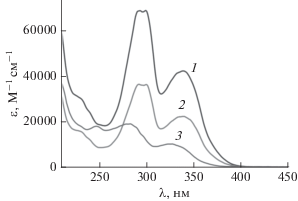
Рис. 2.
Структура граничных молекулярных орбиталей (МО) для s-цис конформера E-8HOSQ, обозначения МО: H (highest occupied) – высшая занятая МО, L(lowest unoccupied) – низшая вакантная МО.

На рис. 3 экспериментальный спектр поглощения E-8OctOSQ (спектр 1) сравнивается с рас-считанными спектрами для s-цис (спектр 2) и s-транс (спектр 3) конформеров E-8HOSQ. Положение и интенсивность полос поглощения, силы осцилляторов, энергии вертикальных переходов и состав переходов приведены в табл. 1.
Таблица 1.
Рассчитанные методом TD B3LYP/6-31G* спектры поглощения s-конформеров E-8HOSQ и экспериментальный (в этаноле) спектр поглощения E-8OctOSQ: максимум полосы (λ, нм ) и соответствующая вертикальная энергия возбуждения (Ev, эВ), сила осциллятора (f) и состав перехода, логарифм молярного показателя поглощения (ε в М–1 см–1)
| Сост.а | s-цисE-8HOSQ | s-трансE-8HOSQ | E-8OctOSQ | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ev | λ | f | Составб | % | Ev | λ | f | Составб | % | Ev | λ | lgε | |
| S1 | 3.39 | 366 | 0.383 | H → L | 93 | 3.54 | 351 | 0.448 | H → L H – 1 → L |
82 15 |
3.67 | 338 | 4.35 |
| S2 | 3.69 | 336 | 0.188 | H – 1 → L H → L + 1 |
71 22 |
3.78 | 328 | 0.283 | H – 1 → L
H → L + 1 H → L |
49 34 14 |
|||
| S3 | 3.94 | 315 | 0.001 | H – 2 → L | 98 | 4.04 | 307 | 0.001 | H – 2 → L | 97 | |||
| S4 | 4.19 | 296 | 0.768 | H → L + 1 H – 1 → L |
69 21 |
4.14 | 299 | 0.706 | H → L + 1 H – 1 → L | 59 34 |
4.15 4.25 |
299 292 |
4.56 4.56 |
Как видно на рис. 3, расчетные спектры модельного E-8HOSQ хорошо согласуются с экспериментальным спектром E-8OctOSQ. Расчет показывает, что для обоих s-конформеров E-8HOSQ ДВПП представляет собой суперпозицию двух полос, связанных с переходами в S1 и S2 возбужденные состояния. Из табл. 1 следует, что возбуждение в S1-состояние обусловлено переходом между граничными МО H → L, энергия этих переходов для обоих s-конформеров (3.39 и 3.54 эВ) слегка занижена по сравнению с экспериментальной (3.67 эВ), измеренной в максимуме ДВПП.
Рис. 3.
Экспериментальный (в этаноле) спектр поглощения E-8OctOSQ (1) и рассчитанные методом TD B3LYP/6-31G* спектры E-8HOSQ, s-цис (2) и s‑транс (3) конформер. Дано отнесение полос в расчетных спектрах.
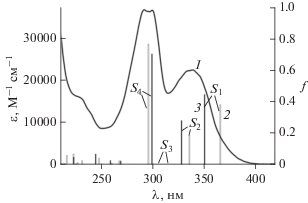
Возбуждение во второе (S2) и четвертое (S4) синглетно-возбужденные состояния связано с переносом электрона между соседними с ВЗМО и НВМО орбиталями (переходы H – 1 → L и H → L + 1). Для исследованных двух s-конформеров E-8HOSQ оба перехода различаются менее, чем на 0.1 эВ (3.69 и 3.78 эВ для S0–S2, 4.19 и 4.14 эВ для S0–S4). Для обоих s-конформеров расчет предсказывает самую большую силу осциллятора для S0–S4 перехода (f4 > 0.7), ему соответствует вторая самая интенсивная полоса в спектре поглощения E-8OctOSQ (рис. 3).
Поскольку основной вклад в третью (сверху) занятую МО (Н – 2) вносит неподеленная электронная пара атома азота (рис. 2) малоинтенсивный S0–S3 переход (f3 = 0.001), обусловлен переносом электрона H – 2 → L (табл. 1) и характеризует nπ*-возбужденное состояние. В экспериментальном спектре эта полоса маскируется соседними более интенсивными полосами.
Отметим также, что по сравнению с s-цис конформером, для s-транс E-8HOSQ наблюдается более сложный состав некоторых переходов переходов в S1 и S2 состояния (табл. 1). Расчет предсказывает, что спектр s-цис конформера батохромно сдвинут относительно спектра s-транс конформера, максимумы полос поглощения равны 366 и 351 нм соответственно (табл. 1). Аналогичное соотношение для спектров двух s-конформеров наблюдалось ранее для замещенного SQ с 4-метокси группой в стирильном фрагменте [7].
Таким образом, квантово-химические расчеты показывают, что экспериментальный спектр поглощения E-8OctOSQ является, по-видимому, суммой спектров двух s-конформеров, соотношение которых зависит от конкретных условий. В обоих s-конформерах ДВПП обусловлена переходами в S1- и S2-состояния с участием граничных и соседних с ними МО, а самая интенсивная полоса характеризует переход в S4-состояние. Возбуждение в S1-состояние приводит к разрыхлению π‑связи этиленовой группы и создает предпосылки для изомеризации двойной связи.
Фотохимические свойства
При облучении растворов модельного E-8Oct2SQ светом с λ = 316 нм происходили спектральные изменения, характерные для обратимой реакции фотоизомеризации: уменьшение поглощения транс-изомера в области 339 нм и симбатный рост поглощения цис-изомера в области 250 нм, рис. 4. В течение всего периода облучения сохранялась изосбестическая точка при 276 нм, свидетельствующая об отсутствии вклада побочных реакций (см. ниже). Спектральные изменения прекращались по достижении (квази)фотостационарного состояния (ФС), рис. 4, спектр 12. На основании спектров транс-изомера и двух разных ФС, полученных при облучении транс-изомера светом с разной длиной волны (316 и 370 нм), по методу Фишера [13] был рассчитан спектр цис-изомера, показанный на рис. 1 (спектр 3). Отметим, что при дальнейшем длительном облучении наблюдался постепенный сдвиг изосбестической точки, свидетельствующий о протекании побочных реакций, природа которых не исследовалась.
Рис. 4.
Спектральные изменения при облучении воз-душно-насыщенного раствора E-8Oct2SQ (4.1 × × 10–5 М) в этаноле светом с длиной волны 316 нм, интенсивность 1.1 × 10–10 Эйнштейн см–2 с–1, время фотолиза 0 (1), 60 (2), 190 (3), 340 (4), 530 (5), 830 (6), 1300 (7), 2000 (8), 3700 (9), 6000 (10), 9000 (11), 12 000 с (12). Вставка: кинетика изменения оптической плотности на длине волны 316 нм, экспериментальные точки и аппроксимирующая кривая, см. текст.
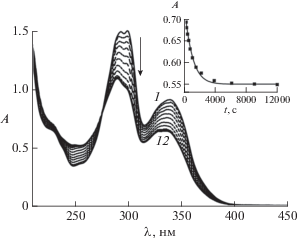
Квантовые выходы транс-цис (φtc) и цис-транс (φct) фотоизомеризации были рассчитаны численным решением дифференциального уравнения (1), описывающего кинетику изменения оптической плотности (A) раствора при обратимой транс-цис фотоизомеризации
(1)
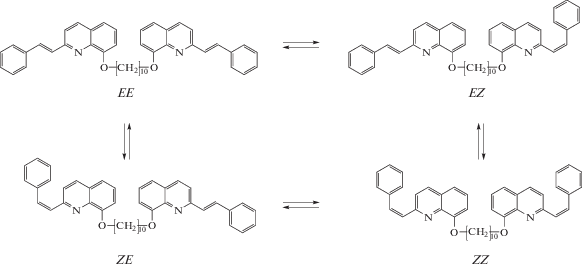
${{dA} \mathord{\left/ {\vphantom {{dA} {dt}}} \right. \kern-0em} {dt}} = --({{\varepsilon }_{{\text{t}}}}--{{\varepsilon }_{{\text{c}}}})({{\varphi }_{{{\text{tc}}}}}{{A}_{{\text{t}}}}--{{\varphi }_{{{\text{ct}}}}}{{A}_{{\text{c}}}}){{I}_{0}}F,$В диаде 1, благодаря наличию двух фотохромных групп, могут протекать четыре обратимые реакции фотоизомеризации с участием четырех изомеров, EE, EZ, ZE и ZZ, причем ввиду равенства фотохромных групп несимметричные EZ и ZE изомеры неразличимы. Каждый из изомеров способен вступать в две обратимые реакции фотоизомеризации, образуя цикл взаимопревращений, показанный на схеме 2.
Схема 2 . Цикл реакций фотоизомеризации бифотохромной диады 1 (с фрагментами SQ в форме s-транс конформеров).
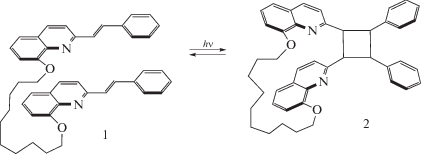
При облучении раствора диады 1 светом с λ = = 365 нм в начальный период (до 100 с) наблюдалось быстрое падение оптической плотности в области обеих длинноволновых полос с сохранением изосбестической точки при 269 нм, рис. 5, спектры 1–7. Эти спектральные изменения соответствовали таковым при облучении модельного 8Oct2SQ, рис. 4. Однако при дальнейшем облучении наблюдались заметные отличия, свидетельствующие о протекании дополнительных реакций: продолжалось падение поглощения в области 270–370 нм и одновременно росло поглощение в области 249 нм, причем начиная с 300 с соблюдались изосбестические точки при 234.4 и 257.5 нм, рис. 5 спектры 10–17. Исчезновении ДВПП свидетельствовало об исчезновении хромофорной системы SQ в результате разрыва π-сопряжения между хинолиновым и бензольным ядрами, т.е. об исчезновении этиленовой группы. Последнее возможно в случае протекания реакций фотовосстановления этиленовой группы, фотоприсоединения растворителя к этиленовой группе, или ФЦП. Анализ реакционной смеси методом электрораспылительной масс-спектрометрии показал наличие в масс-спектрах исходного и конечного растворов только одного пика с m/z 633, соответствующего иону MH+, что свидетельствовало в пользу реакции ФЦП с образованием соответствующего циклобутанового производного 2 (схема 3). Таким образом, наблюдается полная аналогия в фотохимических свойствах диады 1 и ранее исследованных бифотохромных диад с SQ [8, 14], стирилбензохинолиновыми [15, 16] или пиренилхинолилэтиленовыми [6] фотохромами. Было показано, что в реакции ФЦП участвует EE изомер диады, реакция протекает стереоспецифически с образованием rctt-изомера циклобутана [14, 15]. В реакции ФЦП диады 1 образуется циклобутан, содержащий в качестве заместителей несопряженные бензольные и хинолиновые ядра (схема 3), к которым в конечном спектре 17 на рис. 5 относятся полосы поглощения в области 250 и 300 нм соответственно.
Рис. 5.
Спектральные изменения при облучении воздушно-насыщенного раствора EE-SQ10SQ (2.6 × 10–5 М) в этаноле светом с длиной волны 365 нм, интенсивность 6.1 × 10–9 Эйнштейн см–2 с–1, время фотолиза 0 (1), 5 (2), 10 (3), 20 (4), 30 (5), 50 (6), 70 (7), 110 (8), 170 (9), 300 (10), 500 (11), 800 (12), 1300 (13), 2000 (14), 3400 (15), 6000 (16), 12300 с (17). Вставка: кинетика изменения оптической плотности на длине волны 365 нм, экспериментальные точки и аппроксимирующая кривая, см. текст.
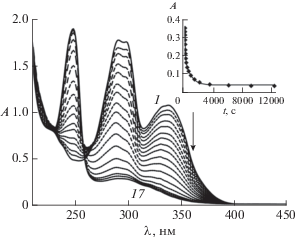
Схема 3 . Реакции [2+2]фотоциклоприсоединения в EE изомере диады 1 с образованием тетразамещенного циклобутана 2.
Как показано ранее [6], кинетика фотолиза бифотохромной диады с учетом реакции фотоизомеризации по схеме 2 и реакции ФЦП по схеме 3 в упрощенном виде описывается системой из 5 дифференциальных уравнений (2)–(6) с учетом уравнения материального баланса (напомним, что в симметричной диаде EZ и ZE изомеры спектрально неразличимы):
(2)
$\begin{gathered} {{d{{c}_{{EE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EE}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}({{c}_{{ZE}}} + {{c}_{{EZ}}})--2{{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}} - \\ --\,\,2{{\varphi }_{{pca}}}{{\varepsilon }_{E}}{{c}_{{EE}}} + {{\varphi }_{{discl}}}{{\varepsilon }_{{CB}}}{{c}_{{CB}}}){{I}_{0}}F, \\ \end{gathered} $(3)
$\begin{gathered} {{d{{c}_{{ZE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZE}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}} - \\ --\,\,({{\varphi }_{{EZ}}}{{\varepsilon }_{E}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}){{c}_{{ZE}}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(4)
$\begin{gathered} {{d{{c}_{{EZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EZ}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}} - \\ --\,\,({{\varphi }_{{EZ}}}{{\varepsilon }_{E}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}){{c}_{{EZ}}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(5)
${{d{{c}_{{ZZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZZ}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}({{c}_{{ZE}}} + {{c}_{{EZ}}})--2{{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F,$(6)
${{d{{c}_{{CB}}}} \mathord{\left/ {\vphantom {{d{{c}_{{CB}}}} {dt}}} \right. \kern-0em} {dt}} = (2{{\varphi }_{{{\text{pca}}}}}{{\varepsilon }_{E}}{{c}_{{EE}}}--{{\varphi }_{{{\text{discl}}}}}{{\varepsilon }_{{CB}}}{{c}_{{CB}}}){{I}_{0}}F,$Систему уравнений (2)–(6) решали численно путем минимизации среднеквадратичной ошибки оптической плотности, см. выше, в качестве примера, на вставке на рис. 5 показаны экспериментальная и аппроксимирующая кинетические кривые. Необходимые значения МПП для синтетически труднодоступных изомеров диады оценивали исходя из соответствующих значений для модельного 8Oct2SQ. Получены средние значения квантовых выходов φEZ = 0.15, φZE = 0.6, φpca = 0.029 и φdiscl = 0.027. По-видимому, как и для ранее исследованных диад [6–8], кинетическая модель фотоизомеризации по уравнениям (2)–(5) дает завышенное значение φZE, однако вариация этого параметра в модельных расчетах мало влияет на соотношение φEZ и φpca.
Сравнение квантовых выходов модельного 8Oct2SQ и диады 1 показывает, что в составе диады SQ-фотохром сохраняет активность в реакции фотоизомеризации. Кроме того, в диаде 1 появляется дополнительный конкурентный канал, связанный с реакцией ФЦП. Этот канал невозможен в модельном 8Oct2SQ (в разбавленных растворах) без супрамолекулярной предорганизации, роль которой в диаде 1 выполняет ковалентное связывание двух SQ-фотохромов. Декаметиленовая цепочка, благодаря своей гибкости, позволяет двум SQ-фотохромам сблизиться в пространстве до расстояния, необходимого для образования эксимера, являющегося интермедиатом реакции ФЦП в возбужденном состоянии.
Ранее, по результатам исследования пирен-содержащей диады PQ10PQ, предполагалось, что дополнительным фактором предорганизации может быть π-стэкинг взаимодействие двух фотохромов в диаде. Однако квантовый выход реакции ФЦП φpca в диаде PQ10PQ (0.05) [6], где можно предположить наличие π-стэкинг взаимодействия, сравним по величине со значением φpca для диады 1 (0.029), где π-стэкинг взаимодействие маловероятно, что свидетельствует о несущественной роли этого фактора в стабилизации эксимера и реакции ФЦП.
Соотношение квантовых выходов реакций фотоизомеризации и ФЦП в диаде 1 объясняет характер спектральных изменений при фотолизе диады на рис. 5. Эти изменения наглядно визуализируются с помощью метода главных компонент (principal component analysis) [17]. На рис. 6 показан график счетов, на котором экспериментальные спектры при фотолизе диады 1 и, для сравнения, модельного соединения 8Oct2SQ представлены в базисе первых двух сингулярных векторов. Каждая точка на графике соответствует конкретному спектру реакционной смеси при фотолизе, при анализе учитывался спектральный диапазон 260–410 нм с шагом 1 нм, т.е. исходная матрица включала 151 значение оптической плотности для каждого спектра. На график также нанесена точка, соответствующая спектру цис-изомера 8Oct2SQ, рассчитанному по методу Фишера, см. выше.
Прямая 1 на рис. 6 характеризует реакцию транс-цис фотоизомеризации модельного 8Oct2SQ, протекающую с участием только двух хромофоров – транс- и цис-изомеров 8Oct2SQ. Спектральные изменения в этой реакции прекращаются при достижении (квази)ФС, которое содержит 52% транс-изомера 8Oct2SQ (точка PS316 на рис. 6).
Рис. 6.
График счетов – обработка методом главных компонент (principal component analysis) спектральных изменений, происходящих при фотолизе (1) модельного 8Oct2SQ и (2) диады 1; экспериментальные спектры представлены в базисе двух первых сингулярных векторов p1 и p2. Отмечены точки, соответствующие исходному спектру EE изомера диады (EE-1), транс-изомера 8Oct2SQ (E-8Oct2SQ), цис-изомера 8Oct2SQ (Z-8Oct2SQ), рассчитанному по методу Фишера, см. текст, и (квази)ФС PS316 в реакции фотолиза 8Oct2SQ и PS365 в реакции фотолиза диады 1.
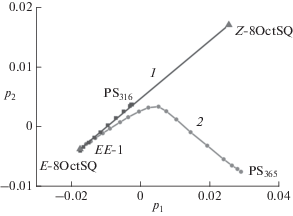
График 2 на рис. 6 характеризует спектральные изменений при фотолизе диады 1. Левая ветвь графика 2 идет вдоль прямой 1 и соответствует быстрым спектральным изменениям при реакции транс-цис фотоизомеризации SQ-фотохрома. Значение φEZ в ~5 раз больше, чем φpca, поэтому реакция ФЦП не оказывает заметного влияния на спектральные изменения в этом временном интервале, о чем также свидетельствует изосбестическая точка при 269 нм (рис. 5, спектры 1–7). Далее устанавливается (квази)ФС по реакции фотоизомеризации, при котором прекращаются спектральные изменения, связанные с этой реакцией, и на фоне сохраняющегося соотношения транс- и цис-изомеров становится заметной медленная реакция ФЦП, временной интервал которой на два порядка больше, чем для реакции фотоизомеризации. В реакции ФЦП расходуется только EE изомер диады, однако, вследствие больших квантовых выходов фотоизомеризации, при дальнейшем фотолизе сохраняется соотношение концентраций транс- и цис-изомеров SQ-фотохрома, о чем свидетельствует наличие изосбестических точек при 234.4 и 257.5 нм в конечном временном интервале (рис. 5, спектры 10–17). Такой интерпретации соответствует и почти прямолинейная правая ветвь графика 2, идущая, практически, перпендикулярно прямой 1. В реакции ФЦП также достигается ФС PS365, которое, по данным расчетов, содержит 88% циклобутана 2, а на долю исходного EE изомера диады 1 приходится 3% (при облучении диады светом 365 нм).
ЗАКЛЮЧЕНИЕ
Таким образом, в бис-стирилхинолиновой диаде 1 под действием света протекают две обратимые конкурентные реакции – транс-цис фотоизомеризация SQ-фотохромов и межфотохромное [2+2]фотоциклоприсоединение с образованием тетразамещенного циклобутана. Необходимым интермедиатом реакции ФЦП является эксимер. Сравнение с результатами исследования модельного моно-фотохромного соединения, а также с ранее полученными результатами для близких по структуре диад, позволяет предположить, что образованию эксимера способствует ковалентное связывание SQ-фотохромов декаметиленовой цепочкой, в то время как π-стэкинг взаимодействие между двумя SQ-фотохромами, по-видимому, не играет существенной роли.
Работа выполнена по теме Государственного задания № 01201361847 и при финансовой поддержке Российского фонда фундаментальных исследований (грант 17-03-00789).
Список литературы
Favaro G., Levi D., Ortica F., Samat A., Guglielmetti R., Mazzucato U. // J. Photochem. Photobiol. C: Photochem. Rev. 2002. V. 149. P. 91.
Perrier A., Maurel F., Jacquemin D. // Acc. Chem. Res. 2012. V. 45. P. 1173.
Kirkus M., Janssen R.A.J., Meskers S.C.J. // J. Phys. Chem. A. 2013. V. 117. P. 4828.
Karatsu T., Nakamura T., Terasawa M., Yagai S., Kitamura A., Nishimura Y., Yamazaki I. // Res. Chem. Intermed. 2013. V. 39. P. 347.
Giribabu L., Sudhakar K., Sabapathi G., Kanapar-thi R.K. // J. Photochem. Photobiol. A: Chem. 2014. V. 284. P. 18.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М., Гак Ю.В., Гринева И.А. // Химия высоких энергий. 2018. Т. 52. № 3. С. 204.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2012. Т. 46. С. 369.
Будыка М.Ф., Гавришова Т.Н., Поташова Н.И., Чащихин О.В.// Химия высоких энергий. 2015. Т. 49. С. 269.
Gaussian 09, Revision B.01 // Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian, Inc., Wallingford CT, 2010.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2008. Т. 42. С. 497.
Budyka M.F., Oshkin I.V. // Int. J. Quantum Chem. 2011. V. 111. P. 3673.
Steiner T. // Angew. Chem. Int. Ed. 2002. V. 41. P. 48.
Fischer E. // J. Phys. Chem. 1967. V. 71. P. 3704.
Budyka M.F., Gavrishova T.N., Potashova N.I., Chernyak A.V. // Mendeleev Commun. 2015. V. 25. P. 106.
Budyka M.F., Gavrishova T.N., Potashova N.I. // ChemistrySelect. 2016. V. 1. P. 36.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2017. Т. 51. С. 216.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2010. Т. 44. С. 436.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий