Химия высоких энергий, 2019, T. 53, № 1, стр. 24-27
Триплет-триплетный перенос энергии как причина тушения тионином триплетного состояния эозина в комплексах с кукурбит[7,8]урилами в воде
Т. В. Федотова a, b, В. Н. Гутров a, Г. В. Захарова a, *, А. К. Чибисов a, **, М. В. Алфимов a
a Центр фотохимии РАН, ФНИЦ “Кристаллография и фотоника“ РАН
119421 Москва, ул. Новаторов, 7а, кор.1, Россия
b Московский физико-технический институт (государственный университет)
141701 Московская обл., Долгопрудный, Институтский пер., 9, Россия
* E-mail: gvzakharova@gmail.com
** E-mail: alexander.chibisov@gmail.com
Поступила в редакцию 19.06.2018
После доработки 03.09.2018
Принята к публикации 03.09.2018
Аннотация
Исследовали тушение тионином триплетного состояния эозина в воде в отсутствие и в присутствии кукурбит[7,8]урилов по данным фосфоресценции, замедленной флуоресценции и триплет-триплетного поглощения. Тушение обусловлено триплет-триплетным (Т-Т) переносом энергии между эозином (донор энергии) и тионином, а также его мономерным с кукурбит[7]урилом (КБ7) и димерным с кукурбит[8]урилом (КБ8) комплексами (акцепторы энергии) в водном обескислороженном растворе при комнатной температуре. Значение константы скорости тушения фосфоресценции, замедленной флуоресценции и триплетного состояния эозина свободным (несвязанным) тионином составляет 3.8 × 109 л · моль–1 с–1. Т-Т перенос энергии между эозином и мономерным комплексом тионина с КБ7 происходит с константой скорости 3.7 × 109 л · моль–1 c–1. Триплет-триплетный перенос между эозином и димерными комплексами тионина с КБ8, измеренный по тушению замедленной флуоресценции и фосфоресценции, происходит с константой скорости 8.3 × 109 л · моль–1 с–1. Перенос энергии по данным триплет-триплетного поглощения происходит с константой скорости 8.7 × 109 л · моль–1 с–1. Различное влияние кукурбит[7]урила и кукурбит[8]урила на эффективность тушения связано с особенностью структуры мономерных и димерных комплексов тионина, а также с величиной кулоновского взаимодействия между анионом эозина и катионом мономерного и дикатионом димерного комплексов. Наблюдаемые различия в значениях констант скорости тушения могут быть обусловлены различающимися формой и протяженностью молекулярных орбиталей мономерных и димерных комплексов тионина, что приводит к различной степени перекрывания волновых функций донора и акцептора энергии.
Тушение триплетного состояния красителей различными добавками является предметом многочисленных исследований [1–6]. В ряде случаев тушение происходит по обменно-резонансному механизму, известному как триплет-триплетный (Т-Т) перенос энергии [2]. Особенности механизма Т-Т переноса были установлены в работах Декстера [7] и подтверждены экспериментальными данными работ Ермолаева и Теренина [2]. Триплет-триплетный перенос наблюдается в газовой фазе, жидких и твердых растворах [2]. Т-Т перенос является известным методическим приемом, используемым для изучения фотоники триплетных состояний молекул с низким квантовым выходом интеркомбинационной конверсии. В этом случае заселение триплетного уровня при непосредственном фотовозбуждении практически не имеет место. Однако заселение триплетного уровня может происходить при сенсибилизированном фотовозбуждении путем Т-Т переноса от триплетной молекулы донора энергии к невозбужденной молекуле акцептора. Определенный интерес представляет выявление особенностей Т-Т переноса в условия ограничения поступательной диффузии донора и акцептора триплетной энергии. Такие условия могут достигаться в комплексах типа “гость-хозяин” между молекулами донора и акцептора энергии с молекулами кукурбитурила. В настоящей работе приведены результаты исследования влияния кукурбит[7]урила и кукурбит[8]урила на эффективность тушения тионином триплетного состояния эозина по данным Т-Т поглощения, фосфоресценции и замедленной флуоресценции.
МЕТОДИКА ЭКСПЕРИМЕНТА
В качестве объектов исследования использовали динатриевую соль эозина, ацетат тионина и кукурбит[7, 8]урилы фирмы Aldrich. Измерение спектров Т-Т поглощения и кинетики дезактивации триплетного состояния проводили на установке нс-лазерного фотолиза [8]. Растворы эозина облучали импульсами лазера на иттрий-алюминий гранате (Nd:YAG, “Solar”, λ = 532 нм) с длительность импульса 10 нс, и энергией до 100 мДж. Измерения спектров и кинетики затухания фосфоресценции и замедленной флуоресценции выполняли на спектрофлуориметре Cary Eclipse. Спектры фосфоресценции и замедленной флуоресценции регистрировали через 100 мкс после прекращения излучения импульсной лампы как источника возбуждения (опция спектрофлуориметра). Спектры поглощения регистрировали на спектрофотометре Agilent 8453. Все измерения проводили на обескислороженных водных растворах при комнатной температуре. Удаление кислорода достигали путем барботирования раствора газообразным азотом. Воду очищали с помощью системы Direct–Q3 Millipore.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В качестве донора триплетной энергии использовали эозин (Эo–), спектрально-люминесцентные и фотохимические свойства которого хорошо известны [9–12]. Для молекул эозина характерным является наличие замедленной флуоресценции и фосфоресценции в водных обескислороженных растворах при комнатной температуре. На рис. 1 (кривая 1) приведен спектр испускания водного обескислороженного раствора эозина, состоящий из двух полос. Спектр испускания эозина характеризуется двумя максимумами при 541 и 679 нм, отвечающими замедленной флуоресценции и фосфоресценции Эo– соответственно.
Рис. 1.
Нормированные спектр испускания обескислороженного водного раствора эозина 3.0 × 10–6 моль/л (1) и спектры поглощения водных растворов тионина 4.5 × 10–6 моль/л (2), мономерного комплекса тионина с КБ7 1.0 × 10–4 моль/л (3), димерного комплекса тионина с КБ8 5.0 × 10–5 моль/л (4).
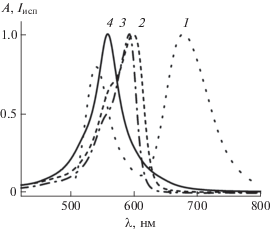
В пользу отнесения полосы при 541 нм к замедленной флуоресценции свидетельствует совпадение положения ее максимума с максимумом обычной (быстрой) флуоресценции. Совпадение времени затухания фосфоресценции с временем затухания замедленной флуоресценции свидетельствует в пользу термически активированной флуоресценции. Кроме замедленной флуоресценции и фосфоресценции характеристикой триплетного состояния Эo– является спектр триплет-триплетного (Т-Т) поглощения с максимумом при 560 нм в водном растворе [11, 12].
В качестве акцепторов триплетной энергии использовали как свободный тионин (ThH+), так и его мономерный комплекс с кукурбит[7]урилом (КБ7) состава 1 : 1 (ThH+@КБ7) и димерный комплекс с кукурбит[8]урилом (КБ8) состава 2 : 1 (${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8). Состав комплексов ThH+ с КБ7 и КБ8 был установлен в работах [13–15]. На рис. 1 (кривые 2–4) приведены нормированные спектры поглощения ThH+, ThH+@КБ7, ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8. Максимумы спектров поглощения комплексов ThH+ с кукурбитурилами гипсохромно смещены относительно максимума спектра поглощения свободного ThH+. Триплетный уровень ThH+ расположен при ${\text{Е }}_{{{\text{Th}}{{{\text{H}}}^{ + }}}}^{Т }$ = 13640 см–1 [5]. Положение Т-уровня ThH+@КБ7 не удалось установить по причине особенности измерения спектра фосфоресценции на спектрофлуориметре Cary Eclipse. Как указано в разделе “Методика эксперимента”, измерения фосфоресценции следует проводить через 100 мкс после прекращения излучения импульсной лампы как источника возбуждения, в то время как время жизни Т-состояния ThH+@КБ7 составляет 14 мкс [16]. Положение Т-уровня ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 не удалось установить по причине отсутствия фосфоресценции комплекса [16].
Эозин – тионин
Перенос триплетной энергии между эозином и тионином и его мономерным ThH+@КБ7 и димерным ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 комплексами изучали как по тушению фосфоресценции и замедленной флуоресценции, так и по убыли триплет-триплетного поглощения. Под действием лазерного импульсного облучения обескислороженного водного раствора эозина 1.0 × 10–5 моль/л наблюдали возникновение полосы Т-Т поглощения. При добавлении ThH+ (1.0 × 10–5 моль/л) к раствору Эo– не наблюдали ни смещение максимума, ни изменение формы полосы синглет-синглетного поглощения эозина, что свидетельствует об отсутствии взаимодействия Эo– с молекулами ThH+. Вместе с тем имело место тушение триплетного состояния эозина молекулами тионина. Тушение регистрировали по сокращению времени жизни как замедленной флуоресценции и фосфоресценции, так и триплетного состояния. На рис. 2а приведены кинетические кривые дезактивации триплетного состояния эозина в присутствии тионина. На рис. 2б представлены кривые затухания фосфоресценции эозина.
Рис. 2.
Кинетические кривые дезактивации триплетного состояния эозина (630 нм) (а) и затухания фосфоресценции эозина (676 нм) (б). Кривая 1 – в отсутствие и кривая 2 – в присутствии тионина 5 × 10–6 моль/л (а), 1 × 10–6 моль/л (б).
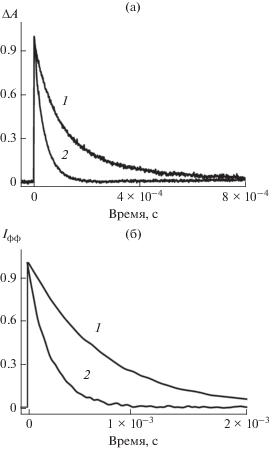
Значение константы скорости тушения, найденное по сокращению времени жизни эозина в триплетном состоянии и по сокращению времени затухания замедленной флуоресценции и фосфоресценции эозина, составляет 3.8 × 109 л моль–1 с–1. В пользу возможности Т-Т переноса энергии указывает тот факт, что положение триплетного уровня эозина $Е _{{{\text{Э }}{{{\text{о }}}^{--}}}}^{{\text{Т }}}$ = 14727 см–1 заметно выше положения триплетного уровня тионина $Е _{{{\text{Th}}{{{\text{H}}}^{ + }}}}^{{\text{Т }}}$ = = 13 640 см–1 [5], разность $Е _{{{\text{Э }}{{{\text{о }}}^{{\text{--}}}}}}^{{\text{Т }}}$ – $Е _{{{\text{Th}}{{{\text{H}}}^{{\text{ + }}}}}}^{{\text{Т }}}$ составляет 1087 см–1.
Эозин – тионин-кукурбит[7, 8]урилы
В настоящей работе установлено, что добавление КБ7 и КБ8 к раствору эозина приводит к уменьшению величины Т-Т поглощения, падению интенсивности фосфоресценции и замедленной флуоресценции. При этом значения константы скорости дезактивации Т-состояния, затухания фосфоресценции и замедленной флуоресценции практически не изменяется. Уменьшение Т-Т поглощения и интенсивности свечения, вероятно, связано с образованием комплексов между эозином и кукурбит[7, 8]урилами. Из зависимости Штерна–Фольмера были найдены значения константы комплексообразования Эо–@КБ7 и Эо–@КБ8, составляющие и 1.5 × 104 моль/л и 5 × 104 моль/л соответственно. Наличие Т-Т переноса энергии между Эо– в триплетном состоянии и ThH+@КБ7 и ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 следует из тушения триплетного состояния Эо– комплексами тионина с кукурбит[7, 8]урилами. Т-Т перенос энергии между эозином и мономерным комплексом тионина с КБ7 происходит с константой скорости 3.7 × 109 л · моль–1 с–1, тогда как Т-Т перенос энергии между эозином и димерным комплексом тионина с КБ8 происходит с большей константой скорости в диапазоне (8.3–8.7) × 109 л · моль–1с–1.
Триплет-триплетный перенос энергии подтверждается возникновением Т-Т поглощения тионина и его мономерных и димерных комплексов с КБ7 и КБ8 соответственно. На рис. 3 кривые 1 и 2 отражают кинетику образования и убыли Т-Т поглощения эозина в отсутствие 1 и в присутствии 2 димерного комплекса тионина ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8. Участок а–б характеризует образование триплетных молекул эозина под действием лазерного импульса, участки б–в и б–г отвечают дезактивации триплетного состояния Эо–. Кривая 3, измеренная на длине волны, отвечающей изобестической точке в спектре триплет-триплетного поглощения эозина, характеризует кинетику образования димерного комплекса ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 в триплетном состоянии (участок а–д) в результате переноса энергии, что проявляется в уменьшении поглощении димерного комплекса (просветление раствора). Участок д–е относится к гибели триплетного состояния димерного комплекса, приводящего к восстановлению спектра поглощения ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8.
Рис. 3.
Кинетические кривые дезактивации триплетного состояния эозина при 630 нм в отсутствие (1) и в присутствии (2) димерного комплекса ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 (2 × 10–6 моль/л) и кинетическая кривая образования и дезактивации триплетного состояния димерного комплекса ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 при 540 нм (3).
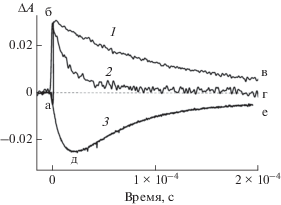
Таким образом, в работе установлено, что триплет-триплетный перенос энергии между эозином и тионином, а также его комплексами с КБ7 и КБ8 происходит с константами скорости в диапазоне (8.3–8.7) × 109 л·моль–1с–1. КБ7 не оказывает влияния на эффективность Т-Т переноса энергии, в то время как КБ8 способствует более эффективному переносу энергии. При этом константа скорости тушения Т-состояния ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 увеличивается более чем в 2 раза по сравнению с константой скорости тушения в системах эозин– свободный тионин и эозин–ThH+@КБ7. Наблюдаемые различия в значениях констант скорости тушения могут быть обусловлены различающимися формой и протяженностью молекулярных орбиталей ThH+@КБ7 и ${\text{ThH}}_{{\text{2}}}^{ + }$@КБ8 комплексов, что приводит к различной степени перекрывания волновых функций донора и акцептора энергии. Кроме того, различное кулоновское взаимодействие в комплексе встреч между анионом эозина и моно- и дикатионом комплекса тионина с КБ7 и КБ8, соответственно, также может оказывать влияние на величину константы скорости Т-Т переноса энергии.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части измерения кинетических кривых затухания замедленной флуоресценции и фосфоресценции и при финансовой поддержке Российского фонда фундаментальных исследований в части проведения спектрально-люминесцентных измерений (проект № 18-03-00183) и в части проведения лазерно-кинетических измерений (проект № 16-29-11765 офи_м).
Список литературы
Чибисов А.К. // Химия высоких энергий. 1976. Т. 10. № 1. С. 3.
Ермолаев В.Л., Бодунов Е.Н., Свешникова Е.Б., Шахвердов Т.А. Безызлучательный перенос энергии электронного возбуждения. Л.: Наука, 1977. 310 с.
Захарова Г.В., Коробов В.Е., Чибисов А.К. // ТЭХ. 1982. Т. 18. № 3. С. 343.
Чибисов А.К. // Успехи химии. 1981. Т. 50. Вып. 7. С. 1169.
Коробов В.Е., Чибисов А.К. // Успехи химии. 1983. Т. 52. Вып. 1. С. 43.
Chibisov A.K. // Progress in Reaction Kinetics. 1984. V. 13. P. 1.
Dexter D.L. // J. Phys. Chem. 1953. № 5. P. 836.
Захарова Г.В., Авакян В.Г., Маркелов В.П и др. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
Zwicker E.F., Grosweiner L.I. // J. Phys. Chem. 1963. V. 67. P. 549.
Kasche V., Lindqvist L. // Photochem. Photobiol. 1965. V. 4. P. 923.
Захарова Г.В., Лифанов Ю.И., Чибисов А.К. // ЖАХ. 1980. Т. 35. Вып. 10. С. 1905.
Захарова Г.В., Чибисов А.К. // Химия высоких энергий. 1984. Т. 18. № 6. С. 552.
Montes–Navajas P., Corma A., Garcia H. // Chem. Phys. Chem. 2008. V. 9. P. 713.
Montes–Navajas P., Garcia H. // Photochem. Photobiol. 2009. V. 204. P. 97.
Xi Y.Y., Tang Q., Huang Y., Tao Z., Xue S.F., Zhu Q.J. // Spectroscopy and Spectral Analysis. 2016. V. 36. № 6. P. 1809.
Атабекян Л.С., Авакян В.Г., Захарова Г.В., Чибисов А.К. // Химия высоких энергий. 2018. Т. 52. № 2. С. 103.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


