Химия высоких энергий, 2019, T. 53, № 1, стр. 15-23
Обратный фотохромизм нитрозамещенного бисспиропиpана на основе бензопирролоиндола
И. Р. Мардалейшвили a, *, Г. В. Любимова a, А. В. Любимов a, Л. С. Кольцова a, А. И. Шиенок a, П. П. Левин a, b, А. С. Татиколов b, Н. Л. Зайченко a
a Федеральное государственное бюджетное учреждение науки Институт химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, ул. Косыгина, 4, Россия
b Федеральное государственное бюджетное учреждение науки Институт биохимической физики им. Н.М. Эмануэля Российской академии наук
119334 Москва, ул. Косыгина, 4, Россия
* E-mail: marli2007@yandex.ru
Поступила в редакцию 13.06.2018
После доработки 31.08.2018
Принята к публикации 29.08.2018
Аннотация
Исследованы фотохромные свойства новых ди- и тетранитробисспиропиранов. Для растворов динитробисспиропирана характерен прямой фотохромизм, в растворах тетранитробисспиропирана в полярных и слабополярных растворителях и также в полимерных матрицах полиметилметакрилата (ПММА) и поливинилбутираля (ПВБ) наблюдается обратный фотохромизм – окрашивание раствора в темновых условиях и его обесцвечивание при действии видимого или УФ света. Обсуждаются особенности обратного фотохромизма, проводится сравнение с фотохромизмом модельных нитрозамещенных моноспиропиранов и динитробисспиропирана.
Обратный (отрицательный) фотохромизм – существование окрашенной формы (ОФ) соединения (или cистемы) в темновых условиях и термообратимое обесцвечивание при световом воздействии [1–4]. Системы с обратным фотохромизмом важны, так как в этом случае фотохромные изменения могут контролироваться мягким длинноволновым светом, нетравматичным, например, для биологических систем или полимерных материалов. Наличие обратного фотохромизма может быть обусловлено как структурными свойствами самой молекулы [1–5], так и условиями его наблюдения (смена растворителя, температуры, агрегация, комплексование) [1–4, 6–9].
В 6-нитрспиропиранах (СП), модифицированных введением в положение - 8 дополнительных нитро-, бром-, метокси-групп или других заместителей [1–4, 7], наблюдается окрашивание растворов при 20°С, связанное с присутствием ОФ и увеличением времени жизни ОФ. Слабая окраска, обусловленная присутствием ОФ, наблюдается в растворах спиробензо- и нафтопиранов, спиробензо- и нафтооксазинов, молекулы которых содержат в качестве заместителей азолы (бензотиазол, бензооксазол), краун эфиры, алкилы в хроменовой части или при индолиновом атоме N [1–4, 9].
Окраска исчезает при облучении видимым светом и восстанавливается в темновых условиях, наблюдается отрицательный фотохромизм. В ряде систем возможно проявление прямого фотохромизма – слабо окрашенные при 20°С растворы окрашиваются при облучении УФ светом и обесцвечиваются термически, возможен также дополнительный фотохимический канал рециклизации ОФ в закрытую форму (ЗФ) при облучении видимым светом. В литературе есть примеры стабилизации ОФ в полярных средах и обратного фотохромизма при введении заместителей в “левую” части молекулы спиропирана [2, 10–12], но их немного.
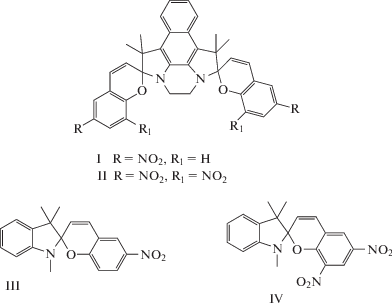
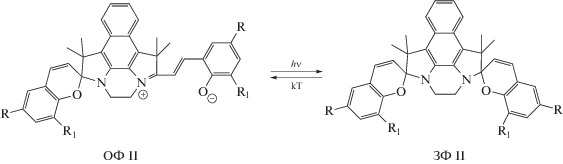
В настоящей работе исследованы фотохромные свойства нитрозамещенных бисспиропиранов I и II, в структуре которых присутствуют две и четыре нитрогруппы соответственно. Фотохромные свойства соединений исследовали в органических растворителях и в полимерных пленках в сравнении с модельными соединениями III и IV. Показано, что для I характерен прямой, а для II – обратный фотохромизм.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Соединения бисспиропираны I (желтые кристаллы), II (темно-фиолетовые кристаллы) синтезированы по модифицированной методике, представленной в [13–15]. Модельные соединения III и IV синтезированы по методике [16].
Для приготовления растворов исследуемых соединений (10–6–10–4 моль/л) использовали органические растворители фирмы Acros марки “для спектроскопии”. Пленки полимеров – полиметилметакрикрилата (ПММА) с температурой стеклования 110–120°С и поливинилбутираля (ПВБ) с температурой стеклования 59°С – получали поливом из совместных растворов полимеров и исследуемых веществ в общем слабополярном или полярном растворителях. Спектры поглощения регистрировали на спектрофотометре MultiSpec-1501. Люминесцентные измерения выполнены на спектрофлуориметре PerkinElmer LS 55. Облучение образцов проводили УФ и видимым светом лампы ДРШ-500 с выделением спектральных линий с λ = 365 нм и 546 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В литературе [13, 14, 17–22] исследовали бисспиропираны различной структуры, отличающиеся разнообразием способов соединения двух или более СП, различием заместителей и линкеров, связывающих СП. Структура исследуемых в настоящей работе бисспиропиранов I и II, образована перекрыванием по бензольному кольцу индолиновых частей двух одинаковых бензоиндолиновых мононитроспиропиранов, что удваивает число присутствующих в молекуле нитрогрупп по сравнению с моноаналогами.
Проводили сравнение фотохромного поведения I (с двумя) и II (с четырьмя нитрогруппами) между собой и с мононитроспиропиранами III и IV с одной и двумя нитрогруппами соответственно. Более точными аналогами бисспиропиранов I и II являются мононафтоспиропираны, синтезированные в [23 и 2], к сожалению их фотохромное поведение подробно не исследовано, хотя есть указание на слабое отличие от I и II.
Растворы I даже в полярных средах при 20°С окрашены слабо, для них характерен прямой фотохромизм – окрашивание под действием УФ света и обесцвечивание в темновых условиях. Понижение температуры способствует смещению термодинамическое равновесия ЗФ-ОФ в сторону ЗФ в исходных растворах и повышению содержания фотоиницированной ОФ в фоторавновесии (рис. 1).
Рис. 1.
Спектр поглощения раствора I в этаноле до (1) и после (2) облучения светом с λ = 365 нм при 0°С, с = 4.5 × 10–5 моль/л.
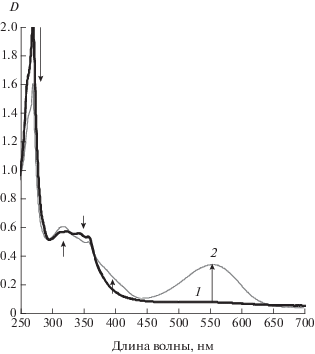
Под действием света в этом соединении наблюдается открытие только одной спиросвязи. Как и для раствора моноспиропиранов III для I, характерен гипсохромный сдвиг полосы поглощения фотоинициированной открытой формы (ОФ) при переходе к полярным средам. Так для растворов I в ряду растворителей толуол, ацетон, этанол наблюдаются следующие значения максимума длинноволновой полосы поглощения 615, 592 и 554 нм соответственно. Константы скорости темнового обесцвечивания фотоокрашенной формы I зависят от растворителя, снижаясь в спиртовых средах [15] (1.3 × 10–2 с–1 в толуоле, 8.6 × 10–4 с–1 в этаноле), при этом они в 2–3 раза выше, чем для модельного спиропирана III.
Соединение II сильно полярно, не растворяется в неполярных средах – метилциклогексане, толуоле, бензоле, растворяется в слабо полярном метиленхлориде и ацетоне, и в полярных растворителях – ацетонитриле, этаноле. При растворении при 20°С при комнатном освещении образуются окрашенные растворы.
В отличие от бисспиропирана I и моноспиропирана IV, для которых наиболее существенное самопроизвольное окрашивание при 20°С происходит в полярных средах, окрашенная мероцианиновая форма соединения II наблюдается как в полярных (ацетонитрил, спирты), так и в менее полярных растворителях (рис. 2–5), причем степень окрашивания II в ацетоне и метиленхлориде выше, чем в полярной спиртовой среде. В спектрах поглощения растворов II не наблюдается дополнительных полос, отличных от присутствующих в модельном моноспиропиране IV, что может свидетельствовать об открытии только одной спиро-связи.
Рис. 2.
Спектры поглощения растворов II в ацетоне до (1) и после облучения светом c λвозб = 546 нм в течение 0.5, 1, 2, 4 , 7, 10 мин (2–8), последующего восстановления окраски через 20 ч выдерживания в темновых условиях (9) и спектры люминесценции раствора II в ацетоне до (10, 12, 14) и после (11, 13, 15) облучения светом c λ = 546 нм в течение 10 мин, спектры эмиссии: λвозб = 365 нм (10, 11) и λвозб = 530 нм (14, 15), спектры возбуждения: λрег = 440 нм (12, 13). Концентрация 2.4 × 10–5 моль/л.
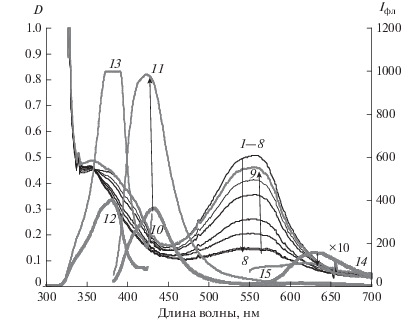
Рис. 3.
Спектры поглощения (1, 2) и люминесценции растворов (3–10) II в ацетоне до (1, 3, 5, 7, 9) и после (2, 4, 6, 8, 10) облучения светом c λвозб = 546 нм, спектры эмиссии люминесценции: λвозб = 360 нм (3, 4) и λвозб = 530 нм (7, 8), спектры возбуждения люминесценции: λрег = 423 нм (5, 6) и λрег = 550 нм (9, 10). Концентрация 5 × 10–6 моль/л.
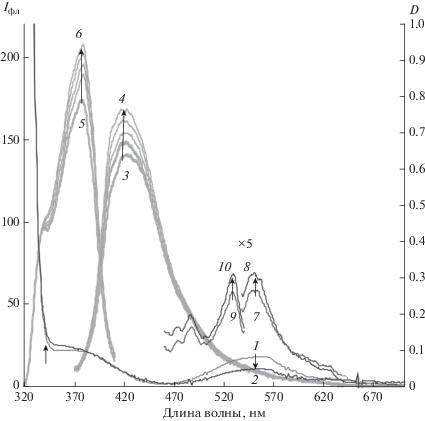
Рис 4.
Спектры люминесценции исходного раствора II в метиленхлориде (8, 9) и спектры поглощения (1–7) до (1) и после облучения светом лампы ДРШ-500 с λ = 365 нм в течение 0.5, 15, 25, 40, 60 мин (2–6) и далее 10 мин (7) светом с λ = 546 нм. Em: λвозб = 365 нм (8), Ex: λрег = 450 нм (9), С = 6 × 10–5моль/л.
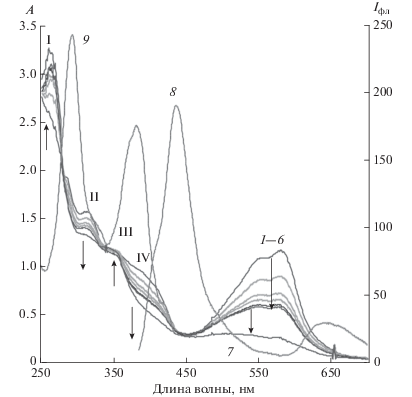
Рис. 5.
Спектры поглощения (1–3,10) и люминесценции (4–9, 11, 12) раствора II в метиленхлориде до (1, 4, 7) и после облучения сначала светом с λ = 546 нм (2, 5, 8), затем светом с λ = 365 нм до фоторавновесия (3,6,9) и последующего выдерживания в темновых условиях 44 ч (10, 11) Em: λвозб = 330 нм ( 4–6, 11), Ex: λрег = 430 нм (7–9, 12).
Положение длинноволнового максимума в спектре поглощения ОФ II зависит от природы растворителя, смещаясь гипсохромно в полярных растворителях. В растворе метиленхлорида в полосе поглощения ОФ наблюдается широкая полоса с двумя максимумами 538 и 585 нм (рис. 4, 5), что характерно и для фотоинициированной ОФ моноаналога спиропирана IV в неполярных средах. В ацетоне, ацетонитриле, спирте наблюдается широкая полоса поглощения с одним максимум 560, 542, 532 нм соответственно.
Зависимость спектра поглощения II от растворителя может быть обусловлена не только сольватохромией, но и стабилизацией различного набора изомеров ОФ в разных средах, что наблюдали для 6.8-динитрозамещенных моноспиропиранов [2] и бис(6-нитроспиропирана), исследуемого в работе [24].
При облучении исходно окрашенных растворов II при 20°С под действием видимого света с λ = 546 нм, т.е. в области длинноволновой полосы поглощения ОФ, происходит выцветание раствора с последующей регенерацией окраски в темновых условиях (рис. 2–4), т.е. наблюдается отрицательный фотохромизм. Обесцвечивание раствора происходит также при облучении растворов УФ светом с λ = 365 нм (рис. 5), что указывает на преобладание в этой спектральной области поглощения изомеров ОФ.
В темновых условиях наблюдается восстановление окраски растворов II, восстановление окраски при 20°С длительное – часы (рис. 2). Полнота восстановления окраски в темновых условиях зависит от природы растворителя. В полярных растворителях полнота регенерации оптической плотности в темноте от цикла к циклу снижается, причем в спирте значительно быстрее, чем в ацетонитриле, в то время как в неполярных растворителях необратимая деградация фотохрома несущественна.
На рис. 4 показано обесцвечивание раствора II в метиленхлориде при облучении УФ светом (λ = 365) в полосе поглощения обеих форм ЗФ и ОФ до установления фоторавновесия ЗФ-ОФ, и дальнейшее более глубокое обесцвечивание при облучении видимым светом с λ = 546 нм. Регистрировали также фотохромные превращения при обратном порядке облучения видимым и УФ светом (рис. 5).
При облучении как УФ, так и видимым светом (рис. 4) в спектре поглощения раствора II в метиленхлориде регистрируются три изобестические точки, разделяющие УФ область спектра поглощения на спектральные области I–IV. Аналогичные области наблюдали в процессе фотоокрашивания в растворе I (рис. 1), для которого характерен прямой фотохромизм и обратный ход изменения оптических плотностей в этих спектральных областях при облучении.
При облучении раствора в метиленхлориде (рис. 4 и 5) происходит уменьшение оптической плотности как в длинноволновой полосе спектра поглощения, что сопровождается просветлением раствора, так и изменениями в УФ области спектра поглощения. При облучении (рис. 4) параллельно со снижением оптической плотности в длинноволновой области спектра поглощения II наблюдается уменьшение оптической плотности в областях спектра поглощения с максимумом λ = 315 нм (область II), λ = 380 нм (область IV), что свидетельствует о преимущественном поглощении в этих областях ОФ. При этом в спектральной области с максимумом λ = 262–268 нм и λ = 350 нм происходит рост оптической плотности, что связано с переходом ОФ в ЗФ при облучении. При выдерживании облученного раствора в темноте наблюдается регенерации окраски и восстановление значений оптической плотности в указанных спектральных областях.
При обратном порядке облучения видимым и УФ светом раствора II в метиленхлориде (рис. 5) наблюдаем сначала глубокое обесцвечивание раствора под действием света с λ = 546 нм, затем окраска обесцвеченных видимым светом растворов при дальнейшем облучении светом с λ = 365 нм восстанавливается до уровня фоторавновесия, и углубляется при дальнейшем выдерживании в темновых условиях.
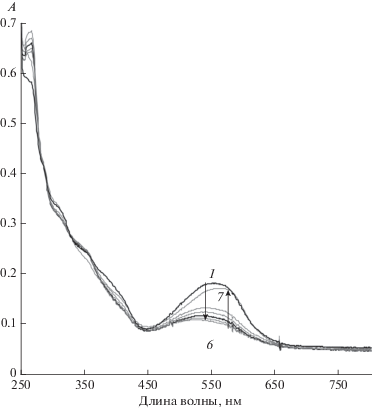
Спектры поглощения II в ПВБ и ПММА более широкие и менее различимы (рис. 6), чем в полярном и слабополярном растворителях, используемых для приготовления пленочных образцов. Как и в случае растворов, облучение окрашенных полимерных пленок УФ светом или видимым светом с λ = 546 нм приводит к их обесцвечиванию. Регенерации окраски при 20°С даже при последующем длительном хранении пленки в темноте (дни) не происходит, однако достигается ее нагревом при температуре близкой к Тст (рис. 6). Важно отметить, что исходный прогрев пленки при той температуре до начала облучения не менял значения оптической плотности в максимуме полосы поглощения ОФ, т.е. наблюдаемое восстановление окраски связано с регенерацией ОФ, а не с возможным термохромизмом и выходом на другое терморавновесие.
Рис. 6.
Спектры поглощения растворов II в пленке ПММА до (1) и после (2) облучения светом c λ = 546 нм (1–6), t = 5, 8, 15, 25, 40 мин и последующем прогреве пленки 20 мин при 110°С.
Соединение II люминесцирует в кристаллическом состоянии, в растворах и полимерных средах. В кристаллическом состоянии II и в растворах наблюдается основная коротковолновая люминесценция с максимумом λ = 430–450 нм и слабые длинноволновые полосы эмиссии с максимумами 550 и 630 нм.
Поскольку интенсивная коротковолновая полоса эмиссии (Em λ = 435–445 нм) при УФ возбуждении нм наблюдается также в исходных бесцветных растворах соединения I, а также при обесцвечивании растворов II, эту полосу эмиссии можно отнести к люминесценции соединений I и II в ЗФ. Возможно, эту коротковолновую люминесценцию определяет наличие в структуре исследуемых соединений центрального фрагмента, представляющего собой производное нафтиламина. Длинноволновая люминесценция, наблюдаемая как при длинноволновом возбуждении, так и при возбуждении УФ светом, может быть обусловлена ОФ или структурами с участием ОФ.
В растворах метиленхлорида, ацетонитрила, ацетона в спектре возбуждения длинноволновой люминесценции при регистрации 630–690 нм присутствует набор полос с основными максимумами около 380, 490, 530, 570, 620 нм. В ацетоне при больших концентрацияx преобладает длинноволновая люминесценция с максимумом 630–650 нм при возбуждении в области 570–620 нм (рис. 1), при низких концентрациях – полосы эмиссии с λ = 550 нм и возбуждения λ = 490–550 нм (рис. 2). В спиртовой среде наблюдается преимущественно длинноволновая люминесценции с максимумом полосы эмиссии λ = 550 нм. Можно предположить, что в разных средах стабилизируются разные изомеры ОФ или что эмиссия на 630–650 нм обусловлена наличием ассоциатов (возможно димеров ЗФ-ОФ).
При обесцвечивании раствора II в ацетоне при облучении светом с λ = 546 нм (рис. 2) в спектрах эмиссии люминесценции при возбуждении светом λ = 365 нм наблюдается рост интенсивности полосы с максимумом на 450 нм и снижение интенсивности длинноволновой полосы эмиссии на 630 нм, что соответствует реакции ОФ-ЗФ, и процессу обесцвечивания, наблюдаемому по спектрам поглощения.
Аналогичное поведение в люминесценции наблюдается при облучении светом с λ = 546 нм раствора II в метиленхлориде (рис. 5). Так, если раствор сначала обесцвечивать светом λ = 546 нм, затем восстанавливать окраску светом λ = 365 нм до фоторавновесия и далее выдерживать раствор в темноте, то при возбуждении λ = 330 нм интенсивность коротковолновой полосы эмиссии 400–430 нм, исходящей от ЗФ, сначала растет, затем падает и вновь растет, т.е. отслеживает переход ОФ в ЗФ, затем ЗФ в ОФ при световом воздействии и установление терморавновесия ЗФ и ОФ при темновом хранении.
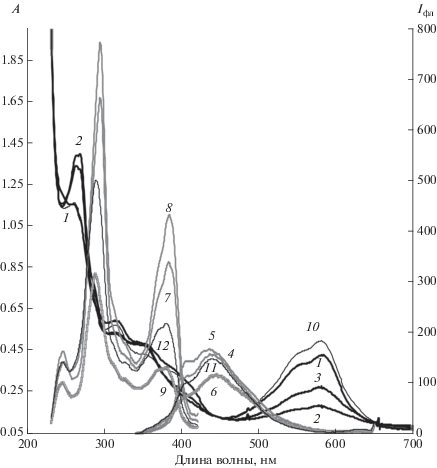
По ходу обесцвечивания раствора II в метиленхлориде (рис. 5) при облучении светом с λ = = 546 нм и затем с λ = 365 нм происходит рост интенсивности длинноволновой люминесценции (рис. 7). Причем, при возбуждении 490 нм для двух наблюдаемых полос эмиссии с λмакс = 530 и 630 нм наблюдается различный характер изменения интенсивности при воздействии света с λ = = 546 нм, затем λ = 365 нм и последующем темновом выдерживании. Так при облучении светом λ = 546 нм наблюдается рост интенсивности полосы эмиссии на 430 нм при сохранении интенсивности полосы на 630 нм, и далее рост интенсивности полосы с λмакс = 630 нм при сохранении интенсивности полосы эмиссии на 530 нм при дальнейшем облучении под светом с λ = 365 нм. При последующем темновом выдерживании заметно снижается интенсивность полосы эмиссии с максимумом 530 нм. Можно предположить, что подобный характер изменений в спектре эмиссии длинноволновой люминесценции связан с процессом трансформации изомеров ОФ или с переходами между ассоциатами типа ОФ-ЗФ.
Рис. 7.
Спектры люминесценции II в растворе метиленхлорида до (1) и после облучения сначала светом с λ = 546 нм (1–4), затем светом с λ = 365 нм до фоторавновесия (5) и последующего выдерживания в темновых условиях (6), λвозб = 490 нм.
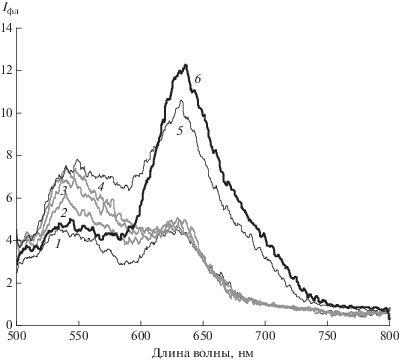
В растворах II в этаноле и метаноле также наблюдается коротковолновая люминесценция с максимумом полосы эмиссии на 420 нм, интенсивность которой растет при облучении светом с λ = 546 нм, и слабая длинноволновая люминесценция с максимумом 550 нм. В разбавленных спиртовых растворах (ниже с = 10–6 моль/л) помимо этих полос при возбуждении в области 490–530 нм и длинноволновой области с максимумом 760 нм дополнительно регистрируется очень слабый сигнал эмиссии на 830 нм, возможно, от ОФ формы II с двумя раскрытыми спиросвязями. Открытию обеих спиросвязей ранее авторы статьи [25] предположительно отнесли наблюдаемое в спектрах поглощения бромзамещенного бисспиропирана аналогичной структуры очень слабое поглощение в области 840 нм.
Для фотохромного поведения соединений I и II существенным оказалось число заместителей – нитрогрупп в структуре бисспиропирана, увеличение их числа в II приводит к появлению обратного фотохромизма. Проявление обратного фотохромизма в II обеспечивается сочетанием высокого уровня самоокрашивания в темновых условиях и низким уровнем окраски в фоторавновесии при облучении УФ светом.
Высокая степень темнового окрашивания может быть связана с увеличением полярных свойств бисспиропирана за счет наличия удвоенного количества нитрогрупп и увеличением времени жизни изомеров ОФ за счет сольватации растворителем или в результате образования устойчивых комплексов ЗФ–ОФ (димеров или ассоциатов более высокого ранга).
Интересно, что в случае бисспиропиранов, описанных в работе [13] с похожей структурой, наличие четырех нитрогрупп не обеспечивало стабилизации ОФ и в растворах преобладала ЗФ. Таким образом, не только наличие нитрогрупп, но и сама структура исследуемых бисспиропиранов способствует стабилизации ОФ, возможно она допускает образование димеров ЗФ–ОФ уже при достаточно низких концентрациях (ниже 10–5 моль/л). На образование димеров или более сложных асcоциатов указывают более высокая, чем в спирте, степень самопроизвольного окрашивания при 20°С в слабополярных растворах II и высокая стабильность этих растворов при хранении.
Характер изменения длинноволновой люминесценции при облучении раствора II в метиленхлориде также может свидетельствовать об образовании свободной ОФ с максимумом эмиссии на 530–550 нм из ассоциатов (рис. 7), люминесцирующих в области с максимумом 630–650 нм. Возможно, при фотооблучении помимо фотохромной реакции ОФ → ЗФ происходит предшествующий ей процесс высвобождения единичных молекул ОФ из ассоциатов.
Из полученных данных следует, что тенденция к увеличению степени окраски исходных растворов в полярных растворителях, наблюдаемая при переходе от моноспиропирана III к IV при введении второй нитрогруппы в положение – 8, усугубляется в паре бисспиропиранов I и II. Особенностью II является высокая степень окраски исходного раствора даже в слабо полярном растворителе – метиленхлориде и наличие обратного фотохромизма в растворителях разной полярности и в полимерных средах. Фотообесцвечивание окрашенных растворов происходит как под видимым, так и УФ светом, при этом обратный процесс восстановления окраски крайне медленный. Фотохромные превращения в растворах II не являются элементарным процессом ОФ → ЗФ → ОФ, а носят сложный характер.
Работа выполнена по теме госзаданий 0082-2018-0006, 0082-2014-0015 и РФФИ (грант 16-03-00275).
Список литературы
Grano Y.C., Guglielmetti R.Y. / Organic Photochromic and Thermochromic Compounds V. 1. Eds. New York; Boston; Dordrecht; London; Moscow: Kluwer Academic Publishers, 2002.
Aiken S., Edgar R.J.L., Gubbutt C.D., Heron B.M. // Dyes and Pigments. 2018. V. 149. P. 92.
Barachevsky V.A. // Rev. Y. of Chem. 2017. V. 7. № 3. P. 334.
Барачевский В.А., Карпов Р.Е. // Химия высоких энергий. 2007. Т. 41. № 3. С. 226.
Барачевский В.А., Валова Т.М., Атабекян Л.С., Любимов А.В. // Химия высоких энергий. 2017. Т. 51. № 6. С. 436.
Levy D., Avnir D. J. // Phys.Chem. 1988. V. 92. P. 4734.
Джапаридзе К.Г. Спирохромены. Тбилиси: Мецниереба, 1979. С. 82.
Zakharova M.I., Coudret C., Pimienta V., Micheau J.C., Delbaere S., Vermeersch G., Metelitsa A.V., Voloshin N., Minkin V.I. // Photochem. Photobiol. Sci. 2010. V. 9. P. 199.
Минкин В.И. // Успехи химии. 2013. 82(1) С.1.
Мардалейшвили И.Р., Кольцова Л.С., Зайченко Н.Л., Шиенок А.И., Левин П.П., Татиколов А.С. // Химия высоких энергии. 2015. Т. 49. № 1. С. 30.
Corley G., Gillmore J.G., Crisman J., Kodis G., Gray C.L., Cherry B.R., Sherman B.D., Liddell P.A., Paquette M.M., Kelbaukas L., Frank N.L., Moore A.L., Moore T.A., Gust T.A. // J. Am. Chem. Sos. 2014. V. 136. C. 11994.
Арсенов В.Д., Паршуткин А.А., Маревцев В.С., Черкашин М.И. // Известия АН СССР. Сер. хим. 1984. С. 1987.
Samsoniya Sh.A., Trapaidze M.V., Nikoleishvili N.N., Japaridze K.G., Maisuradze J.P., Kazmaier U. // Chemistry Heterocyclic Compounds. 2011. V. 47. № 9. P. 1098.
Самсония Ш.А., Трапаидзе М. В., Николеишвили Н.Н., Джапаридзе К. Г., Майсурадзе Дж. П., Кацмайер У. // Химия гетероцикл. соед. 2010. № 8. С. 1259.
Любимов А.В., Любимова Г.В. Шиенок А.И. // Еврозийский Союз Ученых (ЕСУ) 2016. Т. 23. С. 2
Hinnen A., Audio G., Gautron // Bull.Sos.Chim.Fr.1968. P. 2066.
Fihey A., Perrier A., Browne W.R., Jacquemin D. // Chem. Sos. Rev. 2015. V. 44. P. 3719.
Малкин Я.Н., Кузьмин В.А., Михайленко Ф.А., Дядюша Г.Г. // Изв. АН СССР. Сер. хим. 1976. № 3. С. 555.
Малкин Я.Н., Кузьмин В.А., Михайленко Ф.А. // Изв. АН СССР. Сер. Хим. 1977. № 1. С. 83.
Муханов Е.С., Алексеенко Ю.С., Лукьянов Б.С., Дороган И.В., Безуглый С.О. // Химия высоких энергий. 2011. Т. 44. № 3. С. 248.
Lee S., Ji S., Kang Y. // Bull. Korean. Chem. Sos. 2012. V. 33. № 11. P. 3740.
Li Y, Zhou J., Wang Y., Zhang F., Song X. // J. Photochemistry and Photobiology A. 1998. V. 113. C. 65.
Dzhaparidze K.G.,Gachechiladze G.G., Pavlenishvili Ya.I., Gugava M.T., Maisuradze D.P., Mamistvalova N. // Soobshch Akad.Nauk. Gruz SSR. 1973. V. 69. P. 329.
Kundu P.K., Lerner A., Kucanda K., Leitus G., Klajn R. // J.A.C.S. 2014. V. 136. C. 11270.
Samsoniya Sh.A., Trapaidze M.V., Nikoleishvili N.N., Japaridze K.G., Maisuradze J.P. // Bul. of the Georgian nat. acad. of sci. 2013. V. 7 №. 3 P. 51.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий