Химия высоких энергий, 2019, T. 53, № 1, стр. 33-40
Детектирование аналитов из газовой фазы с использованием флуорофоров и комплексов гость–хозяин, встроенных в липидные бислои на наночастицах силикагеля
Б. Б. Мешков a, А. В. Кошкин a, b, Н. Л. Святославский a, М. В. Алфимов a, b, В. А. Лившиц a, b, *
a ЦФ РАН, ФНИЦ “Кристаллография и фотоника” РАН
119421 Москва, ул. Новаторов, д. 7а, корп. 1, Россия
b МФТИ ФГУ “Московский физико-технический институт”
141701 Московская область, Долгопрудный, Институтский переулок, 9, Россия
* E-mail: vlivshi@mail.ru
Поступила в редакцию 18.02.2018
После доработки 29.08.2018
Принята к публикации 23.07.2018
Аннотация
Целью работы являлось создание хемосенсоров по аналогии с биорецепторами на основе липидных мембран, стабилизированных на наночастицах (НЧ) силикагеля (СЛБ). В качестве флуорофоров-рецепторов использованы дансилглицин (ДГ) и комплекс гость–хозяин ДГ с кукурбитурилом CB[8], а в качестве аналитов – нафталин (Н) и триметиламин (ТМА) в газовой фазе. СЛБ получали путем сорбции бислойных липосом на НЧ в условиях, обеспечивающих разрыв липосом и формирование плоского бислоя. Впервые получено связывание CB[8] с СЛБ и доказано путем измерения в супернатанте флуоресценции комплекса тиазол оранж с CB[8]. Образование комплекса ДГ@CB[8] в воде и мембране проявляется в тушении FДГ и смещении максимума FДГ – в воде в сторону коротких, а в мембране – длинных волн. При возбуждении Н на 290 нм отклик FДГ обусловлен переносом энергии с Н на ДГ. В присутствии паров ТМА–Н2О FДГ резко падает, но при удалении паров Н2О возрастает выше исходного значения. Показано, что в отличие от красителей, встроенных в липидную матрицу или сорбированных на НЧ, отклик FДГ для комплексов гость–хозяин пропорционален концентрации аналита, а длина волны FДГ не меняется с изменением его концентрации.
Бислойные липидные мембраны, стабилизированные на твердых или полимерных субстратах (СЛБ), в последние годы вызывают большой интерес благодаря разнообразным научным и технологическим применениям [1–3].
В предыдущей работе [4] мы получили СЛБ на высокопористом субстрате с большой удельной поверхностью и исследовали с помощью спиновых зондов молекулярную динамику на различной глубине в липидном бислое. Целью данной работы является исследование возможностей создания хемосенсоров по аналогии с биологическими рецепторами на основе липидных мембран, в данном случае стабилизированных на наночастицах силикагеля. Для решения этой задачи в качестве индикатора было использовано флуоресцентное производное аминокислоты глицина – дансилглицин (ДГ), квантовый выход и спектры флуоресценции которого чувствительны к полярности окружения. В качестве рецептора изучен макроцикл кукурбит[8]урил (CB[8]), содержащий 8 колец и способный образовывать комплексы гость–хозяин с двумя молекулами гостей, выполняющих функции индикатора и аналита [5–7]. Ранее с помощью таких комплексов и с использованием в качестве индикаторов флуорофоров, красителей [8, 9] и спиновых зондов [10] была показана возможность детектирования аминокислот и пептидов в водных растворах. В данной работе в качестве аналитов использованы неполярный нафталин (Н) и полярный триметиламин (TMA) в газовой фазе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтетический фосфолипид, димиристоилфосфохолин (ДМФХ) получен от “Avanti Polar Lipids” (Alabaster, AL). Флуоресцентный аналог фосфоэтаноламина, 1-пальмитоил-2-[12-[(7-нитро-2-1,3-бензоксадиазол-4-ил) амино додеканоил]-sn-глицеро-3-фосфохолин (NBD-PE) получен от фирмы “Molecular Probes”. Дансилглицин (ДГ), СB[8], дитионит натрия (ДТН), 2-амино-2-гидроксиметил-пропан-1,3-диол (Трис), метанол, хлороформ, CaCl2, NaCl, тиоцианат аммония, хлорид железа получены от “Sigma-Aldrich”. “Сверхчистая вода” получена с использованием “Milli-Q-water purification system”.
Однородные по размерам наночастицы силикагеля были синтезированы по методу Штобера [11]. Гидродинамические радиусы наночастиц, измеренные методом динамического свето-рассеяния, составляли 80–90 нм. Бислойные липосомы получали, как описано в [4]. Раствор ДМФХ в хлороформе высушивали сначала в токе аргона, затем в вакууме и оставляли под вакуумом на ночь в эксикаторе с хлоридом кальция. Образовавшуюся пленку липида гидратировали при температуре выше точки фазового перехода гель–жидкий кристалл (для ДМФХ при 30°С). При этом образуются мультислойные липосомы. На следующем этапе для получения малых по размеру бислойных липосом суспензию диспергировали ультразвуком. Бислойные липосомы выделяли путем пропускания суспензии при температуре 30°С под давлением 1.5 атм 15 раз через поликарбонатные фильтры с размерами пор 200 и 100 нм. Диаметры липосом, измеренные методом динамического рассеяния, составляли в среднем 70 нм. Степень бислойности липосом определяли с использованием флуоресцентного зонда NBD-PE, как описано в [4].
Получение СЛБ
K суспензии наночастиц SiO2 (12 мг/мл) добавляли суспензию бислойных липосом в среде: трис буфер 10 мМ рН 6.0, 100 мМ NaCl, (не содержащей исходно ионы Са), после чего сразу добавляли раствор CaCl2 до конечной концентрации 0.05 мМ. Ионы Са индуцируют связывание липосом с поверхностью НЧ, в результате происходит разрыв и слияние липосом c образованием планарного липидного бислоя на поверхности силикагеля [12]. После инкубации 15 мин при 30°С и центрифугирования 20 мин, 12 000 об/мин не связанные липосомы отделяли от НЧ центрифугированием. Более подробное описание этой методики можно найти в работе [4].
Определение и варьирование концентрации нафталина в газовой фазе
Насыщающие концентрации Н в газовой фазе в оптической ячейке получали путем возгонки предварительно очищенного возгонкой в вакууме кристаллического Н. Методика получения малых концентраций Н в газовой фазе подробно изложена в работе [15]. Кристаллический, очищенный сублимацией Н растворяли в различных весовых концентрациях в диоктиловом эфире себациновой кислоты (ДОС), который имеет весьма низкое давление собственных насыщенных паров. Растворы выдерживали в чашечках, помещенных в стеклянные емкости объемом 1 л, в течение не менее 20 ч в суховоздушном термостате для установления равновесия между раствором и газовой фазой. Затем чашечки извлекали и по убыли их веса определяли количество Н в газовой фазе. Давление паров Н определяли по уравнению Менделеева–Клапейрона. Калибровочная зависимость давления пара Н от его концентрации в ДОС была линейной, что свидетельствует о выполнении закона Рауля для этой системы.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Адсорбция фосфолипидов на наночастицах силикагеля
Количество адсорбированных фосфолипидов определяли методом, основанным на цветной реакции фосфолипидов с ферротиоцианатом аммония [13]. К 300 мкл не cконцентрированной суспензии липосом добавляли 300 мкл CHCl3, после энергичного встряхивания центрифугировали 45 мин на 12 000 об/мин. Всю фракцию в CHCl3 отбирали стеклянным шприцом и высушивали потоком аргона. К пленке высушенных липидов добавляли 2.5 мл CHCl3, растворяли и добавляли 2.5 мл смеси из 0.1 М FeCl3 и 0.4 М NH4SCN; после тщательного перемешивания центрифугировали 10 мин на 3000 об/мин. Далее отбирали 2 мл фракции CHCl3 для измерения оптической плотности на длине волны 488 нм и определяли концентрацию липосом с использованием калибровочной кривой. В типичном эксперименте использовали 2 мл водной суспензии липосом с концентрацией 0.28 мг/мл и суспензию НЧ с весом SiO2 1мг. Концентрацию липосом специально выбирали значительно больше той, которая соответствует предполагаемому числу молекул фосфолипидов, образующих бислой на гладкой поверхности 1 мг НЧ силикагеля, чтобы обеспечить полное заполнение поверхности липидным бислоем. Концентрация липидов в супернатанте оказалась равной 0.18 мг/мл; таким образом, весовое количество связанных с НЧ липосом составляло 0.2 мг.
Связывание CB[8] с мембранами СЛБ
Для создания хемосенсора на основе СЛБ важной задачей являлся выбор адекватного рецептора для индикатора и аналитов, способного связываться с липидной мембраной. Как было отмечено во введении, CB[8] является перспективным рецептором, поскольку он может связывать две молекулы гостей в своей полости. Поэтому первой задачей было изучение связывания CB[8] с СЛБ.
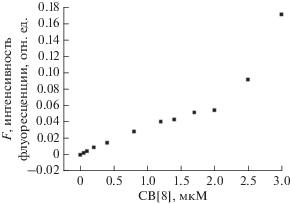
В типичном эксперименте к суспензии СЛБ, содержащей 1 мг частиц силикагеля и 0.2 мг связанного с частицами ДМФХ, добавляли водный раствор CB[8] до концентрации 10 мкМ. Инкубировали 1 ч при 30°С, центрифугировали при 12 000 об/мин (9400g) на центрифуге СМ-50 (Латвия) и промывали трис-буфером (Трис 10 мМ, NaCl 100 мМ, CaCl2 0.05 мМ, рН 6.0 ). В супернатанте определяли концентрацию несвязавшегося CB[8], используя краситель Тиазол оранжевый (ТО), который образует с CB[8] комплексы гость–хозяин с высоким квантовым выходом флуоресценции [14]. В целях мини-атюризации хемосенсора использовали малые количества липидов и CB[8]. Для концентрации ТО 3 мкм и CB[8] в диапазоне 0–3 мкм были измерены спектры флуоресценции (F) комплексов CB[8] с ТО и построена калибровочная зависимость интенсивности F от концентрации CB[8] (рис. 1). Маточные растворы ТО (10–4 М) и CB[8] (2 × 10–4 М) готовили на очищенной от органики воде. Для приготовления раствора CB[8] его помещали в шейкер на 2 ч при 80°С. Пробы готовили смешиванием в определенном соотношении растворов ТО и CB[8] с добавлением воды. Интенсивность F комплекса ТО@CB[8] измеряли на длине волны 605 нм при возбуждении на 465 нм. В супернатанте, полученном после инкубации СЛБ с CB[8], по калибровочной кривой определяли концентрацию CB[8]. В данном эксперименте по связыванию CB[8] с СЛБ концентрация CB[8] в супернатанте составляла 4.3 мкм; соответственно, концентрация связанного с СЛБ CB[8] была равна 5.7 мкм, а молярное отношение связанного CB[8] к ДМФХ составляло ≈0.02. Таким образом, было впервые установлено, что CB[8] связывается с мембранами СЛБ на основе ДМФХ в количествах, достаточных для измерения флуоресценции комплексов с индикаторами и его можно использовать в качестве рецептора в хемосенсорах на основе СЛБ.
Связывание ДГ c CB[8] в водных растворах
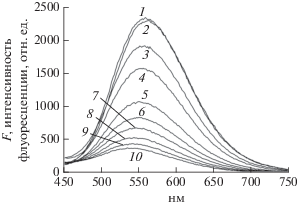
Связывание ДГ c CB[8] изучали по спектрам флуоресценции ДГ (FДГ) при возбуждении на 350 нм. Чтобы добиться более полного связывания ДГ, была взята малая концентрация ДГ (0.7 × × 10–5 M), а концентрацию CB [8] варьировали в широком интервале 0–50 × 10–5 М, так что при максимально достижимой концентрации CB [8] 46.5 × 10–5 М молярное отношение CB [8]/ДГ составляло около 66. Спектры FДГ в зависимости от концентрации CB[8] представлены на рис. 2. Образование комплексов проявляется в падении квантового выхода FДГ и коротковолновом смещении ее максимума oт 562 до 543 нм при максимальной концентрации CB[8]. Аналогичные эффекты тушения F в комплексах с CB[8] наблюдались для других флуорофоров [9, 16].
Рис. 2.
Спектры флуоресценции дансилглицина (ДГ) при различных концентрациях СB[8] в водном растворе. Длина волны возбуждения флуоресценции 350 нм. Концентрация ДГ 0.7 × 10–5 М. Концентрации СB[8]: 0 (1), 5 × 10–5 М (2) , 10 × 10–5 М (3), 15 × 10–5 М(4), 20 × 10–5 М (5), 25 × 10–5 М (6), 30 × 10–5 М (7), 35 × × 10–5 М (8), 40 × 10–5 М (9), 46.5 × 10–5 М (10).
Для стехиометрии 1 : 1 выражение для константы связывания имеет вид
(1)
$\begin{gathered} {{K}_{b}} = {{({\text{Д Г @CB}}\left[ {\text{8}} \right])} \mathord{\left/ {\vphantom {{({\text{Д Г @CB}}\left[ {\text{8}} \right])} {({\text{Д }}{{{\text{Г }}}_{0}}--{\text{Д Г @ CB}}\left[ {\text{8}} \right])}}} \right. \kern-0em} {({\text{Д }}{{{\text{Г }}}_{0}}--{\text{Д Г @ CB}}\left[ {\text{8}} \right])}} \times \\ \times \,\,({\text{CB}}\left[ 8 \right]--{\text{Д Г @CB}}\left[ 8 \right]).\quad \\ \end{gathered} $Концентрация свободного CB[8] почти во всем интервале намного больше концентрации свободного ДГ и в этой области она практически равна исходной концентрации CB[8]. Концентрации комплекса ДГ@CB[8] и свободного ДГ при различных концентрациях CB [8] были определены путем моделирования (фитинга) экспериментальных спектров FДГ суммой спектров флуоресценции свободного ДГ и комплекса ДГ@CB[8]. В качестве последнего мы приближенно использовали спектр FДГ при максимально достижимой концентрации CB[8] 46.5 × 10–5 М. Значение Kb, полученное усреднением значений, вычисленных по формуле (1) для различных концентраций CB[8], равно 0.9 ± 0.15 × 104 М–1.
Связывание ДГ с СЛБ и влияние паров Н на флуоресценцию встроенного ДГ
Длина волны, соответствующая максимуму флуоресценции ДГ, оказалась весьма чувствительна к полярности его окружения. Так, из табл. 1 видно, что положение максимума FДГ изменяется от 562 в воде до 460 нм в декане. Из рис. 3 (спектр 1) следует, что средняя длина волны флуоресценции ДГ, встроенного в СЛБ, равна ≈457 нм, т.е. она практически совпадает с ее значением в декане (см. табл. 1). Это означает, что значительная часть ДГ локализована в липидной мембране в области ацильных цепей. Однако полоса FДГ имеет достаточно большую ширину, искаженную (уплощенную) вершину и плечо в коротковолновой области, которые свидетельствуют о локализации молекул ДГ в окружениях (или ориентациях) с различной, в том числе, еще большей гидрофобностью. Появление длин волн FДГ, соответствующих большей гидрофобности, чем в предельно гидрофобном алифатическом углеводороде (декане), можно объяснить тем, что положение полосы FДГ в жидком углеводороде является средним, динамически усредненным по различным ориентациям, которым соответствуют различные полярности, в то время как в липидной мембране имеет место статическое (во временной шкале метода флуоресценции) распределение по ориентациям (и локализациям), причем это распределение по-видимому не изотропное, а характеризуется преимущественной ориентацией ДГ в анизотропной мембране, подобно ориентации в жидком кристалле.
Таблица 1.
Положение максимумов флуоресценции дансилглицина (ДГ) в растворителях различной полярности
| Растворитель | Положение макcимума флуоресценции (нм) |
|---|---|
| Вода | 562 |
| Этанол | 521.65 |
| Толуол | 486.8 |
| Декан | 460 |
Рис. 3.
Спектры флуоресценции мембран СЛБ на основе ДМФХ со встроенными молекулами ДГ (1) и (СB[8] + ДГ) (2); наночастиц SiO2 с адсорбированным ДГ (3). (1 '), (2 '), (3 ') – спектры флуоресценции образцов (1–3) после их инкубации с парами нафталина (1 ') – 5; (2 ') – 13, (3 ') – 15 мин. Длина волны возбуждения 290 нм. Концентрация ДГ 1 мкм, ДГ@СB[8] 1 мкм.
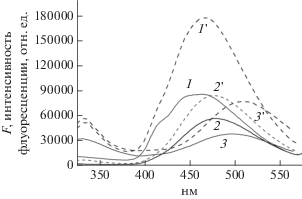
Интересно, что указанное распределение проявляется при действии Н. Из рис. 3 (спектр 1) видно, что при напуске паров Н интенсивность FДГ возрастает так, что центр спектра смещается к 466 нм, соответствующим более полярному окружению ДГ. Этот результат можно объяснить тем, что в более полярных “нано” областях в липидной мембране ДГ оказывается более доступным для газообразного Н нежели в гидрофобном окружении.
Связывание ДГ с мембранами СЛБ, содержащими CB[8], и влияние паров Н на флуоресценцию встроенного ДГ
К суспензии мембран СЛБ, содержащих встроенные молекулы CB[8], добавляли ДГ до конечной концентрации 0.7 × 10–5 М. После инкубации в шейкере 20 мин при 30°С и центрифугировании 12 000 об/мин в течение 30 мин количество связанного ДГ определяли по флуо-ресценции ДГ в супернатанте на длине волны 562 нм и возбуждении на 350 нм.
Были изучены также спектры флуоресценции раствора ДГ в буфере (контроль) и супернатантов из под препаратов СЛБ, содержащих связанные c СЛБ молекулы ДГ (образец 1) и CB[8] + ДГ (образец 2) с одинаковыми концентрациями ДГ 0.7 × × 10–5 М при возбуждении на длине волны 350 нм, соответствующей максимуму поглощения ДГ. Максимальная FДГ наблюдалась в образце 1; в образце 2 FДГ была меньше, чем в образце 1, что очевидно обусловлено связыванием части молекул ДГ c CB[8] в мембране СЛБ.
На рис. 3 приведены спектры флуоресценции ДГ, встроенного в мембраны СЛБ, содержащие CB[8] (спектр 2), и для сравнения – с СЛБ, не содержащими CB[8] (спектр 1). Из рисунка видно, что аналогично водным растворам связывание ДГ с CB[8] в мембране СЛБ приводит к тушению флуоресценции ДГ и сдвигу максимума FДГ, что является индикатором образования комплекса ДГ@CB[8] в мембране. В отличие от водных растворов максимум FДГ в присутствии CB [8] сдвигается в сторону длинных волн на 21 нм (до 477 нм), что означает увеличение полярности окружения ДГ. Противоположное влияние CB[8] на положение максимума флуоресценции ДГ в воде и мембране СЛБ очевидно обусловлено тем, что окружение ДГ в полости CB[8] более полярно, чем в мембране, но менее полярно, чем в воде.
Введение Н приводит к росту FДГ на 50% относительно исходного уровня (спектр 2), причем в отличие от мембран СЛБ + ДГ положение максимума FДГ практически не меняется. Этот результат объясняется тем, что в полости CB [8] в отличие от мембран СЛБ + ДГ локальное окружение одинаково для всех молекул ДГ, находящихся в полостях CB[8]. Из рис. 3 видно, что отклик FДГ при напуске Н в этом случае меньше, чем для мембран СЛБ + ДГ. Это различие в откликах, как и различие в исходных величинах FДГ обусловлено падением квантового выхода FДГ в комплексе с CB[8].
Представляло интерес также сравнить спектральные характеристики ДГ в мембране ДМФХ и в комплексе с CB[8], встроенном в эту мембрану, с характеристиками ДГ, адсорбированного на наночастицах силикагеля. Из рис. 3, спектр 3 видно, что при возбуждении на 290 нм положение максимума FДГ для адсорбированного ДГ (497 нм) соответствует более полярному окружению, чем в обоих функционализированных мембранах ДМФХ. Исходная величина FДГ (рис. 3, спектр 3) падает при адсорбции ДГ в большей степени, чем FДГ в СЛБ в присутствии CB[8]. Введение Н приводит к такому же относительному росту FДГ, что и для мембран СЛБ, и увеличению полярности окружения, что видно по длинноволновому сдвигу максимума до 509.7 нм. Это увеличение полярности при введении гидрофобного нафталина, как и для мембран СЛБ, по-видимому обусловлено гетерогенностью поверхности силикагеля, причем более доступными для Н являются молекулы ДГ в более полярных участках поверхности наночастиц.
Действие газообразного Н на спектры FДГ в воде и в комплексах гость–хозяин в водных растворах
При введении Н из газовой фазы путем возгонки кристаллического Н были получены спектры ДГ и Н в присутствии и в отсутствие CB[8] в водных растворах при возбуждении на 290 и 350 нм. При возбуждении свободного Н на 290 нм наблюдается максимум на 332 нм, соответствующий флуоресценции мономеров Н [15]. Спектр F свободного ДГ в воде имеет максимум на 562 нм, а в присутствии CB[8] он сдвигается до 543 нм.
В смеси Н и ДГ, но в отсутствие CB[8] индивидуальные полосы F этих молекул сохраняют свое положение, но интенсивность флуоресценции Н падает в два раза. Наконец, в сборке всех компонент (Н + CB [8] + ДГ) возбуждение на 290 нм почти не изменяет эмиссию ДГ в полосе 543 нм, (соответствующую комплексу с CB[8]). При облучении на 350 нм не происходит возбуждения Н и присутствие Н в смеси не влияет на интенсивность флуоресценции ДГ. Таким образом, в трехкомпонентной системе индикатор–аналит–рецептор в водной фазе, где флуоресцируют индикатор и аналит, можно выделить вклад аналита во флуоресценцию ДГ и тем самым повысить чувствительность его детектирования по сравнению с аналитом в отсутствие индикатора.
Зависимость переноса энергии от концентрации нафталина в газовой фазе
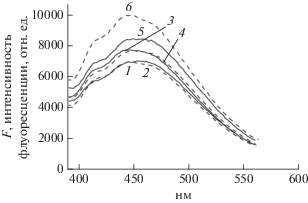
Мы провели также эксперименты по зависимости эффекта Н от концентрации Н в газовой фазе. Различные концентрации Н в газовой фазе создавали и измеряли, как описано в разделе экспериментальная часть. На рис. 4 представлены спектры F в мембранах СЛБ, содержащих CB[8] и не содержащих CB[8] для двух значений давления пара Н: 0.083 и 0.166 мм рт. ст., соответствующих концентрациям Н в растворе ДОС 1% и 2%. Видно, что по спектрам FДГ эти малые концентрации Н могут быть достаточно надежно измерены. Кроме того, для мембран СЛБ, содержащих CB[8], FДГ пропорционально возрастает с увеличением концентрации Н, в то время как в мембранах, не содержащих CB[8], абсолютная величина FДГ возрастает в большей степени, но пропорциональность концентрации Н не наблюдается. Большая величина отклика FДГ на Н для мембран, содержащих только встроенный ДГ, и отсутствие пропорциональности по сравнению с мембранами, содержащими комплекс ДГ@CB[8], наблюдались нами и при больших концентрациях паров Н, близких к насыщающим (см. рис. 3). Отсутствие пропорциональности, как и отмеченные выше спектральные сдвиги в длинноволновую область при напуске Н можно, по-видимому, объяснить микрогетерогенностью мембран, т.е. распределением по полярности и доступности для молекул Н. Эта гетерогенность практически отсутствует в полости CB[8], что приводит к отсутствию спектральных сдвигов и пропорциональной зависимости отклика FДГ от концентрации Н. Таким образом, явление переноса энергии возбуждения с аналита на индикатор может быть применено для детектирования ароматических углеводородов в газовой фазе.
Рис. 4.
Зависимости спектров флуоресценции мембран СЛБ на основе ДМФХ, содержащих встроенные ДГ и СB[8] (1, 3, 5) и ДГ(2, 4, 6) от концентрации нафталина в газовой фазе в мм рт. ст.: 0 (1, 2); 0.083 (3, 4); 0.166 (5, 6). Длина волны возбуждения 290 нм.
Действие газообразного триметиламина (ТМА) на флуоресценцию ДГ
Другим важным классом аналитов, которые могут быть обнаружены с помощью флуоресцентного индикатора дансилглицина в видимой области спектра являются амины. Мы исследовали влияние паров и растворов ТМА на флуоресценцию ДГ в присутствии CB[8] в водном растворе и для ДГ, встроенного в пленку СЛБ.
Спектры FДГ в водных растворах, содержащих CB[8] и ТМА приведены на рис. 5. Из рисунка видно, что флуоресценция ДГ падает в присутствии CB[8], что обычно наблюдается для многих красителей в комплексах с CB[8]. Однако, добавление паров ТМА приводит к значительному возрастанию флуоресценции ДГ, больше исходного значения, которое наблюдается в отсутствие CB[8]. Этот эффект по-видимому обусловлен образованием тройного комплекса CB[8]–TMA–ДГ, в котором подавлен процесс тушения, присутствующий в бинарном комплексе ДГ@CB[8].
Рис. 5.
Влияние паров триметиламина (ТМА) и воды на спектры флуоресценции мембран СЛБ на основе ДМФХ, содержащих встроенные СB[8] и ДГ, 1 – исходный спектр, 2 – после инкубации в парах ТМА + Н2О, 3 – после инкубации в парах ТМА в отсутствие паров Н2О.
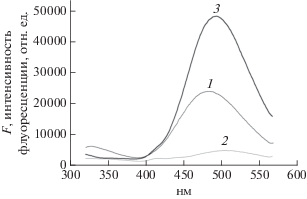
Действие ТМА на СЛБ, содержащие комплекс ДГ@CB[8] представлено на рис. 5. При инкубации в парах ТМА совместно с водяными парами интенсивность флуоресценции ДГ падает в 5–6 раз относительно контроля в отсутствие ТМА. Однако, большая часть этого изменения обусловлена влиянием водяных паров. Наряду с падением интенсивности наблюдается батохромный сдвиг максимума к 508 нм. Удаление паров воды приводит к возрастанию интенсивности выше исходного уровня и коротковолновому сдвигу максимума флуоресценции от 506 до 492 нм. Этот результат – увеличение исходной флуоресценции представляет значительный интерес, поскольку его нельзя объяснить вытеснением ДГ молекулами ТМА из комплекса в раствор. Существенно отметить также, что для ТМА в отличие от Н не происходит возбуждения аналита, поскольку полоса поглощения ТМА находится в области значительно более коротких длин волн. По-видимому, наблюдаемые изменения FДГ, как и в водных растворах, обусловлены образованием тройного комплекса CB[8]–ДГ–TMA, в котором подавлен процесс тушения, присутствующий в бинарном комплексе ДГ@CB[8].
Таким образом, использование комплексов гость–хозяин в качестве рецепторов для индикаторов и аналитов позволяет детектировать спектрально молчащие в видимой области как неполярные, так и полярные аналиты, причем в отличие от липидной матрицы и поверхности адсорбента (силикагеля) имеет место пропорциональность между величиной отклика и концентрацией аналита и отсутствует зависимость длины волны максимума флуоресценции индикатора от концентрации аналита.
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ
Конечной целью проекта является создание модели хемосенсора на основе планарного фосфолипидного бислоя, стабилизированного на наночастицах силикагеля (СЛБ) и содержащего встроенные молекулы флуоресцентных индикаторов. Для решения этой задачи в качестве рецепторов и индикаторов были использованы флуорофор дансилглицин (ДГ) и комплекс гость/хозяин ДГ с кукурбитурилом CB[8], а в качестве аналитов – неполярный нафталин (Н) и полярный триметиламин (TMA) в газовой фазе.
Однородные по размеру наночастицы силикагеля были синтезированы по методу Штобера; для приготовления планарных липидных бислоев на поверхности этих частиц получены бислойные липосомы из ДМФХ; степень бислойности липосом и полученных из них планарных бислоев определена с использованием разработанных ранее методик.
Важным результатом работы является получение впервые функционализированных СЛБ, содержащих встроенные в липидную мембрану молекулы флуорофора ДГ и комплекс гость–хозяин ДГ@CB[8]. Установлено по положению максимума FДГ, что основная часть молекул ДГ встраивается в липидной мембране в максимально гидрофобное окружение, а именно, в область локализации углеводородных остатков. Более того, часть молекул ДГ находятся в еще более гидрофобном окружении, если сравнивать их по положению максимума F с жидкими углеводородами. Этот новый результат объяснен в работе тем, что в маловязком жидком растворе возникает динамически усредненное по ориентациям положение максимума F, в то время как в липидной мембране имеет место статическое распределение по ориентациям, имеющим разные полярности окружения. Сравнение спектров FДГ в растворителях различной полярности показывает также, что в гидрофобном окружении наряду со сдвигом максимума FДГ значительно возрастает квантовый выход – почти на порядок по сравнению с водой.
Образование комплекса гость–хозяин ДГ@CB[8] регистрируется в водном растворе по сдвигу в коротковолновую область и уменьшению квантового выхода. Изучение зависимости FДГ от концентрации CB[8] позволило оценить константу связывания комплекса. При введении CB [8] в липидную мембрану, содержащую ДГ, также обнаружено уменьшение квантового выхода, но смещение максимума FДГ происходит в длинноволновую сторону. Эти эффекты свидетельствуют об образовании в мембране комплекса гость–хозяин ДГ с CB[8], причем окружение в полости CB[8] менее гидрофобно, чем в углеводородах, и квантовый выход соответственно понижен.
В работе были изучены также некоторые хемосенсорные характеристики обоих типов функционализированных СЛБ структур для обоих аналитов. Показано, что при возбуждении на длине волны 290 нм, где поглощает нафталин, но минимально поглощение ДГ, наблюдается флуоресценция ДГ вследствие переноса возбуждения на ДГ. В случае ТМА и возбуждении в полосе поглощения ДГ также наблюдается отклик флуоресценции ДГ на аналит, который, по-видимому, обусловлен образованием тройного комплекса гость–хозяин ДГ–CB[8]–ТМА.
Как уже было отмечено, в гидрофобной матрице квантовый выход флуоресценции ДГ возрастает по сравнению с гидрофильной матрицей, что видно также по спектрам флуоресценции в растворителях различной полярности, а также при сравнении СЛБ с наночастицами силикагеля, на которых был адсорбирован ДГ (рис. 3).
Величина флуоресцентного отклика на нафталин в СЛБ, содержащих встроенные молекулы ДГ, оказалась больше, чем в СЛБ, содержащих комплексы ДГ@CB[8]. Это различие помимо полярности окружения по-видимому обусловлено тем, что при образовании комплекса гость–хозяин с CB[8] падает квантовый выход FДГ, соответственно падает величина флуоресцентного отклика и чувствительность к аналитам. Уменьшение выхода флуоресценции при использовании CB[8] как молекулы хозяина наблюдалось ранее для ряда флуорофоров. С другой стороны, недостатком фосфолипидного слоя (и, по-видимому, других материалов, например, полимеров) в качестве хемосенсорной матрицы является наличие микрогететерогенной структуры, приводящей к распределению по полярности локального окружения, соответственно к уменьшению чувствительности и отсутствию линейной зависимости между концентрацией аналита и величиной флуоресцентного отклика. Этого недостатка, как показано в данной работе, лишены СЛБ, содержащие комплексы гость–хозяин с применением в качестве молекулы–хозяина макроцикла CB[8]. А именно, при использовании таких комплексов отсутствует распределение по полярности и наблюдается пропорциональность между концентрацией аналита и флуоресцентным откликом.
Работа выполнена при финансовой поддержке Федерального агенства научных организаций (соглашение №007-ГЗ/Ч3363/26).
Список литературы
Dsouza R.N., Pischel U., Nau W.M. // Chem. Rev. 2011. T. 111. C. 7941.
Isaacs L. // Chem. Commun. 2009. C. 619.
Lagona J., Mukhopadhayay P., Chakabarty S., Isaacs L. // Angew. Chem. 2005. T. 117. C. 4922.; Angew. Chem. Int. Ed. 2005. T. 44. C. 4844.
Лившиц В.А., Мешков Б.Б., Кошкин А.В., Дзиковский Б.Г., Алфимов M.B. // Хим.Выс.Энергий. 2017. Т. 51. С. 271.
Barrow S.J., Kasera S., Rowland M.J., Barrio J., Scherman O.A. // Chem. Rev. 2015. T. 115(№ 22). C. 12320.
Jeon Y.J., Kim H., Jon S., Selvapalan N., Oh D.H., Seo I., Park C.S., Jung S.R., Koh D.S., Kim K. // J. Am. Chem. Soc. 2004. T. 126. C. 15944.
Rauwald U., Biedermann F., Deroo S., Robinson C.V., Scherman. O.A. // J. Phys. Chem. B 2010. T. 114(26). C. 8606.
Bush M.E., Bouley N.D., Urbach A.R. // J. Am. Chem. Soc. 2005. T. 127. C. 14511.
Reczek J.J., Kennedy A.A., Halbert B.T., Urbach A.R. // J. Am. Chem. Soc. 2009. T. 131. P. 2408.
Лившиц В.А., Мешков Б.Б., Габидинова Р.Ф., Авакян В.Г., Алфимов М.В. // Химия Высоких Энергий. 2018. Т. 52. № 2. С. 140.
Stoeber W., Fink A. // J. Coll. Interface Sci. 1968. T. 26. C. 62.
Cremer P.S., Boxer S.G. // J. Phys. Chem. B. 1999. T. 103. C. 2554.
Stewart J.C.M. // Anal. Chem. 1980. T. 104. C. 10.
Mohanty J., Thakur N., Choudhury S.D., Barooah N., Pal H., Bhasikuttan A. // J. Phys. Chem. B. 2012. T. 116. C. 130.
Воронина Л.В., Мешков Б.Б., Цыбышев В.П., Алфимов М. В., Лившиц В.А. // Российские нанотехнологии. 2013. Т. 8. № 9. С. 10.
Barrow S.J., Kasera S., Rowland M.J., Barrio J., Scherman O.A. // Chem. Rev. 2015. T. 115. № 22. P. 12320.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий