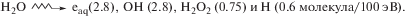Химия высоких энергий, 2019, T. 53, № 2, стр. 167-168
О прооксидантных свойствах тироксина
В. С. Кособуцкий *
Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
* E-mail: kasabutski@bsu.by
Поступила в редакцию 20.09.2018
После доработки 24.10.2018
Принята к публикации 19.10.2018
При работе ядерного реактора образуется большое количество радиоактивных изотопов иода: I123–126, I130, I131, I133 и другие. I131 является одним из самых массовых изотопов в цепочках деления ядерного топлива. При нормальной работе ядерного реактора, а также при аварии радиоактивные изотопы иода поступают в окружающую среду. Все изотопы иода после попадания в живой организм поступают в щитовидную железу. Щитовидная железа концентрирует иод и использует его для синтеза гормонов роста трииодтиронина (Т3) и тироксина (Т4). Высвобождение Т3 и Т4 из щитовидной железы регулируется их концентрацией в крови. Эти гормоны играют важную роль во многих биологических превращениях. Тироксин влияет на все ткани организма, для него нет специфичных клеток-мишеней [1]. Бета- и гамма-излучения радиоактивного иода оказывают угнетающее действие в большей степени на ткани железы. В меньшей степени воздействие облучения сказывается на клетках крови и других тканей и органов за счет радиоактивного иода содержащегося в трииодтиронине и тироксине, которые участвуют в биохимических процессах по всему организму. Бета- и гамма-излучения будут генерировать радикалы воды и далее радикалы биомолекул. В пространстве, окружающем молекулу содержащую радионуклид, будут происходить радиационно-химические свободнорадикальные превращения, в которые вовлекаются близлежащие биомолекулы. Молекулы тироксина также могут быть вовлечены в эти свободнорадикальные процессы. Исход и последствия которых зависят от свойств молекул участвующих в этих превращениях [2].
Действию γ-излучения Cо60 подвергали водные 5 М растворы пропанола-2 (класс чистоты “х.ч.”) в бидистиллированной воде. Облучали растворы, насыщенные аргоном, воздухом и кислородом, как с тироксином, так и без него. Насыщение растворов аргоном и кислородом проводили методом последовательного разбавления в шприце. Облучение проводили в запаянных стеклянных ампулах. Концентрация L-тироксина (Reanal) в растворах составляла ~1.6 × 10–4 моль/л (насыщенный раствор). Мощность поглощенной дозы по ферросульфатному дозиметру составила 0.16 Гр/с. Накопление образующегося при облучении ацетона от дозы облучения анализировали методом ГЖХ с пламенно-ионизационным детектором. Иодид-ион определяли методом потенциометрического титрования растворов нитратом серебра предварительно стандартизированным по фиксанальному раствору хлорида натрия. Радиационно-химические выходы ацетона и иодид-ионов рассчитывали по зависимостям их концентраций от поглощенной дозы.
Полученные в исследованиях результаты приведены в табл. 1. При действии γ-излучения на воду (реакция (1)) образуются активные частицы радиолиза воды с радиационно-химическими выходами приведенными в скобках [3]:
Таблица 1.
Влияние Т4 на образование ацетона при радиолизе водного 5 М раствора пропанола-2 в атмосфере аргона (Ar) и в присутствии кислорода
| Продукт радиолиза | G, молекула/100 эВ | |||||
|---|---|---|---|---|---|---|
| Аr | Аr + Т4 | О2 воздуха | О2 воздуха + Т4 | Насыщен О2 | Насыщен О2 + Т4 | |
| Ацетон | 2.3 ± 0.3 | 4.8 ± 0.3 | 5.9 ± 0.4 | 9.1 ± 0.4 | 7.9 ± 0.3 | 10.0 ± 0.2 |
| Иодид-ион | 1.5 ± 0.3 | 1.0 ± 0.2 | 0.52 ± 0.11 | |||
Активные частицы, далее, взаимодействуют со спиртом по реакциям:
(2)
$^{ \bullet }{\text{OH}}\quad\,\, + \quad\quad{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\text{CHOH}}\quad\, \to \quad{{{\text{H}}}_{{\text{2}}}}{\text{O}}\,\,\quad + \,\,\quad\left( {{\text{C}}{{{\text{H}}}_{3}}} \right)_{2}^{\centerdot }{\text{COH}},$(3)
${{{\text{H}}}^{\centerdot }}\quad\, + \quad\,\,{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\text{CHOH}}\quad \to \quad{{{\text{H}}}_{2}}\quad\, + \quad\quad\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{\centerdot }{\text{COH}}.$Пероксид водорода, который накапливается в растворе по мере облучения, может затем реагировать с гидратированными электронами.
(4)
${{{\text{e}}}_{{{\text{aq}}}}} + \quad\,\,{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}\quad \to \quad{\text{H}}{{{\text{O}}}^{ - }} + \quad{{\quad}^{ \bullet }}{\text{OH}}{\text{.}}$Константа скорости реакции (4) высока – 1.2 × × 1010 л моль–1 с–1 [4, 5].
Образующиеся в реакции (4) гидроксильные радикалы реагируют по реакции (2). Таким образом, за счет реакций (2)–(4) в растворе при облучении образуются гидроксиизопропильные радикалы, которые по реакции (5) превращаются в конечные продукты – ацетон, пропанол-2 и пинакон:
(5)
$2({\text{C}}{{{\text{H}}}_{3}})_{2}^{\centerdot }{COH\;}\quad\, \to \quad\,{\text{п р о д у к т ы }}{\text{.}}$Ацетон является основным продуктом радиолиза водного пропанола-2, и его радиационно-химический выход (G) в отсутствие тироксина составил 2.3 ± 0.3 молекула/100 эВ в атмосфере аргона. При добавлении в раствор тироксина в инертной атмосфере наблюдалось возрастание выходa ацетона до 4.8 ± 0.3 молекула/100 эВ и образование иодид-ионов с выходом 1.5 ± 0.3 молекула/100 эВ. Возрастание выхода ацетона в 2 раза связано с реакцией (6) окисления гидроксиизопропильных радикалов тироксином
(6)
$\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{\centerdot }{\text{COH}}\quad\, + \quad\quad{\text{Т }}4\quad\, \to \quad\,{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\kern 1pt} {\text{CO}}\quad\quad + \quad\,{\text{Т }}{{4}^{{ - \centerdot }}}\quad + \quad\quad{{{\text{Н }}}^{ + }}.$Образование иодид-ионов в этих условиях возможно по реакциям (7) и (8)
(7)
${{{\text{e}}}_{{{\text{aq}}}}}\quad + \quad\quad{\text{Т }}4\quad\quad \to \quad\quad{\text{Т }}{{4}^{{ - \centerdot }}},$(8)
${\text{Т }}{{{\text{4}}}^{{ - \centerdot }}} \to \quad{{{\text{I}}}^{ - }} + \quad\quad{\text{Т }}{{3}^{\centerdot }}.$В присутствии кислорода в растворе наблюдалось возрастание выхода ацетона, и связано оно с протеканием реакций (9)–(11) и (2)
(9)
$\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{\centerdot }{\text{COH}}\quad\, + \,\,\quad{{{\text{O}}}_{2}}\quad\, \to \quad\quad{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\text{CO}}\quad\, + \,\quad{\text{O}}_{2}^{{ - \centerdot }}\quad + {\;}{{{\text{H}}}^{ + }},$(10)
$\begin{gathered} {{{\text{O}}}_{2}}\quad\, + \,\quad{{{\text{e}}}_{{{\text{aq}}}}}\quad\, \to \,\quad{\text{O}}_{2}^{{ - \centerdot }},\quad \\ k = 1.8 \times {{10}^{{10}}}\,\,{\text{л м о л }}{{{\text{ь }}}^{{--1}}}{\text{ }}{{{\text{с }}}^{{--1}}}\left[ {4,{\text{ }}6} \right], \\ \end{gathered} $(11)
$\begin{gathered} {\text{O}}_{2}^{{ - \centerdot }}\quad + \quad\,{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{2}}\quad\, \to \quad\,{{{\text{O}}}_{2}}\quad\, + \quad\,{\text{H}}{{{\text{O}}}^{ - }}\quad\quad + \quad{{\quad}^{\centerdot }}{\text{OH}},\quad \\ k = 15{\text{ л м о л }}{{{\text{ь }}}^{{--1}}}\,{{{\text{с }}}^{{--1}}}\,\,\left[ {3,{\text{ }}7,{\text{ }}8} \right]. \\ \end{gathered} $Выход ацетона в присутствии кислорода воздуха в растворе без тироксина составил 5.9 ± 0.4 молекула/100 эВ. В присутствии тироксина в растворе с кислородом воздуха процесс окисления усиливался и выход ацетона возрастал до 9.1 ± 0.4 молекула/100 эВ. В растворе насыщенном кислородом концентрация кислорода выше (~2 × 10–3 моль/л ) и выход аце-тона составил 7.9 ± 0.3 молекула/100 эВ. Добавление тироксина в раствор, насыщенный кислородом, снова приводило к возрастанию выхода ацетона до 10.0 ± ± 0.2 молекула/100 эВ. В этом растворе также наблюдалось образование иодид-ионов (0.52 ± 0.11 молекула/100 эВ). При такой концентрации кислорода гидратированные электроны будут реагировать по реакции (10), а реакция (7) протекать не будет. Усиление окисления спиртовых радикалов тироксином объясняется протеканием реакции (12) в присутствии тироксина:
(12)
${\text{O}}_{2}^{{ - \centerdot }}\quad + \,\,{\text{Т }}4\quad \to {{{\text{O}}}_{2}}\quad\,\, + \quad\,\,{\text{Т }}{{4}^{{ - \centerdot }}} \to \quad\,\,{{{\text{I}}}^{ - }} + \quad\quad{\text{Т }}{{3}^{\centerdot }}.$Эта же реакция объясняет и образование иодид-ионов в растворах с тироксином насыщенных кислородом. Подобная реакция супероксид-иона с хлорорганическими соединениями сопровождающаяся образованием хлорид-ионов описана в [9–11 ]. Константа скорости подобной реакции 1 л моль–1 с–1 [9], 9 л моль–1 с–1 [10] и соизмерима с константой скорости реакции (11). Радикалы Т3• далее могут реагировать по реакциям (13)–(15) приводя к короткоцепному процессу образования ацетона:
(13)
${\text{Т }}{{3}^{\centerdot }} + \,\,\quad{{{\text{O}}}_{2}} \to {\text{Т }}3{\text{O}}{{{\text{О }}}^{\centerdot }},$(14)
${\text{Т }}{{3}^{\centerdot }} + {{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\text{CHOH}} \to \quad{\text{Т 3H}}\quad\, + \quad\,\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{\centerdot }{\text{COH}},$(15)
$\begin{gathered} {\text{Т 3O}}{{{\text{О }}}^{\centerdot }} + \quad\,\,{{\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)}_{2}}{\text{CHOH}}\quad\, \to \hfill \\ \to {\text{Т 3О О H}}\quad\,\, + \,\,\quad\left( {{\text{C}}{{{\text{H}}}_{{\text{3}}}}} \right)_{2}^{\centerdot }{\text{COH}}{\text{.}} \hfill \\ \end{gathered} $Таким образом, тироксин способен окислять углеродцентрированные α-гидроксилсодержащие радикалы до карбонильных соединений. В присутствии кислорода тироксин ускоряет процесс окисления гидроксиизопропильных радикалов за счет взаимодействия с супероксид-анионом и тем самым проявляет прооксидантные свойства.
Список литературы
Грин Н., Стаут У., Тейлор Д. Биология. Т. 3. М.: Мир, 1996. 376 с. / Green N., Stout G., Taylor D. Biological science. Cambridge university press, 1989.
Das T.N., Prlyadarsini K.I. // J. Phys.Chem. 1994. V. 98. № 20. P. 5272.
Пикаев А.К. // Современная радиационная химия. Радиолиз газов и жидкостей. М.: Наука, 1986. 440 с.
Бугаенко В.Л., Бяков В.М. // Химия высоких энергий. 1998. Т. 32. № 6. С. 407.
Пикаев А.К., Кабакчи С.А., Макаров И.Е. Высокотемпературный радиолиз воды и водных растворов. М.: Энергоатомиздат, 1988. 136 с.
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 513.
Weinstein J., Bielski B.H.J. // J. Am. Chem. Soc. 1979. V. 101. № 1. P. 58.
Майборода В.Д., Петряев Е.П., Бяков В.М., Ивашкевич Л.Ф. // Химия высоких энергий. 1974. Т. 8. № 3. С. 284.
Кособуцкий В.С. // Журн. общей химии. 2009. Т. 79. Вып. 3. С. 419.
Roberts J.L., Sawyer D.T. // J. Am. Chem. Soc. 1981. V. 103. № 3. P. 712.
Кособуцкий В.С. // Журн. общей химии. 2014. Т. 84. Вып. 5. С. 746.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий