Химия высоких энергий, 2019, T. 53, № 3, стр. 206-213
Обратимая реакция [2+2]-фотоциклоприсоединения в супрамолекулярной ковалентно-связанной диаде с 3-(4-оксистирил)бензо[f]хинолином в качестве фотохрома И о-ксилиленовой мостиковой группой
М. Ф. Будыка a, *, Н. И. Поташова a, Т. Н. Гавришова a, Ю. А. Федулова a, b
a Институт проблем химической физики Российской академии наук
142432 Московская обл., г. Черноголовка, просп. Академика Семенова, 1, Россия
b Факультет фундаментальной физико-химической инженерии МГУ им. Ломоносова
119992 Москва, Ленинские горы, 1, Россия
* E-mail: budyka@icp.ac.ru
Поступила в редакцию 17.12.2018
После доработки 25.12.2018
Принята к публикации 28.12.2018
Аннотация
В ковалентно-связанной бифотохромной диаде, в которой стирилбензохинолиновые (СБХ) фотохромы связаны о-ксилиленовой мостиковой группой, наблюдается реакция [2+2]-фотоциклоприсоединения (ФЦП). Образующийся циклобутан CB4M, содержащий два одинаковых вицинальных бензохинолиновых (БХ) заместителя, подвергается обратной реакции раскрытия цикла (ретро-ФЦП). Сравнение с исследованным ранее близким по структуре циклобутаном CB4N, который имеет аналогичные БХ заместители, но другую мостиковую группу, и не вступает в реакцию ретро-ФЦП, показывает, что фотохимическими свойствами циклобутана можно управлять, меняя структуру мостиковой группы. Квантово-химические расчеты в приближении теории функционала плотности (DFT) предсказывают существование конформеров с π-стэкинг взаимодействием СБХ фотохромов в диаде и БХ заместителей в циклобутане.
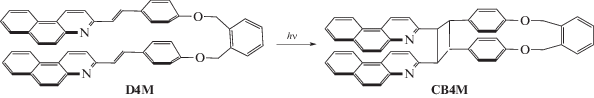
Недавно было показано, что в бис-стирилбензохинолиновых (СБХ) диадах, в которых два СБХ-фотохрома соединены о-ксилиленовой мостиковой группой, под действием света протекает реакция [2+2]-фотоциклоприсоединения (ФЦП) с образованием тетразамещенных циклобутанов [1, 2]. На схеме 1 реакция ФЦП показана на примере диады D4M, в которой фотохромом является 3-(4-оксистирил)бензо[f]хинолин, продуктом реакции является циклобутан CB4M, имеющий два вицинальных бензохинолиновых (БХ) заместителя.
Схема 1 . Реакция [2+2]-фотоциклоприсоединения в диаде D4M с образованием тетразамещенного циклобутана CB4M.
Реакция ФЦП возможна только в возбужденном димере, т.е. в эксимере, который является интермедиатом на пути замыкания цикла. Образованию эксимера способствует предорганизующее действие о-ксилиленовой группы, которая удерживает два СБХ фотохрома на расстоянии, достаточном для их взаимодействия. Следует отметить, что термин “эксимер” обычно применяют к возбужденному димеру, который связан в возбужденном состоянии, но имеет несвязывающее основное (S0) состояние. Здесь мы применяем термин “эксимер” к любому возбужденному димеру, независимо от способа его образования – в результате связывания двух мономеров, один из которых находится в основном состоянии, а другой – в возбужденном (“динамический эксимер”), или в результате возбуждения димера, связанного (в результате межмолекулярного взаимодействия) уже в S0-состоянии (предварительно связанный или “статический эксимер”).
При замыкании четырехчленного цикла исчезает двойная связь этиленовой группы, происходит разрыв цепи π-сопряжения между БХ и бензольным ядрами, поэтому УФ спектр конечного циклобутана сдвинут гипсохромно относительно спектра исходной диады, т.к. определяется поглощением ароматических заместителей – БХ с одной стороны четырехчленного цикла и фенилена – с другой стороны. Вследствие этого, при облучении СБХ диад в области длинноволновой полосы поглощения (ДВПП) светом с длиной волны 370 нм, который не поглощался конечными продуктами реакции ФЦП, наблюдалось практически полное превращение диад в соответствующие циклобутаны [2].
Известно, что реакция ФЦП обратима [3, 4]. Было предположено, что отсутствие обратной реакция раскрытия цикла (ретро-ФЦП), приводящее к необратимости реакции ФЦП для СБХ диад, связано с условиями эксперимента: конечные продукты реакции – тетразамещенные циклобутаны – не поглощали действующий длинноволновый свет (370 нм), однако детально этот вопрос не исследовался [2]..
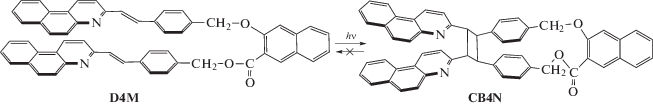
Недавно было найдено [5], что в близкой по структуре СБХ диаде D4N с 2,3-нафтиленовой мостиковой группой, образующийся циклобутан CB4N действительно фотостабилен: при облучении коротковолновым УФ светом (316 нм), который поглощают БХ заместители, реакция ретро-ФЦП не наблюдается, т.е. необратимость ФЦП в диаде D4N обусловлена не условиями эксперимента, а свойствами циклобутана CB4N, схема 2 .
Схема 2 . Реакция [2+2]-фотоциклоприсоединения в диаде D4N с образованием тетразамещенного циклобутана CB4N.
Вследствие существенного различия в свойствах близких по структуре диад и циклобутанов (схемы 1 и 2 ), представляло интерес более детально исследовать реакцию ФЦП в диаде D4M, в частности, спектрально-люминесцентные и фотохимические свойства циклобутана CB4M, его способность вступать в реакцию раскрытия циклобутана (ретро-ФЦП).
Как показали исследования, реакция ФЦП в диаде D4M обратима – продукт реакции, циклобутан CB4M, при облучении в области поглощения БХ заместителей (316 нм) подвергается реакции ретро-ФЦП, которая конкурирует с флуоресценцией БХ. Промежуточной стадией реакции ретро-ФЦП является перенос энергии (ПЭ), поскольку при облучении циклобутана CB4M в области поглощения БХ заместителей энергия возбуждения локализуется вначале на одном из них. Затем происходит ПЭ (перераспределение энергии по системе связей) и локализация ее на соседней σ-связи в циклобутане, что инициирует разрыв связи и раскрытие циклобутанового кольца. Наличие ПЭ приводит, во-первых, к уменьшению квантового выхода флуоресценции БХ в CB4M по сравнению с модельным соединением, во-вторых, к последующему раскрытию четырехчленного цикла.
Сравнение свойств двух циклобутанов – CB4M (в котором наблюдается ретро-ФЦП) и CB4N (в котором ретро-ФЦП не идет) – показывает, что фотохимическими свойствами циклобутана можно управлять, меняя структуру мостиковой группы, которая связывает СБХ фотохромы в исходной диаде и две фениленовые группы в конечном циклобутане.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диада D4M синтезирована по описанной ранее методике [1]. Циклобутан CB4M получали in situ путем облучения раствора диады D4M светом светодиода LED-371, при этом диада практически количественно превращалась в циклобутан, по данным абсорбционной спектроскопии, его выход составлял более 97%.
Электронные спектры поглощения записаны на спектрофотометре “Specord M-400”, спектры эмиссии сняты на спектрофлуориметре фирмы “PerkinElmer” “LS-55” в Аналитическом центре коллективного пользования ИПХФ РАН.
Все исследования выполнены при комнатной температуре в воздушно-насыщенных растворах в этаноле с добавлением хлористого метилена (для повышения растворимости диады) в кварцевых кюветах с длиной оптического пути l = 1 см. Квантовые выходы флуоресценции измеряли, используя в качестве эталона разбавленный спиртовой раствор антрацена, квантовый выход флуоресценции которого составляет 0.3 [6], точность измерения 15%.
В качестве источника УФ света использовали светодиоды LED-316 (λmax = 316 нм, FWHM = 1 нм), LED-370 (λmax = 370 нм, FWHM = 14 нм), LED-371 (λmax = 371 нм, FWHM = 8 нм), интенсивность действующего света (1–2) × 10‑10 Эйнштейн см–2 с–1 для LED-316 и (1.1–1.2) × 10–9 Эйнштейн см–2 с–1 для LED-370 (измерена ферриоксалатным актинометром). Ошибка измерения квантовых выходов реакций 20%.
Квантово-химические расчеты соединений в основном (S0) состоянии проводили методом функционала плотности с использованием гибридного функционала M06-2X, учитывающего дисперсионные взаимодействия, с базисом 6-31G*, пакет программ GAUSSIAN-09 [7]. Структуры соединений рассчитаны с полной оптимизацией геометрии. Оптимизированные структуры соответствовали минимуму на поверхности потенциальной энергии, поскольку в колебательном спектре отсутствовали мнимые частоты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Реакция ФЦП и ретро-ФЦП
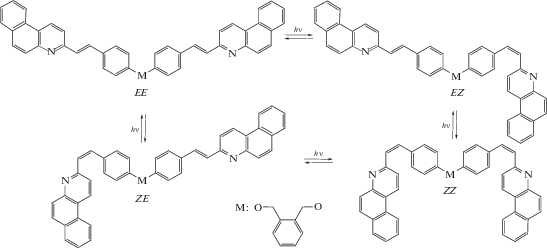
При протекании обратимой реакции фотоизомеризации, когда действующий свет поглощают оба изомера (вследствие перекрывания их спектров поглощения), спектральные изменения прекращаются по достижении фотостационарного состояния (ФСλ), состав которого зависит от длины волны облучения λ. В случае бифотохромной диады D4M, ФС реакции фотоизомеризации содержит все четыре изомера диады, схема 3 – EE, EZ, ZE и ZZ (поскольку диада D4M содержит два одинаковых СБХ фотохрома, EZ и ZE изомеры неразличимы).
Схема 3 . Фотоизомеризация бифотохромной диады D4M (СБХ фотохромы показаны в форме s-транс конформеров).
Если реакция ФЦП обратима, то при облучении диады светом, который поглощают как исходная диада, так и конечный циклобутан, спектральные изменения также должны прекратиться по достижении ФС. Постольку параллельно с ФЦП идет реакция фотоизомеризации, в данном случае будет наблюдаться ФС для обеих реакций, т.е. реакционная смесь будет содержать все изомеры диады и циклобутан (который, формально, также является циклическим изомером диады). В качестве такой длины волны, на которой поглощают все участвующие в обеих реакциях соединения, мы использовали 316 нм (соответствует максимуму излучения светодиода).
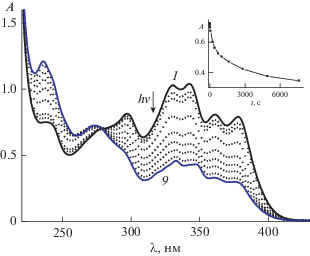
На рис. 1 показаны спектральные изменения при облучении раствора диады D4M светом 316 нм. Наблюдалось падение поглощения в области 280–410 нм и симбатный рост в области 230–270 нм. Эти спектральные изменения соответствовали наблюдавшимся ранее на начальной стадии при облучении диады светом 370 нм [2], однако в данном случае реакция не доходила до полного превращения диады в циклобутан, что свидетельствовало о достижении ФС как для реакции фотоизомеризации, так и для реакции ФЦП. Как и следовало ожидать для обратимой реакции, при использовании в качестве исходного субстрата циклобутана CB4M наблюдались обратные спектральные изменения (рост в области 280–410 нм и падение в области 230–270 нм), которые также прекращались по достижении ФС.
Рис. 1.
Спектральные изменения при облучении воздушно-насыщенного раствора диады D4M (1.7 × 10–5 М) светом с длиной волны 316 нм, интенсивность 2 × 10–10 Эйнштейн см–2 с–1, время фотолиза 0 (1), 30 (2), 60 (3), 240 (4), 720 (5), 1620 (6), 2820 (7), 4920 (8), 7620 с (9); вставка: кинетика изменения оптической плотности на длине волны 316 нм, экспериментальные точки и аппроксимирующая кривая по системе уравнений (1)–(5) (см. текст).
Для описания кинетики фотолиза диады D4M с учетом реакции фотоизомеризации по схеме 3 и реакции ФЦП по схеме 1 мы использовали упрощенную систему дифференциальных уравнений (1)–(5) (см. подробнее [8, 9]):
(1)
$\begin{gathered} {{d{{c}_{{EE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EE}}}} {dt}}} \right. \kern-0em} {dt}} = ({{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}({{c}_{{ZE}}} + {{c}_{{EZ}}})--2{{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}}-- \\ - \,\,2{{\varphi }_{{{\text{pca}}}}}{{\varepsilon }_{E}}{{c}_{{EE}}} + {{\varphi }_{{{\text{discl}}}}}{{\varepsilon }_{{{\text{CB}}}}}{{c}_{{{\text{CB}}}}}){{I}_{0}}F, \\ \end{gathered} $(2)
$\begin{gathered} {{d{{c}_{{ZE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZE}}}} {dt}}} \right. \kern-0em} {dt}} = \quad({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}}--({{\varphi }_{{EZ}}}{{\varepsilon }_{E}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}){{c}_{{ZE}}} + \\ + \,\,{{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(3)
$\begin{gathered} {{d{{c}_{{EZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EZ}}}} {dt}}} \right. \kern-0em} {dt}} = \quad({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}{{c}_{{EE}}}--({{\varphi }_{{EZ}}}{{\varepsilon }_{E}} + {{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}){{c}_{{EZ}}} + \\ + \,\,{{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(4)
${{d{{c}_{{ZZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZZ}}}} {dt}}} \right. \kern-0em} {dt}} = \quad({{\varphi }_{{EZ}}}{{\varepsilon }_{E}}({{c}_{{ZE}}} + {{c}_{{EZ}}})--2{{\varphi }_{{ZE}}}{{\varepsilon }_{Z}}{{c}_{{ZZ}}}){{I}_{0}}F,$(5)
${{d{{c}_{{{\text{CB}}}}}} \mathord{\left/ {\vphantom {{d{{c}_{{{\text{CB}}}}}} {dt}}} \right. \kern-0em} {dt}} = \quad(2{{\varphi }_{{{\text{pca}}}}}{{\varepsilon }_{E}}{{c}_{{EE}}}--{{\varphi }_{{{\text{discl}}}}}{{\varepsilon }_{{{\text{CB}}}}}{{c}_{{{\text{CB}}}}}){{I}_{0}}F,$Систему уравнений (1)–(5) решали численно путем минимизации среднеквадратичной ошибки оптической плотности ΔA = (Σ(Acalc − Aexp)2/m)1/2, где Acalc – оптическая плотность, рассчитанная численным интегрированием уравнений (1)–(5), Aexp – измеренная оптическая плотность реакционной смеси, m – число экспериментальных точек на кинетической кривой. В качестве примера, на вставке на рис. 1 показана рассчитанная аппроксимирующая кривая. Получены средние значения квантовых выходов φEZ = 0.44, φZE = 0.85, φpca = 0.058 и φdiscl = 0.13. Отметим, что как и для ранее исследованных диад [2], кинетическая модель фотоизомеризации по уравнениям (1)–(5) дает завышенное значение φZE, однако вариация этого параметра в модельных расчетах не влияет на соотношение φEZ$ \gg $ φpca и φdiscl ~ 2φpca.
Поскольку квантовый выход φEZ реакции транс-цис фотоизомеризации в несколько раз превышает значение φpca для реакции ФЦП, при фотолизе диады в начальный период реакции успевает накопиться значительное количество изомеров диады, содержащих СБХ-фотохром в цис-форме. Как показывает анализ кинетики изменения относительной концентрации компонентов реакционной смеси (рис. 2), при облучении светом 316 нм суммарная доля изомеров диады с СБХ-фотохромом в цис-форме на начальном этапе достигает почти 60%, однако далее по мере облучения уменьшается до 33% в ФС316. При этом содержание EE изомера диады постепенно уменьшается до 16% (рис. 2, кривая 1), а содержание циклобутана CB4M в ФС316 достигает 51% (рис. 2, кривая 4).
Рис. 2.
Кинетика изменения концентраций при облучении раствора диады D4M светом с длиной волны 316 нм: (1) EE, (2) (EZ + ZE), (3) ZZ изомер диады, (4) циклобутан CB4M.
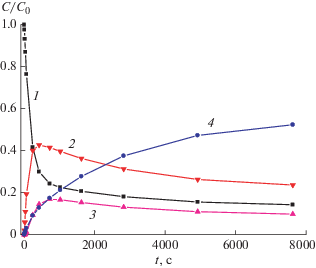
Расчет кинетических кривых на рис. 2 проводился путем численного решения системы уравнений (1)–(5), которая предполагает, что циклобутан CB4M образуется из EE изомера диады, уравнение (5). Это предположение основано на том факте, что для близких по структуре СБХ диад ранее было показано, что реакция ФЦП протекает стереоспецифично с участием EE изомера диады и образованием единственного rctt-изомера циклобутана [1, 5].
Для подтверждения предположения, что реакция ФЦП в диаде D4M, как и в исследованных ранее СБХ-диадах, также протекает с участием EE изомера, а обратная реакция ретро-ФЦП приводит к образованию именно этого изомера, мы проанализировали спектральные изменения при облучении диады D4M и циклобутана CB4M методом главных компонент (МГК, principal component analysis) [10]. На рис. 3 показан график счетов, на котором экспериментальные спектры при фотолизе диады D4M светом 316 нм (кривая 1), светом 371 нм (кривая 2) и циклобутана CB4M светом 316 нм (кривая 3) представлены в базисе первых двух сингулярных векторов. Каждая точка на графике соответствует конкретному спектру реакционной смеси при фотолизе, при анализе учитывался спектральный диапазон 270–420 нм с шагом 1 нм, т.е. исходная матрица включала 151 значение оптической плотности для каждого спектра. Звездочками отмечены точки, соответствующие спектрам EE и EZ изомеров диады и циклобутана. Спектр EZ изомера рассчитан теоретически, исходя из спектров транс- и цис-изомеров модельного СБХ фотохрома и о-ксилиленовой группы (см. [2]).
Рис. 3.
График счетов – обработка методом главных компонент (principal component analysis) спектральных изменений, происходящих при фотолизе: (1) диады D4M светом 316 нм, (2) диады D4M светом 371 нм, (3) циклобутана CB4M светом 316 нм; экспериментальные спектры представлены в общем базисе двух первых сингулярных векторов p1 и p2. Отмечены точки, соответствующие экспериментальному спектру EE изомера и модельному спектру EZ изомера диады (см. текст), спектру циклобутана CB и ФС316 (PS316), стрелки показывают направление спектральных изменений при фотолизе.
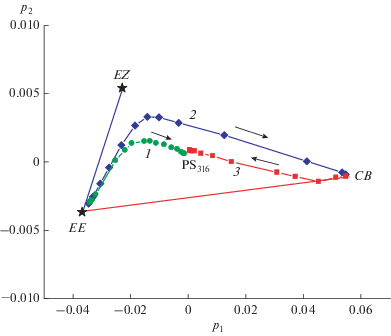
Отрезок EE–EZ на рис. 3 показывает ход спектральных изменений при протекании в EE изомере диады D4M только реакции фотоизомеризации, отрезок EE–CB – ход спектральных изменений при протекании в том же изомере только реакции ФЦП. Видно, что при фотолизе диады D4M, как светом 316 нм (кривая 1), так и светом 371 нм (кривая 2), начальные прямолинейные участки идут вдоль отрезка EE–EZ, поскольку в этом временном интервале, вследствие соотношения φEZ$ \gg $ φpca, спектральные изменения обусловлены, в основном, быстрой реакцией транс-цис фотоизомеризации. Затем на кривых 1 и 2 наблюдаются точки излома (поворота), характеризующие достижение квази-ФС реакции фотоизомеризации, причем при фотолизе светом 316 нм, по сравнению с 371 нм, точка излома находится ближе к точке EE, поскольку реакционная смесь содержит меньше изомеров диады с СБХ-фотохромом в цис-форме.
После достижения квази-ФС реакции фотоизомеризации соотношение концентраций СБХ-фотохромов в форме транс- и цис-изомеров в реакционной смеси перестает меняться, после поворота кривые 1 и 2 направлены к точке CB и характеризуют сравнительно медленную реакцию ФЦП. В этой реакции расходуется только EE-изомер диады, но соотношение между концентрациями всех изомеров диады сохраняется вследствие быстрого восстановления фотодинамического равновесия в реакции фотоизомеризации, поэтому после поворота на кривых 1 и 2 также наблюдаются прямолинейные участки. В отличие от фотолиза светом 371 нм, при фотолизе светом 316 нм спектральные изменения заканчиваются в точке ФС316, когда достигается равновесие для обеих обратимых реакций – фотоизомеризации и ФЦП, и в смеси содержатся все изомеры диады (рис. 2), полный состав ФС316 указан выше.
Ход спектральных изменений при фотолизе циклобутана, рис. 3, кривая 3, подтверждает, что последний образуется именно из EE-изомера диады и раскрывается в этот изомер. Начальный участок кривой 3 идет вдоль отрезка EE–CB, поскольку в начале реакции ретро-ФЦП в реакционной смеси присутствуют только циклобутан и образующийся из него EE-изомер диады. По мере накопления последнего становится заметной реакция транс-цис фотоизомеризации и кривая 3 отклоняется в сторону точки EZ. Теоретически, конечные точки на кривых 1 и 3 должны совпадать, поскольку при облучении светом 316 нм, как диады D4M, так и циклобутана CB4M, достигается одно и то же ФС316 и его положение не должно зависеть от пути его получения. Небольшое различие в положении двух точек (т.е. в форме спектров двух ФС), которое выявляет МГК, свидетельствует о том, что при длительном облучении жестким УФ светом (316 нм) в реакционной смеси постепенно накапливаются побочные продукты, природа которых не исследовалась.
Спектральные свойства циклобутана
На рис. 4 показаны спектры люминесценции и возбуждения люминесценции циклобутана CB4M в сравнении с модельным 3-метилбензохинолином (МБХ). В спектрах МБХ наблюдаются черты, характерные для люминофоров с жесткой структурой, которые имеют близкую геометрию основного и возбужденного состояний: спектр люминесценции (спектр 1) является зеркальным отражением спектра возбуждения люминесценции (спектр 2) с небольшим Стоксовым сдвигом, в обоих спектрах четко видна колебательная структура, спектр возбуждения люминесценции МБХ совпадает со спектром поглощения.
Рис. 4.
Нормированные спектры (1, 3) люминесценции и (2, 4) возбуждения люминесценции для (1, 2) 3-метилбензохинолина (возбуждение при 330 нм, наблюдение при 365 нм) и (3, 4) циклобутана CB4M (возбуждение при 333 нм, наблюдение при 380 нм).
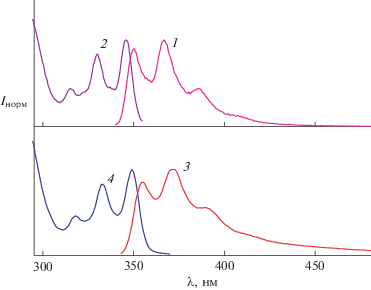
Спектры люминесценции (спектр 3) и возбуждения люминесценции (спектр 4) циклобутана CB4M, рис. 4, практически совпадают с таковыми для МБХ (с небольшим батофлорным сдвигом 3 нм для спектра возбуждения и 5 нм для спектра излучения), в них наблюдаются аналогичные характерные черты: колебательная структура, небольшой Стоксов сдвиг, зеркальное отражение спектров. Эти данные свидетельствуют о том, что БХ заместители в CB4M излучают раздельно, т.е. не взаимодействуют между собой в возбужденном состоянии. Квантовый выход люминесценции CB4M, 0.1, меньше, чем модельного МБХ, 0.44, что свидетельствует о наличии дополнительных каналов дезактивации возбужденного состояния БХ в CB4M. Очевидно, что один из этих каналов – это ПЭ на циклобутановое кольцо, который конкурирует с флуоресценцией БХ. Как отмечено выше, ПЭ – необходимая стадия реакции ретро-ФЦП, поскольку при облучении циклобутана CB4M светом 316 нм, энергия возбуждения локализуется вначале на БХ заместителях и должна быть перенесена затем на соседнюю σ-связь в циклобутане, чтобы инициировать ее разрыв и раскрытие циклобутанового кольца.
Таким образом, не только фотохимические, но спектрально-люминесцентные свойства циклобутана CB4M отличаются от таковых для циклобутана CB4N, для которого была зафиксирована длинноволновая бесструктурная полоса излучения, приписанная эксимеру между двумя БХ заместителями [5].
Мы провели квантово-химические расчеты по теории функционала плотности (DFT), при этом использовали гибридный функционал M06-2X [11], включающий дисперсионную поправку, которую необходимо учитывать при описании межмолекулярных нековалентных взаимодействий, стабилизирующих конформеры диады со сближенными СБХ фотохромами.
Благодаря наличию (квази)одинарных связей, диада D4M способна существовать в форме нескольких конформеров, в которых СБХ фотохромы находятся на разном расстоянии друг от друга. На рис. 5 показана оптимизированная структура конформера диады, в котором два СБХ фотохрома сближены уже в основном состоянии вследствие π-стэкинг взаимодействия, аналогичные конформеры были найдены и в исследованных ранее СБХ диадах [1, 5]. Очевидно, этот конформер при возбуждении способен образовать статический эксимер, см. введение. Расстояние между этиленовыми группами СБХ фотохромов составляет 3.64 Å, т.е. структура этого конформера уже предорганизована для реакции ФПЦ в возбужденном состоянии. Известно, что для протекания реакции ФЦП в кристалле расстояние между этиленовыми группами диарилэтилена должно быть меньше 4.2 Å, чтобы обеспечить перекрывание π‑орбиталей реагентов [12].
Рис. 5.
Структуры конформеров диады D4M (слева) и циклобутана CB4M (справа) с π-стэкинг взаимодействием, оптимизированные на уровне M06-2X/6-31G*.
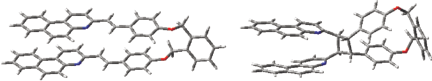
Разность энергий конформера диады с π‑стэкингом и конформера с максимально удаленными невзаимодействующими СБХ фотохромами, этиленовые группы которых разнесены на 13.09 Å, равна 12.77 ккал/моль, что можно использовать как оценку энергии π-стэкинг взаимодействия СБХ фотохромов в диаде.
Циклобутан CB4M также способен к конформационной изомерии. На рис. 5 показан конформер с π-стэкинг взаимодействием между двумя БХ заместителями. Разность энергий этого конформера и конформера, имеющего V-образную структуру с расходящимися в разные стороны БХ заместителями, равна 2.3 ккал/моль, т.е. энергия π-стэкинг взаимодействия в циклобутане меньше, чем в диаде, очевидно, вследствие меньшей π-системы БХ (14 π-электронов) по сравнению с СБХ (22 π-электрона) и стерического влияния четырехчленного цикла. В отличие от диады D4M, где образование эксимера подтверждается протекающей в нем реакцией ФЦП, для циклобутана CB4M отсутствуют экспериментальные свидетельства об образовании эксимера при возбуждении БХ заместителей. Возможно, расчет на уровне M06-2X/6-31G* завышает энергию нековалентного взаимодействия и переоценивает стабильность конформеров с π-стэкингом. Также следует учитывать, что расчет сделан для изолированной молекулы без учета влияния растворителя, в котором относительная стабильность конформеров может меняться.
ЗАКЛЮЧЕНИЕ
Таким образом, в бис-стирилбензохинолиновой диаде D4M под действием света протекают две конкурентные реакции – транс-цис фотоизомеризация СБХ-фотохромов и межфотохромное [2+2]-фотоциклоприсоединение (ФЦП) с образованием тетразамещенного циклобутана CB4M, причем обе реакции являются обратимыми. Квантово-химические расчеты на уровне M06-2X/6-31G* предсказывают наличие π-стэкинг взаимодействия между двумя СБХ-фотохромами в диаде, что способствует образованию эксимера, в котором протекает реакция ФЦП.
Циклобутан CB4M имет два вицинальных бензохинолиновых (БХ) заместителя, при облучении в полосе поглощения которых происходит раскрытие четырехчленного цикла. Реакция раскрытия цикла инициируется переносом энергии от возбужденного БХ заместителя на соседнюю циклобутановую σ-связь. Наличие этого процесса проявляется в уменьшении квантового выхода флуоресценции БХ в CB4M по сравнению с модельным метилбензохинолином. Сравнение свойств CB4M с исследованным ранее близким по структуре циклобутаном CB4N, который имеет аналогичные вицинальные БХ заместители в четырехчленном цикле, но другую мостиковую группу, и не вступает в реакцию ретро-ФЦП, показывает, что фотохимическими свойствами циклобутана можно управлять, меняя структуру мостиковой группы. Необходимы дальнейшие экспериментальные и теоретические исследования для выяснения механизма влияния мостиковой группы на свойства циклобутана.
Авторы выражают благодарность д.х.н. Е.Н. Ушакову за обсуждение результатов работы.
Работа выполнена по теме Государственного задания № 01201361847 и при финансовой поддержке Российского фонда фундаментальных исследований (грант 17-03-00789).
Список литературы
Budyka M.F., Gavrishova T.N., Potashova N.I. // ChemistrySelect. 2016. V. 1. P. 36.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2017. Т. 51. С. 216.
Somlai A.P., Cozad R.A., Page K.A., Williams H.R., Creed D., Hoyle C.E. // Photochem. Photobiol. Sci. 2008. V. 7. P. 578.
Будыка М.Ф., Гавришова Т.Н., Поташова Н.И., Чащихин О.В.// Химия высоких энергий. 2015. Т. 49. С. 269.
Budyka M.F., Gavrishova T.N., Potashova N.I., Li V.M. // ChemistrySelect. 2018. V. 3. P. 10651.
Becker H.D. // Chem. Rev. 1993. V. 93. P. 145.
Gaussian 09, Revision B.01 // M.J. Frisch, G.W. Trucks, H.B. Schlegel, et al. Gaussian, Inc., Wallingford CT, 2010.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М., Гак Ю.В., Гринева И.А. // Химия высоких энергий. 2018. Т. 52. С. 204.
Будыка М.Ф., Гавришова Т.Н., Ли В.М., Дозмо-ров С.А. // Химия высоких энергий. 2019. Т. 53. № 1. С. 7.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2010. Т. 44. С. 436.
Zhao Y., Truhlar D.G. // Theor. Chem. Account. 2006. V. 120. P. 215.
Chung J.W., You Y., Huh H.S., An B.K., Yoon S.J., Kim S.H., Lee S.W., Park S.Y. // J. Am. Chem. Soc. 2009. V. 131. P. 8163.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий