Химия высоких энергий, 2019, T. 53, № 3, стр. 193-198
Фотопроцессы в 2-бензилиден-5-(пиридин-4-илметилиден)циклопентаноне и его производных в ацетонитриле
В. Н. Гутров a, Г. В. Захарова a, *, Н. А. Артюшевский b, В. Н. Нуриев a, b, С. З. Вацадзе a, b, С. П. Громов a, b, **, А. К. Чибисов a
a Центр фотохимии РАН, Федеральное государственное учреждение “Федеральный научно-исследовательский центр “Кристаллография и фотоника” Российской академии наук”
119421 Москва, ул. Новаторов, 7а, кор. 1, Россия
b Московский государственный университет имени М.В. Ломоносова, Химический факультет
19991 Москва, ГСП-1, Ленинские горы, 1, стр. 3, Россия
* E-mail: gvzakharova@gmail.com
** E-mail: spgromov@mail.ru
Поступила в редакцию 20.11.2018
После доработки 12.12.2018
Принята к публикации 25.12.2018
Аннотация
Приведены результаты исследования спектральных, люминесцентных и спектрально-кинетических свойств 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его диэтиламино-, метокси-, метилтио-, диметоксипроизводных в ацетонитриле при комнатной температуре. Введение электронодонорных заместителей приводит к батохромному смещению максимума поглощения на 121 нм по отношению к максимуму незамещенного диенона и батохромному смещению максимума флуоресценции на 129 нм по отношению к максимуму метоксипроизводного. Под действием лазерного облучения обескислороженных растворов диенонов происходит переход в триплетное состояние с временем полупревращения 0.7–3.0 мкс, тогда как для метокси-, метилтио- и диметоксипроизводных диенонов наблюдается образование стабильного фотопродукта.
Кросс-сопряженные диеноны, также известные как кетоцианины, содержащие электронодонорную группу в пара-положении, проявляют сольватохромные свойства [1] и в этом отношении могут быть использованы для определения степени полярности среды [2, 3]. Помимо этого, диеноны применяются в лазерах на красителях, используются в качестве фотосенсибилизаторов [4, 5], для оптической регистрации информации и в органическом синтезе [6, 7]. Влияние полярности среды находит отражение не только в спектрах поглощения, но и в спектрах флуоресценции и квантовых выходах флуоресценции. Так, в работах [8–11], для ряда кетоцианиновых красителей с ростом полярности растворителя имел место батохромный сдвиг максимума и снижение интенсивности флуоресценции.
Ранее нами были исследованы спектрально-люминесцентные и спектрально-кинетические свойства серии симметричных 2,5-бисбензилиденциклопентанонов с различными электронодонорными заместителями в пара-положениях бензольных циклов [12]. При импульсном лазерном возбуждении в ацетонитриле наблюдали кратковременное изменение поглощения, обусловленное переходом в триплетное состояние с временем жизни 0.3–1 мкс и образование стабильного продукта, также способного к переходу в триплетное состояние с временем жизни ~1 мкс.
В настоящей работе приведены результаты спектрально-люминесцентного исследования производных 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона, а также результаты спектрально-кинетического изучения промежуточных продуктов импульсного лазерного возбуждения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2-Бензилиден-5-(пиридин-4-илметилиден)циклопентанон (кетоцианин) и его производные были синтезированы на химическом факультете МГУ.
Для приготовления растворов кетоцианина использовали ацетонитрил компании “Криохром” марки осч. Измерения разностных спектров триплет-триплетного (Т-Т) поглощения и продуктов лазерного возбуждения, а также кинетики дезактивации триплетного состояния проводили на установке лазерного импульсного фотолиза [13, 14]. Импульсное возбуждение осуществляли с помощью 3-й (λ = 354 нм) гармоники лазера Nd:YAG, “Solar”. Растворенный кислород воздуха удаляли барботированием раствора азотом. Обработку результатов эксперимента выполняли с помощью программного обеспечения из пакета Origin Lab версии 8.0. Соединение экспериментальных точек на спектральных кривых в экспериментах по лазерному фотолизу проводили с помощью операции сплайн. Регистрацию спектров поглощения проводили на спектрофотометре “Agilent 8453", спектров флуоресценции осуществляли на спектрофлуориметре “Cary Eclipse”. Все измерения выполняли при комнатной температуре.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
Поглощение и флуоресценция
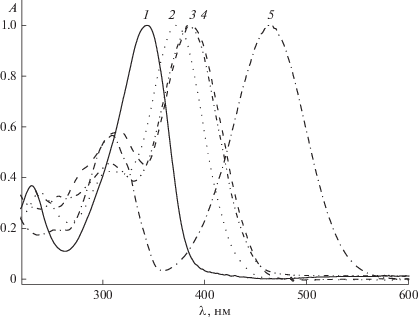
На рис. 1 приведены спектры поглощения 2‑бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его производных в ацетонитриле. Спектры характеризуются двумя полосами поглощения, из которых наиболее интенсивной является длинноволновая полоса с максимумами при 340–460 нм. Максимумы коротковолновой полосы расположены в интервале 230–320 нм. Согласно [15, 16], наиболее интенсивная полоса в спектрах поглощения диенонов принадлежит полосе с переносом заряда от электронодонорной группы на карбонильную, тогда как наименее интенсивная обусловлена π → π*-переходом в ароматическом кольце. Длинноволновая полоса поглощения претерпевает существенный батохромный сдвиг максимума с ростом электронодонорности заместителя. Для пиридинсодержащих диенонов 1b-e длинноволновая полоса также относится к полосе с переносом заряда от электронодонорного заместителя на карбонильную группу, тогда как коротковолновую полосу можно отнести к состоянию с переносом заряда от электронодонорного заместителя на атом азота пиридинового остатка, выступающего в качестве электроноакцепторного заместителя. Коротковолновая полоса растет по мере увеличения электронодонорности заместителя.
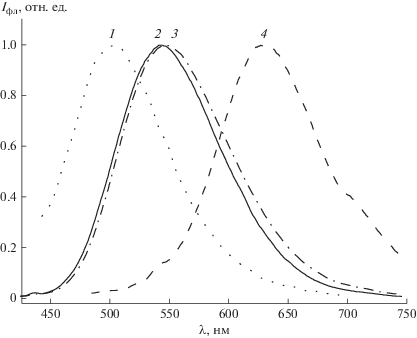
На рис. 2 приведены спектры флуоресценции 2‑бензилиден-5-(пиридин-4-илметилиден)циклопентанона с различными электронодонорными заместителями. Спектры испускания состоят из одной полосы, которая претерпевает батохромный сдвиг при увеличении электронодонорности заместителя. Для незамещенного диенона флуоресценция не была обнаружена. Разгорание флуоресценции при введении электронодонорных заместителей обусловлено инверсией положения nπ* и ππ* уровней в молекуле диенона, приводящей к расположению nπ* уровня над ππ*.
В табл. 1 приведены результаты спектрально-люминесцентных измерений. Интенсивность флуоресценции измеряли в условиях одинакового поглощения на длине волны возбуждения. Из приведенных данных следует, что с ростом электронодонорности заместителя имеет место увеличение Стоксова сдвига, достигающего 162 нм для диэтиламинопроизводного диенона. Наблюдаемые изменения флуоресцентных свойств производных 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона указывают на стабилизацию его возбужденного состояния при введении электронодонорных заместителей.
Таблица 1.
Спектральные характеристики 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его замещенных
| Диенон | Максимум поглощения*, нм | Максимум флуоресценции, нм | Стоксов сдвиг, нм | Интенсивность флуоресценции, отн. ед. |
|---|---|---|---|---|
| 1a | 344, 230 | – | – | – |
| 1b | 371, 308 | 498 | 127 | 15 |
| 1c | 386, 316 | 546 | 160 | 659 |
| 1d | 384, 307 | 540 | 156 | 453 |
| 1e | 465, 308 | 627 | 162 | 85 |
Импульсный лазерный фотолиз
При лазерном импульсном облучении обескислороженных растворов 1а-е диенонов наблюдали изменения в поглощении, обусловленные образованием триплетного состояния, с временем полупревращения 0.7–3.0 мкс и стабильного продукта фотохимической реакции. Для незамещенного диенона 1a наблюдали только триплет-триплетное поглощение с временем полупревращения 0.7 мкс (рис. 3).
Рис. 3.
Разностные спектры триплет-триплетного поглощения 1a в ацетонитриле, измеренные через 0.5 (1), 1.0 (2), 2.0 (3) и 5.0 (4) мкс после лазерного импульса. На вставке – кинетика дезактивации триплетного состояния (λ = 460 нм).
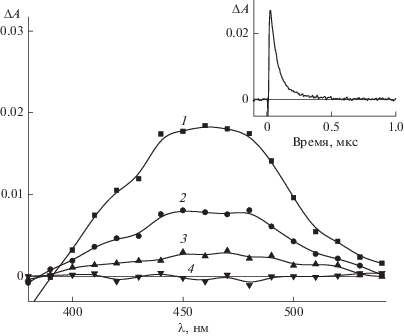
Лазерное импульсное облучение метокси-, диметокси- и метилтиопроизводных диенонов (1b, 1c, 1d соответственно) приводит к образованию двух промежуточных продуктов. Время полупревращения триплетного состояния для метокси-, диметокси- и метилтиопроизводных диенонов составляет 0.9, 2.5, 1.0 мкс соответственно.
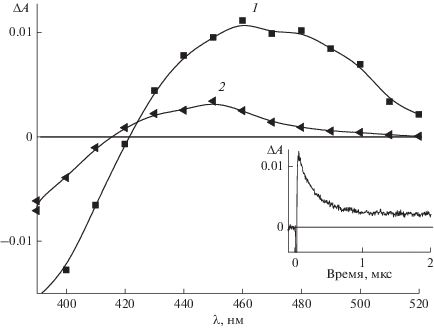
На рис. 4 приведены разностные спектры поглощения и кинетика превращения 1с, измеренные к различным моментам времени после лазерного импульса. Спектр 1 на рис. 4 с максимумом при 450–460 нм является суммарным поглощением, обусловленным образованием как триплетного состояния 1с, так и стабильного промежуточного фотопродукта, в то время как спектр 2 отвечает поглощению только стабильного продукта. Разностные спектры поглощения 1b и 1d подобны разностным спектрам 1с.
Рис. 4.
Разностные спектры поглощения 1с в ацетонитриле, измеренные через 0.5 (1) и 5.0 (2) мкс после лазерного импульса. На вставке – кинетика дезактивации триплетного состояния и поглощение продукта фотореакции (λ = 460 нм).
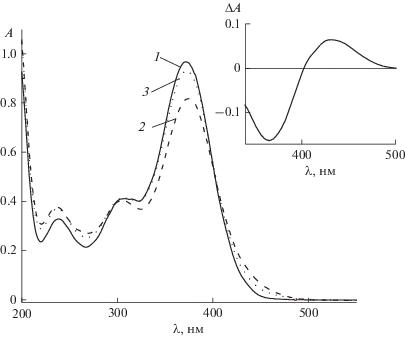
Ранее нами было показано [17], что для 2,5-бис-(диаминобензилиден)циклопентанона при лазерном импульсном и стационарном облучении наблюдается образование стабильного фотопродукта (В) фотохимической реакции, способного к интеркомбинационному переходу в триплетное состояние. Продукт (В) обнаруживает способность к фотоиндуцированному переходу в исходный 2,5-бис-(диаминобензилиден)циклопентанон, протекающему как через синглетно-возбужденное, так и через триплетное состояние. Для замещенных 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона также происходит образование стабильного продукта фотохимической реакции при лазерном облучении. На рис. 5 приведены спектры поглощения 1c, измеренные до лазерного облучения (спектр 1), после серии повторных лазерных импульсов (спектр 2), а также при последующем стационарном облучении в области λ > 450 нм (спектр 3), отвечающей поглощению продукта (В) фотохимической реакции. При стационарном облучении происходит обратное превращение продукта В в исходный диенон. На вставке рис. 5 представлен разностный спектр поглощения, полученный вычитанием спектра 1 из спектра 2. Разностный спектр совпадает со спектром долгоживущего продукта лазерного возбуждения (рис. 4, спектр 1). Для 1е не наблюдали образование стабильного продукта фотохимической реакции, в отличие от соединений 1a–d.
ВЫВОДЫ
1. Введение электроннодонорных заместителей в молекулу 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона приводит к батохромному сдвигу в спектрах поглощения и флуоресценции.
2. При импульсном лазерном облучении 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его метокси-, диметокси-, метилтио-, диэтиламинопроизводных имеет место переход в триплетное состояние с временем жизни 0.7–3.0 мкс и образование стабильного продукта для 2-бензилиден-5-(пиридин-4-илметилиден)циклопентанона и его метокси-, диметокси-, метилтиопроизводных, способного к фотопревращению в исходный диенон.
Работа выполнена при поддержке Российского научного фонда (проект № 14-13-00076) в части синтеза и спектрально-люминесцентных измерений кетоцианинов и Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части спектрально-кинетических измерений кетоцианинов.
Список литературы
Doroshenko A.O., Pivovarenko V.G. // J. Photochem. Photobiol. A: Chemistry. 2003. V. 156. № 1–3. P. 55.
Khalaf A.A., Etaiw S.H., Issa R.M., El-Shafei A.K. // Rev. Roum. Chim. 1977. V. 22. P. 1251.
Kessler M.A., Wolfbeis O.S. // Spectrochim. Acta. A: Molecular Spectroscopy. 1991. V. 47. № 2. P. 187.
Barnabas M.V., Liu A., Trifunac A.D. et al. // J. Phys. Chem. 1992. V. 96. № 1. P. 212.
Zoto C.A., Ucak-Astarlioglu M.G., Connors R.E. // J. Mol. Struct. 2016. V. 1105. P. 396.
Вацадзе С.З., Манаенкова М.А., Свириденкова Н.В. и др. // Изв. АН, Сер. хим. 2006. Т. 55. С. 1141.
Вацадзе С.З., Голиков А.Г., Кривенько А.П., Зык Н.В. // Успехи химии. 2008. Т. 77. Вып. 8. С. 707.
Doroshenko A.O., Grigorovich A.V., Posokhov E.A. et al. // Mol. Eng. 1998. V. 8. № 3. P. 199.
Rurack K., Dekhtyar M.L., Bricks J.L. et al. // J. Phys. Chem. A. 1999. V. 103. № 48. P. 9626.
Rurack K., Bricks J.L., Reck G. et al. // J. Phys. Chem. A. 2000. V. 104. № 14. P. 3087.
Doroshenko A.O., Sychevskaya L.B., Grygorovych A.V., Pivovarenko V.G. // J. Fluorescence. 2002. V. 12. № 3–4. P. 455.
Захарова Г.В., Зюзькевич Ф.С., Гутров В.Н. и др. // Химия высоких энергий. 2017. Т. 51. № 2. С. 121.
Атабекян Л.С., Чибисов А.К., Алфимов М.В. // Химия высоких энергий. 1997. Т. 31. № 5. С. 381.
Захарова Г.В., Авакян В.Г., Маркелов В.П. и др. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
Mondal J.A.l., Verma S., Ghosh H.N., Palit D.K. // J.Chem. Sci. 2008. V. 120. № 1. P. 45.
Marcotte N., FeryForgues S. // J. Photochem. Photobiol. A: Chemistry. 2000. V. 130. P. 133.
Гутров В.Н., Захарова Г.В., Зюзькевич Ф.С. и др. // Химия высоких энергий. 2018. Т. 52. № 6. С. 463.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий