Химия высоких энергий, 2019, T. 53, № 3, стр. 186-192
Актинометрическое измерение энергетической экспозиции с учетом спектрального распределения источника полихроматического излучения
Н. А. Левичев a, *, Б. Г. Ершов a
a ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина Российской Академии Наук
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: n.a.levichev@gmail.com
Поступила в редакцию 12.11.2018
После доработки 24.12.2018
Принята к публикации 25.12.2018
Аннотация
Обоснована возможность применения уранилоксалатного актинометра в качестве средства измерения энергетической экспозиции от источника высокоинтенсивного импульсного излучения сплошного спектра. Предложена и апробирована методика расчета в стационарной фотохимической системе, показывающая хорошую сходимость с расчетными методами.
ВВЕДЕНИЕ
Современный уровень промышленного производства диктует повышенные требования к степени очистки и обеззараживания сточных и питьевых вод. В связи с чем получили развитие технологии на основе фотоиндуцированных процессов [1, 2] с различными источниками ультрафиолетового (УФ) излучения.
В качестве источников света все чаще применяются получившие широкое распространение в медико-биологической и экологической сферах [3–5] импульсные ксеноновые лампы (ИКЛ), отличительными особенностями которых являются: сплошной спектр излучения в диапазоне длин волн от средней ультрафиолетовой до ближней инфракрасной области (190–1100 нм), высокие значения пиковых интенсивностей излучения, импульсно-частотный характер работы и возможность варьирования радиационных характеристик в зависимости от поставленных задач за счет изменения параметров разрядного контура.
Реактор, в котором протекают фотохимические реакции, проектируется из условия максимальной передачи энергии излучения в обрабатываемую среду, что решается организацией движения потоков воды с целью их перемешивания и равномерного распределения энергетической экспозиции (или дозы – значения энергии, приходящей на единицу площади) по объему.
Численное моделирование позволяет рассчитать гидродинамические траектории потоков воды и учесть распределение поля интенсивности от источника излучения [6], что в сумме позволяет получить информацию о сообщенных участкам среды значениях доз. Однако, апробация таких расчетов фотофизическими, основанными на внутреннем или внешнем фотоэффекте, или пироэлектрическими (реагирование за счет изменения температуры приемной головки) измерительными методами, используемыми для измерения энергетической экспозиции на определенной поверхности, затруднительна.
Альтернативным физическим методам регистрации параметров излучения является измерение с помощью химического актинометра (дозиметра) – химической системы, подвергающейся фотоиндуцированной реакции (с определенными длинами волн), для которой квантовый выход точно известен. Фотохимическое преобразование актинометра прямо пропорционально числу поглощенных им фотонов, поскольку химическое воздействие света приводит к обратимому или необратимому химическому изменению. На сегодняшний день известно большое число эффективных актинометрических систем [7]. Основные типы и характеристики жидкофазных химических актинометров, наиболее часто и успешно использующихся исследователями, приведены в табл. 1.
Таблица 1.
Характеристики жидкофазных актинометрических систем
| Поглощающее вещество | Область спектральной чувствительности, нм | Квантовый выход |
|---|---|---|
| C2H5OH | 185 | 0.4 |
| HN3 | 200–260 | 0.95–1.05 |
| K2S2O8–(CH3)3COH | 200–300 | 1.6–2.0 |
| UO2C2O4 | 200–440 | 0.49–0.61 |
| Уридин | 216–280 | 0.016–0.034 |
| Азобензол | 230–460 | 0.4–0.5 |
| Аденин | 250–300 | 0.0027–0.0029 |
| Лейкоцианид малахитового зеленого | 250–330 | 1.0 |
| Азоксибензол | 250–350 | 0.02 |
| K3Fe(C2O4)3 | 250–480 | 0.93–1.25 |
| ClCH2COOH | 253.7 | 0.31 |
| CH3I–I2 | 253.7 | 1.0 |
| NaNO3–C6H5COOH | 305–320 | 0.0015 |
| Соль Рейнеке | 315–750 | 0.27–0.32 |
Для актинометрии высокого качества фотохимическая система должна удовлетворять следующим требованиям: квантовый выход реакции постоянен в используемой области спектра (или известна его зависимость от длины волны) и не зависит от интенсивности света, температуры и pH раствора; высокая поглощательная способность раствора; однозначность протекающей фотохимической реакции, т.е. отсутствие побочных реакций и мешающего влияния продуктов.
Предварительные исследования и анализ данных табл. 1 показали, что актинометры на основе органических соединений, как правило, либо имеют ограниченную оптическую область фиксации света, либо не обнаруживают требуемой химической стойкости и чувствительны к образованию продуктов разложения. Так, например, при актинометрии на основе цис-транс-изомеризации азобензола [8] образующиеся в ходе процесса соединения имеют различные устойчивость, молярный коэффициент поглощения и квантовый выход фотоизомеризации. В наибольшей степени указанным выше условиям удовлетворяют актинометры на основе неорганических соединений UO2C2O4 и K3Fe(C2O4)3. Действительно, уранилоксалатный актинометр применяется для определения интенсивности света ксеноновой дуговой лампы [9, 10]. Для измерения потока фотонов импульсной ксеноновой лампы ранее использовали ферриоксалатный актинометр [11]. Однако без учета спектрального распределения излучения полученные результаты не дают информации об энергетической экспозиции в различных диапазонах длин волн. При этом для исследования фотохимических и фотобиологических систем с источниками полихроматического излучения необходима информация о спектральном распределении числа поглощенных объектом фотонов [12].
В настоящей работе был исследован уранилоксалатный актинометр, обоснована возможность и апробирована методика его применения для определения энергетической экспозиции от источника излучения сплошного спектра в лабораторном макете по фотохимическому разложению органических загрязнителей в воде в стационарных условиях. Также проведено сравнение полученных с помощью актинометра результатов с расчетом и экспериментальным измерением по методике с калиброванным фотоэлектрическим приемником излучения [13].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления растворов применяли UO2C2O4 ∙ 3H2O, полученный взаимодействием UO2(NO3)2 ∙ 6H2O (98%, Panreac) с H2C2O4 ∙ 2H2O (99.5%, Riedel-de Haen) [14]. Исходный актинометрический раствор (pH 1.6) имел следующий состав: [${\text{UO}}_{2}^{{2 + }}$] = 0.01 моль/л и [C2${\text{O}}_{4}^{{2 - }}$] = 0.05 моль/л. Концентрация оксалат-ионов в актинометре определялась титрованием 0.1 Н KMnO4. Оптические спектры поглощения регистрировались с помощью двулучевого спектрофотометра LEKI SS2110UV. Для приготовления водных растворов исследуемых соединений использовали дистиллированную воду при температуре 22 ± 1°С. Эксперименты повторяли по 3 раза для достижения минимальной ошибки измерений и проверки воспроизводимости результатов.
Источником излучения послужила импульсная ксеноновая лампа с межэлектродным расстоянием 120 мм и внутренним диаметром 5 мм, работавшая в разрядном контуре с частотой следования импульсов 3.3 Гц и средней потребляемой мощностью 200 Вт. Излучательные характеристики регистрировались с помощью спектрометра AvaSpec-ULS2048-USB2.
В качестве объекта облучения использовался актинометрический раствор объемом 85 мл, помещенный в чашку Петри с внутренним диаметром 104 мм, что соответствовало облучаемому слою толщиной 10 мм. Лабораторный макет представлял собой закрытый бокс с размещенной внутри ИКЛ, расположенной на высоте 207 мм от центра дна чашки Петри. Геометрические размеры системы подобраны с целью возможности применения приближения квазиколлимированного пучка при анализе фотохимических процессов. Для предотвращения возможного нагрева дозиметрических растворов при длительном облучении использовалась проточная система вентилирования воздуха.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 показаны оптические спектры поглощения водных растворов ${\text{UO}}_{2}^{{2 + }}$ и ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ при длине оптического пути 10 мм. Видно, что при соотношении [${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$]/[${\text{UO}}_{2}^{{2 + }}$] = 5 поглощение в области 300–500 нм обусловлено в основном уранил-ионами.
Рис. 1.
Спектральная зависимость коэффициента поглощения растворов. Состав: 1 – 1 × 10–2 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × × 10–2 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }};$ 2 – 1 × 10–3 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × 10–3 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }};$ 3 – 1 × 10–4 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × 10–4 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ и 4 – 5 × 10–2 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}.$
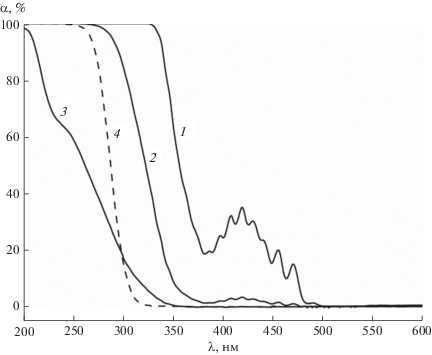
Предполагается, что поглощение фотонов актинометрическим раствором осуществляется комплексами U(VI) с оксалат-ионами. Возможными фоточувствительными соединениями являются следующие комплексы [15]: UO2C2O4, ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{\text{H}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{ + },$ UO2(HC2O4)2, ${\text{U}}{{{\text{O}}}_{{\text{2}}}}{{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 + }}$ и ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}}} \right)_{2}^{{2 - }}.$ В диапазоне pH от 1 до 7 в основном преобладают UO2C2O4 и ${\text{U}}{{{\text{O}}}_{{\text{2}}}}\left( {{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}}} \right)_{2}^{{2 - }},$ которые имеют максимальные поглощательные свойства.
Фотохимическое разложение оксалат-ионов в присутствии ионов уранила можно описать следующим стехиометрическим уравнением [16]:
(1)
$\begin{gathered} {\text{UO}}_{2}^{{2 + }} + {{{\text{H}}}_{{\text{2}}}}{{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {\text{h}}\nu \to \\ \to \,\,{\text{UO}}_{2}^{{2 + }} + {\text{C}}{{{\text{O}}}_{2}} + {\text{CO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}. \\ \end{gathered} $Авторами работы [15] был предложен и обоснован механизм фотолиза уранилоксалатных комплексов, согласно которому первичной реакцией является перенос электронов от оксалатного лиганда к U(VI) с образованием CO2 и U(V):
(2)
${{{\text{O}}}_{{\text{2}}}}{\text{U}}\left( {{\text{VI}}} \right){{{\text{C}}}_{{\text{2}}}}{{{\text{O}}}_{4}} + {\text{h}}\nu \to {{{\text{O}}}_{{\text{2}}}}{\text{U}}\left( {\text{V}} \right){\text{OCO}} + {\text{C}}{{{\text{O}}}_{2}}.$Вторичная реакция представляет собой согласованный внутрисферный перенос электрона в комплексе O2U(V)OCO с участием протона из воды:
(3)
$\begin{gathered} {{{\text{O}}}_{{\text{2}}}}{\text{U}}\left( {\text{V}} \right){\text{OCO}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} \to \\ \to \,\,\left[ {{{{\text{O}}}_{{\text{2}}}}{\text{U}}\left( {{\text{VI}}} \right){\text{OOC}}{{{\text{H}}}^{{\text{ + }}}}} \right]{\text{*}} + {\text{O}}{{{\text{H}}}^{ - }}. \\ \end{gathered} $Монооксид углерода образуется при низких pH в реакции протонирования и последующего распада углерод-кислородной связи комплекса U(VI) в возбужденном состоянии:
(4)
$\begin{gathered} \left[ {{{{\text{O}}}_{{\text{2}}}}{\text{U(VI)OOC}}{{{\text{H}}}^{ + }}} \right]{\text{*}} + {{{\text{H}}}^{ + }} \to \\ \to \,\,{{{\text{O}}}_{{\text{2}}}}{\text{U(VI)O}}{{{\text{H}}}^{ + }} + {\text{HC}}{{{\text{O}}}^{ + }}. \\ \end{gathered} $Ион HCO+ быстро разлагается на оксид углерода(II) и ион водорода. В отсутствие достаточного количества протонов возбужденные комплексы U(VI) (реакция 4) теряют свою избыточную энергию, предположительно образуя формиат-ионы в качестве продуктов фотохимической реакции.
Особенностью уранилоксалатного дозиметра является то, что при его применении практически не происходит изменения концентрации ${\text{UO}}_{2}^{{2 + }}.$ То есть, уранил-ион катализирует фотохимический распад оксалат-ионов, практически не претерпевая при этом химического превращения (реакция 1), что является одним из основных достоинств актинометра, определивших его использование. Действительно, в ходе проведения исследований даже при разложении 50% оксалат-ионов изменение оптической плотности раствора не превышало 2%.
По зарегистрированным спектрам поглощения актинометрического раствора с различной концентрацией оксалата и уранила при соотношении [${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$]/[${\text{UO}}_{2}^{{2 + }}$] = 5 была построена спектральная зависимость молярного десятичного коэффициента поглощения (рис. 2). Согласно исследованиям, проведенным в работе [17], отношение концентраций оксалат-ионов и ионов уранила существенно влияет на интенсивность поглощения в видимой части спектра, а при его увеличении наблюдается “красный” сдвиг полос поглощения.
Рис. 2.
Зависимость молярного коэффициента поглощения уранилоксалатного актинометра ([${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$]/[${\text{UO}}_{2}^{{2 + }}$] = 5) от длины волны.
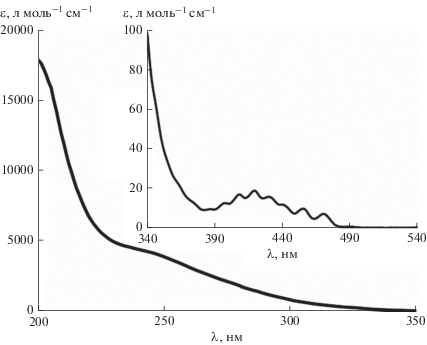
Используя полученную зависимость молярного коэффициента поглощения от длины волны, можно определить число поглощенных фотонов (Эйнштейн/нм):
(5)
${{N}_{{{abs,\lambda }}}}\left( \lambda \right) = {{N}_{{{ref,\lambda }}}}\left( \lambda \right)K\left( {1 - {{{10}}^{{ - \varepsilon \left( \lambda \right)lC}}}} \right)S,$Квантовый выход процесса (отношение числа распавшихся ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ к числу поглощенных фотонов) в области длин волн от 200 до 460 нм изменяется от 0.49 до 0.61 [16, 18]. Для полихроматического излучения с достаточной степенью точности можно принять квантовый выход равным 0.55 для каждого поглощенного фотона. При этом согласно предварительным вычислениям учет спектральной зависимости квантового выхода вносит незначительное влияние на обработку результатов измерений (менее 5%).
Убыль оксалат-ионов (моль) с учетом спектрального распределения квантового выхода процесса рассчитывается по формуле:
(6)
${{n}_{{ox}}} = \frac{{\int\limits_{200}^{460} {{{N}_{{{abs,\lambda }}}}} \left( \lambda \right){\gamma }\left( \lambda \right)d\lambda }}{{{{N}_{{\text{A}}}}}},$Количество разложившихся оксалат-ионов определялось по разности между количествами перманганата калия, необходимых для титрования эквивалентных количеств облученного и необлученного актинометрических растворов. Для повышения точности метода использовались времена экспозиции, при которых количество разложившихся ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$ составляло от 10 до 30% от исходного содержания в растворе. На рис. 3 показана зависимость убыли оксалат-ионов от числа импульсов ксеноновой лампы. Наличие линейной зависимости (скорректированный R2 равен 0.998) подтверждает строго пропорциональную взаимосвязь числа поглощенных фотонов с убылью ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}.$
Рис. 3.
Зависимость убыли оксалатов от числа импульсов лампы при облучении актинометрических растворов. Состав: 1 – 1 × 10–2 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × × 10–2 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }};$ 2 – 1 × 10–3 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × × 10–3 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}.$
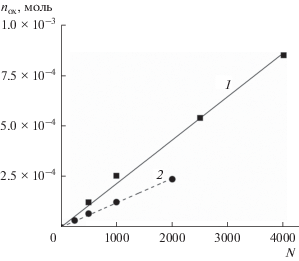
Используя формулы (5) и (6) и экспериментально определив убыль оксалат-ионов, можно вычислить коэффициент пропорциональности фотохимической системы, характеризующий число пришедших на поверхность раствора квантов при известном спектральном распределении испускаемых источником полихроматического излучения фотонов.
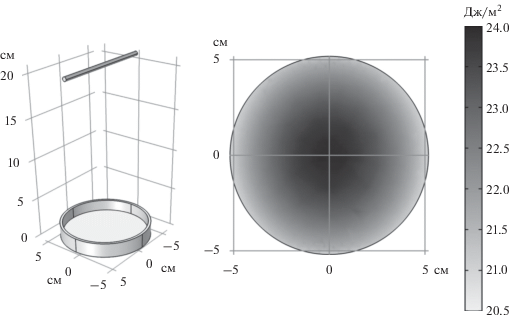
Для верификации методики было проведено сравнение результатов, полученных с помощью уранилоксалатной актинометрии, с измерением по методике с калиброванным фотоэлектрическим приемником излучения UV Sensor TOCON-probe [13] и расчетом облученности различными методами. Для этого было выполнено численное моделирование распространения излучения от лампы (рис. 4). Модель также проверялась аналитическим расчетом, предложенным в работе [19].
Рис. 4.
Геометрическое представление источника излучения и чашки Петри в модели и результаты численного расчета энергетической экспозиции за один импульс в диапазоне длин волн от 200 до 400 нм на поверхности раствора.
Относительное спектральное распределение излучаемых фотонов (Nref,λ) исследуемой импульсной ксеноновой лампы и распределение числа пришедших на поверхность раствора фотонов – фотонной экспозиции (Nir,λ), полученное с помощью актинометрии, приведены на рис. 5. Результаты усредненного значения фотонной экспозиции в диапазоне длин волн от 200 до 400 нм, определенной различными методами, обобщены в табл. 2.
Рис. 5.
Спектральные распределения испускаемых импульсной ксеноновой лампой фотонов и фотонной экспозиции на поверхности раствора.
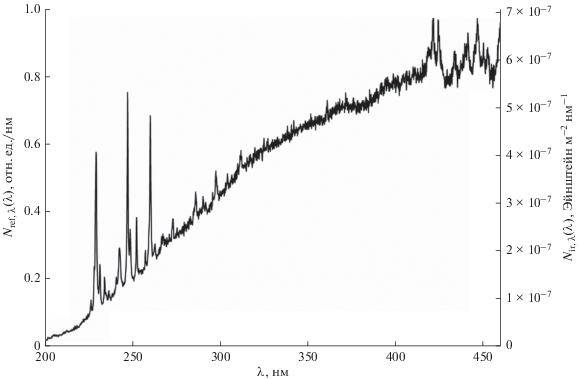
Таблица 2.
Сравнение результатов актинометрии с другими методами
| Метод | Фотонная экспозиция (200–400 нм), Эйнштейн/м2 |
|---|---|
| Уранилоксалатная актинометрия (1 × 10–2 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × 10–2 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$) |
5.7 × 10–5 |
| Уранилоксалатная актинометрия (1 × 10–3 моль/л ${\text{UO}}_{2}^{{2 + }}$ + 5 × 10–3 моль/л ${{{\text{C}}}_{{\text{2}}}}{\text{O}}_{4}^{{2 - }}$) |
6.2 × 10–5 |
| Измерение по методике [11] и численный расчет | 6.0 × 10–5 |
| Измерение по методике [11] и аналитический расчет | 5.9 × 10–5 |
Результаты, полученные с помощью уранилоксалатного дозиметра, отличаются от измерения с помощью физического метода и расчета не более чем на 5%. Используя результаты расчетов, был установлен поток испускаемых лампой фотонов в спектральном диапазоне от 200 до 400 нм, который с учетом режима работы составлял 7.5 × 10–5 Эйнштейн/с. При этом энергия излучения лампы за один импульс в данном диапазоне равняется 9.3 Дж.
Применение уранилоксалатной актинометрии позволяет получить информацию о спектральном распределении энергетической и фотонной экспозиции от источника полихроматического излучения в стационарной фотохимической системе, не используя численные расчеты. Результаты, полученные при использовании актинометрии с различными концентрациями, но при одинаковом молярном отношении реагентов, коррелируют с измерением и расчетами. Согласно проведенным исследованиям, уранилоксалатный актинометр можно рекомендовать для измерения характеристик источников излучения сплошного спектра как в стационарных, так и проточных фотохимических системах. Также одним из вариантов возможного применения дозиметра является его использование при калибровке физических устройств регистрации параметров излучения.
Список литературы
Legrini O., Oliveros E., Braun A.M. // Chem. Rev. 1993. V. 93. № 2. P. 671.
Litter M.I. // Environmental Photochemistry Part II. The Handbook of Environmental Chemistry (eds.: Boule P., Bahnemann D.W., and Robertson P.K.J.). V. 2M. Springer, Berlin, Heidelberg. 2005. P. 325.
Камруков А.С., Козлов Н.П., Селиверстов А.Ф. и др. // Безопасность в техносфере. 2006. № 1. С. 38.
Gómez-López V.M., Ragaert P., Debevere J., Devlieg-here F. // Trends in Food Science & Technology. 2007. V. 18. № 9. P. 464.
Benchea R.E., Cretescu I., Kalinowski S., Koronkie-wicz S. // Anal. Methods. 2013. V. 5. P. 3650.
Casado C., Marugán J., Timmers R. et al. // Chem. Eng. J. 2017. V. 310. P. 368.
Kuhn H.J., Braslavsky S.E., Schmidt R. // Pure Appl. Chem. 2004. V. 76. № 12. P. 2105.
Zimmerman G., Chow L.-Y., and Paik U.-J. // J. Am. Chem. Soc. 1958. V. 80. P. 3528.
Esplugas S., Gimenez J., Contreras S. et al. // Water Research. 2002. V. 36. P. 1034.
Bayarri B., Illana E., Curcó D. et al. // Water Science & Technology. 2007. V. 55. № 12. P. 147.
Panich N.M., Seliverstov A.F., Ershov B.G. // Russian J. Applied Chemistry. 2008. V. 81. № 12. P. 2104.
Bolton J.R., Mayor-Smith I., Linden K.G. // Photochemistry and Photobiology. 2015. V. 91. № 6. P. 1252.
Киреев С.Г., Архипов В.П., Шашковский С.Г., Козлов Н.П. // Фотоника. 2017. Т. 68. № 8. С. 48.
Jayadevan N.C., Chackraburtty D.M. // Acta Cryst. 1972. V. B28. № 11. P. 3178.
Heidt L.J., Tregay G.W., Middleton F.A. Jr. // The J. Physical Chemistry. 1970. V. 74. № 9. P. 1876.
Curcó D., Malato S., Blanco J., Giménez J. // Solar Energy Materials and Solar Cells. 1996. V. 44. P. 199.
Havel J., Soto-Guerrero J., Lubal P. // Polyhedron. 2002. V. 21. № 14–15. P. 1411.
Leighton W.G., Forbes G.S. // J. Am. Chem. Soc. 1930. V. 52. № 8. P. 3139.
Kowalski W. // Ultraviolet Germicidal Irradiation Handbook. Springer, Berlin, Heidelberg. 2009. 501 p.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


