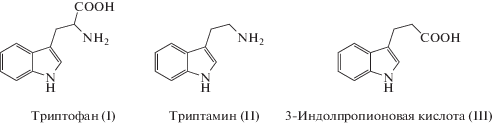
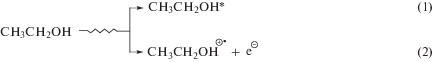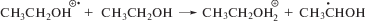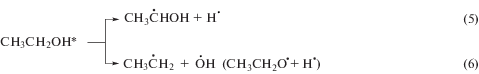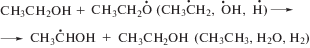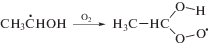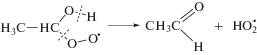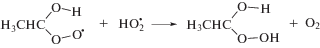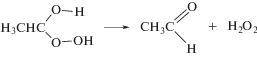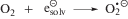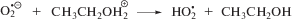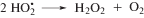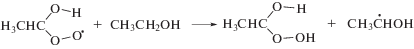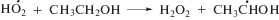Химия высоких энергий, 2019, T. 53, № 6, стр. 478-483
Радиационно-индуцированные превращения триптофана и его производных в оксигенированном этаноле
С. Д. Бринкевич a, Д. А. Кузьмук a, Р. Л. Свердлов a, О. И. Шадыро a, *
a Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Беларусь
* E-mail: shadyro@tut.by
Поступила в редакцию 10.05.2019
После доработки 07.06.2019
Принята к публикации 18.06.2019
Аннотация
Методом стационарного радиолиза исследовано взаимодействие триптофана, триптамина и 3-индолпропионовой кислоты с пероксильными радикалами, образующимися при радиолизе насыщенного кислородом этанола. Установлено, что 3-индолпропионовая кислота обладает низкой реакционной способностью по отношению к пероксильным радикалам. В то время как триптамин и, в меньшей степени, триптофан ингибируют радиационно-индуцированные процессы окисления этанола за счет переноса электрона с неподеленной пары аминогруппы на кислородцентрированные радикалы. Образующиеся в этих реакциях катион-радикалы триптофана и триптамина преимущественно регенерируются до исходных соединений при взаимодействии с ${\text{O}}_{2}^{{\centerdot - }}$ и ${\text{HO}}_{2}^{\centerdot },$ о чем свидетельствуют невысокие радиационно-химические выходы разложения тестируемых соединений.
ВВЕДЕНИЕ
Триптамин, серотонин, мелатонин, мексамин и др. производные триптофана обладают выраженными радиопротекторными, антиоксидантными, нейропротекторными свойствами [1]. Молекулярные механизмы, лежащие в основе их физиологической активности, являются предметом интенсивного изучения. Известно, что за формирование радиопротекторных свойств могут быть ответственны сосудосуживающие свойства производных триптофана, что приводит к снижению парциального давления кислорода в тканях [2]. Кроме того, они способны подавлять радиационно-индуцированные повреждения в биологических системах за счет эффективного взаимодействия с радикальными продуктами радиолиза воды [3]. Однако при соотношении максимально переносимых концентраций производных триптофана к усредненным концентрациям органических соединений в клетках становится очевидным, что индолсодержащие соединения в организме экспериментальных животных не способны выиграть конкуренцию за радикальные продукты радиолиза воды. В этих условиях их радиопротекторные и антиоксидантные свойства могут быть обусловлены взаимодействием с углерод- и кислородцентрированными радикалами биогенных органических соединений.
Ранее мы показали [4], что синтезируемые in vivo производные триптофана эффективно ингибируют процессы с участием углеродцентрированных радикалов. При этом триптофан, 5-гидрокситриптофан, серотонин и в меньшей степени мелатонин способны присоединять α‑гидроксиэтильные радикалы (α-ГЭР) по индольному фрагменту, в то время как β-карболиновые алкалоиды подавляют рекомбинацию α‑ГЭР за счет их окисления. Отдельные производные триптофана также эффективно подавляют процессы с участием кислородцентрированных радикалов, причем активность может быть связана как с наличием фенольного гидроксила [5], так и с незамещенной аминогруппой [6].
В то же время в литературе описаны [7, 8] выраженные антиоксидантные свойства 3-индолпропионовой кислоты, которая не имеет ни одного из этих функциональных фрагментов. В работах [9, 10] показаны перспективы использования 3-индолпропионовой кислоты для профилактики нейродегенеративных заболеваний и сахарного диабета второго типа, в развитии которых важную роль играют свободнорадикальные реакции. Это обусловливает необходимость исследования механизма взаимодействия 3-индолпропионовой кислоты с кислородцентрированными радикалами.
В настоящей работе методом стационарного радиолиза изучено взаимодействие триптофана, триптамина и 3-индолпропионовой кислоты с пероксильными радикалами, образующимися при радиолизе этанола, насыщенного кислородом.
МЕТОДИКА ЭКСПЕРИМЕНТА
Без предварительной очистки использовали триптофан (I), триптамин (II) и 3-индолпропионовую кислоту (III), гидроксид натрия фирмы “Sigma-Aldrich”, TiOSO4 · 2H2O “Вектон”, (NH4)6Mo7O24 · · 4H2O, иодид калия, гидрофталат калия “Беллесхимкомплект”. Чистота использованных соединений составляла не менее 98%. Спирт этиловый пищевой марки “Люкс” (96 об. %) перед использованием очищали перегонкой на ректификационной колонне.
Для приготовления оксигенированных растворов тестируемых соединений в этаноле с концентрацией 5 × 10–4 моль/л использовали следующую методику. В силу высокой летучести растворителя растворы продували кислородом высокой степени чистоты (99.999%) в мерных колбах в течение 60 мин, после чего объем испарившегося растворителя компенсировали оксигенированным этанолом, далее растворы перемешивали. Предварительно продутые кислородом пенициллиновые флаконы заполняли растворами и закрывали пластиковыми крышками. По нашим наблюдениям использование флаконов для радиационно-химических превращений органических веществ, насыщенных кислородом, имеет ряд преимуществ перед ампулами. В частности, концентрация O2 в растворе в меньшей степени изменяется по ходу облучения, кроме того исключаются артефакты, связанные с выгоранием (иногда с детонацией) кислорода при запайке ампул.
Облучение образцов проводили на установке МРХ-γ-25М с источником 60Co. Мощность поглощенной дозы составляла 0.113 ± 0.007 Гр/с. Интервал поглощенных доз 0.07–0.38 кГр.
Концентрацию пероксида водорода определяли реагентнофотометрическим методом аналогично [11]. Детектирование желтого комплекса пероксида водорода с сульфатом титанила в сернокислом растворе выполняли при λmax = 405 нм на Specord S600 (Analytik Jena, Германия). Суммарную концентрацию органических и неорганических пероксидов определяли реагентнофотометрическим методом, основанным на молибдат-активированном окислении иодида [12]. Предварительно готовили раствор, содержащий 0.2 г NaOH, 0.02 г (NH4)6Mo7O24 · 4H2O, 6.6 г KI в 100 мл дистиллированной воды, а также 2% водный раствор гидрофталата калия. Непосредственно перед анализом пероксидов растворы смешивали в соотношении 1 : 1 для приготовления аналитического реагента. Для количественного определения суммы пероксидов к 1.2 мл исследуемой пробы добавляли 2 мл реагента и 4 мл дистиллированной воды. Оптическую плотность измеряли на Specord S600 при длине волны максимума поглощения трииодид-аниона – 350 нм.
Количественный анализ соединений (I), (II) проводили методом высокоэффективной жидкостной хроматографии на хроматографе “Shimadzu” (Япония) с использованием детектора на диодной матрице SPD-M20A при длине волны 281 нм. Условия хроматографирования: колонка Shim-pack VP-ODS (длина – 150 мм, внутренний диаметр – 4.6 мм, размер зерен – 4.6 мкм); элюент – метанол/вода (10/90); скорость подачи элюента 0.4 мл/мин; температура 25°С; объем вводимой пробы – 1 мкл, 3-индолпропионовую кислоту (III) анализировали спектрофотометрическим методом на Specord S600 при длине волны 281 нм.
Концентрацию ацетальдегида (АА) определяли аналогично [13] на газовом хроматографе GC-17A фирмы “Shimadzu” с кварцевой капиллярной колонкой SupelcoWAX (длина 30 м, внутренний диаметр – 0.25 мм, толщина пленки неподвижной фазы – 0.5 мкм). Качественный и количественный анализ проводили с помощью внешнего стандарта. Условия анализа: начальная температура – 40°С, с градиентом 5°С/мин подъем температуры до 80°С и затем с градиентом 15°С/мин – до 180°С; температура инжектора – 240°С; температура детектора – 220°С; линейная скорость потока в колонке – 20 см/с; газ-носитель – азот; детектор – пламенно-ионизационный; объем задаваемой пробы – 1 мкл.
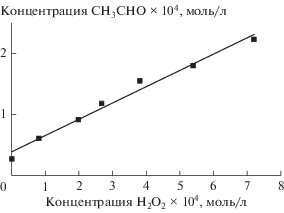
Для улучшения коэффициента разделения легколетучих продуктов радиационно-индуцированных превращений насыщенного кислородом этанола использовали относительно высокую температуру инжектора, что приводило к термическому разложению пероксида водорода, содержащегося в исследуемых образцах. Зависимость регистрируемой концентрации ацетальдегида от содержания пероксида водорода в необлученном этаноле была линейная в используемом диапазоне концентраций H2O2 (рис. 1). Приведенные в работе значения радиационно-химического выхода ацетальдегида указаны за вычетом количеств, образующихся при термическом разложении.
Рис. 1.
Образование ацетальдегида при термическом разложении пероксида водорода в инжекторе хроматографа.
Для получения величин радиационно-химических выходов использовали результаты не менее трех независимых экспериментов. Значение ошибки определения радиационно-химических выходов рассчитывали в программе Origin 8.1 Pro методом наименьших квадратов с использованием коэффициента доверительной вероятности 0.95.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Радиационно-химические превращения этанола, насыщенного кислородом, детально исследованы [14], что делает его удобной и доступной моделью для изучения реакций кислородцентрированных радикалов с тестируемыми веществами. Основным радикальным продуктом радиолиза деаэрированного этанола является α-ГЭР, образующийся с радиационно-химическим выходом ~5.5 частиц/100 эВ в результате реализации ион-молекулярной реакции (4), радикал-молекулярных процессов (7) и непосредственно при распаде возбужденной молекулы спирта (5):
Как и большинство других углеродцентрированных радикалов α-ГЭР с константой скорости реакции 4.6 × 109 л моль–1 с–1 [15] присоединяют молекулярный кислород с образованием α-гидроксиэтилпероксильных радикалов по реакции (8). Дальнейшие превращения этих частиц включают фрагментацию с элиминированием гидропероксильных радикалов (реакция (9)) или восстановление до соответствующего органического гидропероксида по реакции (10).
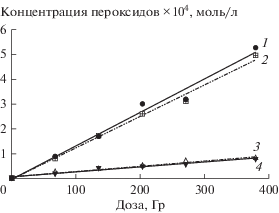
В этаноле α-гидроксиэтилпероксид распадается на ацетальдегид и пероксид водорода (реакция (11)). Представленные на рис. 2 графики изменения концентрации Н2О2 (титанильный метод анализа) и суммы пероксидов (иодный метод) от дозы при облучении насыщенного кислородом этанола без добавок и в присутствии триптамина различаются менее чем на 5%. Таким образом, органические пероксиды не детектируются в качестве конечных молекулярных продуктов радиолиза насыщенного кислородом этанола.
Рис. 2.
Зависимости концентрации пероксидов, измеренных иодным (1, 4) и титанильным (2, 3) методами, от поглощенной дозы при облучении этанола без добавок (1, 2) и в присутствии триптамина (3, 4).
Насыщение этанола кислородом также приводит к исключению сольватированного электрона из состава радикальных продуктов радиолиза вследствие реализации реакции (12) с константой скорости реакции 2 × 1010 л моль–1 с–1 [3]. Конечным молекулярным продуктом превращения ${\text{O}}_{2}^{{\centerdot - }}$ и ${\text{HO}}_{2}^{\centerdot }$ является пероксид водорода.
Таким образом, основными продуктами радиационно-индуцированных превращений этанола, насыщенного кислородом, являются ацетальдегид и пероксид водорода.
Радиационно-химические выходы ацетальдегида и пероксида водорода, наблюдаемые при радиолизе оксигенированного этанола в отсутствие добавок (табл. 1) превышают первичный выход α‑ГЭР более чем в 2 раза. Это свидетельствует о том, что окисление этанола происходит по короткоцепному механизму вследствие протекания следующих реакций:
Таблица 1.
Влияние триптофана и его производных на радиационно-индуцированные превращения насыщенного кислородом этанола
| Тестируемое соединение |
Радиационно-химический выход (G), молекула/100 эВ | ||
|---|---|---|---|
| Ацетальдегид | H2O2 | Разложение добавки | |
| Без добавок | 16.18 ± 1.09 | 14.23 ± 1.37 | – |
| Триптофан (I) | 11.48 ± 0.73 | 9.53 ± 0.51 | –0.46 ± 0.09 |
| Триптамин (II) | 8.85 ± 0.60 | 3.01 ± 0.41 | –1.22 ± 0.12 |
| 3-Индолпропионовая кислота (III) | 14.90 ± 1.28 | 12.72 ± 0.70 | –0.16 ± 0.15 |
Поскольку концентрации исследуемых веществ (I–III) в растворе составляли 5 × 10–4 моль/л, реакциями исследуемых соединений с Н•, алкильными, гидроксиалкильными и алкоксильными радикалами, образующимися при радиолизе этанола, можно пренебречь. Соответственно, наблюдаемые изменения радиационно-химических выходов основных продуктов радиолиза насыщенного кислородом этанола (табл. 1) в присутствии соединений (I–III) связаны с их способностью взаимодействовать с пероксильными радикалами, образующимися в реакциях 8, 9, 12, 13.
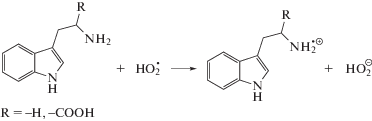
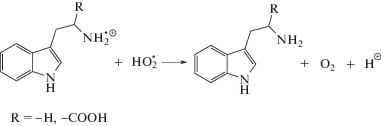
При облучении насыщенного кислородом этанола в присутствии триптофана (I) и триптамина (II) происходит снижение радиационно-химических выходов основных молекулярных продуктов радиолиза, что свидетельствует о способности тестируемых веществ регулировать процессы с участием кислородцентрированных радикалов. При этом в случае 3-индолпропионовой кислоты (III), не имеющей аминогруппы в отличие от соединений (I) и (II), снижение радиационно-химических выходов ацетальдегида и пероксида водорода по сравнению с системой без добавок не превышает величины погрешности измерения этих величин. Следовательно, за взаимодействие с пероксильными радикалами ответственна именно аминогруппа триптофана (I) и триптамина (II), а не индольный фрагмент в структуре тестируемых веществ.
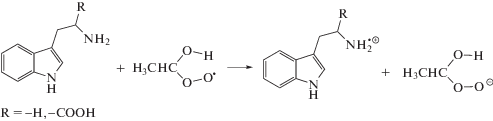
Ранее было показано, что депротонированная аминогруппа может выступать донором электрона в реакциях аминокислот с различными кислородцентрированными радикалами [4, 16, 17]. Взаимодействие триптофана (I) и триптамина (II) с пероксильными радикалами может происходить по следующим реакциям:
Восстановление пероксильных радикалов по реакциям (17)–(18) приводит к терминации короткоцепного процесса окисления этанола, что и обуславливает снижение выходов основных продуктов радиолиза оксигенированного этанола в присутствии триптофана (I) и триптамина (II). Различия в реакционной способности рассматриваемых соединений могут быть связаны с тем, что триптофан (I) в этаноле частично находится в цвиттер-ионной форме, и протонированная аминогруппа не способна восстанавливать пероксильные радикалы.
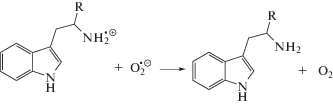
Невысокие радиационно-химические выходы разложения триптофана (I) и триптамина (II) при радиолизе в оксигенированном этаноле указывают на способность катион-радикалов, образующихся в реакциях (17)–(18), восстанавливаться до исходных соединений. К регенерации триптофана (I) и триптамина (II) могут приводить реакции их катион-радикалов с супероксид анион-радикалами и гидропероксильными радикалами:
Представленные в работе результаты могут свидетельствовать о том, что радиопротекторные, антиоксидантные, антигипоксантные свойства триптамина (II), наблюдаемые in vivo, могут быть связаны с его способностью эффективно подавлять процессы с участием кислородцентрированных радикалов пероксильного типа. В то же время 3-индолпропионовая кислота (III) обладает низкой реакционной способностью по отношению к пероксильным радикалам, поэтому ее антиоксидантные и нейропротекторные свойства могут быть связаны или с акцептированием •OH (k = 7.8 × 1010 л моль–1 с–1 [7]), или с присоединением углеродцентрированных радикалов по индольному фрагменту.
ВЫВОДЫ
Сопоставление полученных в работе данных свидетельствует о том, что триптамин (II) и, в меньшей степени, триптофан (I) ингибируют радиационно-индуцированные процессы окисления этанола, что связано с наличием у этих соединений непротонированной аминогруппы. Значения радиационно-химических выходов продуктов радиолиза насыщенного кислородом этанола в присутствии 3-индолпропионовой кислоты (III) лишь в пределах ошибки эксперимента ниже по сравнению с системой без добавок. Таким образом, антиоксидантные и радиопротекторные свойства триптофана (I) и триптамина (II) могут быть обусловлены способностью этих соединений восстанавливать кислородцентрированные радикалы за счет переноса электрона с неподеленной пары аминогруппы. Образующиеся в этой реакции катион-радикалы преимущественно восстанавливаются до исходных соединений, о чем свидетельствуют невысокие радиационно-химические выходы разложения исследуемых веществ. К регенерации триптофана (I) и триптамина (II) могут приводить реакции их катион-радикалов с супероксид анион-радикалами и гидропероксильными радикалами.
Список литературы
Halliwell B., Gutteridge J.M.C. Free radicals in biology and medicine. Oxford: University press, 1999.
Straube R.L., Patt H.M. // Annu. Rev. Pharmacol. 1963. V. 3. P. 293.
Buxton G.V., Greenstock C.L., Helman W.P., Ross A.B. // J. Phys. Chem. Ref. Data. 1988. V. 17. № 2. P. 513.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Free radical research. 2014. V. 48. № 10. P. 1200.
Galano A., Castaneda-Arriada R., Perez-Gonzalez A., Tan D.-X., Reiter R.J. // Molecules. 2016. V. 21. № 11. P. 1442.
Свердлов Р.Л., Хрищанович А.В., Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2015. Т. 49. № 2. С. 89.
Poeggeler B., Pappolla M.A., Hardeland R., Rassoulpour A., Hodgkins P.S., Guidetti P., Schwarcz R. // Brain Res. 1999. V. 815. № 2. P. 382.
Chyan Y.-J., Poeggeler B., Omar R.A., Chain D.G., F-rangione B., Ghiso J., Pappolla M.A. // J. Biol. Chem. 1999. V. 274. № 31. P. 21937.
De Mello V.D., Paananen J., Lindstrom J., Lankinen M.A., Shi L., Kuuisto J., Pihlajamaki J., Auriola S., Lehtoten M., Rolandsson O., Bergdahl I.A., Nordin E., Ilanne-Parikka P., Keinanen-Kuikaanniemi S., Landberg R., Eriksson J.G., Tuomilento J., Hanhineva K., Uusitupa M. // Scientific reports. 2017. V. 7. № 46337.
Behdheim P.E., Poeggeler B., Neria E., Ziv V., Pappolla M.A., Chain D.C. // J. Mol. Neurosci. 2002. V. 19. P. 213.
Бринкевич С.Д. // Химия высоких энергий. 2015. Т. 49. № 2. С. 83.
Allen A.O., Hochanadel C.J., Ghormley J.A., Davis T.W. // J. Phys. Chem. 1952. V. 56. № 5. P. 575.
Бринкевич С.Д., Малиборский А.Я., Капусто И.А., Свердлов Р.Л., Григорьев Ю.В., Ивашкевич О.А., Шадыро О.И. // Химия высоких энергий. 2019. Т. 53. № 2. С. 140.
Freeman G.R. // Radiation chemistry of ethanol: a review of data on yields, reaction rate parameters, and spectral properties of transients / Washington: NBS, 1974.
Adams G.E., Willson R.L. // Trans. Faraday Soc. 1969. V. 65. P. 2981.
Sviardlou R.L., Brinkevich S.D., Shadyro O.I. // Free Radic. Biol. Med. 2017. V. 108. № 1. P. S38.
Sverdlov R.L., Brinkevich S.D., Shadyro O.I. // Radiat. Phys. Chem. 2014. V. 98. P. 77.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий