Химия высоких энергий, 2019, T. 53, № 6, стр. 441-447
Фотоперенос электрона в системе эозин–европий–кукурбит[6–8]урилы в воде
Т. В. Федотова a, b, Г. В. Захарова a, *, В. Н. Гутров a, А. К. Чибисов a, b, **
a Центр фотохимии РАН, Федеральное государственное учреждение “Федеральный научно-исследовательский центр “Кристаллография и фотоника“ Российской академии наук”
119421 Москва, Россия
b Московский физико-технический институт (государственный университет)
141701 Московская обл., Россия
* E-mail: gvzakharova@gmail.com
** E-mail: alexander.chibisov@gmail.com
Поступила в редакцию 15.05.2019
После доработки 05.06.2019
Принята к публикации 19.06.2019
Аннотация
Исследовали тушение триплетного состояния эозина европием(III) в воде в отсутствие и в присутствии кукурбит[6–8]урилов по данным фосфоресценции и триплет-триплетного поглощения в водном обескислороженном растворе при комнатной температуре. Тушение обусловлено фотопереносом электрона с эозина на европий, а также на его комплексы с кукурбит[6–8]урилами. Значение константы скорости тушения фосфоресценции эозина европием в отсутствие кавитандов составляет 1.9 × 106 л моль–1с–1, а в присутствии КБ6, КБ7 и КБ8 значения констант скорости возрастает до 2.1, 2.2 и 2.6 × 106 л моль–1 с–1 соответственно. Одновременно с уменьшением времени жизни молекулы эозина в триплетном состоянии наблюдали увеличение выхода полуокисленной формы эозина, как продукта фотопереноса электрона. Было также показано, что при увеличении концентрации КБ7 и КБ8 константа скорости тушения возрастает в 2 раза. Различие в значениях констант скорости тушения может быть обусловлено тем, что выступающий в качестве тушителя европий присутствует в виде комплексов с кукурбит[6–8]урилами различного состава.
Ионы металлов часто выступают в качестве реагентов окислительно-восстановительных фотореакций, а также в качестве доноров и акцепторов энергии. Так, ранее нами было показано, что аква-ионы ${\text{UO}}_{2}^{{2 + }},$ Cu1+, Cr3+, Со2+, Се+3, Мn+2, Fe+2, Fe+3, а также цианидные комплексы Fe2+, Ru2+, Fe3+, Co3+, Mo4+, W4+ вступают в реакцию переноса электрона с молекулой эозина в триплетном состоянии [1–6]. В последнее время значительное внимание уделяется изучению процессов молекулярной фотоники комплексов красителей с кавитандами и в частности с кукурбит[6–8]урилами [7, 8]. Особенностью кукурбит[6–8]урилов является их способность образовывать комплексы “гость–хозяин”. Формирование комплексов включения органических флуорофоров с кукурбитурилами обычно проявляется в значительном усилении флуоресценции [7, 9–15], а также сказывается на скорости темновой реакции цис → транс изомеризации [15] и реакции переноса электрона [16]. Кроме того, комплексообразование с кукурбитурилами повышает фотостабильность красителей, что является существенным при их использовании в качестве активных лазерных сред [17, 18]. Влияние кукурбитурилов проявляется также в увеличении времени жизни фотоизомеров тиакарбоцианина и индолениновых красителей [19–21]. Особенностью кукурбитурилов является их стимулирующее действие на процесс димеризации красителей. Было показано, что димеры 3,3'-диметил- и 3,3'-диэтилтиакарбоцианины образуют с кукурбит[8]урилом комплексы состава 2:1, способные к термически-активированной замедленной флуоресценции [22, 23]. Димеры 3,3'-диэтилтиакарбоцианина в триплетном состоянии, присутствующие в комплексе с кукурбит[8]урилом, вступают в реакцию переноса электрона с п-нитроацетофеноном [19, 22] с образованием катион-радикала димера. Наряду с переносом электрона комплексы полиметинов с кукурбит[7]урилом проявляют способность к триплет-триплетному переносу энергии. Так, комплекс тионина с кукурбит[7, 8]урилами выступает в качестве акцептора при переносе энергии от триплетной молекулы эозина [24]. Образование комплексов имеет место также для ионов щелочных, щелочноземельных металлов, а также лантаноидов с кукурбит[6, 7]урилами [25, 26]. Аквакомплексы щелочных и щелочноземельных металлов связываются с атомами кислорода карбонильных групп порталов кукурбит[6]урила, тогда как аквакомплексы лантаноидов связываются с макроциклом за счет прямой координации металла атомами кислорода, а также за счет водородных связей. Образование комплексов включения с кукурбитурилами оказывает влияние на окислительно-восстановительные свойства производных ферроцена и виологена [27, 28]. Следует отметить, что в литературе практически отсутствуют сведения о влиянии кукурбитурилов на реакцию фотопереноса электрона между красителями и аква-ионами металлов.
В настоящей работе приведены результаты сравнительного спектрально-кинетического изучения реакции одноэлектронного окисления европием(III) молекулы эозина в триплетном состоянии в воде как в отсутствие, так и в присутствии кукурбит[6–8]урилов. Выбор европия как представителя группы лантаноидов был обусловлен его способностью к образованию внешнесферных комплексов различного строения с кукурбит[6, 7]урилами, выступающими в качестве макролигандов [25, 26].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали Эозин Н, (динатриевая соль 2,4,5,7-тетрабромфлуоресцеин), нитрат европия Eu(NO3)3 ⋅ xH2O, кукурбит[6–8]урилы и гликолурил фирмы Aldrich. Измерения спектров поглощения и кинетики превращения промежуточных продуктов лазерного возбуждения эозина проводили на установке наносекундного лазерного фотолиза [20]. Тушение триплетного состояния эозина наблюдали как по сокращению времени фосфоресценции, так и по убыли полосы триплет-триплетного поглощения красителя при λ = 600 нм. Продукты одноэлектронного окисления и восстановления эозина регистрировали по спектрам поглощения при λ = 454 и λ = 410 нм соответственно. Спектры поглощения эозина в основном состоянии регистрировали на спектрофотометре Agilent 8453, спектры фосфоресценции измеряли на спектрофлуориметре Varian Cary Eclips. В качестве растворителя использовали воду, очищенную с помощью системы Direct–Q3 Millipore. Все измерения проводили с обескислороженными растворами при комнатной температуре. Удаление кислорода воздуха осуществляли путем продувки раствора аргоном. Концентрации красителя составляла (0.2 – 1) × 10–5 моль/л, концентрация кукурбит[6–8]урилов – 1 × 10–5–1 × 10–4 моль/л, концентрация гликоурила – 1 × 10–4 моль/л, концентрация европия – (1–6) × 10–3 моль/л.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Особенностью эозина (дианион, Эо2–) является его способность вступать в реакцию фотопереноса электрона с образованием полуокисленной и полувосстановленной форм в отсутствие экзогенных доноров и акцепторов электрона [29], а также способность к фосфоресценции в водных обескислороженных растворах при комнатной температуре [24]. В настоящей работе исследование фотопереноса электрона между эозином и европием проводили как по кинетике дезактивации триплетного состояния Эо2–, так и по кинетике тушения фосфоресценции красителя.
На первом этапе исследовали реакцию фотоокисления эозина аква-ионами европия. Известно, что молекула эозина способна к интеркомбинационному переходу в триплетное состояние с квантовым выходом φТ = 0.7 [29]. Эозин в триплетном состоянии (3Эо2–) образует полуокисленную (${\text{Э}}{{{\text{о}}}^{{--\centerdot }}},$ моноанион-радикал) и полувосстановленную (${\text{Э}}{{{\text{о}}}^{{3--\centerdot }}},$ трианион-радикал) формы в отсутствие экзогенных доноров и акцепторов электрона в результате реакции дисмутации (1) и концентрационного тушения (2) [29]
(1)
$^{3}{\text{Э}}{{{\text{о}}}^{{2--}}}~ + {{~}^{3}}{\text{Э}}{{{\text{о}}}^{2}}^{--}~ \to ~{\text{Э}}{{{\text{о}}}^{{3--\centerdot }}}~ + ~{\text{Э}}{{{\text{о}}}^{{--\centerdot }}},$(2)
$^{3}{\text{Э}}{{{\text{о}}}^{{2--}}}~ + {{~}^{1}}{\text{Э}}{{{\text{о}}}^{{2--}}}~ \to ~{\text{Э}}{{{\text{о}}}^{{3--\centerdot }}} + ~{\text{Э}}{{{\text{о}}}^{{--\centerdot }}}.$На рис. 1 приведены кинетические кривые образования полуокисленной (а) и полувосстановленной (б) форм эозина. Из рис. 1 следует, что форма кинетической кривой достижения максимума поглощения полуокисленной формы (1а) отличается от формы кривой достижения максимума поглощения полувосстановленной формы (1б). В последнем случае кривая состоит из двух компонентов, включающих первоначальный скачкообразный рост ΔА с последующим плавным увеличением значения ΔA, и является результатом наложения кинетических кривых триплет-триплетного поглощения и поглощения полувосстановленной формы эозина.
Рис. 1.
Кинетические кривые образования полуокисленной (а) и полувосстановленной (б) форм эозина (1 × 10–5 моль/л).
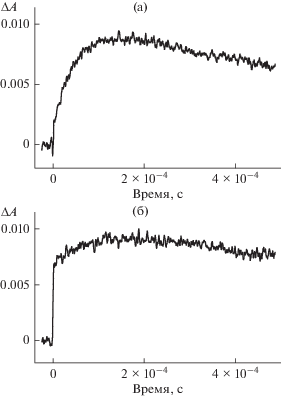
Перенос электрона с образованием полуокисленной формы эозина имеет место также между эозином в триплетном состоянии и гидратированным ионом европия (Eu3+). На рис. 2 приведены кинетические кривые изменения оптической плотности эозина в присутствии Eu3+ в воде.
Рис. 2.
Кинетические кривые дезактивации триплетного состояния эозина (1 × 10–5 моль/л) (а) в отсутствие (1) и в присутствии (2) Eu3+ (6 × 10–3 моль/л). Кинетика образования и гибели полуокисленной формы эозина (б) в присутствии Eu3+ (6 × 10–3 моль/л).
Из рис. 2а следует, что добавление Eu3+ к раствору эозина приводит как к росту величины ΔA, являющейся мерой относительного квантового выхода интеркомбинационного перехода в триплетное состояние φST, так и к сокращению времени жизни триплетного состояния эозина. Полученный результат может быть следствием двух причин. Согласно первой увеличение выхода триплетных молекул эозина имеет место в результате интеркомбинационной конверсии синглетной ион-радикальрной пары 1[Эо–•…Eu2+], образующейся при тушении флуоресценции, в триплетную ион-радикальныую пару 3[Эо–•…Eu2+], с ее последующей диссоциацией на Эо–• и Eu2+. Подобный механизм был рассмотрен в работе [30] для реакции фотоокисления ароматических углеводородов ионом европия в ацетонитриле. Однако данный механизм для системы Эо2––Eu3+ является маловероятным ввиду того, что тушение флуоресценции эозина ионом европия не наблюдали в области концентраций 1 × 10–3–6 × 10–3 моль/л. Другой причиной возрастания выхода триплетных молекул эозина является влияние спин-орбитального взаимодействия на интеркомбинационный переход (“внешний эффект тяжелого атома”) в молекуле эозина, находящегося в комплексе с европием. Параметром спин-орбитального взаимодействия является константа ξ спин-орбитального взаимодействия, равная ξ = 1469 см–1 для европия [31]. Отметим, что для Br как тяжелого атома значение константы спин-орбитального взаимодействия составляет ξ = 2460 см–1 [31]. Известно [29] что атомы брома, входящие в состав молекулы эозина, обуславливают существенное увеличение φST по сравнению с φST для флуоресцеина, молекула которого не содержит атомов брома. Наблюдаемое сокращение времени триплетного состояния эозина в присутствии Eu3+ обусловлено переносом электрона на ион Eu3+ (3) с образованием Eu2+ и моно анион-радикала 2Эо–• (полуокисленная форма эозина):
(3)
$^{3}{\text{Э}}{{{\text{о}}}^{2}}^{--}~ + ~\,\,{\text{E}}{{{\text{u}}}^{{3 + }}}~ \to ~{\text{Э}}{{{\text{о}}}^{{--\centerdot }}} + \,\,~{\text{E}}{{{\text{u}}}^{{2 + }}}.$На рис. 2б приведена кинетическая кривая образования полуокисленной формы эозина в присутствии Eu3+. Увеличение выхода Эо–• является подтверждением фотопереноса электрона между красителем и аква-ионом металла. Константа скорости тушения триплетного состояния эозина в воде равна 1.9 × 106 л моль–1с–1. Следует отметить, что перенос энергии между триплетным состоянием эозина и ионом европия является маловероятным ввиду эндотермичности процесса: положение энергетического уровня Eu3+ (17300 см–1, [32]) превышает положение триплетного уровня эозина (14 730 см–1, [29]) на 2570 см–1.
На втором этапе исследовали влияние кукурбит[6–8]урилов на спектрально-люминесцентные и спектрально-кинетические свойства эозина. Ранее нами было показано [24], что в присутствии КБ7 и кукурбит[8]урила (КБ8) происходит падение выхода фосфоресценции Эо2– при неизменном времени жизни, что указывает на статическое тушение фосфоресценции. В настоящей работе наблюдали статическое тушение фосфоресценции Эо2– также в присутствии кукурбит[6]урила (КБ6) при неизменном времени жизни. Статическое тушение фосфоресценции является следствием образования неактивно поглощающих комплексов между эозином и кукурбит[6–8]урилами: Эо2–@КБ6, Эо2–@КБ7 и Эо2–@КБ8. На рис. 3 приведены спектры фосфоресценции обескислороженного раствора эозина в отсутствие и в присутствии КБ6, КБ7 и КБ8 в воде. Наиболее значительное падение фосфоресценции имеет место для КБ8, что указывает на более эффективное образование неактивно поглощающего комплекса Эо2–@КБ8. Добавление к раствору эозина гликолурила в концентрации 10–4 моль/л не приводит к изменению выхода фосфоресценции.
Рис. 3.
Нормированные спектры фосфоресценции обескислороженного раствора эозина в отсутствие (1) и в присутствии КБ6 (2), КБ7 (3), КБ8 (4) в концентрации 1 × 10–5 моль/л.
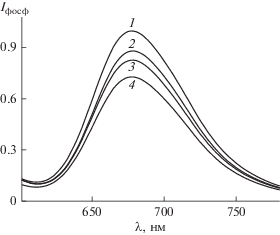
Следует отметить, что кукурбитурилы в концентрации до 1 × 10–5 моль/л не оказывают влияния ни на спектр поглощения, ни на спектр флуоресценции эозина. Используя уравнение Штерна–Фольмера, были найдены константы статического тушения фосфоресценции эозина, обусловленного образованием комплексов Эо2–@КБ6, Эо2–@КБ7 и Эо2–@КБ8, значения которых составляют 1.3 × 104, 2.3 × 104 и 3.1 × 104 М–1 соответственно.
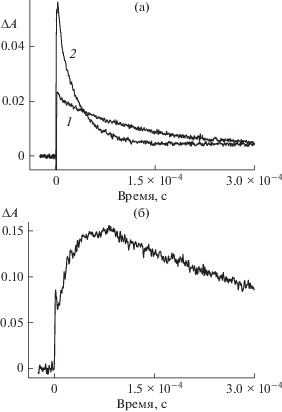
Молекулы эозина в комплексе Эо2–@КБ6, Эо2–@КБ7 и Эо2–@КБ8 также проявляют способность к интеркомбинационному переходу в триплетное состояние, при этом спектр триплет-триплетного (Т-Т) поглощения эозина в комплексе сходен со спектром Т-Т поглощения свободного Эо2–. Сходство спектров указывает на отсутствие заметного влияния кукурбитурилов на электронную конфигурацию (структуру) молекулы эозина и на положение уровней энергии. Для комплексов Эо2– с кукурбит[7]урилом имеет место образование полуокисленной Эо–•@КБ7 и полувосстановленной Эо3–•@КБ7 форм, сопровождающееся ростом величины изменения оптической плотности, ΔA. На рис. 4 приведены кинетические кривые образования полуокисленной и полувосстановленной форм Эо2– в присутствии КБ7. Обращает внимание тот факт, что величина ΔA для Эо–•@КБ7 и Эо3–• @КБ7 превышает величину ΔA для Эо–• и Эо3–•. Из рис. 4 следует, что кинетические кривые состоят из трех участков. На первом участке (<1 мкс) происходит скачкообразное увеличение Т-Т поглощения, на втором участке (5–100 мкс) наблюдается рост ΔA с последующим ее падением через 150–200 мкс, обусловленным превращением полуокисленной и полувосстановленной форм. Образование полуокисленной и полувосстановленной форм Эо2– в комплексе происходит в результате реакции дисмутации
(4)
$\begin{gathered} ^{3}{\text{Э}}{{{\text{о}}}^{{2--}}}{\kern 1pt} @{\kern 1pt} {\text{КБ}}7~\,\, + \,\,{{~}^{3}}{\text{Э}}{{{\text{о}}}^{{2--}}}{\text{КБ7}} \to \\ \to \,\,{\text{Э}}{{{\text{о}}}^{{3--\centerdot }}}{\kern 1pt} @{\kern 1pt} {\text{КБ}}7\,\,~ + \,\,~{\text{Э}}{{{\text{о}}}^{{--\centerdot }}}{\kern 1pt} @{\kern 1pt} {\text{КБ}}7. \\ \end{gathered} $Рис. 4.
Кинетические кривые образования полуокисленной (а) и полувосстановленной (б) форм эозина (1 × 10–5 моль/л) в присутствии КБ7 (1 × 10–4 моль/л).
На третьем этапе исследовали тушение Eu3+ триплетного состояния эозина в присутствии КБ6, КБ7 и КБ8. Концентрация кукурбитурилов составляла 1 × 10–5 моль/л, что лимитировалось предельной растворимостью КБ6 в воде. В табл. 1 приведены значения константы скорости тушения триплетного состояния Эо2– ионом Eu3+ в присутствии гликоурила и кукурбит[6–8]урилов.
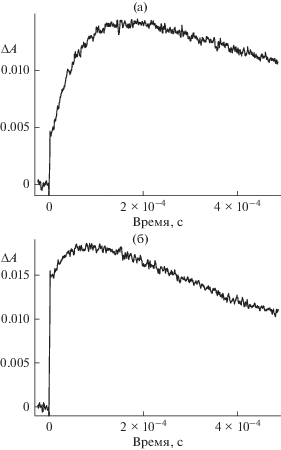
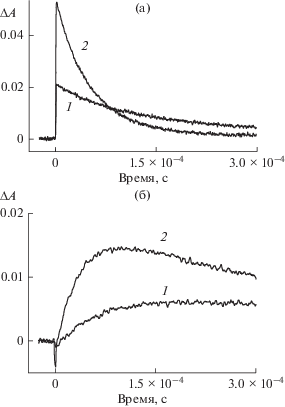
Из табл. 1 видно, что добавление КБ6, КБ7 и КБ8, а также гликоурила в концентрации 1 × × 10–4 моль/л приводит к увеличению константы скорости тушения фосфоресценции эозина. При этом наибольший эффект наблюдается в присутствии КБ6. На рис. 5 приведены кинетические кривые дезактивации триплетного состояния и образования полуокисленной формы эозина в присутствии КБ6 в отсутствие и в присутствии Eu3+. Из рисунка следует, что выход полуокисленной формы эозина, ΔА, в присутствии Eu3+ возрастает на 0.008. В присутствии КБ7 и КБ8 увеличение выхода полуокисленной формы составляет 0.009 и 0.004 соответственно.
Рис. 5.
Кинетические кривые дезактивации триплетного состояния эозина (1 × 10–5 моль/л) (а) и образования полуокисленной формы эозина (б) в присутствии КБ6 (1 × 10–5 моль/л). (1) – в отсутствие Eu2+ (2) – в присутствии Eu2+ (6 × 10–3 моль/л).
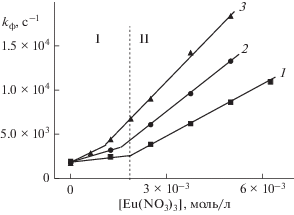
На примере КБ8 и КБ7 исследовали влияние концентрации КБ на фотоперенос электрона между эозином и европием. Рис. 6 иллюстрирует влияние КБ8 на эффективность тушения фосфоресценции. Зависимость константы скорости затухания фосфоресценции эозина от концентрации Eu состоит из двух участков (I и II), отражающих различную эффективность тушения. Значения констант скорости тушения на участках I и II различаются в 10 раз. По-видимому, наблюдаемое различие в константах скорости тушения обусловленo различным состоянием ионов европия в растворе. Известно [25], что ионы переходных металлов и, в частности, лантаноидов способны образовывать комплексы с кукурбитурилами. Добавление КБ8 смещает равновесие в сторону закомплексованных ионов, что приводит к увеличению эффективности тушения. Установлено, что при увеличении концентрации КБ8 с 1 × × 10–5 до 5 × 10–5 моль/л константа скорости тушения возрастает до 4.7 × 106 л · моль–1с–1. Аналогично, увеличение концентрации КБ7 в 10 раз приводит к возрастанию константы скорости тушения в два раза (4.8 × 106 л · моль–1с–1). Возможной причиной различий в значениях kq является способность Eu3+ образовывать комплексы разного состава с кукурбитурилом.
Рис. 6.
Зависимость константы скорости затухания фосфоресценции эозина (kф) от концентрации европия ((0.5 – 6) × 10–3 моль/л) в присутствии КБ8 в концентрации 1 × 10–5 моль/л (1), 3 × 10–5 моль/л (2) и 5 × 10–5 моль/л (3).
Таким образом, образование комплексов эозина с кукурбит[6–8]урилами влияет на величину константы скорости реакции фотоокисления эозина ионами европия, способствуя протеканию фотоокисления эозина.
Работа выполнена при поддержке Министерства науки и высшего образования в рамках выполнения работ по Государственному заданию ФНИЦ “Кристаллография и фотоника” РАН в части проведения спектрально-люминесцентных измерений эозина в присутствии кукурбит[6–8]урилов и Российского фонда фундаментальных исследований (проект № 18-03-00183) в части кинетических измерений реакции фотопереноса электрона.
Список литературы
Захарова Г.В., Лифанов Ю.И., Чибисов А.К. // Химия высоких энергий. 1981. Т. 15. № 1. С. 68.
Захарова Г.В., Коробов В.Е., Чибисов А.К. // Теорет. экспер. хим. 1982. № 3. С. 343.
Захарова Г.В., Кнолль Х., Хенниг Х., Чибисов А.К. // Изв. АН СССР сер. хим. 1987. № 3. С. 539.
Чибисов А.К., Захарова Г.В. // J. I nf. Rec. Mater. 1987. V. 15. № 6. С. 395.
Чибисов А.К., Захарова Г.В. // Успехи научн. фотографии. 1989. Т. 25. С. 114.
Захарова Г.В., Чибисов А.К. // Химическая физика. 1990. Т. 9. № 10. С. 1311.
Dsouza R.N., Pichel U., Nau W.M. // Chem. Rev. 2011. V. 111. № 12. P. 7941.
Koner A.L., Nau W.M. // Supramol. Chem. 2007. V. 19. № 1–2. P. 55.
Liu Y., Li C., Guo D. et al. // Supramol. Chem. 2007. V. 19. № 7. P. 517.
Bhasikuttan A.C., Mahanty J., Nau W.M., Pal H. // Angew. Chem. Int. Ed. 2007. V. 46. № 22. P. 4120.
Petrov N.Kh., Ivanov D.A., Golubkov D.V. et al. // Chem. Phys. Lett. 2009. V. 480. № 1–3. P. 96.
Захарова Г.В., Жижимов Д.А., Авакян В.Г. и др. // Химия высоких энергий. 2014. Т. 48. № 2. С. 104.
Zakharova G.V., Zhizhimov D.A., Sazonov S.K. et al. // J. Photochem. Photobiol. A: Chemistry. 2015. V. 302. P. 69.
Atabekyan L.S., Vedernikov A.I., Avakyan V.G. et al. // J. Photochem. Phobiol. A: Chem. 2013. V. 253. P. 52.
Атабекян Л.С., Кулемин Н.А., Авакян В.Г., Чибисов А.К. // Изв. АН. Сер. хим. 2013. № 4. С. 966.
Yuan L., Macartney D.H. // J. Phys. Chem. B. 2007. V. 111. № 24. P. 6949.
Mohanty J., Pal H., Ray A.K. et al. // Chem. Phys. Chem. 2007. V. 8. № 1. P. 54.
Mahanty J., Nau W.M. // Angew. Chem. Int. Ed. 2005. V. 44. № 24. P. 3750.
Атабекян Л.С., Авакян В.Г., Чибисов А.К. // Химия высоких энергий. 2011. Т. 45. № 2. С. 152.
Захарова Г.В., Авакян В.Г., Маркелов В.П. // Химия высоких энергий. 2015. Т. 49. № 6. С. 451.
Чибисов А.К., Алфимов М.В., Захарова Г.В. и др. // Химия высоких энергий. 2017. Т. 51. № 6. С. 480.
Захарова Г.В., Чибисов А.К. // Химия высоких энергий. 2016. Т. 50. № 5. С. 388.
Захарова Г.В., Авакян В.Г., Чибисов А.К., Алфи-мов М.В. // Химия высоких энергий. 2017. Т. 51. № 3. С. 210.
Федотова Т.В., Гутров В.Н., Захарова Г.В. и др. // Химия высоких энергий. 2019. Т. 53. № 1. С. 24.
Герасько О.А., Самсоненко Д.Г., Федин В.П. // Успехи химии. 2002. Т. 71. № 9. С. 842.
Liang L.L., Ni X.L., Zhao Y. et al. // Inorg. Chem. 2013. V. 52. № 4. P. 1909.
Gadde S., Kaifer A.E. // Current Organic Chemistry. 2011. V. 15. № 1. P. 27.
Qiu Y., Kaifer A.E. // Isr. J. Chem. 2011. V. 51. № 7. P. 830.
Коробов В.Е., Чибисов А.К. // Успехи химии. 1983. Т. 52. № 1. С. 43.
Sabbatini N., Indolfi M.T., Gandolfi M.T., BaIzani V. // J. phys. Chem. 1982. V. 86. № 18. P. 3585.
Montalti M., Credi A., Prodi L., Gandolfi M.T. // Handbook of photochemistry. New York: CRC Press. 2006. P. 633.
Полуэктов Н.С., Кононенко Л.И., Ефрюшина Н.П., Бельтюкова С.В. Спектрофотометрические и люминесцентные методы определения лантаноидов. Киев: Наукова думка, 1989. 256 с.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


