Химия высоких энергий, 2019, T. 53, № 6, стр. 484-488
Влияние объемного расхода компонентов реакционной смеси на неокислительную конверсию метана с добавкой воды в барьерном разряде
А. Ю. Рябов a, *, С. В. Кудряшов a, А. Н. Очередько a
a Федеральное государственное бюджетное учреждение науки Институт химии нефти Сибирского отделения РАН
634055 Томск-55, просп. Академический, 4, Россия
* E-mail: Andrey@ipc.tsc.ru
Поступила в редакцию 03.05.2019
После доработки 18.06.2019
Принята к публикации 19.06.2019
Аннотация
Изучено влияние объемного расхода компонентов реакционной смеси на неокислительную конверсию метана с добавкой воды в барьерном разряде. Повышение объемного расхода воды с 1.3 до 6 см3/ч не оказывает заметное влияние на конверсию метана, а также на содержание водорода и этана в газообразных продуктах реакции. Наблюдается рост содержания пропана и бутанов, а суммарное содержание этилена и пропилена в продуктах снижается. Увеличение объемного расхода метана с 5 до 60 см3/мин приводит к снижению конверсии метана с 29.3 до 6.2 об. % и энергозатрат на его превращение с 88.3 до 34.7 эВ/молекула, а также сопровождается снижением скорости образования газообразных алканов и олефинов. Экспериментальные данные подтверждают выводы о механизме и кинетике процесса неокислительной конверсии метана в БР, полученные ранее с использованием математической модели.
ВВЕДЕНИЕ
Ранее авторами настоящей статьи в работе [1] предложен способ неокислительной конверсии метана в присутствии воды в барьерном разряде (БР) с образованием водорода, газообразных углеводородов и жидких алканов С5–С10, преимущественно изомерного строения. Добавка воды в поток метана создает условия для эффективного вывода продуктов из разрядной зоны реактора и позволяет предотвратить нежелательное образование депозита на поверхности электродов реактора, что кардинально отличает полученные результаты от данных, опубликованных в работах по превращению только газообразных углеводородов, например [2–12].
В работе [13] авторами обсужден состав продуктов реакции и результаты моделирования кинетики превращения метана в присутствии воды в БР, но в ней отсутствуют данные о влиянии экспериментальных условий на исследуемый процесс. Настоящая работа является логическим продолжением исследований, опубликованных в [1, 13].
В статье приведены результаты изучения влияния объемного расхода компонентов реакционной смеси на неокислительную конверсию метана с добавкой воды в БР. Экспериментальные данные свидетельствуют в пользу выводов о механизме и кинетике процесса неокислительной конверсии метана в БР, полученные ранее с использованием математической модели.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперименты проведены на лабораторной установке, общий вид которой показан в работе [1]. Поток метана смешивается с водой при комнатной температуре. Далее газожидкостная смесь направляется в плазмохимический реактор, где подвергается воздействию БР.
Плазмохимический реактор является разборной конструкцией коаксиального типа с одним диэлектрическим барьером. Зазор в разрядной зоне составляет 1 мм, ее длина 10 см, объем равен 7 см3. Во всех экспериментах амплитуда высоковольтных импульсов напряжения не превышала 7.2 кВ, частота их повторения 2 кГц. Активная мощность разряда составляла 9.6 Вт.
Анализ продуктов реакции выполнен с помощью газового хроматографа HP 6890 и хромато-масс-спектрометра “Thermo Scientific DFS”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 представлено содержание газообразных продуктов реакции в зависимости от объемного расхода воды при постоянно объемном расходе метана. Увеличение объемного расхода воды не влияет на содержание водорода и этана в продуктах реакции, но приводит к снижению содержания пропана с 7.8 до 4.1%, а также этилена и пропилена с 3.3 до 0.3% и с 0.5 до 0.1% соответственно. Наблюдается небольшой рост содержания бутанов, в составе продуктов реакции появляется в незначительном количестве метанол ~0.2%.
Рис. 1.
Содержание газообразных продуктов реакции в зависимости от объемного расхода воды. Расход метана составляет 30 см3/мин: + − H2, △ − C2H6, ◻ – C3H8, ⚪ – C4H10, ▽ − C5+, ▲ − C2H4, ◼ – C3H6, × − CH3OH.
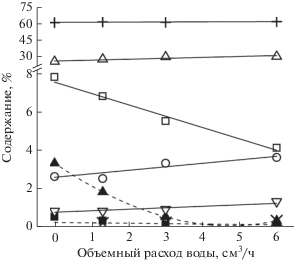
Для интерпретации результатов, приведенных на рис. 1, рассмотрим основные стадии механизма образования газообразных продуктов реакции.
Представленные ранее [13] результаты математического моделирования кинетики превращения метана и смеси метан–вода показывают, что диссоциация электронно-возбужденной молекулы метана приводит к образованию основных частиц:
(1)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e\;}} \to {\text{C}}{{{\text{H}}}_{3}} + {\text{H}} + {\text{e,}}\,\,\,\,{\text{76}}\% ,$(2)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e\;}} \to {\text{C}}{{{\text{H}}}_{2}} + {{{\text{H}}}_{2}} + {\text{e,}}\,\,\,\,14.4\% ,$(3)
${\text{C}}{{{\text{H}}}_{4}} + {\text{e}} \to {\text{CH}} + {{{\text{H}}}_{2}} + {\text{H}} + {\text{e,}}\,\,\,\,7.3\% .$Образование основных продуктов – этана и молекулярного водорода происходит в результате рекомбинации СН3 и Н радикалов:
(4)
$2{\text{C}}{{{\text{H}}}_{3}} + {\text{М\;}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{6}}{\text{,}}$Из уравнений (4), (5) видно, что образование этана и молекулярного водорода не зависит от присутствия паров воды в газовой фазе, что косвенно подтверждается данными рис. 1.
Образование непредельных соединений возможно в результате реакций, для этилена:
(6)
${\text{C}}{{{\text{H}}}_{4}} + {\text{CH}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{4}} + {\text{H,}}$(7)
${{{\text{С}}}_{2}}{{{\text{Н}}}_{6}} + {\text{CH\;}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{4}} + {\text{С}}{{{\text{H}}}_{3}}{\text{\;}},$или пропилена:
(8)
${{{\text{С}}}_{2}}{{{\text{Н}}}_{6}} + {\text{CH\;}} \to {{{\text{C}}}_{3}}{{{\text{H}}}_{6}} + {\text{Н}}{\text{.}}$Наряду с реакциями (6)–(8) СН-радикал взаимодействует с молекулой воды в конкурирующей реакции:
Дальнейшее превращение СН2ОН-радикала приводит к образованию метанола, появление которого наблюдается при добавлении воды в поток метана (рис. 1).
Константы скорости взаимодействия CH-радикала с молекулами воды и метаном существенно различаются, 3.39 × 10–11 [15] и 2.49 × 10–12 [16] см3/с соответственно. Таким образом, наличие паров воды в метане может привести к снижению скорости образования этилена и пропилена.
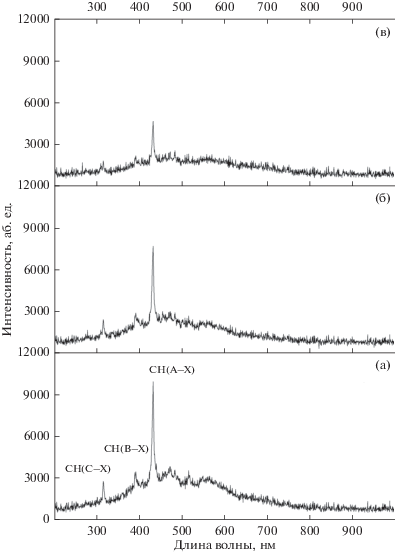
На рис. 2 приведены эмиссионные спектры плазмы БР при разном объемном расходе воды. В спектре чистого метана наблюдаются характерные полосы электронно-колебательных переходов СН-радикала (А–Х, В–Х, C–Х), излучающих на длинах волн 316, 390, 431 нм [14] соответственно. Видно, что с увеличением объемного расхода воды в разрядной зоне снижается интенсивность излучения CH-радикала, следовательно, в экспериментах мы должны наблюдать снижение содержания этилена и пропилена в продуктах реакции, что и показано на рис. 1.
Рис. 2.
Эмиссионные спектры плазмы барьерного разряда при разном объемном расходе воды. Расход метана составляет 30 см3/мин: а – чистый СН4; б – смесь СН4–Н2О (Расход воды = 1.3 см3/ч); в – смесь СН4–Н2О (Расход воды = 3 см3/ч).
На рис. 3 приведено содержание газообразных продуктов реакции в зависимости от объемного расхода метана. Увеличение объемного расхода воды приводит к снижению содержания углеводородов С3+, в особенности бутанов, в продуктах реакции.
Рис. 3.
Содержание газообразных продуктов реакции в зависимости от объемного расхода метана. Расход воды составляет 3 см3/ч: + − H2, △ − C2H6, ◻ – C3H8, ⚪ – C4H10, ▽ − C5+, ▲ − C2H4, ◼ – C3H6, × − CH3OH.
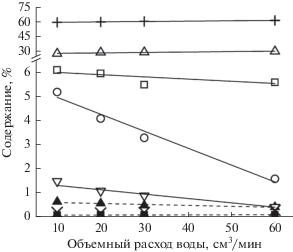
Кинетические расчеты, проведенные в [13] показали, что скорость образования алканов С3+ существенно зависит от продолжительности воздействия разряда на исходную смесь, что подтверждается данными рис. 3, поскольку увеличение объемного расхода метана приводит к уменьшению времени контакта исходной смеси с разрядной зоной реактора.
Анализ коэффициентов чувствительности скоростей реакций в модели превращения смеси метан–вода выполненный в [13], показал что образование пропана, бутана и других жидких углеводородов С5+ преимущественно связано с реакцией встраивания CH2-радикала в С–С-связь молекулы углеводорода. Например, образование пропана происходит в результате реакции взаимодействия CH2-радикала с молекулой этана:
(10)
${{{\text{C}}}_{2}}{{{\text{H}}}_{6}} + {\text{C}}{{{\text{H}}}_{2}} \to {{{\text{C}}}_{3}}{{{\text{H}}}_{8}}{\text{\;}}.$В случае образования бутанов возможно появление дополнительных реакционных каналов:
(12)
${{{\text{C}}}_{2}}{{{\text{H}}}_{6}} + {\text{Н}} \to {{{\text{C}}}_{2}}{{{\text{H}}}_{5}} + {{{\text{Н}}}_{2}},$Образование других углеводородов с большей молекулярной массой происходит аналогично, по мере накопления в разрядной зоне соответствующих соединений.
На рис. 4 приведены конверсия метана и энергозатраты на его превращение в зависимости от его объемного расхода.
Рис. 4.
Конверсия и энергозатраты на превращение метана в зависимости от его объемного расхода. Расход воды составляет 3 см3/ч.
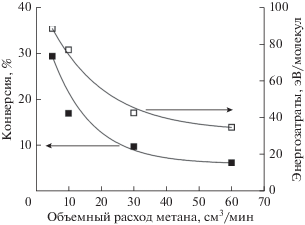
Увеличение объемного расхода метана приводит к снижению конверсии с 29.3 до 6.2 об. % и энергозатрат на его превращение с 88.3 до 34.7 эВ/молекула. Энергозатраты на превращение метана в БР, при соответствующих значениях конверсии, сопоставимы с результатами, приведенными в литературе [17], которая обобщает работы по превращению метана в различных электрических разрядах.
ЗАКЛЮЧЕНИЕ
Изменение объемного расхода воды с 1.3 до 6 см3/ч не влияет на конверсию метана и содержание основных продуктов реакции – водорода и этана. Наблюдается снижение содержания пропана и непредельных соединений – этилена и пропилена, а содержание углеводородов С4+ увеличивается.
Изменение объемного расхода метана с 5 до 60 см3/мин приводит к снижению его конверсии с 29.3 до 6.2 об. % и понижению энергозатрат на его превращение с 88.3 до 34.7 эВ/молекула. Снижается содержание газообразных алканов С4+ и олефинов. Полученные экспериментальные данные свидетельствуют в пользу выводов о механизме и кинетике процесса неокислительной конверсии метана в БР, полученные ранее с использованием математической модели.
Работа выполнена по программе фундаментальных научных исследований государственных академий наук на 2013–2020 гг. Проект V.44.3.1 “Создание научных основ переработки каустобиолитов и регулирования физико-химических свойств углеводородсодержащих коллоидных систем в условиях экстремального воздействия физических факторов (низкотемпературная плазма, механохимия и акустические методы)” № ГР AAAA-A17-117030310198-4.
Список литературы
Kudryashov S.V., Ryabov A.Y., Ochered’ko A.N. // High Energ. Chem. 2017. V. 51. № 2. P. 128.
Scapinello M., Delikonstantis E., Stefanidis G.D. // Fuel. 2018. V. 222. P. 705.
SriBala G., Michiels D., Leys Ch., Geem K.M.V., Marin G.B., Nikiforov A. // J. Clean. Prod. 2019. V. 209. P. 655.
Jeon B., Park E.D., Kim Yu K. // Res. Chem. Intermed. 2018. V. 44. № 6. P. 3761.
Khoja A.H., Tahir M., Amin N.A.S. // Energy Convers. Manag. 2019. V. 183. P. 529.
Moshrefi M.M., Rashidi F. // Plasma Chem. Plasma Process. 2018. V. 38. № 3. P. 503.
Khadir N., Khodja K., Belasri A. // Plasma Sci. Technol. 2017. V. 19. № 9. P. 095502.
Lim M.S., Chun Y.N. // Plasma Chem. Plasma Process. 2016. V. 36. № 5. P. 1211.
Indarto A., Coowanitwong N., Choi J.-W., Lee H., Song H.K. // Fuel Process. Technol. 2008. V. 89. № 2. P. 214.
Shapoval V., Marotta E. // Plasma Process. Polym. 2015. V. 12. № 8. P. 808.
Kadoa S., Sekine Y., Nozaki T., Okazaki K. // Catal. Today. 2004. V. 89. № 1–2. P. 47.
Dors M., Nowakowska H., Jasiński M., Mizeraczyk J. // Plasma Chem. Plasma Process. 2014. V. 34. № 2. P. 313.
Kudryashov S.V., Ryabov A.Y., Ochered’ko A.N. // High Energ. Chem. 2018. V. 52. № 2. P. 167.
Luque J. // Database and Spectral simulation for diatomic molecules. Lifebase 2.0. url: http://www.sri.com/psd/lifbase/ (дата обращения 23 марта 2019).
Zabarnick S., Fleming J.W., Lin M.C. // Symp. Combust. 1988. V. 21. № 1. P. 713.
Braun W., McNesby J.R., Bass A.M. // J. Chem. Phys. 1967. V. 46. P. 2071.
Pushkarev A.I., Zhu Ai-M., Li X.-S., Sazonov R.V. // High Energ. Chem. 2009. V. 43. № 3. P. 156.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


