Химия высоких энергий, 2020, T. 54, № 2, стр. 105-111
Композитный гранулированный аэрогель оксид графена/TiO2 как высокоэффективный фотокатализатор
С. А. Баскаков a, b, *, Ю. В. Баскакова a, b
a ФГБУН Институт проблем химической физики РАН
142432 Московская обл., г. Черноголовка, просп. Академика Семенова, 1, Россия
b Общество с ограниченной ответственностью “ГРАФЕНОКС”
142432 Московская обл., г. Черноголовка, просп. Академика Семенова, 1, Россия
* E-mail: sabaskakov@gmail.com
Поступила в редакцию 14.10.2019
После доработки 25.10.2019
Принята к публикации 25.10.2019
Аннотация
Разработан и испытан композитный фотокатализатор на основе оксида графена и диоксида титана. Катализатор был получен в виде аэрогеля, который представлял собой гранулы (сферы и полусферы) диаметром 4–6 мм. Такая форма катализатора оказалась более удобной для использования по сравнению с порошкообразными фотокатализаторами с технологической точки зрения. Полученные композиты показали высокие фотокаталитические свойства на примере фотодеградации основных красителей метилового фиолетового (МФ) и метиленового синего (МС) в водных растворах.
Среди различных типов полупроводников (TiO2, ZnO, CdS, WO3 и др.) [1–4], диоксид титана (ТiO2) выделяется как важный и один из наиболее изученных полупроводниковых фотокатализаторов благодаря своей высокой фотокаталитической активности, доступности сырья, низкой стоимости, отсутствию токсичности (зарегистрирован как пищевая добавка Е171), высокой химической стабильности и так далее. Однако, не смотря на все положительные качества, имеются факторы, препятствующие широкому применению TiO2 в фотокаталитических системах очистки сточных вод. Это и большая ширина запрещенной зоны TiO2 (~3.2 эВ) и короткая средняя длина свободного пробега электронов в этом материале [5]. Для преодоления этих двух недостатков используются в основном два метода: допирование (легирование) примесей в структуру TiO2 и поверхностная сенсибилизация, приводящая к увеличению общей фоточувствительности и сдвигу зоны спектральной чувствительности в область видимого спектра [6, 7]. В данном случае частицы TiO2 покрывают сенсибилизатором либо располагают частицы диоксида титана на его поверхности. Известно, что для легированного азотом рутила ширина запрещенной зоны уменьшается до 1.55 эВ [8]. Группа Чжоу обнаружила, что уровень примеси TiO2, легированного атомами La, примерно на 0.3 эВ ниже, чем зона проводимости чистого TiO2, при этом полоса поглощения сдвигается в красную область спектра до 436 нм [9].
Несмотря на то, что допирование приводит к образованию нового энергетического уровня в материале, который обеспечивает активность TiO2 в видимой области спектра, дополнительные примесные атомы или ионы одновременно исполняют роль центров рекомбинации для фотогенерированных пар “электрон–дырка” [10, 11]. Поэтому создание сенсибилизирующего слоя снаружи частицы диоксида титана считается предпочтительным для модификации TiO2. Для успешного использования в паре с TiO2, сенсибилизатор должен удовлетворять некоторым ключевым критериям. Ширина запрещенной зоны должна быть уже, чем у TiO2, т.к. сенсибилизатор будет возбуждаться излучением в видимой области спектра. Зона проводимости сенсибилизатора должна быть более положительной, чем у TiO2 или, соответственно, валентная зона сенсибилизатора более отрицательной, чем у TiO2. Необходимо учитывать особенности морфологии сенсибилизатора, его физико-химические особенности поверхности, для удобства способов получения, загрузки–выгрузки фотокатализатора из зоны реакции.
В последнее время в качестве сенсибилизатора диоксида титана активно исследуются различные модификации углеродных материалов, в том числе активированный уголь [12, 13], фуллерен С60 [14, 15], углеродные нанотрубки (УНТ) [16, 17] и др. Среди множества углеродных материалов особо стоит выделить графен. Уникальные свойства этого “звездного” материала, такие как высокая подвижность электронов при комнатной температуре (до 2.5 × 105·см2 · В–1 · с–1, превосходная механическая прочность (модуль Юнга ≈ 1 ТПа), внутреннее сопротивление деформации более 130 ГПа, высокая теплопроводность (выше 3000 Вт · м–1 · К–1), полная непроницаемость для любых газов, большая удельная поверхность (до 2640 м2/г) и др. [18], делают графен универсальным материалом, который справедливо привлекает к себе пристальное внимание исследователей из разных областей знаний. Естественно, графен считается перспективным модификатором для фотокатализаторов, основываясь на его уникальных свойствах. Нулевая запрещенная зона графена обеспечивает предварительное условие для использования в качестве идеального сенсибилизатора и его высокая подвижность электронов, являющаяся результатом делокализованного сопряженного р-электрона, полезна для результирующих фотокаталитических характеристик. Также графен осуществляет быстрый перенос фотоиндуцированного электрона между собой и TiO2, что эффективно подавляет рекомбинацию фотогенерированных электронно-дырочных пар в TiO2 [19].
Присутствие графена дает еще несколько полезных свойств. Большая удельная поверхность графена обеспечивает прочный и устойчивый каркас для размещения и поддержки частиц диоксида титана. Наличие остаточных кислородсодержащих групп (например, в восстановленном оксиде графена (ВОГ)) приводит к дополнительной фиксации TiO2 за счет Ван-дер-Ваальсового взаимодействия.
В данной работе предложен новый подход к синтезу фотокатализатора на основе оксида графена и TiO2. Разработанный образец представлял собой гранулы аэрогеля с равномерным распределением частиц диоксида титана. По нашему мнению, такая модификация фотокатализатора может дать дополнительные преимущества материалам на основе графена и TiO2 для применения в системах очистки сточных вод от органических загрязнений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Оксид графита был синтезирован модифицированным методом Хаммерса. Суспензии оксида графена (ОГ) в воде получали микромеханическим расслоением суспензии оксида графита в ультразвуковом поле с использованием УЗ-диспергатора МЭФ 93.1 (ООО “МЭЛФИЗ Ультразвук”).
Методика приготовления гранулированного аэрогеля (TiO2/ОГ) состояла в следующем. На первом этапе была приготовлена суспензия TiO2/ОГ. Для этого рассчитанное количество порошка TiO2 вводили в заранее приготовленную суспензию ОГ таким образом, чтобы концентрация компонентов в суспензии не превышала 20 мг/мл. Суспензию по каплям с помощью шприца дозатора прикапывали в стеклянный сосуд Дьюара заполненный жидким азотом. Замороженные капли в виде сфер или полусфер были высушены лиофильно в аппарате лиофильной сушки Martin Christ Alfa 1–2. Таким образом были получены композиты следующих составов: 70 : 30 и 50 : 50 (ОГ : ТiO2 вес. %). Аэрогели TiO2/ОГ легко разрушаются при контакте с водой, поэтому ОГ в образцах подвергался восстановлению, после которого гранулы при смачивании водой сохраняли форму. Восстановление проводили обработкой гранул в парах гидразина.
Удельную поверхность и распределение пор по размерам образцов определяли на анализаторе QADRASORB SI (США). Электронные микрофотографии исследуемых образцов были получены на сканирующем электронном микроскопе “Zeiss SUPRA 25" (энергия электронов 3.4 kV, давление в камере 2 × 10–5 Pa).
Для проведения эксперимента по фотодеградации использовали растворы красителей: кристаллический фиолетовый (метиловый фиолетовый 10В) (МФ) и метиленовый синий (МС). Экспериментальная установка состояла из стеклянного реактора объемом 250 мл с охлаждающим контуром, снабженного тефлоновым мешателем. Реактор устанавливали на магнитную мешалку, контур охлаждения подключали к термостату. Источником света служила энергосберегающая лампа F-SP-23-865-E27 “ЭРА” мощностью 23 Вт и цветовой температурой 4200 К. Спектр источника света с такой цветовой температурой максимально приближен к спектру дневного света. 150 мл раствора красителя и 150 мг композита ОГ/ТiO2 вносили в реактор и погружали в него лампу. Раствор термостатировали при Т = 30°С в течение 20 мин. До включения лампы отбирали 1 мл раствора и определяли его как нулевую точку. После включения лампы каждые 30 или 60 мин отбирали на анализ 1 мл раствора. Фотодеградацию в процентах рассчитывали по изменению площади основного пика поглощения с максимумом 583–585 нм. Оптические спектры растворов были получены с помощью спектрофотометра ПЭ-5400УФ в спектральном диапазоне 190–1000 нм при спектральной ширине щели 4 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Несмотря на многочисленные преимущества применения графена и его модификаций в качестве носителя фотокаталитических частиц, были обнаружены некоторые существенные недостатки. Объемные графеновые материалы в основном имеют существенно более низкую фактическую площадь по сравнению с теоретическим значением для монослоя графена [20], что может существенно сказаться на скорости переработки загрязнителей. В структуре ВОГ имеется множество дефектов, что отрицательно сказывается на длине свободного пробега электронов и может привести к сокращению жизни фотоиндуцированных электронов [21]. При восстановлении ОГ результирующие частицы ВОГ получаются неоднородными по толщине и размеру, что ухудшает контакт между базисной плоскостью листов графена и каталитическими частицами. Наконец, существует проблема удаления такого катализатора из зоны фотореакции. Предложенный в данной работе метод получения гранулированного фотокатализатора в виде аэрогеля TiO2/ОГ не требует работы с сосудами под большим давлением, как в случае метода самосборки, требующего автоклавирования, является простым в техническом плане и имеет большой потенциал для масштабирования. Получаемые гранулы имеют вид сфер или полусфер диаметром 4–6 мм. На рис. 1 представлены фотографии образцов гранул ОГ–TiO2 до и после восстановления.
Рис. 1.
Фотографии образцов композитных аэрогелей: а – ОГ–TiO2 (70% : 30%); б – RGO–TiO2 (70% : 30%) (после восстановления).

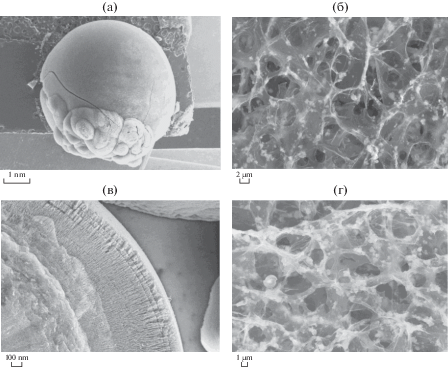
Полученные образцы фотокатализатора после восстановления были изучены методом сканирующей электронной микроскопии. На рис. 2 можно видеть микрофотографии полученных гранул, содержащих 30 и 50 вес. % диоксида титана. На рисунках отчетливо видна пористая структура аэрогеля с равномерно распределенными частицами TiO2 на поверхности слоев ВОГ (RGO).
Рис. 2.
СЭМ-изображения гранул композитов и их внутренней пористой структуры при разном разрешении: а, б – RGO–TiO2 (70% : 30%), в, г – RGO–TiO2 (50% : 50%).
Структура поверхности и пористость фотокатализатора оказывает существенное влияние на его эффективность. Большая удельная площадь поверхности графенового аэрогеля создает прочную сеть для крепления и удержания фотокаталитических наночастиц. Также известно, что ОГ и RGO имеют высокую сорбционную емкость по отношению ко многим органическим загрязнителям. Для оценки поверхности и пористости образцы фотокатализатора были исследованы методом БЭТ по поглощению азота. Результаты анализа приведены в табл. 1.
Таблица 1.
Результаты анализа композитов методом БЭТ
| Образец | Sуд., м2/г | Vпор, см3/г | Dср, нм |
|---|---|---|---|
| RGO–TiO2 (70% : 30%) | 141.7 | 0.181 | 3.4 |
| RGO–TiO2 (50% : 50%) | 130.9 | 0.269 | 3.1 |
Согласно результатам анализа, удельные площади поверхности обоих образцов аэрогелей близки по своим значениям, однако, объем пор для образца состава 50 : 50 существенно больше образца, содержащего 30% диоксида титана. Таким образом, можно предположить, что диоксид титана при сушке препятствует сближению нанолистов ОГ, образуя систему пор между ними, и чем выше содержание TiO2 в образце, тем объем пор больше. Диараммы распределения пор по размерам для испытываемых образцов аэрогелей показали, что объем пор приходится на нанопоры от 0.6 до 4.5 нм.
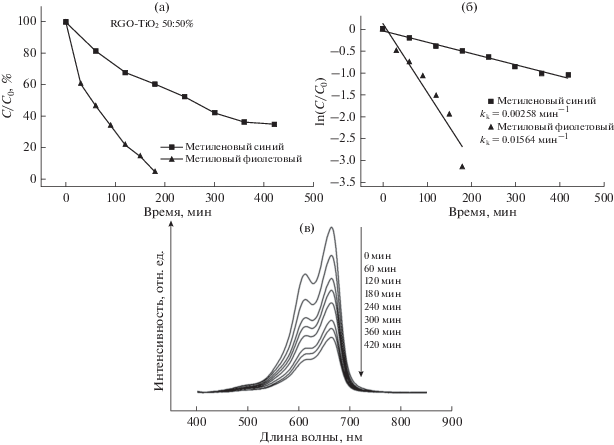
Была изучена фотодеградация красителя метилового фиолетового (МФ) в водных растворах (концентрация красителя 0.02 г/л) с композитными фотокатализаторами RGO–TiO2 (70% : 30%) и RG–TiO2 (50% : 50%) в качестве фотокатализатора.
Механизм фотодеградации в настоящее время достаточно хорошо изучен и в упрощенной форме проиллюстрирован в работе [22] еще в 1981 г., и объясняется адсорбцией фотона (hν) с более высокой энергией, чем 3.2 эВ, что приводит к возбуждению в связи с разделением заряда [23]. Когда запрещенную зону синтезированных нанокомпозитов подвергают облучению светом с большей энергией, чем энергия их запрещенной зоны, это приводит к генерации возбужденных электронно-дырочных пар e–/h+ (проводящий зонный электрон $e_{{{\text{CB}}}}^{ - }$ и дырка в валентной зоне $h_{{{\text{VB}}}}^{ + }$). Образующиеся дырка и электрон считаются сильными окислителями и восстановителями соответственно. $h_{{{\text{VB}}}}^{ + }$ при реакции с красителем вызывает его окисление с разложением на простые вещества (CO2, H2O и другие продукты минерализации).
Кроме того, в процессе фотодеградации может участвовать радикал •ОН. Его образование может быть обусловлено окислением воды при взаимодействии с $h_{{{\text{VB}}}}^{ + }.$ Полученный таким образом свободный радикал (•ОН) обладает высоким окислительным потенциалом (2.80 В), который может окислить большинство богатых электронами органических молекул, превращая их в воду и углекислый газ.
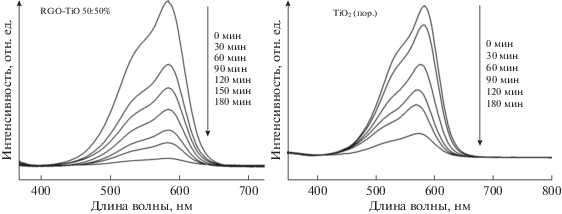
На рис. 3 представлены оптические спектры водных растворов МФ вблизи основного пика при разных временах облучения для катализаторов TiO2 и RGO–TiO2 (50% : 50%). Из рисунка видно, что в присутствии композитного фотокатализатора после экспозиции раствора в течение 180 мин пик поглощения практически полностью исчезает, а в случае с чистым диоксидом титана, интенсивность основного пика еще достаточно высока.
Рис. 3.
Оптические спектры растворов красителя МФ в присутствии чистого TiO2 и катализатора RGO–TiO2 (50% : 50%).
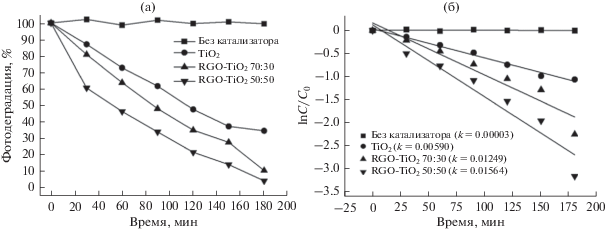
На рис. 4а представлены экспериментальные данные по фотодеградации красителя МФ в процентах от времени облучения. Из рисунка видно, что при облучении красителя в растворе без катализатора фотодеградация не происходит. Лучший результат показал композит, содержащий 50% TiO2. При этом через 3 ч в растворе остается менее 3% от начальной концентрации красителя МФ. Медленнее всего фотодеградация происходит при использовании чистого TiO2 в качестве фотокатализатора. Известно, что ширина запрещенной зоны для анатаза составляет 3.2 эВ и для перехода электрона из валентной зоны в зону проводимости необходимы фотоны с длиной волны менее 390 нм, что уже попадает в ультрафиолетовый диапазон. Однако при использовании в качестве источника света бытовой люминесцентной лампы, как видно из рис. 4а, фотокаталитическая активность чистого TiO2 достаточно высока. Это может быть объяснено тем, что спектр испускаемого света лампы частично захватывает и ближнюю УФ-область.
Рис. 4.
а – Кривые изменения концентрации красителя МФ в процентах в зависимости от времени экспозиции; б – кинетика разложения метилового фиолетового.
Были построены графические зависимости –ln(Ct/C0) от времени облучения t, которые были аппроксимированы прямыми линиями (рис. 4б). Кинетические исследования были выполнены исходя из скорости распада красителя. Для описания кинетики фотодеградации органических молекул на поверхности полупроводикового материала успешно используют модель Ленгмюра–Хиншельвуда [24, 25], которая ранее применялась для систем газ/твердое тело. Согласно этой модели скорость мономолекулярной поверхностной реакции пропорциональна доле поверхности, покрытой реагентом, когда реагент более сильно адсорбируется на поверхности, чем продукты. После ряда упрощений [25] фотокаталитическое разложение метилового фиолетового описывается кинетической зависимостью псевдопервого порядка, выраженной как:
Интегрирование вышеприведенного уравнения (с ограничением C = C0 при t = 0, где C0 является начальной концентрацией в объемном растворе после темновой адсорбции, а t является временем реакции), приводит к следующему соотношению:
(2)
$--\ln \left( {{{{{C}_{t}}} \mathord{\left/ {\vphantom {{{{C}_{t}}} {{{C}_{0}}}}} \right. \kern-0em} {{{C}_{0}}}}} \right) = {{k}_{к}}t,$Исходя из полученных результатов, можно заключить, что оптимальным в качестве фотокатализатора является состав RGO–TiO2 50% : 50%. На данном катализаторе был проведен эксперимент по фотодеградации другого широко применяемого в промышленности красителя – метиленового синего при тех же экспериментальных условиях.
На рис. 5а приведены кривые изменения концентрации красителя МС и МФ (для сравнения) в процентах в зависимости от времени облучения. Так же были построены логарифмические зависимости от С/С0 и кажущиеся константы скорости реакции фотодеградации (рис. 5б). Из рисунков видно, скорость реакции в случае с МС несколько ниже по сравнению с МФ. Константа скорости реакции фотодеградации МФ составляет 0.01564 мин–1, а для МС – 0.00258 мин–1. Видно, что реакция фотодеградации метиленового синего протекает существенно медленнее по сравнению с МФ, что может быть связано с химической структурой красителя МС.
ЗАКЛЮЧЕНИЕ
Модифицированные графеном композитные фотокатализаторы с TiO2 стали “горячей” темой для исследований в последнее десятилетие. Графен оказался многообещающим носителем для фотоактивных наночастиц. Большая площадь поверхности, нулевая ширина запрещенной зоны, высокая подвижность и большое время жизни электронов, превосходная способность к их накоплению превращают графен в замечательный модификатор для традиционных фотокатализаторов. Разработанный нами гранулированный фотокатализатор на основе аэрогеля оксида графена показал достаточно высокую эффективность по сравнению с литературными данными. Кроме этого гранулированная форма ФК может быть удобна для промышленного применения, когда значительно упрощается процесс введения и выведения ФК из зоны реакции по сравнению с порошкообразыми материалами.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Исследование выполнено по государственному заданию Российской Федерации (государственный регистрационный номер 0089-2019-0008 и при финансовой поддержке РФФИ в рамках научного проекта № 17-43-500093 р_а.
Список литературы
Guoa Q., Zhang, Q., Wang H., Zhao Z. // Catalysis Communications. 2018. V. 103. P. 24
Chen X., Wu Z., Liu D., Gao Z. // Nanoscale Research Letters. 2017. V. 12. P. 143
Cheng L., Xiang Q., Liao Y., Zhang H. // Energy Environ. Sci. 2018. V. 11. P. 1362
Korala S., Germain J.R., Chen E., Pala I.R., Li D., Brock S.L. // Inorg. Chem. Front. 2017. V. 4. № 9. P. 1451.
Hu G.X., Tang B. // Mater. Chem. Phys. 2013. V. 138. P. 138:608.
Fuentes G.G., Elizalde E., Yubero F., Sanz J.M. // Surf. Interface Anal. 2002. V. 33. P. 230.
Khairy M., Zakaria W. // Egypt. J. Chem. 2014. V. 23. P. 419.
Zeng Z.L., Zheng G., Wang X.C., He K.H., Chen Q.L., Yu L., Wang Q.B. // J. At. Mol. Sci. 2010. V. 1. P. 177.
Zhang X.T., Zhou G.W., Zhang H.Y., Wu C.C., Song H.B. // Trans. Metal Chem. 2011. V. 36. № 2. P. 217.
Chowdhury I.H., Ghosh S., Naskar M.K. // Ceramics Int. V. 42. № 2. P. 2488.
Linsebigler A.L., Lu G., Yates J.T., Jr. et al. // Chem. Rev. 1995. V. 95. P. 735.
Yao S., Li J., Shi Z. // Particuology. 2010. V. 8. № 3. P. 272.
Martinsa A.C., Cazetta A.L., Pezoti O., Souza J.R.B., Zhang T, Pilau E.J., Asefa T., Almeida V.C. // Ceramics International. 2017. V. 43. P. 4411.
Qi K., Selvaraj R., Al-Fahdi T, Al-Kindy S., Kim Y., Wang G.-C., Taie C.-W., Sillanpää M. // Appl. Surf. Sci. 2016. V. 387. P. 750.
Panahian Y., Arsalani N., Nasiri R. // J. Photochemistry & Photobiology A: Chemistry. 2018. V. 365. P. 45.
Abdullahi N., Saion E., Shaari A.H., Al-Hada N.M., Keiteb A. // PLoS One. 2015. V. 10. № 5. P. 0125511.
Xu Y-J., Zhuang Y, Fu X. // J. Phys. Chem. C. 2010. V. 114. № 6. P. 2669.
Balandin A.A. // Nature Mater. 2011. V. 10. P. 569.
Zhang L.W., Fu H.B., Zhu Y.F. // Adv. Funct. Mater. 2008. V. 18. № 15. P. 2180.
Zhang X.Y., Li H.P., Cui X.L., Lin Y.H. // J. Mater. Chem. 2010. V. 20. P. 2801.
Bai X.J., Wang L., Zong R.L., Lv Y.L., Sun Y.Q., Zhu Y.F. // Langmuir. 2013. V. 29. № 9. P. 3097.
Kalyanasundaram K., Borgarello E., Gráutzel M. // Helvetica Chim. Acta. 1981. V. 64. № 1. P. 362.
Boroski, M., Rodrigues, A.C., Garcia, J.C., Sampaio, L.S., Nozaki, J., Hioka, N. // J. Hazard. Mater. 2009. V. 162. P. 448.
Al-Ekabi H., Serpone N. // J. Phys. Chem. 1988. V. 92. № 20. P. 5726.
Wang X.H., Li J.-G., Kamiyama H, Moriyoshi Y. Ishigaki T. // J. Phys. Chem. B. 2006. V. 110. № 13. P. 6804.
Yang S, Xu Y., Huang Y., Zhou G., Yang Z., Yang Y., Wang G. // Int. J. Photoenergy V. 2013. Article ID 191340. 5 p.
Ahmad S., Ashraf A. // International J. Chemical Studies. 2016. V. 4. № 5. P. 98.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий