Химия высоких энергий, 2020, T. 54, № 2, стр. 97-104
Спектрально-люминесцентные свойства N,N'-бис(салицилиден)-1,4-бутилендиамина, N,N'-бис(5-бромсалицилиден)-1,4-бутилендиамина и комплексов Zn(II) на их основе
А. Н. Борисов a, *, М. В. Пузык a, Е. А. Посадская a, Л. П. Ардашева a, В. Н. Пак a
a Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, наб. р. Мойки, 48, Россия
* E-mail: alexey-borisov@mail.ru
Поступила в редакцию 10.10.2019
После доработки 22.10.2019
Принята к публикации 22.10.2019
Аннотация
Изучены спектрально-люминесцентные свойства ароматических азометинов N2O2-типа – N,N'-бис(салицилиден)-1,4-бутилендиамина, N,N'-бис(5-бромсалицилиден)-1,4-бутилендиамина и комплексов Zn(II) на их основе. Все вещества при 293 К флуоресцируют в растворах и поликристаллическом состоянии. К росту интенсивности флуоресценции азометинов в спиртовых растворах приводит их перевод в хиноидную форму. Определены основные фотолюминесцентные параметры растворов веществ в ДМФА и ДМСО. В зависимости от наличия бром-арильных заместителей в структуре лиганда и свойств растворителя комплексы цинка флуоресцируют с квантовыми выходами до 50%.
Комплексные соединения переходных металлов с азометиновыми основаниями (основаниями Шиффа) привлекают внимание исследователей и рассматриваются в качестве прекурсоров для создания новых функциональных материалов. В частности, комплексы некоторых d-элементов с ароматическими азометинами N2O2-, NO- и N4-типа ([M(Schiff)]) обладают люминесцентными [1, 2], каталитическими [3] и сенсорными свойствами [4], а также способностью к образованию устойчивых проводящих полимеров [5].
Известно, что некоторые комплексы Zn(II) с ароматическими азометинами (основаниями Шиффа), производными салицилового альдегида, интенсивно флуоресцируют в видимой области спектра и могут использоваться при создании эмиссионного слоя электролюминесцентных устройств [6]. Спектрально-люминесцентные свойства комплексов [Zn(Schiff)] определяются главным образом природой координированного азометинового основания – электронным характером заместителей в арильных фрагментах, строением диаминового моста и протяженностью системы π-сопряжения [7, 8]. Таким образом, структурные особенности лигандного окружения, как и характер межмолекулярного взаимодействия, определяют энергию излучательного перехода и эффективность люминесценции комплексов цинка в поликристаллическом виде и растворах.
В работе рассмотрены электронные абсорбционные и эмиссионные свойства тетрадентатных ароматических азометинов N2O2-типа – N,N'-бис(салицилиден)-1,4-бутилендиамина – H2(salbn-1,4), N,N'-бис(5-бромсалицилиден)-1,4-бутилендиамина – H2(5Br-salbn-1,4) и комплексов Zn(II) на их основе (схема 1 ).
Схема 1 . Структурные формулы азометинов (а) и комплексов Zn(II) на их основе (б): Х = H – H2(salbn-1,4) и [Zn(salbn-1,4)]; X = Br – H2(5Br-salbn-1,4) и [Zn(5Br-salbn-1,4)].
Выбор азометиновых оснований для синтеза комплексов Zn(II) обусловлен предельным характером диаминового фрагмента −(CH2)4−, ограничивающим длину внутренней системы сопряжения и благоприятствующим тетраэдрическому строению координационного узла [ZnN2O2]. Люминесцентные свойства азометина H2(salbn-1,4), H2(5Br-salbn-1,4) и соответствующих комплексов цинка ранее не изучались.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез азометинов H2(salbn-1,4) и H2(5Br-salbn-1,4) проводили в условиях общего кислотного катализа ледяной уксусной кислотой.
Синтез H2(salbn-1,4). N-N'-бис(салицилиден)-1,4-бутилендиамин получали реакцией конденсации бутилендиамина-1,4 (Merck, 99%, 0.149 г, 1.69 ммоль) и салицилового альдегида (0.412 г, 3.38 ммоль, 10 мл этанола). После нагревания и перемешивания полученного раствора в течение 15 мин образовался осадок лимонно-желтого цвета. Вещество отфильтровали, промыли холодным этиловым спиртом, эфиром и высушили. Результаты элементного анализа (брутто-формула C18H20N2O2) – вычислено/найдено, %: С 72.97/72.84; Н 6.76/6.85; N 9.46/9.54. ИК-спектр, ν/см−1: ν(С=N) – 1632; ν(Ar−O) – 1285; ν(O−H) – 2864. Выход – 86%.
Синтез H2(5Br-salbn-1,4). N,N'-бис(5-бромсалицилиден)-1,4-бутилендиамин получали реакцией конденсации бутилендиамина-1,4 (Merck, 99%; 0.039 г, 0.44 ммоль) и 5-бромсалицилового альдегида (Aldrich, 98%, 0.18 г, 0.88 ммоль; 15 мл этанола). При смешивании реагентов образуется раствор желтого цвета, который затем нагревали в течение 10 мин. Выделившийся осадок желтого цвета отфильтровали, промыли этанолом, эфиром и высушили. Брутто-формула – C18H18N2O2Br2. Результаты элементного анализа – вычислено/найдено, %: С 47.58/47.46; Н 3.96/4.02; N 6.17/6.15. ИК-спектр, ν/см−1: ν(С=N) – 1633; ν(Ar−O) – 1281; ν(O−H) – 2864. Выход – 80%.
Синтез [Zn(salbn-1,4)]⋅H2O. Для получения комплекса к раствору H2(salbn-1,4) в этаноле (0.23 г, 0.77 ммоль; 10 мл спирта) добавляли насыщенный водный раствор Zn(CH3COO)2 ⋅ 2H2O (0.17 г, 0.77 ммоль). Полученную смесь перемешивали и нагревали. Выделившийся осадок бледно-желтого цвета отфильтровали, промыли горячим этанолом и высушили. Брутто-формула – C18H20N2O3Zn. Результаты элементного анализа – вычислено/найдено, %: С 57.19/57.06; Н 5.30/5.42; N 7.41/7.50. ИК-спектр, ν/см−1: ν(С=N) – 1628; ν(Ar−O) – 1278; ν(H2O) – 3550−3350. Выход – 73%.
Синтез [Zn(5Br-salbn-1,4)]⋅H2O. К раствору H2(5Br-salbn-1,4) (0.27 г, 0.59 ммоль; 15 мл этанола) при перемешивании и нагревании добавляли насыщенный водный раствор Zn(CH3COO)2 · 2H2O (0.13 г, 0.59 ммоль). Образовался осадок бледно-желтого цвета, который отфильтровали, промыли горячим этиловым спиртом и высушили. Брутто-формула – C18H18N2O3Br2Zn. Результаты элементного анализа – вычислено/найдено, %: С 40.34/40.26; Н 3.36/3.49; N 5.23/5.32. ИК-спектр, ν/см−1: ν(С=N) – 1623; ν(Ar−O) – 1280; ν(H2O) – 3650−3350. Выход – 68%.
Рис. 1.
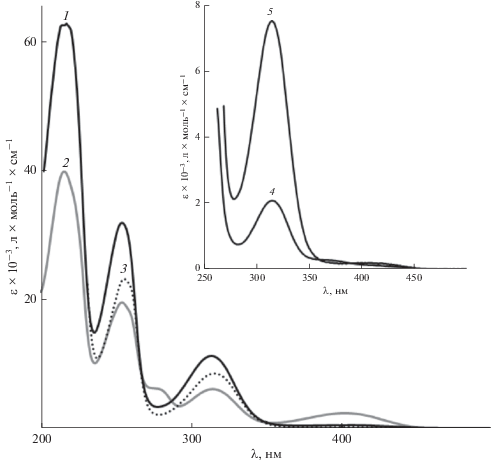
ЭСП H2(salbn-1,4) в CH3CN − (1); C2H5OH – (2); CH2Cl2 – (3); ДМФА – (4); ДМСО – (5). С = 0.1 мг/мл, 293 К.
ИК спектры пропускания азометинов и комплексов Zn(II) регистрировали в интервале 4000−400 см−1 (таблетки с KBr) на ИК-Фурье спектрометре “Shimadzu IR-Prestige 21”.
Электронные спектры поглощения (ЭСП) растворов азометина и комплекса Zn(II) записывали при 293 К в диапазоне 200−700 нм на спектрофотометре “Shimadzu UV 2550 PC”.
Cпектры люминесценции поликристаллических образцов, а также растворов комплекса Zn(II) в этаноле, ДМФА и ДМСО при 293 К получали с помощью спектрофлуориметр “Флюорат-02-Панорама”. Относительные квантовые выходы люминесценции (Фотн) рассчитывали по формуле Паркера [9]:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
ЭСП растворов H2(salbn-1,4) и H2(5Br-salbn-1,4) в этаноле, дихлорметане, ДМФА и ДМСО обусловлены спин-разрешенными переходами различной орбитальной природы. Основные параметры спектров приведены в табл. 1.
Таблица 1.
Характеристики ЭСП азометинов и комплексов Zn(II) в различных растворителях
| Соединение | C2H5OH, Z = 79.6 ккал · моль−1 |
ДМСО, Z = 71.1 ккал · моль−1 |
ДМФА, Z = 68.5 ккал · моль−1 |
CH2Cl2, Z = 64.2 ккал · моль−1 |
|---|---|---|---|---|
| λmax, нм (lgε) | λmax, нм (lgε) | λmax, нм (lgε) | λmax, нм (lgε) | |
| H2(salbn-1,4) | 215 (4.60); 255 (4.28); [278] (3.79); 313 (3.79); 402 (3.40) |
315 (3.78); [375] (2.90); [403] (3.42) |
315 (3.87); [375] (3.63); 415 (3.33) |
255 (4.36); 315 (3.90) |
| H2(5Br-salbn-1,4) | 220 (4.74); 250 (4.26); [277] (3.5); 326 (3.79); 409 (3.34) |
326 (3.89); 415 (3.04) |
326 (3.58); 415 (2.36) |
224 (4.83); 253 (4.31); 326 (3.92) |
| [Zn(salbn-1,4)] | − | [259] (4.38); [325] (3.25); 366 (3.72) | [272] (4.00); [321] (3.45); 367 (3.80) | − |
| [Zn(5Br-salbn-1,4)] | − | [269] (4.10); 374 (3.90) |
[268] (4.10); 373 (3.91) |
− |
Высокоинтенсивные полосы поглощения с максимумами в области 215−220 и 250−250 нм соответствуют ππ*-переходам в арильных фрагментах азометинов [11]; на их положение практически не влияет изменение спектроскопического параметра полярности растворителя Z (табл. 1, рис. 2). Полоса с максимумом в области 315 нм (326 нм – для H2(5Br-salbn-1,4)) обусловлена ππ*-переходами в азометиновых группах [12].
Рис. 2.
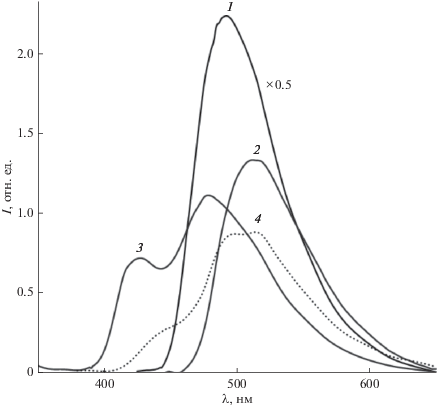
Спектры люминесценции поликристаллических образцов при 293 К: H2(salbn-1,4) – (1); H2(5Br-salbn-1,4) – (2); [Zn(salbn-1,4)] – (3); и [Zn(5Br-salbn-1,4)] – (4). λвозб: 420 нм – (1) и (2); 337 нм – (3) и (4).
В растворителях с высоким значением Z (спирты) и высокой нуклеофильностью (ДМФА, ДМСО) в ЭСП азометинов появляется дополнительная широкая полоса средней интенсивности с максимумом в области 400 нм, соответствующая nπ*-переходам в биполярных кето-иминных структурах – хиноидных формах [13, 14]. В ацетонитриле и дихлорметане данная полоса отсутствует.
В отличие от азометинов комплексы цинка растворяются только в ДМФА и ДМСО и имеют очень ограниченную (<0.1 мг/мл) растворимость в этаноле. Низкая растворимость подобных комплексов объясняется образованием кластерных структур за счет межмолекулярных донорно-акцепторных связей Zn–O–Zn [15]. Растворяющее действие ДМФА и ДМСО, очевидно, обусловлено координацией молекул растворителя, сопряженной с разрушением межмолекулярных связей.
При комплексообразовании практически не изменяются положение полос, соответствующих ππ*-переходам в арильных фрагментах. Вместе с тем, образование координационного узла приводит к разрушению кето-иминных структур и закономерному исчезновению “хиноидной”, а также незначительному батохромному смещению “азометиновой” полосы.
В ЭСП комплексов по сравнению с азометинами появляется дополнительная полоса средней интенсивности с максимумом при 367 нм. В литературе [16] имеются сведения об отнесении ее к переходу с переносом заряда от лиганда к металлу (ПЗЛМ), что согласуется с тетраэдрическим строением координационного узла. Полосы ПЗЛМ, как правило, батохромно смещаются с ростом параметра Z растворителя [17], однако, из-за малой растворимости комплексов данную закономерность проверить не удалось.
При 293 К исследуемые вещества люминесцируют в поликристаллическом виде и растворах. Согласно литературным данным [18], фотолюминесценция ароматических азометинов (оснований Шиффа) и соответствующих комплексов [Zn(Schiff)] обусловлена излучательной деградацией короткоживущих (τ < 1 мкс) синглетных электронно-возбужденных состояний (ЭВС) 1(π*−π)-типа.
По всей видимости, необходимым условием флуоресценции азометиновых оснований является наличие в их структуре гидроксигрупп арильного типа. В наших экспериментах показано, что азометины – производные бензальдегида, 3-метоксибензальдегида и 2-аминобензальдегида, не содержащие арильных гидроксигрупп, в твердом виде и растворах не люминесцируют.
Флуоресценция характерна для ароматических азометинов N2O2-типа в хиноидной форме, которая образуется при возбуждении в результате фотопереноса протона на атом азота иминогруппы [19]. Однако при рассмотрении фотохимического механизма образования люминесцирующего таутомера следует учитывать, что кристаллические азометины изначально содержат незначительное количество хиноидной формы, не связанной с фотопереносом протона. В частности, в рентгеновских фотоэлектронных спектрах азометинов N2O2-типа всегда присутствуют малоинтенсивные компоненты, отвечающие хиноидному кислороду и азоту с локализованным и делокализованным положительным зарядом [20], исчезающие при комплексообразовании.
При 293 K спектры люминесценции поликристаллических образцов H2(salbn-1,4) и H2(5Br-salbn-1,4) представляют собой широкие неструктурированные полосы с максимумами при 493 и 510 нм соответственно (рис. 2, кривые 1 и 2). Наблюдаемое батохромное смещение максимума флуоресценции H2(5Br-salbn-1,4) обусловлено участием в сопряжении p-орбиталей бром-арильных заместителей, понижающим энергию излучательного перехода. В отличие от азометинов полосы флуоресценции твердых образцов комплексов имеют многокомпонентный характер: 422, 475 и 518 нм для [Zn(salbn-1,4)] и 443, 495 и 515 нм – для [Zn(5Br-salbn-1,4)] (рис. 2, кривые 3 и 4). Предположительно, первые две компоненты эмиссионных полос комплексов имеют колебательную природу и соответствуют валентным колебаниям С=С-связей в арильных фрагментах, а дополнительное расщепление излучательного уровня обусловлено спецификой межмолекулярного взаимодействия в кристаллическом состоянии.
Поскольку люминесценция азометинов обусловлена наличием хиноидной формы, следует ожидать, что рост ее содержания повысит интенсивность эмиссионных полос. Для перевода азометинов в хиноидную (солевую) форму использовали депротонирование арильных гидроксигрупп щелочью в спиртовом растворе. Очевидно, это исключает возможность образования люминесцирующего таутомера в результате фотопереноса протона.
В качестве примера на рис. 3 представлена динамика изменения ЭСП этанольного раствора азометина H2(salbn-1,4) при постепенном добавлении щелочи. Концентрация NaOH в спирте была подобрана таким образом, чтобы свести к минимуму эффект разбавления, а общее количество добавленного NaOH эквивалентно депротонированию обеих гидроксигрупп. Постепенный рост поглощения в области 400 нм, соответствующей nπ*-переходу в хиноидной форме, однозначно свидетельствует о росте ее концентрации. Падение интенсивности полос с максимумами при 215 и 255 нм указывает на снижение ароматичности системы, а интенсивности полосы ππ*-перехода в иминогруппе (λmax = 313 нм) – на участие последней в стабилизации образующегося аниона. Изменения в ЭСП азометина, происходящие при его депротонировании, хорошо согласуются со схемой 2 делокализации отрицательного заряда в образующихся анионах:
Рис. 3.
Динамика изменения ЭСП, спектров возбуждения и люминесценции (на вставке) H2(salbn-1,4) в этанольном растворе (С = 0.05 мг/мл) при добавлении 1.0 × 10–3 М раствора NaOH в C2H5OH порциями по 0.2 мл.
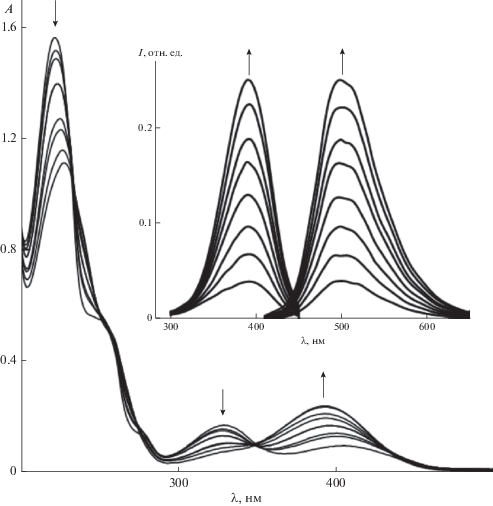
Схема 2 . Стабилизация аниона азометинового основания в спиртовом растворе при добавлении щелочи; X = H или Br.
Добавление щелочи вызывает не только изменения в ЭСП спиртовых растворов азометинов, но и предсказуемый рост интенсивности спектров возбуждения и люминесценции (рис. 3, вставка).
Исследуемые комплексы цинка интенсивно люминесцируют в разбавленных растворах в ДМФА и ДМСО. По сравнению с твердыми образцами спектры флуоресценции растворов теряют многокомпонентный характер, что, вероятно, обусловлено разрушением кластерных структур, снижением степени ππ-стекингового взаимодействия и координацией молекул растворителя.
Для растворов комплексов положение максимумов и формы излучательных полос не зависят от энергии возбуждающего света, а спектры возбуждения флуоресценции комплексов хорошо согласуются со спин-разрешенными оптическими переходами в ЭСП (рис. 4, кривые 1 и 2). Это подтверждает отнесение люминесценции исследуемых комплексов к излучательным переходам из низшего по энергии ЭВС 1(π*–π)-типа. Вероятность внутренней конверсии из высших ЭВС в низшее близка к единице.
Рис. 4.
Cпектры возбуждения люминесценции (1) и поглощения (2) раствора [Zn(salbn-1,4)] (293 K, ДМСО). Спектры люминесценции (λвозб = 370 нм, 293 K): [Zn(salbn-1,4)] в ДМСО (С = 2.5 × 10–5 M) (4) и этаноле (насыщенный раствор) (5); флуоресцеина в 0.1 M NaOH/H2O (3).

Значения квантовых выходов люминесценции Фотн разбавленных растворов азометинов и комплексов приведены в табл. 2. Из данных следует, что переход к комплексам Zn(II) приводит к значительному росту средней величины Фотн флуоресценции: в случае раствора [Zn(salbn-1,4)] в ДМСО – до 52%. Уменьшение эффективности безызлучательных процессов при переходе к комплексам [Zn(Schiff)] обусловлено более “жесткой” структурой азометинов в координированном состоянии.
Таблица 2.
Некоторые параметры фотолюминесценции азометинов и комплексов Zn(II)
| Растворитель/соединение | λmax, нм (Фотн) | |||
|---|---|---|---|---|
| H2(salbn-1,4) | H2(5Br-salbn-1,4) | [Zn(salbn-1,4)] | [Zn(5Br-salbn-1,4)] | |
| Поликристаллический образец | 493 (−) | 515 (−) | 422, 475, 518 (−) | 443, 495, 515 (−) |
| ДМФА | 452 (0.05) | 453 (0.03) | 450 (0.01) | 0.32 |
| ДМСО | 453 (0.05) | 455 (0.02) | 445 (0.52) | 0.18 |
| C2H5OH | 452 (<0.01) | 455 (<0.01) | 445 (0.21) | − |
С другой стороны, конформационная “гибкость” алифатического диаминового моста способствует тетраэдрическому строению координационного узла [ZnN2O2]. Это, в свою очередь, затрудняет стекинг-взаимодействие молекул комплекса и появление дополнительных ππ-состояний, ответственных за безызлучательную дезактивацию ЭВС. Уменьшение значений Фотн в случае бромзамещенных азометина и комплекса связано с тем, что присутствие тяжелых атомов брома повышает скорость процессов безызлучательной деградации энергии.
ЗАКЛЮЧЕНИЕ
В работе исследованы спектральные и люминесцентные свойства азометиновых оснований H2(salbn-1,4), H2(5Br-salbn-1,4) и их комплексов с цинком. Установлено, что перевод азометинов в солевую (хиноидную) форму приводит к существенному росту квантового выхода флуоресценции. Высокие квантовые выходы люминесценции в сине-фиолетовой области спектра растворов комплексов Zn(II) (~50%) обусловлены природой лигандного окружения и растворителя.
Список литературы
Wang S. // Coord. Chem. Rev. 2001. V. 251. № 1. P. 79–98. https://doi.org/10.1016/S0010-8545(00)00403-3
Ардашева Л.П., Шагисултанова Г.А. // ЖНХ. 1998. Т. 43. № 1. С. 92–99.
Canali L., Sherrington D.C., Deleuze H. // React. Funct. Polym. 1999. V. 40. № 2. P. 155–168.
Shahrokhian S., Fotouhi L. // Sensors and Actuators B: Chemical. 2007. V. 123. № 2. P. 942–949. https://doi.org/10.1016/j.snb.2006.10.053
Шагисултанова Г.А. // Теор. и эксп. химия. 1991. Т. 3. С. 330–337.
Evans R.C., Douglas P., Winscom C.J. // Coord. Chem. Rev. 2006. V. 250. № 15–16. P. 2093–2126. https://doi.org/10.1016/j.ccr.2006.02.007
Wong W.-Y., Lu G.-L., Liu L., Shi J.-X., Lin J. // Eur. J. Inorg. Chem. 2004. № 10. P. 2066–2077. https://doi.org/10.1002/ejic.200300677
Zheng S.-L., Zhang J.-P., Chen X.-M., Huang Z.-L., Lin Z.-Y., Wong W.-T. // Chem. Eur. J. 2003. V. 9. № 16. P. 3888–3896. https://doi.org/10.1002/chem.200304855
Калверт Дж., Питтс Дж. Фотохимия. М.: Мир, 1968. 672 с.
Беккер Г.О. Введение в фотохимию органических соединений. Л.: Химия, 1976. 384 с.
Estiu G.L., Jubert A.H., Costamagna J., Vargas J. // J. Molec. Struct.: Theochem. 1996. V. 367. P. 97–110. https://doi.org/10.1016/S0166-1280(96)04575-7
Alexander P.V., Sleet R.J. // Australian J. Chem. 1970. V. 23. № 6. P. 1183–1190. https://doi.org/10.1071/CH9701183
Alexander P.V., Sleet R.J. // Australian J. Chem. 1970. V. 23. № 6. P. 1183–1190. https://doi.org/10.1071/CH9701183
Estiu G.L., Jubert A.H., Costamagna J., Vargas J. // J. Molec. Struct.: Theochem. 1996. V. 367. P. 97–110. https://doi.org/10.1016/S0166-1280(96)04575-7
Ma C.T.Z., Lo A., Abdolmaleki A., MacLachlan M.J. // Organic Lett. 2004. V. 6. № 21. P. 3841–3844. https://doi.org/10.1021/ol0483549
Temel H., Çakir Ü., Otludil B., Uğraş I. // Synth. React. Inorg. Met.-Org. Chem. 2001. 31(8). P. 1323−1337. https://doi.org/10.1081/SIM-100107201
Ливер Э. Электронная спектроскопия неорганических соединений. В 2 т. Т. 1. М.: Мир. 1987. 491 с.
Гарновский Д.А., Бурлов А.С., Васильченко И.С., Ураев А.И., Коршунова Е.В. // Вестник ЮНЦ РАН. 2014. Т. 10. № 3. С. 35–53.
Tong Y.-P., Zheng S.-L., Chen X.-M. // Eur. J. Inorg. Chem. 2005. Iss. 18. P. 3734−3741. https://doi.org/10.1002/ejic.200500174
Шагисултанова Г.А., Щукарев А.В., Семенистая Т.В. // Коорд. химия. 2005. Т. 50. № 6. С. 991−1004.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий