Химия высоких энергий, 2020, T. 54, № 2, стр. 155-157
Фотовосстановление триплетного состояния бискарбоцианинового красителя
А. Е. Егоров a, *, А. А. Костюков a, Т. Д. Некипелова a, А. Ш. Радченко a, А. В. Шибаева a, М. А. Климович a, Ю. Е. Борисевич b, c, В. А. Кузьмин a
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
b Sao Paulo University
СЕР 14040-901 Ribeirao, Preto, Brazil
c Institute of Physics, Federal University of Goiânia
Goiânia, Brazil
* E-mail: ae.yegorov@gmail.com
Поступила в редакцию 26.09.2019
После доработки 26.09.2019
Принята к публикации 23.10.2019
Бискарбоцианиновые красители (БКЦ) обладают двумя полосами поглощения, возникающими в следствие диполь-дипольного взаимодействия. Данные соединения обладают высокой молярной экстинкцией в красной и ближней ИК области [1, 2]. Способность поглощать свет в области “терапевтического окна” рассматриваемых соединений хорошо согласуется с требованиями для применяемых в ФДТ фотосенсибилизаторов [3–6]. Заселение триплетного состояния при прямом фотовозбуждении дает возможность осуществления реакции быстрого фотопереноса электрона от доноров к триплету БКЦ. В работе [7] было установлено, что введение в структуру хромофора индотрикарбоцианинов нитроксильного радикала с частичной циклизацией полиметиновой цепи приводит к увеличению выхода триплета в результате ускорения процесса ИКК, что подтверждает полученные ранее данные по механизму тушения триплетных состояний цианиновых красителей нитроксильными радикалами [8]. Два процесса обусловливают тушение триплетного состояния в рассматриваемой системе: эффект парамагнитной частицы (ускорение ИКК) и фотоперенос электрона (образование комплекса с переносом заряда между триплетом красителя и нитроксильным радикалом, как донором электрона). Ранее было установлено, что при взаимодействии триплетных состояний бискарбоцианинов с нитроксильными радикалами происходит процесс полного переноса электрона [9]. Данный процесс имеет важное значение для установления химического механизма процесса фотосенсибилизации в фотодинамической терапии. Фотоперенос электрона приводит к образованию восстановленной формы БКЦ, которая при взаимодействии с молекулой кислорода образует интермедиат – супероксид анион-радикал, который разрушает различные клеточные структуры и приводит к процессам некроза и апоптоза.
В настоящей работе исследованы реакционная способность триплетных состояний бис-карбоцианинового красителя, 1,1'-ди-3,3,3',3'-тетраметил-бисиндокарбо-2,5-диметил-бензо[1,2-d:4,5-d']-бистиазол иодидa (БКЦ), и процесс фотовосстановления красителя при взаимодействии с донором электрона – аскорбиновой кислотой. Эксперименты проводили в пропаноле-1 при комнатной температуре. Удаление кислорода воздуха проводили методом вакуумирования.
Измерение спектров поглощения БКЦ проводили на спектрофотометре “Shimadzu UV-3101PC” в кварцевых кюветах (1 × 1 см) (λмакс1 = 518 нм (ε = 4.6 × 104 М−1 см−1), λмакс2 = 597 нм (ε = 1.5 × 105 М−1 см−1)). Кинетика гибели и спектры поглощения интермедиатов были измерены на установке импульсного фотолиза в кварцевых кюветах с длиной оптического пути 20 см при фотовозбуждении Xe лампой с энергией вспышки 80 Дж (15 мкс), с использованием комбинации светофильтров СЗС-23 и ЖС-17 (пропускание 500–600 нм), регистрацию осуществляли фотодиодом “ОРТ-101 BURR BROWN CORP” в области 400–1100 нм.
Фотовозбуждение раствора БКЦ (6 × 10–7 М) в пропаноле-1 в отсутствие кислорода приводит к образованию короткоживущего триплетного состояния красителя с максимумом при 630 нм и временем жизни около 200 мкс. В присутствии аскорбиновой кислоты (D) в концентрациях 10–6–10–5 М наблюдается ускорение гибели триплетного состояния. Из зависимости кинетики гибели триплета от концентрации аскорбиновой кислоты (рис. 1а, 1б) была вычислена константа скорости фотопереноса электрона на триплет БКЦ (k1). Значение константы фотопереноса электрона k1 = 2.4 × 109 М–1 с–1 близко к значению диффузионной константы скорости для пропанола-1, что свидетельствует об эффективности этого процесса в жидкой фазе. Аскорбиновая кислота необратимо реагирует с триплетом красителя.
Рис. 1.
Дифференциальные спектры поглощения интермедиатов БКЦ (6 × 10–7 М) в пропаноле-1 при импульсном фотолизе (200 мкс после вспышки): (1) в отсутствие (сплошная линия – триплетное состояние БКЦ) и (2) в присутствии аскорбиновой кислоты 1 × 10–4 М (штрих линия – анион-радикал БКЦ). Вставка: кинетика гибели триплета БКЦ при 1010 нм (а) в отсутствие и (б) в присутствии аскорбиновой кислоты (2 × 10–6 М), (в) –кинетика образования анион-радикала БКЦ при 440 нм в присутствии аскорбиновой кислоты (1 × 10–2 М).
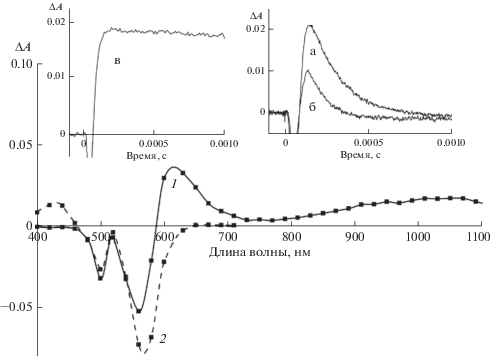
Тушение триплетного состояния БКЦ(Т) донором электрона приводит к появлению в дифференциальном спектре поглощения новой полосы с максимумом при 420 нм (рис. 1), которая соответствует полувосстановленной форме красителя ${{{\text{R}}}^{{\centerdot - }}}$ (анион-радикала) (рис. 1в), образовавшегося в результате одноэлектронного переноса от аскорбиновой кислоты на триплет красителя.
В результате фотопереноса электрона происходит разрушение одной из полиметиновых цепей в БКЦ, что проявляется в исчезновении расщепления синглетного уровня БКЦ.
Процесс разрушения хромофорной системы БКЦ в присутствии донора электрона (аскорбиновой кислоты), происходящий с участием триплетного состояния красителя, моделирует образование анион-радикала красителя в комплексе с белками при использовании БКЦ в качестве фотосенсибилизатора в процессах фотодинамической терапии [10]. В качестве донора электрона в этих процессах могут выступать ароматические аминокислоты (тирозин, триптофан), входящие в структуру белка (например, альбумина). Одним из путей гибели радикальной полувосстановленной формы БКЦ может быть реакция с молекулярным кислородом, в результате которой при переносе электрона образуется супероксид анион радикал, который участвует в механизме фотодинамической терапии. Этот интермедиат может взаимодействовать с различными клеточными структурами и приводить к гибели раковых клеток в результате процессов некроза и апоптоза. Образование супероксида в процессах фотодинамического разрушения раковых клеток в присутствии фотосенсибилизаторов БКЦ было установлено нами ранее методом конфокальной микроскопии [11].
Таким образом, на модельной системе установлено разрушение хромофорной структуры бискарбоцианинового красителя с образованием анион-радикала БКЦ при фотопереносе электрона от донора (аскорбиновая кислота) на триплетное состояние БКЦ.
Спектральные измерения были выполнены на спектрофотометрическом комплексе ЦКП ИБХФ РАН.
Список литературы
Давыдов А.С. Теория молекулярных экситонов. М.: “Наука”, 1968.
Борисевич Ю.Е. // Докл. АН СССР. 1978. Т. 241. С. 743.
Борисевич Ю.Е., Кузьмин В.А., Михайленко Ф.А., Дядюша Г.Г. // Докл. АН СССР. 1976. Т. 228. С. 375.
Борисевич Ю.Е., Кузьмин В.А., Дядюша Г.Г., Михайленко Ф.А. // Докл. АН СССР. 1976. Т. 229. С. 131.
Schaberle F.A., Kuzmin V.A., Borissevitch I.E. // Biochim. Biophys. Acta. 2003. V. 1621. Part 2. P. 183.
Murakami L.S., Ferreira L.P., Santos J.S., Silva R.S., Nomizo A., Kuzmin V.A., Borissevitch I.E. // Biochim. Biophys. Acta. 2015. V. 1850. P. 1150.
Jiao L., Song F., Cui J., Peng X. // Chem. Comm. 2018. V. 54. P. 9198.
Kuzmin V.A., Tatikolov A.S., Borisevich Y.E. // Chem. Phys. Lett. 1978. V. 53. P. 52.
Костюков А.А., Некипелова Т.Д., Кузьмин В.А. // Химия высоких энергий. 2019. Т. 53. № 1. С. 76.
Костюков А.А., Некипелова Т.Д., Радченко А.Ш., Головина Г.В., Климович О.Н., Штиль А.А., Debora C.K. Codograto, Pablo J. Goncalves, Andre L.S. Pavanelli, Lucimara P. Ferreira, Andre M. Amado, Борисевич Ю.Е., Кузьмин В.А. // Химия Высоких Энергий. 2017. Т. 51. № 2. С.161.
Radchenko A.S., Kostyukov A.A., Mestergazi M.G., Borissevitch I.E., Kuzmin V.A. // 17th International Congress on Photobiology. Book of Abstracts. P. 759.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий