Химия высоких энергий, 2020, T. 54, № 3, стр. 245-250
Биполярный вариант плазмоэлектрохимического синтеза углеродных наноструктур, декорированных MnOx
В. К. Кочергин a, Р. А. Манжос b, А. С. Коткин b, А. Г. Кривенко b, *
a Московский государственный университет им. М.В. Ломоносова, Химический факультет
119992 Москва, Россия
b Институт проблем химической физики Российской академии наук
142432 Московская обл., г. Черноголовка, пр. акад. Семенова, 1, Россия
* E-mail: krivenko@icp.ac.ru
Поступила в редакцию 05.12.2019
После доработки 05.12.2019
Принята к публикации 27.12.2019
Аннотация
Предложен новый одностадийный способ синтеза электрокатализатора восстановления кислорода на основе нанокомпозита малослойных графеновых структур и оксидов марганца. Показано, что использование биполярного варианта расщепления графита в режиме электролизной плазмы в растворах, содержащих соли марганца, позволяет получать графеновые наноструктуры, декорированные оксидами марганца, с высокой каталитической активностью в реакции восстановления кислорода, заключающейся в существенном снижении перенапряжения и увеличении величины тока восстановления кислорода.
ВВЕДЕНИЕ
Реакция восстановления кислорода (РВК) является основной катодной реакцией в топливных элементах и металл-воздушных батареях, а в качестве наиболее эффективных катализаторов для нее применяются Pt и ее сплавы. В то же время высокая стоимость платины и проблемы с толерантностью к метанолу и эксплуатационной стабильностью лимитирует их широкое использование [1]. Для преодоления этих проблем был разработан широкий ряд бесплатиновых электрокатализаторов, в том числе на основе оксидов переходных металлов в смеси с углеродными носителями, см. например, обзоры [2, 3]. Среди последних существенное внимание уделяется исследованиям оксидов марганца вследствие их высокой каталитической активности, минимального воздействия на окружающую среду и достаточно низкой стоимости [4–8]. Однако и на пути внедрения таких систем имеются определенные трудности, обусловленные многостадийностью и реальной сложностью производства электрокатализатора, включающей, как правило, технологически несвязанные процессы: синтез наноуглеродного носителя, приготовление оксида марганца того или иного состава и создание собственно нанокомпозита углерода и MnOх, что отражается в том числе и на их стоимостных характеристиках [2, 9, 10]. В этой связи необходимо отметить, что в последнее время получает все большее распространение электрохимический подход, который позволяет синтезировать малослойные графеновые структуры (МГС), допированые атомами p-элементов (O, S, N), а также нанокомпозиты МГС с оксидами переходных металлов в рамках одного электрохимического процесса [11–14]. Положительной стороной данного подхода является и широкий спектр физико-химических характеристик синтезируемых графеновых структур благодаря высокой вариабельности условий его проведения, включающей временные характеристики накладываемого напряжения, состав и температуру раствора электролита, использование моно- или биполярной схемы подачи потенциала. При этом данный метод во всех вариантах остается простым, эффективным и экологически чистым способом получения графеноподобных структур и их композитов.
Целью настоящей работы было дальнейшее развитие плазмоэлектрохимического синтеза МГС в биполярном варианте в плане его использования для создания эффективных электрокатализаторов РВК на основе накомпозитов МГС с оксидами марганца [15, 16]. В данной работе была реализована так называемая “закрытая” схема, в которой биполярные электроды находятся в различных электрохимических ячейках, а импульсы напряжения подаются на фидерные электроды, имеющие по сравнению с ними существенно большую площадь поверхности [17]. Варьирование режима расщепления и состава электролита в каждой из ячеек, позволяет в одном процессе одновременно получать два типа углеродных наноструктур, существенно различающихся по морфологии и химическому составу поверхностного слоя. Представляется очевидным, что изготовление электродных материалов путем сочетания в различных пропорциях синтезированных таким образом МГС расширит возможности для создания композитных электрокатализаторов с требуемыми свойствами.
МЕТОДИКА
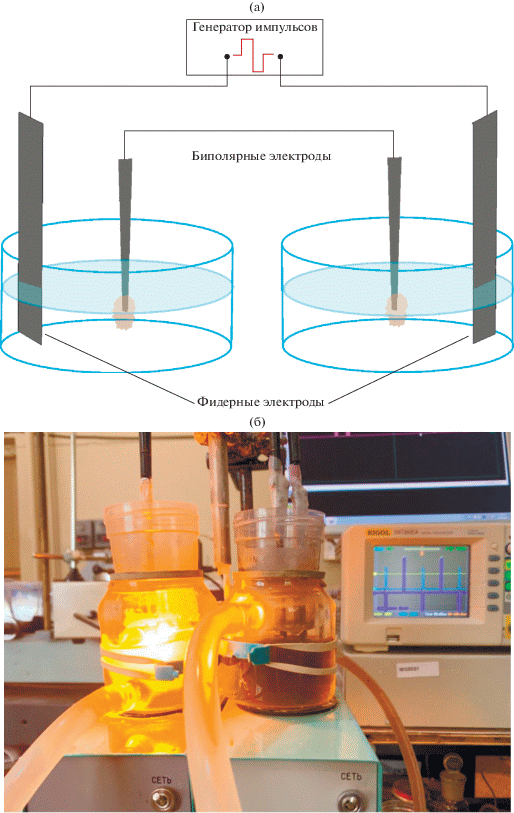
Схема установки и ее изображение приведено на рис. 1. Биполярные электроды представляли собой два стержня из графита ГР-280 длиной ~10 см сечением ~2 × 2 мм, соединенных между собой медным проводником. В качестве фидерных электродов использовали аналогичные графитовые стержни длиной ~10 см, сечением ~10 × 10 мм. Для достижения необходимой плотности тока на биполярных электродах использовали установку, разработанную в лаборатории лазерной электрохимии ИПХФ РАН, которая позволяет подавать на фидерные электроды заданную последовательность импульсов напряжения различной полярности амплитудой до 300 В, длительностью 10 мс и временем нарастания ~0.5 мкс. При достижении плотности тока >20 А/см2 на биполярных электродах происходило образование электролизной плазмы и наблюдалось взрывное испарение раствора, сопровождавшееся интенсивной световой и акустической генерацией, см. рис. 1б. Подробное описание установки и основных физических и химических процессов, характерных для расщепления графита на МГС под действием электролизной плазмы, приведены в [18–20]. Синтез МГС проводили в растворах разного состава в режиме чередующейся анодно-катодной плазмы, который реализуется при смене полярности подаваемых импульсов напряжения. В одной ячейке использовали раствор 1 М Na2SO4 + + 0.01 М MnSO4, в другой – 1 М Na2SO4. В первом растворе происходило образование суспензии МГС, декорированных оксидами Mn, а во второй ячейке были получены малослойные графеновые структуры, функционализированные кислородсодержащими группами.
Рис. 1.
Схема установки для плазмоэлектрохимического расщепления графита в биполярном варианте (а). Фотография установки в момент плазменной вспышки в одной из ячеек (б).
Исследования методом вольтамперометрии с линейной разверткой потенциала проводили в трехэлектродной ячейке на установке с вращающимся дисковым электродом ВЭД-06 (Вольта, Россия) с использованием потенциостата IPC Pro-L (Институт физической химии и электрохимии РАН им. А.Н. Фрумкина, Россия). Рабочим электродом служил стеклоуглеродный (СУ) диск диаметром 3 мм, запрессованный в тефлон, на поверхность которого наносился нанокомпозит, вспомогательным электродом – платиновая фольга, электродом сравнения – Ag/AgCl (насыщ. KCl) электрод, относительно которого приведены все величины потенциалов (E). Способ приготовления рабочих электродов на основе полученных нанокомпозитов не отличался от описанного в [21].
Образцы для сканирующей электронной микроскопии (СЭМ), рентгеновской фотоэлектронной спектроскопии (РФЭС) готовили путем покапельного нанесения на поверхность проводящей подложки обработанной ультразвуком водной суспензии МГС и последующей сушки на воздухе при комнатной температуре. Электронные микрофотографии исследуемых образцов были получены на сканирующем электронном микроскопе Zeiss SUPRA 25 (Carl Zeiss, Германия). РФЭ-спектры получали с помощью прибора Specs PHOIBOS 150 MCD (Specs, Германия) с использованием MgKα-излучения (1253.6 эВ). Исследованная площадь составляла 300–700 мкм2, а информационная глубина ~1–2 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
На рис. 2 приведено СЭМ-изображение осадка суспензии, полученной в растворе 1 М Na2SO4 + + 0.01 М MnSO4 (МГС/Mn) в режиме чередующейся анодно-катодной плазмы. Из изображения видно, что осадок состоит из агломератов, образованных графеноподобными структурами с характерными латеральными размерами в пределах от 0.02 до 0.20 мкм, а их поверхность декорирована мелкодисперсным оксидом марганца с характерными размерами структурных элементов менее 10 нм.
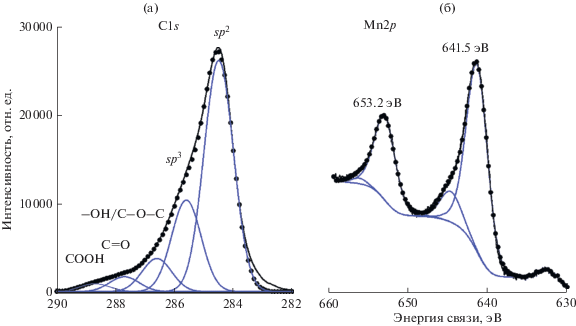
На рис. 3а приведен спектр С1s образца МГС/Mn, полученного в ячейке с раствором 1 М Na2SO4 + 0.01 М MnSO4, и его декомпозиция на отдельные пики с их отнесением, сделанным в соответствии с работами [22–25]. Линия C1s аппроксимируется пятью пиками, соответствующими энергиям связи атомов углерода в состоянии sp2- и sp3-гибридизации; гидроксильным группам и/или эфирным фрагментам (–OH/C–O–C); карбонильным C=O и карбоксильным COOH-группам. Поверхностные концентрации кислородсодержащих групп составляют 8.5, 4.0 и 3.0 ат. % соответственно. На рис. 3б приведен спектр высокого разрешения Mn2p образца МГС/Mn. Спектр состоит из двух основных пиков, соответствующих 2p3/2 и 2p1/2 спин-орбитальным компонентам. Разность энергий между этими пиками составляет 11.7 эВ, что согласуется с литературными данными для смешанного оксида марганца Mn3O4 [26, 27]. Декомпозиции пиков 2p3/2 и 2p1/2 содержат по две составляющие с максимумами при 641.4, 644.9, и 653.1, 655.6 эВ. Наличие двух компонент для каждого из 2p пиков указывают, что Mn присутствует в двух степенях окисления (Mn3+ и Mn2+), что означает присутствие Mn3O4 в нанокомпозите.
Рис. 3.
РФЭ-спектры высокого разрешения С1s (а) и Mn2p (б) осадков суспензий, синтезированных в растворе 1 М Na2SO4 + 0.01 М MnSO4.
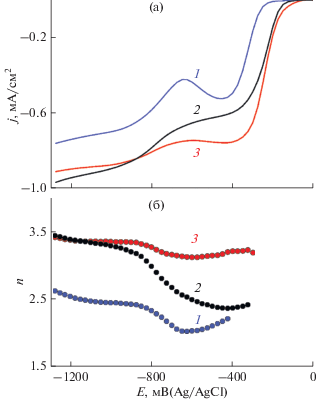
Кинетика РВК для исходного СУ-электрода и электродов на основе нанокомпозитов МГС и МГС/Mn была исследована методом вращающегося дискового электрода, см. рис. 4а. Для всех электродов на вольтамперограммах наблюдалось увеличение предельного тока с увеличением скорости его вращения ω, пропорциональное ω0.5, что указывает на диффузионное ограничение протекания исследуемой реакции. Из рис. 4а видно, что каталитическая активность нанокомпозитов заметно превышает таковую для СУ и заключается в существенном уменьшении перенапряжения РВК η на ~110 мВ и увеличении тока реакции. При этом если значения η для МГС и МГС/Mn близки, то величины токов на последнем значительно больше. Число электронов n, участвующих в восстановлении О2, определялось с использованием уравнения Коутецкого–Левича [7]. Вольтамперограммы регистрировались при изменении частоты вращения электрода в диапазоне 900–6400 об./мин и скорости развёртки потенциала 10 мВ/с. Далее величины плотности тока j при различных потенциалах E строились в координатах Коутецкого–Левича j – ω–0.5 и по значениям наклона полученных прямых определялись n, E-зависимости, см. рис. 4б. Для СУ значения n находятся в диапазоне ~2.1–2.3 при E > –700 мВ, что типично для такого типа электродов [28, 29]. В то же время, для МГС/Mn число электронов, участвующих в электродной реакции, уже при E ≈ –300 мВ достигает ~3.2–3.4, что свидетельствует о значительной каталитической активности данного нанокомпозита. Необходимо отметить, что для МГС значения n, близкие к числу переносимых электронов для МГС/Mn, достигаются только при E < –1000 мВ. Из рис. 4а, б следует, что наблюдаемая для МГС ярко выраженная первая катодная волна соответствует переносу ~2.5 электронов, что заметно выше, чем было бы в случае только двухэлектронного восстановления O2 в щелочных растворах с образованием ${\text{HO}}_{2}^{ - }$ (реакция 1), типичного для углеродных материалов. Можно предположить, что на поверхности МГС, декорированной кислородсодержащими функциональными группами, имеются в относительно малом количестве активные центры, на которых происходит “прямое” четырехэлектронное восстановление О2 в соответствии с реакцией (2) [30–32]. При более отрицательных потенциалах, начиная с E ≈ –600 мВ наблюдается вторая волна, выходящая при E < –1000 мВ на уровень переноса 3.3 электронов, по-видимому, обусловленная увеличением доли четырехэлектронного восстановления кислорода (реакция 1) в общем процессе [33]:
(1)
${{{\text{O}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2e}} \to {\text{HO}}_{{\text{2}}}^{--} + {\text{O}}{{{\text{H}}}^{--}},$(2)
${{{\text{O}}}_{{\text{2}}}} + {\text{2}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{4e}} \to {\text{4O}}{{{\text{H}}}^{--}}.$Рис. 4.
Вольтамперные (а) и n, E (б) зависимости для различных электродов: 1 – СУ, 2 – СУ + МГС, 3 – СУ + МГС/Mn. 0.1 М KOH без деаэрации, v = 10 мВ/с, ω = 2000 об./мин.
Другая ситуация наблюдается для МГС/Mn. В этом случае первая волна отвечает смешанному механизму восстановления кислорода, включающему преимущественно четырехэлектронный процесс (реакция 2) и частичное двухэлектронное восстановление (реакция 1). Также пероксид водорода, образующийся на углеродном компоненте нанокомпозита (МГС), может восстанавливаться до воды (реакция 3) или диспропорционировать (реакция 4) на частицах Mn3O4 [33–35]:
(3)
${\text{HO}}_{{\text{2}}}^{--} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} + {\text{2e}} \to {\text{3O}}{{{\text{H}}}^{--}},$(4)
${\text{2HO}}_{{\text{2}}}^{--} \to {{{\text{O}}}_{{\text{2}}}} + {\text{2O}}{{{\text{H}}}^{--}}.$Такой механизм РВК характерен для электрокатализаторов на основе оксидов переходных металлов. Полученные результаты близки к имеющимся в литературе данным по многочисленным электрокаталитическим системам с использованием оксидов марганца, находящихся на поверхности различных графеновых структур [4–7, 33]. Хотя точный механизм работы активного центра катализа РВК неизвестен, не вызывает сомнений, что наблюдаемая для МГС/Mn каталитическая активность связана с присутствием на поверхности как Mn2+, так и Mn3+ ионов. Можно предположить, что адсорбция O2 и интермедиатов РВК на оксидных частицах Mn3O4 способствует протеканию восстановления кислорода по четырехэлектронному механизму.
ЗАКЛЮЧЕНИЕ
Продемонстрирована возможность синтеза беcплатиновых катализаторов на основе нанокомпозитов углеродных структур с окислами переходных металлов в рамках электрохимического расщепления графита в режиме импульсной электролизной плазмы при биполярной схеме подключения потенциала. Показано, что использование электролитов, содержащих соли марганца, позволяет синтезировать МГС, декорированные Mn3O4 и обладающие высокой электрокаталитической активностью в реакции восстановления кислорода.
Список литературы
Xia W., Mahmood A., Liang Z.B., Zou R.Q., Guo S.J. // Angew Chem Int Ed. 2016. V. 55. P. 2650
Stacy J., Regmi Y.N., Leonard B., Fan M. // Renewable and Sustainable Energy Reviews. 2017. V. 69. P. 401.
Kuznetsov D.A., Han B., Yu,Y., Rao R.R., Hwang J., Román-Leshkov Y., Shao-Horn Y. // Joule. 2018. V. 2. P. 1.
Ryabova A.S., Bonnefont A., Simonov P.A., Dintzer T., Ulhaq-Bouillet C., Bogdanova Y.G., Tsirlina G.A., Savinova E.R. // Electrochimica Acta. 2017. V. 246. P. 643.
Hazarika K.K., Goswami C., Saikia H., Borah B.J., Bharali P. // Molecular Catalysis. 2018. V. 451. P. 153.
Ahmad Shah S.S., Najam T., Cheng C., Chen S., Xiang R., Peng L., Lu L., Ding W., Wei Z. // Electrochimica Acta. 2018. V. 272. P. 169.
Roche I., Chaînet E., Chatenet M., Vondrák J. // The J. Physical Chemistry C. 2006. V. 4111. P. 1434
Kuzmin S.M., Chulovskaya S.A., Parfenyuk V.I. // Electrochimica Acta. 2018. V. 292. P. 256.
Malkhandi S., Trinh P., Manohar A.K., Jayachandrababu K.C., Kindler A., Prakash G.K.S., Narayanan S.R. // J. Electrochem. Soc. 2013. V. 160. F943.
Wang Y., Xing Ding, Wang F., Li J., Song S., Zhang H. // Chemical Science. 2016. V. 7. P. 4284.
Ejigu A., Fujisawa K., Spencer B.F., Wang B., Terrones M., Kinloch I.A., Dryfe R.A.W. // Advanced Functional Materials. 2018. V. 28. 1804357.
Chen D., Wang F., Li Y., Wang W.-W., Huang T.-X., Li J.-F., Novoselov K.S., Tian Z.-Q., Zhan D. // Chemical Communications. 2019. V. 55. P. 3379.
Paredes J.I., Munuera J.M. // J. Mater. Chem. A. 2017. V. 5. P. 7228.
Ejigu A., Le Fevre L.W., Fujisawa K., Terrones M., Forsyth A.J., Dryfe, R.A.W. // ACS Applied Materials & Interfaces. 2019. V. 11. P. 23261.
Krivenko A.G., Manzhos R.A., Kotkin A.S. // High Energy Chem. 2018. V. 52. P. 272.
Van Thanh D., Li L.-J., Chu C.-W., Yen P.-J., Wei K.-H. // RSC Advances. 2014. V. 4. P. 6946.
Sequeira C.A.C., Cardoso D.S.P., Gameiro M.L.F. // J. Chem. Eng. Com. 2016. V. 203. Iss. 8.
Krivenko A.G., Manzhos R.A., Kotkin A.S., Kochergin V.K., Piven N.P. // Instrum. Sci. & Technol. 2019. V. 47. P. 535.
Krivenko A.G., Manzhos R.A., Kochergin V.K., Malkov G.V., Tarasov A.E., Piven N.P. // High Energy Chemistry. 2019. V. 53. P. 254.
Belkin P.N., Kusmanov S.A. // Review Surface Engineering and Applied Electrochemistry. 2016. V. 52. P. 531.
Vasiliev V.P., Kotkin A.S., Kochergin V.K., Manzhos R.A., Krivenko A.G. // J. Electroanalyt. Chem. 2019. V. 851. 113440.
Shirley D.A. // Physica Scripta. 1975. V. 11. P. 117.
Kim H.W., Ross M.B., Kornienko N., Zhang L., Guo J., Yang P., McCloskey B.D. // Nature Catalysis. 2018. V. 1. P. 282.
Li O.L., Chiba S., Wada Y. // J. Materials Chemistry A. 2017. V. 5. P. 2073.
Gardner S.D., Singamsetty C.S.K., Booth G.L., He G.-R. // Carbon. 1995. V. 33. P. 587.
Duan J.J, Chen S., Dai S., Qiao S.Z. // Adv. Funct. Mater. 2014. V. 24. P. 2072.
Gao F., Qu J.Y., Zhao Z.B., Zhou Q., Li B.B., Qiu J.S. // Carbon. 2014. V. 80. P. 640.
Krivenko A.G., Manzhos R.A., Protasova S.G. // Electrochem. Com. 2018. V. 96 P. 57.
Taylor R.J., Humffray A.A. // J. Electroanal. Chem. 1975. V. 64. P. 63.
Shen A., Zou Y., Wang Q., Dryfe R.A.W., Huang X., Dou S., Dai L., Wang S. // Angew. Chem. 2014. V. 126. P. 1.
Serban N.S., Hussainova I., Ivanov R., Colavita P.E. // ACS Catal. 2016. V. 6. P. 5215.
Toh S.Y., Loh K.S., Kamarudin S.K., Daud W.R.W. // Electrochim. Acta. 2016. V. 199. P. 194.
Araújo M.P., Nunes M., Rocha I.M., Pereira M.F.R., Freire C. // J. Materials Science. 2019. V. 54. P. 8919.
Qian Y., Lu S., Gao F. // Materials Letters. 2011. V. 65. P. 56.
Lima F.H.B., Calegaro M.L., Ticianelli E.A. // J. Electroanal. Chem. 2006. V. 590. P. 152.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий



