Химия высоких энергий, 2020, T. 54, № 4, стр. 259-262
Влияние непрямых электронных переходов в оксиде индия на Фотоадсорбцию кислорода и фотокаталитическое окисление моноксида углерода
В. С. Захаренко a, *, Е. Б. Дайбова b
a Институт катализа им. Г.К. Борескова Сибирского отделения Российской академии наук
630090 г. Новосибирск, Россия
b Сибирский научно-исследовательский институт сельского хозяйства и торфа
634050 г. Томск, Россия
* E-mail: zakh@catalysis.ru
Поступила в редакцию 30.01.2020
После доработки 30.01.2020
Принята к публикации 16.02.2020
Аннотация
Обнаружена фотокаталитическая активность оксида индия(III) в реакции окисления моноксида углерода при поглощении квантов света из области непрямых электронных переходов (энергии квантов <2.9 эВ). Определены квантовые выходы и спектральные зависимости квантовых выходов фотокаталитического окисления моноксида углерода и фотоадсорбции кислорода. Исследованы адсорбционные, фотоадсорбционные и фотокаталитические свойства микрочастиц оксида индия.
МЕТОДИКА ЭКСПЕРИМЕНТА
Оксид индия (In2O3) получали из азотнокислого индия осаждением аммиаком при комнатной температуре. Осадок фильтровали и промывали водой, затем сушили на воздухе при температуре 400 К. Для полного удаления анионов ${\text{NO}}_{3}^{ - }$ осадок прогревали на воздухе при температуре 570 К в течение 1.5 ч, а затем прокаливали при 700 К в течение 2 ч. Полученный порошкообразный оксид индия имел удельную поверхность 4 м2/г с размерами пор от 22 Å до 50 Å.
Изучаемые образцы In2O3 состояли из одной фазы кубической сингонии с параметром элементарной ячейки а равном 10.570 Å. Измеренный в работе [1] параметр а для наноструктурированной тонкой пленки In2O3 равнялся 10.09 Å.
Фазовый состав образцов In2O3 определяли методом рентгенофазового анализа на дифрактометре “Shimadzu XRD-6000” c использованием CuKα-излучения ($\lambda $ = 1.5418 Å) без фильтра. Анализ фазового состава проведен с помощью баз данных PCPDFWIN и программы полнопрофильного анализа POWDER CELL 2.4 и PDF 4+.
Определение параметров пористой структуры и удельной поверхности материалов проводили с помощью автоматического анализатора “TriStar II 3020 Micromeritics” (США) методом многоточечного измерения по низкотемпературной адсорбции азота. Перед определением удельной поверхности образцы дегазировали в вакууме 1 × × 10–4 Па при температуре 473 К в течение 2 ч.
Образцы наносили из водной суспензии в виде тонкого слоя на стенки реактора из оптического кварца, по конструкции представляющего аналог абсолютно черного тела.
Состав газов, выделяющихся с поверхности образцов, контроль чистоты, используемых газов, и анализ продуктов реакции проводили конденсационным и масс-спектрометрическим (с помощью масс-спектрометра АПДМ-1) методами.
Для освещения образцов применяли осветитель ОСЛ-1 с ртутной лампой ДРШ-250 и тепловым водяным фильтром. Для выделения определенных участков спектра излучения ртутной лампы использовали интерференционные фильтры.
Квантовый выход фотоадсорбции или фотокаталитического окисления определяли, как отношение числа фотоадсорбированных молекул или числа прореагировавших молекул моноксида углерода к числу поглощенных квантов в начальный момент времени освещения.
Спектры диффузного отражения регистрировали на спектрофотометре SPECORD M-40.
Более подробно методика эксперимента приведена в работе [2].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные образцы оксида индия выдерживали длительное время на воздухе и затем снимали спектры поглощения.
Спектр поглощения порошкообразного оксида индия, длительное время выдержанного на воздухе, приведен на рис. 1, кривая 1. В отличие от спектров поглощения порошкообразного диоксида титана, полученного диспергированием монокристалла рутила [3], и спектра поглощения плазмотронного непористого оксида цинка [4] (рис. 1, кривые 2 и 3, соответственно), спектр поглощения оксида индия не имеет области резкого увеличения поглощения.
Рис. 1.
Спектры поглощения относительно порошкообразного оксида магния: 1 – оксид индия(III); 2 – диоксид титана из монокристалла рутила; 3 – непористый оксид цинка.
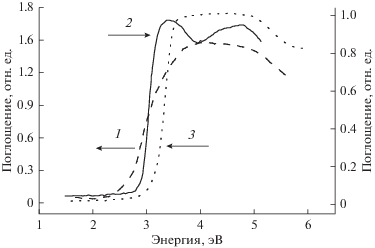
Согласно спектру для оксида индия (рис. 1) поглощение начинается с 2.4 эВ и соответствует непрямым электронным переходам [5, 6]. Затем следует полоса поглощения (энергия квантов >2.9 эВ), связанная с переходами электронов с потолка валентной зоны на дно зоны проводимости, разрешенные после снятия запрета на эти переходы из-за приготовления наноструктурированных образцов оксида индия [6, 7]. Прямые разрешенные переходы для In2O3 наблюдаются при энергиях больших 3.75 эВ [7, 8].
Особенность оксида индия в том, что в его спектре поглощения, наряду с собственным поглощением, связанным с прямыми электронными переходами, наблюдается собственное поглощение, связанное с непрямыми электронными переходами. В результате непрямых переходов, так же, как при прямых переходах, происходит образование подвижных электронов в зоне проводимости и подвижных “дырок” в валентной зоне оксида индия. Поглощение, связанное с непрямыми электронными переходами, имеет меньшую величину, чем поглощение в результате прямых переходов [9].
Для наблюдения фотоадсорбции и фотодесорбции газов достаточно поглощения квантов излучения с последующим образованием или свободных, подвижных электронов в зоне проводимости, или “дырок” в валентной зоне [10]. Однако для протекания фотокаталитических реакций необходимо совместное образование и электронов в зоне проводимости, и “дырок” в валентной зоне [11].
В отсутствие освещения при комнатной температуре с поверхности микрочастиц оксида индия, выдержанного длительное время на воздухе, выделяются, в основном, вода (порядка монослоя поверхности оксида индия) и углекислый газ (~10% монослоя), а также, в небольшом количестве моноксиды углерода и азота (~1%). По условиям эксперимента вода остается в реакционном объеме, а диоксид углерода частично откачивается.
Исследование фотоадсорбции кислорода на поверхности оксида индия показало, что область фотоадсорбционной активности больше спектральной области поглощения (рис. 2, кривая 1). Оксид индия имеет длинноволновый край спектра действия фотоадсорбции кислорода при длинах волн около 2 эВ (рис. 2, кривая 2). Максимум спектральной зависимости квантового выхода фотоадсорбции кислорода на In2O3 находится в области энергий квантов около 2.9 эВ. Край поглощения In2O3 соответствует энергии фотонов около 2.4 эВ. Таким образом, длинноволновая граница фотоадсорбционной активности выходит за длинноволновый край поглощения оксида индия. Максимум активности лежит в области поглощения, связанного с непрямыми переходами. Падение квантового выхода фотоадсорбции в области поглощения, связанного с прямыми переходами, вероятно, происходит из-за резкого уменьшения площади освещаемой поверхности частиц порошкообразного In2O3 при переходе в область более эффективного собственного поглощения из-за увеличения коэффициента поглощения квантов излучения.
Рис. 2.
Спектральные зависимости: 1 – поглощения оксида индия относительно оксида магния; 2 – квантового выхода фотоадсорбции кислорода; 3 – квантового выхода фотокаталитического окисления моноксида углерода.
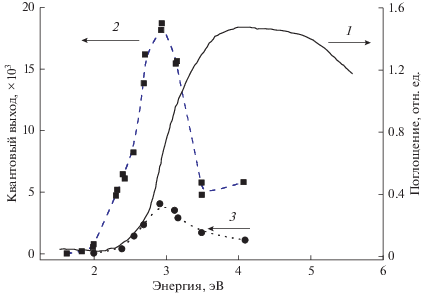
Фотоадсорбция кислорода на оксиде индия имеет воспроизводимый характер в случае, если перед фотоадсорбцией оксид прогревали в вакууме ~10–3 Па в течение 1 ч при температуре 680 К.
Характеристикой активности фотокатализатора является спектральная зависимость квантового выхода фотокаталитической реакции. Как удельная активность для реакций темнового катализа [12], так и квантовые выходы фотокаталитических реакций, главным образом, определяются химическим составом поверхности катализатора. Наиболее существенные изменения химического состава поверхности катализатора происходят в результате взаимодействия катализатора с реакционной смесью и продуктами реакции. В начальный период освещения скорость фотокаталитического окисления СО уменьшается из-за установления квазистационарного состояния поверхности оксида металла [13] в присутствии стехиометрической смеси 2СО + О2. Измерение фотокаталитической активности оксида индия в реакции окисления моноксида углерода проводилось после достижения оксидом индия стационарной активности.
На рис. 2 представлены спектральные зависимости квантовых выходов фотоиндуцированных процессов на оксиде индия. Фотокаталитическое окисление моноксида углерода наблюдается при энергии квантов более 2.4 эВ, т.е. в полосе собственного поглощения, связанного с непрямыми переходами в оксиде индия (спектр диффузного отражения оксида индия на рис. 2, кривая 1).
Фотокаталитическое окисление моноксида углерода в этой полосе поглощения характеризуется малой отрицательной энергией активации (около одной ккал/моль), что хорошо согласуется с предлагаемым в работе [14] механизмом фотокаталитического окисления, согласно которому взаимодействие моноксида углерода происходит с поверхностным решеточным кислородом в момент его разрядки подвижной свободной “дыркой” валентной зоны оксида металла. Первый порядок реакции фотокаталитического окисления по моноксиду углерода при освещении монохроматическим светом с энергией 2.84 эВ также соответствует такому механизму.
Спектральная зависимость фотокаталитического окисления моноксида углерода на In2O3 (рис. 2, кривая 3) относится к спектрам действия двух процессов. В областях непрямых переходов In2O3 (энергии квантов <2.9 эВ) и прямых переходов (>2.9 эВ) она характеризует процесс фотокаталитического окисления моноксида углерода. Для оксида индия квантовый выход в полосе непрямых переходов существенно больше квантового выходa в полосе прямых электронных переходов.
ЗАКЛЮЧЕНИЕ
Обнаружена фотокаталитическая активность оксида индия(III) в реакции окисления моноксида углерода при поглощении квантов света из области непрямых электронных переходов в оксиде индия (энергии квантов <2.9 эВ). Определены квантовые выходы и спектральные зависимости квантовых выходов фотокаталитического окисления моноксида углерода и фотоадсорбции кислорода. Исследованы адсорбционные, фотоадсорбционные и фотокаталитические свойства микрочастиц оксида индия.
Список литературы
Khan M.A.M., Khan W., Ahamed M., Alhoshan M. // Material Lett. 2012. V. 79. № 1. P. 119.
Zakharenko V.S., Daibova E.B. // High Energy Chemistry. 2014. V. 48. № 2. P. 93.
Захаренко В.С., Филимонов А.П. // Оптика атмосферы и океана. 2009. Т. 22. № 6. С. 611.
Zakharenko V. In Book “Rutile Properties, Synthesis and Applications”. Ed. Jim Low, New York, Nova, 2012.
Weiher R.L., Lay R.P. // J. Applied Phys. 1966. V. 37. № 1. P. 299.
Ховив А.М., Афонин Н.Н., Логачева В.А., Герасименко Ю.А., Лукин А.Н., Лобанов М.В., Шамари-на Ю.Ю. // Конденсированные среды и межфазные границы. 2014. Т. 16. № 3. С. 361.
Форш Е.А., Форш П.А., Кашкаров П.К. // Физика и техника полупроводников. 2015. Т. 49. Вып. 9. С. 1184.
Walsh A., Da Silva J.L.F., Wai S.-H.,Korber C., Klein A., Piper L.F.J., De Masi A., Smith K.E., Panaccione G., Torelli P., Payne D.J., Bourlange A., Egdell R.G. // Phys. Rev. Lett. 2008. V. 100. P. 167402.
Вавилов В.С. Действие излучений на полупроводники. М.: Физматгиз. 1963.
Солоницын Ю.П. // Кинетика и катализ. 1966. Т. 7. № 3. С. 480.
Zakharenko V.S. // Catalysis Today. 1997. V. 39. № 3. P. 243.
Боресков Г.К. Гетерогенный катализ. М.: Наука. 1986.
Захаренко В.С., Черкашин А.Е., Кейер Н.П. // React. Kinet. Catal. Lett. 1974. Т. 1. № 3. С. 381.
Пармон В.Н., Захаренко В.С. Фотокатализ и фотосорбция в земной атмосфере. Химия в интересах устойчивого развития. 2001. Т. 9. № 3. С. 461.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий


