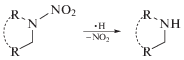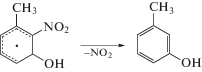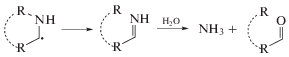Химия высоких энергий, 2020, T. 54, № 5, стр. 394-398
Электронно-лучевая очистка воды от 2,4,6-тринитротолуола и гексогидро-1,3,5-тринитро-1,3,5-триазина
Ю. Ким a, А. В. Пономарев b, *, Б. Г. Ершов b
a EB Tech Co., Ltd. 170-9 Techno 2-ro Yuseong-gu Daejeon
34028 Republic of Korea
b ФГБУН Институт физической химии и электрохимии им. А.Н. Фрумкина РАН
119071 Москва, Ленинский просп., 31, корп. 4, Россия
* E-mail: ponomarev@ipc.rssi.ru
Поступила в редакцию 07.04.2020
После доработки 07.04.2020
Принята к публикации 20.04.2020
Аннотация
Исследована радиолитическая деградация 2,4,6-тринитротолуола и гексогидро-1,3,5-тринитро-1,3,5-триазина в индивидуальных водных растворах и в реальной сточной воде в струйном режиме под действием пучка ускоренных электронов. Вследствие последовательных процессов денитрования, окисления и декарбоксилирования в растворах увеличивается степень минерализации органических соединений и их биоразлагаемость. Выходы радиолитической деградации 2,4,6-тринитротолуола и гексагидро-1,3,5-тринитро-1,3,5-триазина составляют около 0.027 и 0.064 мкмоль/Дж, а соответствующие дозы их полупревращения достигают 10 кГр и 1.8 кГр. Доказана высокая эффективность очистки реального стока от 2,4,6-тринитротолуола при последовательном применении коагуляции, облучения и биологической обработки.
В производстве 2,4,6-тринитротолуола (тротил, TNT) и гексогидро-1,3,5-тринитро-1,3,5-триазина (гексоген, RDX) неизбежно образуются сточные воды, требующие обезвреживания. Растворенные TNT и RDX обладают высокой токсичностью и канцерогенностью [1, 2]. Они легко аккумулируются в почве, растениях и живых организмах, вызывая мутации последних. Сточная вода, содержащие TNT и его производные, нередко именуется “красной” водой. Обычно ее обезвреживают методами выпаривания и сжигания. Но такая обработка порождает опасные отходы (золу и газы) и требует слишком больших затрат тепла. Полагают [1–3], что было бы более разумным использовать методы биологической очистки. Однако TNT и RDX имеют очень низкую биоразлагаемость – исходные соотношения БПК/ТОС и БПК/ХПК (где БПК – биохимическое потребление кислорода, ТОС – общее содержание органического углерода и ХПК – химическое потребление кислорода) для растворов TNT и RDX составляют менее 0.1. Соответственно, биохимической обработке должны предшествовать операции, повышающие биоразлагаемость компонентов красной воды. Радиолиз может рассматриваться как один из методов разложения органических нитросодержащих соединений [4–8], а также как удобный прием повышения биоразлагаемости органических примесей в воде [9]. В настоящей работе исследуется влияние облучения ускоренными электронами (далее ЭЛО – электронно-лучевая обработка) на состав и показатели красной воды и модельных растворов TNT и RDX.
МЕТОДИКА ЭКСПЕРИМЕНТА
Исследовались растворы, содержащие 120 и 50 мг дм–3 TNT и RDX, соответственно, предоставленные производителем взрывчатых веществ в Республике Корея. Соответствующие пределы растворимости этих соединений при 20°С составляют 130 и 60 мг/дм3. Содержание общего органического углерода (TOC) определяли на приборе Shimadzu 5000A TOC Analyzer. Для определения концентрации TNT, RDX и органических кислот использовали высокоэффективную жидкостную хроматографию (Hewlett Packard 1050 Series). TNT и RDX определяли из ацетонитрильной фазы с использованием шприцевого микрофильтра Acrodisk-13 0.2 мкм (Gelman Sciences, Ahn Arbor, MI) и колонки с обращенной фазой C18 5 мкм (ZO-RBAX SB-C18, Agilent Tech., Santa Clarita, CA). Для анализа органических кислот использовали колонку C-610H, Supelcogel, Bellefonte, PA. Общий анализ органических продуктов проводился с использованием GC/MS (электронный удар) и методик [10]. Образец красной воды содержал 4.1% Na2SO3; 6.0% NaNO3; 2.9% NaNO2 и около 12 вес. % органических соединений и их солей (включая 2,4,5-TNT – 5.0%; 2,3,4-TNT – 2.1%; 2,3,6-TNT – 0.4%; гексанитробензол – 3.5%; тринитробензойная кислота – 0.2%; нитроформиат – 0.2% и 2,4,6-TNT – следы). Исходные показатели красной воды: ХПКCr = 1490 ± ± 30 мг/дм3; БПК20 = 170 ± 13 мг/дм3; общее содержание азота (TN) = 690 ± 21 мг/дм3; цветность по платиново-кобальтовой шкале 68700 ± 100 градусов; содержание взвешенных веществ 1350 ± ± 25 мг/ дм3. Образцы красной воды облучали после коагуляции с Al2(SO4)3 и нейтрализации с NaOH. ЭЛО проводилась при доступе воздуха в струйном режиме [9] при расходе 5 дм3/мин. Исходное содержание растворенного кислорода в растворах TNT и RDX при рН 7 составляло 6.0 и 4.5 мг дм–3 соответственно. Облучателем служил прямоточный ускоритель электронов ЭЛВ (2.5 МэВ, 40 мА, расположен в EB Tech, Республика Korea). Для дозиметрии использовали пленочный дозиметр с феназиновым красителем СО ПД(Ф)Р-5/50 (ГСО 7865-2000) [11].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
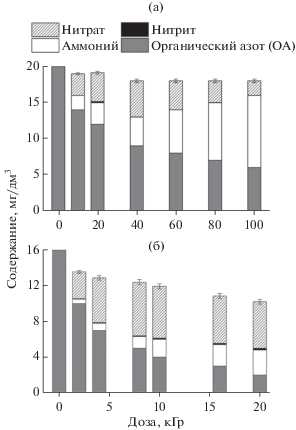
Одним из важнейших радиолитических преобразований является денитрование исходных TNT и RDX с конверсией связанных нитрогрупп преимущественно в нитраты и аммоний, а также в следы нитритов (рис. 1). При малых дозах доминирует образование нитратов. В свою очередь, рост содержания аммония с дозой происходит медленнее. Это указывает на то, что нитрат является одним из первичных продуктов, а аммоний – вторичным. Убыль суммарной концентрации всех форм азота с дозой свидетельствует о частичном их превращении в летучие соединения. Образование газообразных форм азота из нитратов за счет их реакций с восстановительными интермедиатами радиолиза воды было показано ранее [12, 13]:
(1)
${\text{NO}}_{{\text{3}}}^{ - }\xrightarrow{{{\text{e}}_{{{\text{aq}}}}^{ - }{\text{,}}\,\,{\text{H}}}}{\text{NO}}\xrightarrow{{{\text{e}}_{{{\text{aq}}}}^{ - }{\text{,}}\,\,{\text{H}}}}{{{\text{N}}}_{{\text{2}}}}{\text{O}}\xrightarrow{{{\text{e}}_{{{\text{aq}}}}^{ - }{\text{,}}\,\,{\text{H}}}}{{{\text{N}}}_{{\text{2}}}}.$Рис. 1.
Влияние поглощенной дозы на содержание азота в растворах TNT (а) и RDX (б): в форме нитратов, нитритов, аммония и органических соединений.
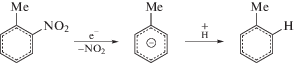
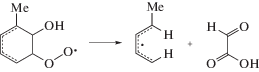
Очевидно, денитрование обусловлено, главным образом, диссоциативным захватом гидратированных электронов ${\text{e}}_{{{\text{aq}}}}^{ - }$ и атомов $\centerdot {\text{H:}}$
Поскольку накопления нитрита не наблюдается (рис. 1), отщепление нитрогруппы происходит, вероятно, в форме радикала $^{\centerdot }{\text{N}}{{{\text{O}}}_{{\text{2}}}},$ который затем легко превращается в нитрат в реакциях с $^{\centerdot }{\text{OH,}}$ $^{\centerdot }{{{\text{O}}}_{{\text{2}}}}{\text{H}}$ и Н2О2. Вклад в денитрование TNT может вносить также распад Н- и ОН-аддуктов:
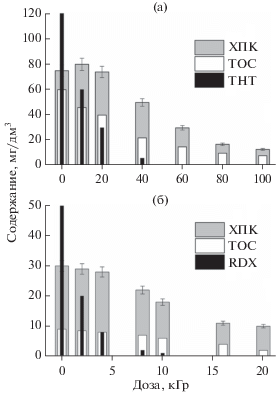
Рисунок 2 показывает степень деградации TNT и RDX при различных поглощенных дозах. Несомненно, различия в радиационной стойкости TNT и RDX обусловлены, прежде всего, различием их строения. Наличие сопряженной ароматической структуры делает TNT более устойчивым. Для полупревращения TNT требуется около 10 кГр, а для RDX – 1.8 кГр. Это соответствует выходам деградации 0.26 и 0.62 молекул/100 эВ (0.027 и 0.064 мкмоль/Дж). Такие величины выходов типичны для сложного механизма превращений, включающего конкурирующие и обратные реакции [7, 8, 11]. Эффективное денитрование TNT и RDX сопровождается снижением показателей общего органического углерода (ТОС) и химического потребления кислорода (ХПК). Это указывает на то, что вслед за денитрованием происходит разрушение структуры органических молекул и повышение степени окисления образующихся продуктов.
Рис. 2.
Влияние поглощенной дозы на содержание TNT (а) и RDX (б) в водных растворах, а также на соответствующие показатели ХПК и ТОС.
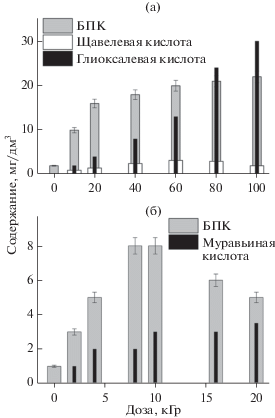
Важным следствием ЭЛО является повышение БПК и образование легких органических кислот (рис. 3): щавелевой и глиоксалевой в растворе TNT и муравьиной кислоты в растворе RDX. Как отмечалось выше, исходные TNT и RDX обладают пониженной биоразлагаемостью. Однако при дозе 20 кГр, соотношение БПК/ХПК становится выше почти в 8 раз для раствора TNT и в 15 раз для раствора RDX. Повышение биоразлагаемости может свидетельствовать о повышении степени окисления растворенного вещества, как это наблюдалось ранее для азотсодержащих красителей [9]. Появление легких органических кислот свидетельствует о разрыве скелетных связей (С–С для TNT и C–N для RDX). Вместе с тем, накопление нитрата с ростом дозы (рис. 1) происходит существенно легче, чем кислот (рис. 3) и аммония. Это означает, что нитрат образуется на более ранних стадиях по более простому механизму. При малых дозах, нитрат накапливается почти линейно с ростом дозы, тогда как большие дозы приводят к убыли его содержания. Такой эффект может свидетельствовать о вовлечении вторичных радиолитических продуктов в процессы деградации нитрата. Ранее было показано, что растворенный нитрат весьма устойчив к радиолитическим превращениям из-за того, что процессу (1) с участием восстановительных интермедиатов, противостоит обратный процесс, инициируемый окислительными (главным образом, радикалом $ \cdot {\text{OH}}$) интермедиатами радиолиза воды [12, 13]:
(5)
${\text{NO}}\xrightarrow{{ \cdot {\text{OH}}}}{\text{NO}}_{2}^{ - }\xrightarrow{{ \cdot {\text{OH}}}}{\text{NO}}_{2}^{ \cdot }\xrightarrow{{ \cdot {\text{OH}}}}{\text{NO}}_{3}^{ - }.$Рис. 3.
Влияние поглощенной дозы на показатели БПК и содержание органических кислот в растворах TNT (а) и RDX (б).
Однако присутствие формиата, являющегося селективным акцептором ОН-радикалов [12], способствует увеличению относительной роли процесса (1) и, как следствие, частичной трансформации нитрата в летучие соединения. Очевидно, в случае радиолиза TNT и RDX, появление глиоксалевой, щавелевой и муравьиной кислот также ослабляет процесс (2). Причем нелинейная динамика накопления кислот (рис. 3) и снижение ТОС (рис. 2) с ростом дозы указывает на их частичную конверсию в СО2 (декарбоксилирование) [12]. В отличие от нитратов, состав молекул TNT и RDX обеспечивает возможность селективного акцептирования интермедиатов, поскольку ${\text{e}}_{{{\text{aq}}}}^{{\text{ - }}}$ и $ \cdot {\text{H}}$ более охотно реагируют с нитрогруппами, а преобладающими реакциями радикалов $ \cdot {\text{OH}}$ являются отрыв водорода от алкильных групп и/или присоединение к ароматическому кольцу.
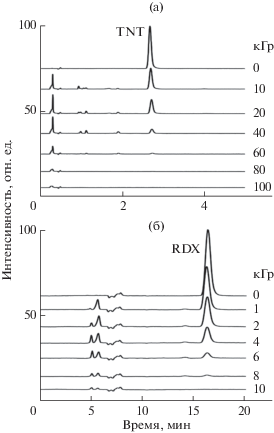
Радиолитическая деградация TNT и RDX является многостадийной. По мере роста дозы наблюдается последовательное появление и исчезновение более легких продуктов, регистрируемых хроматографически (рис. 4). Однако в конечном итоге, при дозе 100 кГр в растворе TNT и 20 кГр в растворе RDX, органические продукты представлены только легкими кислотами. Исходные TNT и RDX являются довольно стабильными благодаря симметричному строению их молекул. Радиолитические повреждения состоят в нарушении этой симметрии и, как следствие в перераспределении прочности химических связей. Раскрытие кольца в молекулах TNT и RDX, обусловливающее появление кислот, может происходить, главным образом, вследствие образования радикального центра в кольце. В TNT такие радикальные центры возникают преимущественно в результате присоединения Н и ОН. В RDX циклические радикалы образуются главным образом в результате денитрования и/или отщепления водорода радикалом ОН или Н. Как правило, разрыв связи в результирующих радикалах происходит в β-положении относительно радикального центра
Рис. 4.
Изменение хроматограмм (GC/MS) органических соединений в растворах TNT (а) и RDX (б) в зависимости от поглощенной дозы.
В результате вышеуказанных реакций появляются интермедиаты, дальнейшее участие которых в радиолитических превращениях обеспечивает образование легких органических кислот и аммония. Несомненно, образование кислот облегчается за счет участия растворенного кислорода в радиолитических превращениях [12, 13].
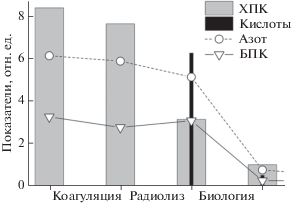
Рисунок 5 демонстрирует влияние ЭЛО на реальный образец красной воды в процессе комбинированной очистки. Красная вода сначала подвергается коагуляционной обработке (ввиду высокого содержания взвешенных веществ), а затем облучению. Видно, что наиболее существенные изменения состава воды происходит на стадиях радиолиза (100 кГр) и пост-радиационной биологической обработки. Электронно-лучевая обработка снижает ХПК почти в 2.4 раза и преобразует стойкие производные TNT в био-разлагаемую форму. В частности, имеет место эффективная конверсия нитротолуолов (БПК/ХПК ≤ 0.1) в легкие кислоты (БПК/ХПК ≈ 1). Следует отметить, что влияние дозы на деградацию нитро-содержащих органических соединений несколько слабее, чем в растворе TNT, из-за изначального присутствия нитратов и нитритов. Чтобы минимизировать их влияние, в красную воду перед практическим облучением должны вводиться селективные акцепторы радикалов ОН, например, формиат или оксалат.
ЗАКЛЮЧЕНИЕ
Радиолиз водных растворов TNT и RDX приводит к практически важным процессам. Имеет место минерализация, которая подтверждается снижением ТОС и одновременным появлением нитрата в растворе. Происходит преобразование стойких органических компонентов в биоразлагаемую форму, что демонстрируется сближением показателей ХПК и БПК. И, наконец, происходит частичное удаление компонентов в виде летучих соединений, о чем свидетельствует снижение ТОС и TN. Растворы TNT и RDX представляют собой удачные системы, где есть одновременно селективные акцепторы гидратированного электрона (нитрогруппы) и ОН (алкильные группы). Устойчивый режим нейтрализации TNT и RDX обеспечивается тем, что по мере их исчерпания, роль селективных акцепторов ОН-радикалов берут на себя малые органические кислоты, возникающие из углеводородных групп. Высокая концентрация радиолитических радикалов, генерируемых электронным пучком в воде, обеспечивает быстрое завершение сложных превращений TNT и RDX в легкие биоразлагаемые кислоты и безвредные летучие соединения. Соответственно, электронно-лучевая обработка может служить полезной стадией перед биологической обработкой красной воды. Настоящая работа демонстрирует совершенствование ЭЛО до уровня прикладного моделирования обезвреживания TNT, RDX и красной воды с помощью промышленного ускорителя и проточного режима облучения.
Список литературы
Khan M.I., Lee J., Park J. // J. Microbiol. Biotechnol. 2012. T. 22. № 10. C. 1311.
Wang Y., Zhang L., Yang L., Chang G. // Chemical Engineering J. 2020. T. 384. C. 123358.
Khilyas I.V., Lochnit G., Ilinskaya O.N. // Front Microbiol. 2017. T. 8. C. 2600.
Elovitz M.S., Shemer H., Peller J.R., Vinodgopal K., Sivaganesan M., Linden K.G. // J. Water Supply: Research and Technology-Aqua. 2008. T. 57. № 6. C. 391.
Макаров И.Е., Жесткова Т.П., Жукова Т.Н. // Химия высоких энергий. 2011. Т. 45. № 2. С. 119.
Макаров И.Е., Протасова Е.Л., Хайкин Г.И. // Журн. физической химии. 2008. Т. 82. № 11. С. 2044.
Wojnárovits L., Takács E. // J. Radioanal. Nucl. Chem. 2017. T. 311. № 2. C. 973.
Ершов Б.Г. // Успехи химии. 2004. Т. 73. С. 107.
Han B., Kim J.K., Kim Y., Choi J.S., Jeong K.Y. // Radiat. Phys. Chem. 2012. T. 81. № 9. C. 1475.
APHA, AWWA and WPCF, Standard Methods for the Examination of Water and Wastewater, 23rd Edition, Washington, D. C., 2017.
Пикаев А.К. // Химия высоких энергий. 2000. Т. 34. С. 83.
Makarov I.E., Ponomarev A.V. In Ionizing Radiation Effects and Applications; InTech, 2018. https://doi.org/10.5772/intechopen.72074
Ponomarev A.V., Bludenko A.V., Makarov I.E. // Mendeleev Communications. 2002. T. 12. № 3. C. 92.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий