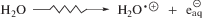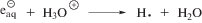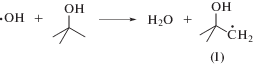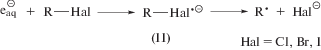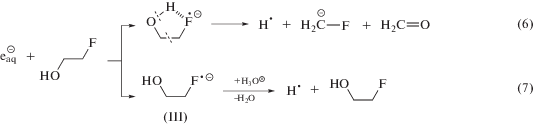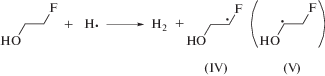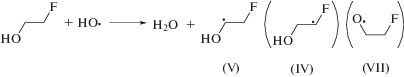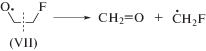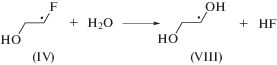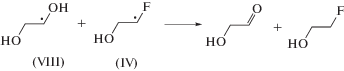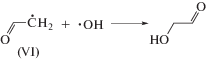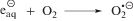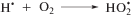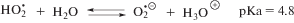Химия высоких энергий, 2020, T. 54, № 6, стр. 474-481
Радиационно-индуцированные превращения 2-фторэтанола в водных растворах
С. Д. Бринкевич a, *, О. В. Тугай a, А. А. Сладкова a, О. И. Шадыро a
a Белорусский государственный университет
220030 Минск, просп. Независимости, 4, Республика Беларусь
* E-mail: BrinkevichSD@bsu.by
Поступила в редакцию 16.05.2020
После доработки 16.05.2020
Принята к публикации 06.07.2020
Аннотация
Методом стационарного радиолиза изучены радиационно-индуцированные превращения 2-фторэтанола в разбавленных водных растворах в качестве модельной системы для установления закономерностей авторадиолитического дегалогенирования радиофармпрепарата “2-[18F]фтордезоксиглюкоза”. Разработана реагентно-хроматографическая методика определения фторид-аниона на фоне фторорганических соединений. Установлено, что дегалогенирование 2-фторэтанола в водных растворах индуцируют •ОН и Н•. В отличие от бром- и хлоргидринов 2-фторэтанол не взаимодействует с ${\text{e}}_{{{\text{aq}}}}^{ - }$ по механизму диссоциативного захвата. Показано, что за счет окисления гидроксилсодержащих углеродцентрированных радикалов 2-фторэтанола О2 снижает радиационно-химический выход фторида в 2 раза. Рассчитанная с использованием инструментария метода конкурирующих реакций константа мономолекулярного дегалогенирования радикала 2-фторэтанола составляет 3.9 × 106 с–1.
ВВЕДЕНИЕ
Радиолиз фторорганических соединений в водных растворах и по сей день остается слабоизученным разделом химии высоких энергий, даже несмотря на то, что радиационно-индуцированные процессы с участием этой группы веществ имеют важное прикладное значение. Так, электронное облучение полифторированных соединений (например, перфтороктановой кислоты) в растворах и в сложных дисперсных системах (почве) рассматривается в качестве промышленной технологии переработки этих стойких органических загрязнителей [1]. Одной из основных проблем производителей радиофармпрепаратов (РФП), меченных изотопом фтор-18, являются радиационно-индуцированные превращения меченых соединений под действием собственного излучения – авторадиолиз [2]. В большинстве случаев этот процесс сопровождается элиминированием [18F]фторид-аниона, который накапливается в костной ткани и обладает из-за этого высокой радиобиологической опасностью.
Для 2-[18F]фтор-2-дезокси-D-глюкозы ([18F]ФДГ), которая является наиболее массовым РФП для диагностики онкологических, кардиологических и неврологических заболеваний методом позитронно-эмиссионной томографии (ПЭТ) [3], накопление радиолитического фторида является ключевым фактором, ограничивающим срок годности готовой лекарственной формы [4]. При высоких начальных объемных активностях [18F]ФДГ, которые обеспечивают наименьшую себестоимость производства [5], препарат становится непригодным к диагностическому применению уже через 1 ч после синтеза [6].
Для улучшения качества РФП и увеличения сроков его хранения активно ведутся работы, посвященные исследованию основных закономерностей авторадиолиза [4, 6–8] и тестированию стабилизаторов [6, 8]. Однако идентификация нерадиоактивных продуктов разложения [18F]ФДГ, а также установление механизма авторадиолиза этого меченого соединения оказались сложно выполнимыми задачами в силу высокой радиоактивности коммерческих партий РФП (до нескольких Зв/час) и наномолярных концентраций радиоактивного вещества в растворе [9]. Для решения обозначенных проблем, связанных с исследованием авторадиолиза РФП, мы предлагаем использовать стационарный радиолиз модельных соединений и нерадиоактивной копии [18F]ФДГ.
В настоящей работе будут рассмотрены радиационно-индуцированные превращения простейшего фторгидрина – 2-фторэтанола в разбавленных (10–3 моль/литр) водных растворах.
МЕТОДИКА ЭКСПЕРИМЕНТА
В работе без предварительной очистки использовали следующие коммерчески доступные вещества: 2,4-динитрофенилгидразин (ДНФГ) 97%-й чистоты, 2-фторэтанол (95%), триметилхлорсилан, натрия фторид (99.9%), водный 37% раствор формальдегида, соляную кислоту, гликолевый альдегид (>98%), формиат аммония (>99%), трет-бутанол фирмы Sigma-Aldrich; калия гидроксид и хлорную кислоту фирмы Aplichem; метанол для ВЭЖХ “J.T. Baker”; гексан для хроматографии “Криохим”. Высокочистый ацетальдегид получали методом кислотного гидролиза паральдегида. Первичный дистиллят сутки обезвоживали над Na2SO4, после чего повторно перегоняли. Полученный таким образом сухой ацетальдегид разливали по ампулам, запаивали и хранили при –20°С не более 5 лет. Водные растворы 2-фторэтанола готовили весовым методом, их насыщение газами, ампулирование проводили аналогично [10].
Неорганический фторид на фоне фторорганических соединений в водных растворах определяли по адаптированной реагентно-хроматографической методике [11]. К 1 мл облученного водного раствора 2-фторэтанола, заранее охлажденного в ледяной бане, прибавляли 2.5 мл 1.2 М раствора HCl и 20 мкл триметилхлорсилана. Полученную смесь тщательно перемешивали на ультразвуковой бане со льдом в течение 5 мин. Образующийся фтортриметилсилан экстрагировали 980 мкл гексана на ультразвуковой бане в течение 5 мин на холоде. Для газохроматографического анализа отбирали 600 мкл верхнего органического слоя. В плотно закрытой виале при +4°С полученный раствор может храниться до суток.
Количественный анализ фтортриметилсилана выполняли на Shimadzu GC-17AAF/APC с колонкой RTX502.2. Условия анализа: начальная температура колонки – 40°С, изотермический режим – 2 мин и далее градиент 6°С/мин до температуры 200°С; температура испарителя – 220°С, детектора – 250°С; скорость газа-носителя (азота) – 21 см/с; объем вводимой пробы – 1 мкл. Определение концентрации проводили методом внешнего стандарта. Экспериментально определенный предел детектирования фторид-аниона на фоне высоких концентраций фторорганических соединений – не менее 1 × 10–6 моль/л, линейность – 2.5 × 10–6–2.5 × 10–4 моль/л.
Анализ карбонильных продуктов радиолиза 2‑фторэтанола проводили в форме аддуктов с ДНФГ (гидразонов) на хроматографе Shimadzu LCMS-2020 с колонкой Shim-pack VP-ODS C18 длинной 150 мм и последовательно соединенными диодно-матричным (PDA) и масс-спектрометрическим детекторами. Условия проведения хроматографического анализа: подвижная фаза – метанол : : вода в объемном соотношении 70 : 30; скорость подачи элюента – 0.8 мл/мин, температура термостата – 35°C; объем вводимой пробы – 1 мкл. Количественный анализ выполняли по поглощению аддуктов с ДНФГ при 366 нм с использованием внешних стандартов карбонильных соединений. Идентификацию гидразонов выполняли масс-спектрометрически: метод ионизации – электроспрей с отрицательной ионизацией (ESI-); напряжение интерфейса – 1.5 кВ; напряжение на детекторе – 1.20 кВ; температура блока нагревания и десольватации – 400 и 250°С соответственно; поток газа распылителя – 1.5 л/мин.
Для приготовления дериватизирующего реактива 0.03 г ДНФГ и 6.2 мл концентрированной соляной кислоты вносили в мерную колбу объемом 100 мл и доводили до метки метанолом. Для получения гидразонов карбонильных соединений исследуемые пробы смешивали в объемном соотношении 1 : 1 с дериватизирующим агентом и выдерживали 15 мин до анализа.
Концентрацию 2-фторэтанола в растворе определяли газохроматографически на Shimadzu GC-17AAF/APC с капиллярной колонкой RTX-Wax и пламенно-ионизационным детектором, условия анализа аналогичны описанным в работе [10]. Анализ пероксида водорода выполняли реагентно-фотометрическим методом с TiOSO4 согласно [12].
Облучение образцов проводили на установке МРХ-γ-25М с источником 60Co при температуре 20 ± 5○С. Мощность поглощенной дозы составляла 0.148 ± 0.008 Гр/с по результатам дозиметрии с ферросульфатной системой Фрикке. Интервал поглощенных доз 0.089–1.066 кГр. Для получения величин радиационно-химических выходов использовали результаты не менее трех независимых экспериментов. Значение ошибки определения радиационно-химических выходов рассчитывали в программе Origin 8.1 Pro методом наименьших квадратов с использованием коэффициента доверительной вероятности 0.95.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученные в работе значения радиационно-химических выходов продуктов радиолиза 2‑фторэтанола в водных растворах с концентрацией 10–3 моль/л приведены в табл. 1. Можно заметить, что основным типом радиолитических превращений исследуемого вещества является дегалогенирование, причем величины выходов фторид-аниона и, в меньшей степени, разложения исследуемого вещества сильно зависели от условий проведения облучения. В качестве минорных продуктов радиолиза мы детектировали формальдегид, ацетальдегид и гликолевый альдегид.
Таблица 1.
Выходы продуктов радиационно-индуцированных превращений 2-фторэтанола в водных растворах с концентрацией 10–3 моль/л
| Радиационно-химические выходы, молекула/100эВ | Условия облучения | ||||
|---|---|---|---|---|---|
| Ar | t-BuOH + Ar | N2O | О2 | ||
| Разложение 2-фторэтанола | 2.58 ± 0.27 | 1.72 ± 0.71 | 4.54 ± 0.44 | 2.13 ± 0.75 | |
| Продукты радиолиза | Фторид-анион | 2.79 ± 0.18 | 0.21 ± 0.03 | 3.18 ± 0.30 | 1.43 ± 0.26 |
| Ацетальдегид | 0.14 ± 0.02 | 0.03 ± 0.01 | 0.13 ± 0.02 | 0.02 ± 0.01 | |
| Формальдегид | 0.04 ± 0.01 | 0.04 ± 0.01 | 0.14 ± 0.01 | 0.61 ± 0.06 | |
| Гликолевый альдегид | 0.05 ± 0.01 | 0 | 0.17 ± 0.04 | 0.30 ± 0.04 | |
| Пероксид водорода | 0.35 ± 0.07 | 0 | 1.00 ± 0.09 | 2.38 ± 0.12 | |
В деаэрированных водных растворах 2-фторэтанола выход фторид-аниона соответствует G•OH и заметно превышает соответствующие величины для неорганического фосфата при облучении 1 мМ водных растворов 1-глицерофосфата и 1-глюкозофосфата (соответственно, 2.23 ± ± 0.07 и 2.00 ± 0.07 ионов/100 эВ [13]). При этом значения констант свободнорадикального дефосфорилирования гидроксилсодержащих органических фосфатов считаются одними из самых больших для монорадикальных радиационно-индуцированных процессов.
Радиолиз исследуемого вещества в деаэрированном 0.1 М водном растворе трет-бутанола позволяет количественно конвертировать •ОН радикалы в менее реакционноспособные углерод-центрированные радикалы (I) по реакции (4). В этих условиях наблюдается более чем десятикратное снижение радиационно-химического выхода фторида по сравнению с системой без t-BuOH, что свидетельствует о малой вероятности реализации диссоциативного захвата гидратированного электрона, характерного для хлор-, бром- и йодорганических соединений, по реакции (5).
Важно отметить, что введение в раствор акцептора •ОН радикалов приводит лишь к 30%-ному снижению радиационно-химического выхода разложения 2-фторэтанола по сравнению с деаэрированной системой. Следовательно, гидратированные электроны, •H и радикалы трет-бутанола (I) способны взаимодействовать с 2-фторэтанолом, в результате чего происходит расходование исследуемого соединения, но преимущественно без образования фторид-аниона.
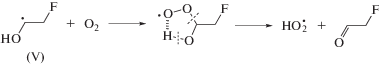
В монографии Джагацпаняна [14], посвященной радиационной химии галогенорганических соединений, было указано, что фторорганические соединения акцептируют сольватированные электроны, в результате чего может происходить деструкция их углеродного скелета. Мы не можем исключить возможность реализации такого рода процессов (например, реакции (6)), поскольку при введении в систему трет-бутанола радиационно-химический выход формальдегида не изменился по сравнению с деаэрированными растворами. Однако, принимая во внимание значение G(CH2O), значительно более вероятна нейтрализация анион-радикала(III) с H3O+ по реакции (7).
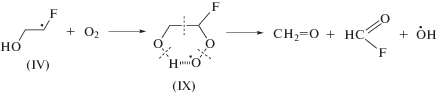
Образующиеся в ходе последней реакции •Н могут взаимодействовать с 2-фторэтанолом с образованием преимущественно α-фторметильных (IV) и, в меньшей степени, α-гидроксиметильных (V) радикалов по реакции (8). Нельзя также исключать возможность реализации аналогичной реакции и с участием радикалов трет-бутанола (I).
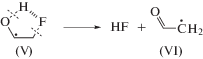
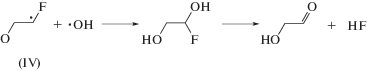
Поскольку в присутствии трет-бутанола не образуется гликолевый альдегид, можно утверждать, что α-фторметильные радикалы (IV) не подвергаются гидролизу в этих экспериментальных условиях. Происходит это из-за низкой скорости гидролиза α-фторметильных радикалов (IV) и восстановительных свойств доминирующих в системе интермедиатов (${\text{e}}_{{{\text{aq}}}}^{ - },$ •H и радикалов (V)). По нашему мнению, фторид-анионы с небольшим выходом при радиолизе 2-фторэтанола в присутствии акцептора •ОН радикалов образуются только в результате свободнорадикальной фрагментации радикалов (V) по реакции (9). Ранее было показано, что аналогичного рода реакции приводят к радиационно-индуцированному дегалогенированию различных бром- и хлоргидринов в водных растворах [15].
Последующее восстановление радикалов (VI) будет приводить к образованию ацетальдегида, который регистрируется в качестве конечного молекулярного продукта радиолиза 2-фторэтанола во всех исследованных в работе системах.
В заключение рассмотрения системы необходимо отметить, что относительно невысокие радиационно-химические выходы фторид-аниона при радиолизе 2-фторэтанола в присутствии трет-бутанола также связаны со способностью этого акцептора взаимодействовать с •H по реакции аналогичной (4), в результате чего уменьшается вероятность реализации реакции (8) с образованием радикалов (V).
Насыщение водных растворов закисью азота приводит при радиолизе к удвоению выхода •OH и удалению из системы гидратированных электронов за счет реакции (10). Однако представленные в табл. 1 данные свидетельствуют, что при почти двукратном увеличении радиационно-химического выхода разложения 2-фторэтанола в присутствии N2O по сравнению с деаэрированной системой наблюдается лишь 15%-й прирост радиационно-химического выхода неорганического фторида.
Обнаруженный экспериментальный факт может быть связан со следующими обстоятельствами. Во-первых, в насыщенном аргоном растворе дегалогенирование 2-фторэтанола было вызвано, в том числе, и взаимодействием с гидратированным электроном за счет последовательности уже рассмотренных нами реакций (7)–(9). Поэтому удаление из системы ${\text{e}}_{{{\text{aq}}}}^{ - }$ приводит к исключению одного из путей образования фторид-аниона. Во‑вторых, в силу низкой концентрации 2-фторэтанола часть •ОН в объеме раствора расходовалась не в радикал-молекулярных реакциях с исследуемым веществом, а в бирадикальных, о чем свидетельствует G(H2O2) > ${{{\text{G}}}_{{{{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}}}}}$ (табл. 1).
Взаимодействие 2-фторэтанола с •ОН помимо углеродцентрированных радикалов (IV) и (V) будет также приводить к образованию кислородцентрированного радикала (VII). Последний подвергается β-фрагментации по реакции (12) с разрывом углерод-углеродной связи, что проявляется в увеличении значения радиационно-химического выхода формальдегида по сравнению с раствором, насыщенным аргоном.
Способные элиминировать фтористый водород по реакции (9) α-гидроксилсодержащие углеродцентрированные радикалы (V) являются основным источником неорганического фторида при радиолизе 2-фторэтанола в растворе, насыщенном N2O.
Образование гликолевого альдегида в этих условиях вероятно происходит преимущественно вследствие гидролиза радикала α-фторметильного типа (IV) по реакции (13). Образующийся в последней реакции радикал этиленгликоля (VIII) может окисляться до гликолевого альдегида в реакциях диспропорционирования с углеродцентрированными радикалами, присутствующими в системе, например, по реакции (14).
В силу низкой концентрации 2-фторэтанола в растворе нельзя полностью исключить и возможность образования гликолевого альдегида в результате рекомбинации •ОН с радикалами α‑фторметильного типа (IV), а также ацетальдегида (VI) по следующим реакциям:
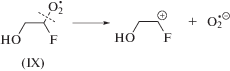
В водных растворах 2-фторэтанола, насыщенных кислородом, гидратированные электроны и атомы водорода взаимодействуют с О2 по реакциям (17) и (18), в результате чего эти радикальные продукты радиолиза воды количественно превращаются при рН ~ 7 в ${\text{O}}_{2}^{{ \bullet - }}.$
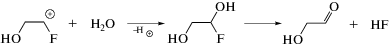
Поэтому радиационно-индуцированные превращения 2-фторэтанола в насыщенных кислородом водных растворах происходят вследствие взаимодействия этого фторгидрина с •ОН и ${\text{O}}_{2}^{{ \bullet - }}$ – радикалами, проявляющими окислительные свойства. Наблюдаемое в этих условиях двукратное снижение радиационно-химического выхода неорганического фторида по сравнению с раствором, насыщенным аргоном, может быть отчасти связно с удалением из системы •Н и, как следствие, невозможностью реализации реакции (8). Однако, лишь незначительное снижение радиационно-химического выхода разложения 2-фторэтанола, а также кратное уменьшение выхода ацетальдегида свидетельствуют о том, что ингибирование дегалогенирования исследуемого вещества может происходить вследствие окисления кислородом α-гидроксилсодержащих углеродцентрированных радикалов (V) по следующей реакции
Реализация процесса, аналогичного реакции (20), при хранении РФП “2-[18F]фтордезоксиглюкоза” может быть причиной обнаруженного нами ингибирования его авторадиолитического разложения в присутствии кислорода [7].
К сожалению, нам не удалось идентифицировать 2-фторацетальдегид в качестве продукта радиолиза 2-фторэтанола, что может быть связано как с ограничениями использованной аналитической методики, так и высокой реакционной способностью этого галогенсодержащего альдегида в условиях радиолиза.
Увеличение радиационно-химических выходов формальдегида и гликолевого альдегида при радиолизе насыщенных кислородом растворов 2‑фторэтанола происходит вследствие взаимодействия радикалов α-фторметильного типа (IV) с кислородом. Реакцию аналогичную (21) ранее наблюдали при облучении α-диолов в водных растворах, насыщенных кислородом [15]. Элиминирование ${\text{O}}_{2}^{{ \bullet - }}$ пероксильными радикалами ранее было обнаружено при радиолизе дисахаридов в присутствии кислорода [16].
Несмотря на образование дополнительных количеств неорганического фторида в реакциях (22) и (24), его радиационно-химический выход в оксигенированных растворах 2-фторэтанола снижается примерно в 2 раза по сравнению с деаэрированными. Это указывает на высокую эффективность ингибирования кислородом свободнорадикального дегалогенирования 2-фторэтанола (реакция (9)) за счет окисления его α-гидроксилсодержащих углерод-центрированных радикалов (V) по реакции (20).
Представленные в работе значения радиационно-химических выходов фторид-аниона при радиолизе исследуемого вещества в различных условиях позволяют оценить константу скорости монорадикального дегалогенирования (реакция (9)) 2-фторэтанола. Если принять допущение, что неорганический фторид образуется только из α-гидроксилсодержащих углеродцентрированных радикалов (V), то наблюдаемое в присутствии кислорода 50% ингибирование элиминирования фторид-аниона будет свидетельствовать о равенстве скоростей реакций окисления радикала (V) кислородом по реакции (20) и монорадикального дегалогенирования этого радикала по реакции (9)
Тогда, с учетом концентрации кислорода в растворе 1.22 × 10–3 моль/л [17] и константы присоединения кислорода к радикалу (V) равной 3.2 × × 109 л × моль–1 × с–1 (взята константа взаимодействия О2 с радикалом этиленгликоля (VIII) из работы [18]) константа скорости монорадикального дегалогенирования 2-фторэтанола составит
(26)
$k1 = k2 \times [{{{\text{O}}}_{2}}] = 3.904 \times {{10}^{6}}\,\,{{{\text{c}}}^{{ - {\text{1}}}}}$Полученная величина более чем на 4 порядка превосходит константу скорости дегидратации радикалов этиленгликоля (VIII) и примерно равна константе скорости реакции дефосфорилирования радикала лизофосфохолина (3.5 × 106 с–1 [19]).
ЗАКЛЮЧЕНИЕ
Методом стационарного радиолиза изучен механизм и конечные молекулярные продукты радиационно-индуцированных превращений 2-фторэтанола в разбавленных водных растворах как модель авторадиолитического дегалогенирования радиофармпрепарата “2-[18F]фтордезоксиглюкоза”. Разработана реагентно-хроматографическая методика определения фторид-аниона на фоне фторорганических соединений. Установлено, что дегалогенирование 2-фторэтанола в водных растворах происходит вследствие его взаимодействия с ОН• и Н•. При этом присоединение ${\text{e}}_{{{\text{aq}}}}^{ - }$ не приводит к элиминированию фторида, что отличает радиационную химию 2-фторэтанола от гидроксилсодержащих хлор- и броморганических соединений. Показано, что основным механизмом радиационно-индуцированного дегалогенирования 2-фторэтанола в водных растворах является свободнорадикальная фрагментация его гидроксилсодержащего углеродцентрированного радикала, сопровождающаяся разрывом двух σ-связей в β‑положении к радикальному центру. За счет окисления гидроксилсодержащего углеродцентрированного радикала 2-фторэтанола кислород снижает радиационно-химический выход неорганического фторида примерно в 2 раза. Рассчитанная величина константы скорости реакции монорадикального дегалогенирования 2-фторэтанола составила 3.9 × 106 с–1.
Список литературы
Trojanowicz M., Bartosiewicz I., Bojanowska-Czajka A., Kulisa K., Szreder T., Bobrowski K., Nichiporc H., Garcia-Reyes J.F., Nałęcz-Jaweckie G., Męczyńska-Wiel-gosz S., Kisała J. // Chemical Engineering J. 2019. V. 357. P. 698.
Scott P.J., Hockley B.G., Kung H.F, Manchanda R., Zhang W., Kilbourn M.R. // Applied Radiation and Isotopes. 2009. V. 67. № 1. P. 88.
Бринкевич С.Д., Суконко О.Г., Чиж Г.В., Полой-ко Ю.Ф. // Медико-биологические проблемы жизнедеятельности. 2014. № 11. С. 151.
Бринкевич С.Д., Тугай О.В., Невзоров Д.И. // Химия высоких энергий. 2019. Т. 53. № 4. С. 294.
Brinkevich S., Pires L.P., Portilho F.L., Santos-Oliveira R. // Current Radiopharmaceuticals. 2018. V. 11. P. 69.
Walters L.R., Martin K.J., Jacobson M.S., Hung J.C., Mosman E.A. // J. Nuclear Medicine Technology. 2012. V. 40. № 1. P. 52.
Бринкевич С.Д., Тугай О.В. // Химия высоких энергий. 2020. Т. 54. № 1. С. 60.
Joszai I., Svidro M., Pótári N. // Applied Radiation and Isotopes 2019. V. 146. P. 78.
Búriová E., Macášek F., Melichar F., Kropá M., Procházka L. // J. Radioanal. Nucl. Chem. 2005. V. 264. № 3. P. 595.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2018. Т. 52. № 4. С. 347.
Sarathchandraprakash N.K., Balaji J., Manral K. // International J. Innovative Research in Science, Engineering and Technology. 2014. V. 3. № 12. P. 18269.
Бринкевич С.Д., Кузьмук Д.А. Свердлов Р.Л., Шадыро О.И. // Химия высоких энергий. 2019. Т. 53. № 6. С. 478.
Бринкевич С.Д., Шадыро О.И. // Химия высоких энергий. 2009. Т. 43. № 6. С. 491.
Джагацпанян Р.В., Филиппов М.Т. // Радиационная химия галогенсодержащих органических соединений. М.: Атомиздат, 1973. 271 с.
Петряев Е.П., Шадыро О.И. // Радиационная химия бифункциональных органических соединений. Минск: Университетское, 1986. 165 с.
Edimecheva I.P., Kisel R.M., Shadyro O.I., Kazem K., Murase H., Kagiya T. // J. Radiat. Res. 2005. V. 46. № 3. P. 319.
Xing W., Yin M., Lv Q., Hu Y., Liu, C., Zhang J. // Ox-ygen solubility, diffusion coefficient and solution viscosity. (Chapter in) Rotating Electrode Methods and Oxygen Reduction Electrocatalysts. Elsevier, 2014. P. 1.
Adams G.E., Willson R.L. // Trans. Faraday Soc. 1969. V. 65. P. 2981.
Müller S.N., Batra R., Senn M., Giese B., Kisel M., Shadyro O. // J. American Chemical Society. 1997. V. 119. № 12. P. 2795.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий