Химия высоких энергий, 2021, T. 55, № 1, стр. 25-38
Фотоизомеризация и перенос энергии в несимметричной бифотохромной диаде с продольным сдвигом фотохромов – производных 3-стирилбензо[f]хинолина и оксиметиленовой мостиковой группой
М. Ф. Будыка a, *, Т. Н. Гавришова a, В. М. Ли a, С. А. Дозморов a, b
a Институт проблем химической физики Российской академии наук
142432 Московская обл., Черноголовка,
просп. Академика Семенова, 1, Россия
b Факультет фундаментальной физико-химической инженерии МГУ им. Ломоносова
Москва, Россия
* E-mail: budyka@icp.ac.ru
Поступила в редакцию 08.07.2020
После доработки 18.08.2020
Принята к публикации 02.09.2020
Аннотация
Синтезирована и исследована несимметричная бифотохромная диада D2, содержащая производные 3-стирилбензо[f]хинолина (SBQ). Структура диады разработана таким образом, чтобы препятствовать протеканию реакции [2 + 2] фотоциклоприсоединения, что достигнуто использованием оксиметиленовой мостиковой группы, двух разных SBQ фотохромов и продольным сдвигом их друг относительно друга. Под действием света в диаде зафиксирована реакция фотоизомеризации и перенос энергии между двумя SBQ фотохромами с эффективностью 99%, приводящий к тушению SBQ-донора и сенсибилизации SBQ-акцептора. Длинноволновая флуоресценция, которую можно было бы приписать эксиплексу, не наблюдалась. При длительном облучении диады наблюдалась побочная реакция, предположительно, фотоциклизация SBQ-акцептора. Квантовохимические расчеты относительной стабильности конформеров диады проведены с применением теории функционала плотности (DFT). Сравнение расчетных и экспериментальных данных показало, что функционалы B3LYP-GD3 и M06-2X, учитывающие дисперсионные поправки, с базисом 6-31G*, возможно, переоценивают стабильность конформеров диады с π-стэкинг взаимодействием SBQ фотохромов, которые могут быть предшественниками эксиплексов.
Фотопереключаемые люминофоры (ФЛ) представляют интерес для применения в флуоресцентной микроскопии сверхвысокого разрешения (“наноскопии”) [1–3], в качестве фотонных молекулярных переключателей (МП) и молекулярных логических вентилей (МЛВ) [4–8]. Функции ФЛ могут выполнять как сложные супрамолекулярные конструкции и белки, так и сравнительно простые соединения, способные к фотоизомеризации, причем изомеры фотохрома должны обладать разными люминесцентными свойствами.
Такие свойства проявляют некоторые фотохромы из класса диарилэтиленов, в частности, производные 3-стирилбензо[f]хинолина (SBQ), которые имеют квантовые выходы обратимой транс-цис фотоизомеризации (ФИ) 0.2–0.5 и сравнимые по величине квантовые выходы флуоресценции транс-изомеров [9–11]. Чтобы соединение могло функционировать в качестве двухадресных фотонных МЛВ, оно должно содержать не менее двух фотохромов. Например, бифотохромная диада, содержащая два ковалентно-связанных остатка 2‑стирилхинолина, способна выполнять функции шести двухадресных МЛВ [7].
По сравнению с 2-стирилхинолином, производные SBQ имеют более высокие квантовые выходы ФИ и флуоресценции, а также батохромно сдвинутые спектры поглощения и излучения, что делает их более привлекательными фотохромами для построения МЛВ. Однако при исследовании фотохимических свойств бис-стирилбензохинолиновых диад было найдено [12–16], что в диадах, параллельно с реакцией ФИ, протекает реакция [2 + 2]-фотоциклоприсоединения (ФЦП), которая в данном случае является побочной и мешает функционированию МЛВ. Эффективность ФЦП в SBQ-диадах объясняется наличием жесткого ароматического “каркаса”, с которым связаны два SBQ фотохрома, и который ориентирует фотохромы в параллельных плоскостях. Такая ориентация заложена в структуре диад, чтобы способствовать образованию в возбужденном состоянии эксимера, флуоресценция которого может служить дополнительным каналом считывания информации при использовании диад в качестве МЛВ.
Известно, что интермедиатом реакции ФЦП является эксимер (или эксиплекс, если реагируют два разных производных этилена) [17–20]. По-видимому, в случае SBQ-диад, в эксимере (эксиплексе) конкурируют два процесса, фотофизический – флуоресценция, и фотохимический – реакция ФЦП, и второй процесс преобладает над первым.
Чтобы исключить реакцию ФЦП, но сохранить флуоресценцию эксимера, можно использовать разные требования к структуре “реагирующего” и “излучающего” эксимеров. Для протекания реакции ФЦП реагирующие этиленовые группы должны находиться на расстоянии не более 4.2 Å [21], в то время как для излучающего эксимера такого ограничения нет, требуется только плоскопараллельное расположение флуорофоров, обеспечивающее перекрытие их электронных оболочек, которое достигается при межмолекулярном расстоянии 3.3–5.5 Å, в зависимости от размера π‑системы мономера [22].
В симметричных диадах SBQ фотохромы связаны с жестким каркасом одинаковыми мостиковыми группами. Вследствие π-стэкинг взаимодействия между SBQ фотохромами, в некоторых конформерах диад этиленовые группы оказываются на расстоянии менее 4.2 Å друг от друга, что способствует реакции ФЦП [13–16]. Чтобы увеличить расстояние между этиленовыми группами, но оставить SBQ фотохромы в плоскопараллельной ориентации, нужно внести в структуру диады элемент асимметрии – сдвинуть фотохромы продольно в плоскости относительно друг друга, прикрепив их к жесткому каркасу мостиковыми группами разной длины. Этот подход был реализован и позволил понизить квантовый выход реакции ФЦП, но не исключить эту реакцию полностью.
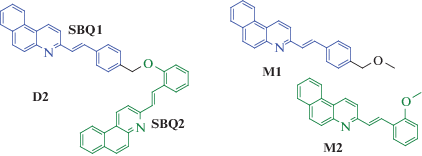
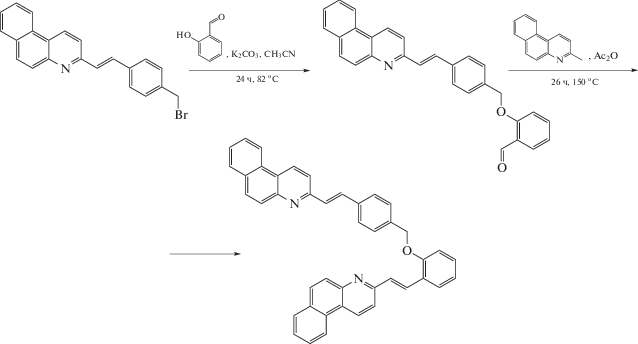
В настоящей работе мы использовали другой подход. Асимметрия и сдвиг этиленовых групп достигнуты путем сочетания двух разных SBQ фотохромов. Была разработана структура (3-(E)-2-{4-((E)-2-бензо[f]хинолин-3-ил-винил)феноксиметил]-фенил}-винил)-бензо[f]хинолина – бифотохромной диады D2, в которой SBQ фотохромы соединены между собой оксиметиленовым мостиком, причем фотохром SBQ1 замещен в пара-положении стирильного фрагмента, а фотохром SBQ2 – в орто-положении, схема 1 . Модельным фотохромом для SBQ1 является 3-(4-метоксиметилстирил)бензо[f]хинолин М1, для SBQ2 – 3‑(2-метоксистирил)бензо[f]хинолин М2, схема 1 , которые детально исследованы ранее [11].
Схема 1 . Структура бис-стирилбензохинолиновой диады D2 и модельных (E)-3-(4-метоксиметилстирил)бензо[f]хинолина М1 и (E)-3-(2-метоксистирил)бензо[f]хинолина М2.Предварительные квантово-химические расчеты структуры диады D2 по теории функционала плотности (DFT) показали возможность существования конформеров диады с π-стэкинг взаимодействием между SBQ фотохромами в основном S0-состоянии. Такие конформеры могут быть предшественниками эксимера (в данном случае – эксиплекса) в возбужденном S1-состоянии. Расчеты показали также, что даже в конформациях диады с максимально сближенными SBQ фотохромами расстояние между этиленовыми группами больше 4.2 Å, что делает невозможным реакцию ФЦП.
Диада D2 была синтезирована, ее спектрально-люминесцентные и фотохимические свойства были исследованы в сравнении со свойствами модельных SBQ. Экспериментальные исследования подтвердили наличие в диаде реакции ФИ и отсутствие реакции ФЦП. Отсутствуют также данные об образовании эксиплекса. В диаде наблюдается перенос энергии (ПЭ) между двумя SBQ-фотохромами, что приводит к тушению SBQ-донора и сенсибилизации SBQ-акцептора. Кроме того, при длительном облучении диады обнаружена побочная реакция, предположительно, внутримолекулярной фотоциклизации в цис-изомере фотохрома SBQ2, которая наблюдалась ранее в модельном SBQ М2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Диада D2 синтезирована исходя из 3-((E)-2-(4-(бромметил)фенил)-винил)-бензо[f]хинолина, салицилового альдегида и 3-метилбензо[f]хинолина (см. схему 2 ). Выход 38%. Белый порошок, т.пл. 188°C. ИК-спектр, ν, см–1: 3053, 3032, 2922, 2853, 1599, 1578, 1483, 1452, 1407, 1241, 1104 (νсим, С–O–С), 1025, 966 (δ, –CH=CH), 826, 745, 425. Спектр ЯМР 1H (CDCl3), δ, м.д.: 5.24 c (2H, CH2), 6.97 – 7.07 м (2Н), 7.26–7.30 м (1H), 7.46 д (1Н, Ht-CH=, J 16.2 Гц), 7.52 д (1Н, Ht-CH=, J 16.4 Гц), 7.55 д (2H, J 8.1 Гц), 7.60–7.74 м (6H), 7.76–7.82 м (4H), 7.90–7.95 м (2H), 7.97–8.00 м (4H), 8.16 д (1Н, CH=, J 16.4 Гц), 8.60 дд (2Н, J 6.6 Гц, J 7.6 Гц), 8.91 дд (2Н, J 7.4 Гц, J 8.3 Гц). Спектр ЯМР 13С (CDCl3), δ, м.д.: 69.9, 112.1, 117.0, 118.5, 118.8, 120.5, 121.7, 123.2, 123.4, 125.2, 125.3, 126.0, 126.1, 126.2, 126.5, 126.6, 126.8, 127.2, 127.3, 127.7, 127.8, 127.9, 128.0, 128.4, 128.7 (2), 128.8, 129.9, 130.0, 130.1, 130.2, 130.6 (2), 132.5, 135.4, 136.5, 147.1 (2), 154.2, 155.0, 155.4. Найдено, %: С 87.24, H 5.21, N 4.68. C43H30N2O. Вычислено, %: C 87.43, H 5.12, N 4.74.
Электронные спектры поглощения записаны на спектрофотометре Specord M-400. Флуоресцентные исследования проведены в Аналитическом центре коллективного пользования ИПХФ РАН: спектры эмиссии сняты на спектрофлуориметре фирмы PerkinElmer LS-55. Спектры ЯМР 1Н и ЯМP 13C регистрировали на спектрометре Bruker Avance III (рабочая частота 500 МГц и 126 МГц) в CDCl3, величины химических сдвигов приведены по шкале δ, в качестве внутреннего стандарта использовали ТМС. ИК спектры зарегистрированы на Фурье-спектрометре Perkin-Elmer Spectrum 100. Элементный анализ выполнен на анализаторе vario MICRO cube Elementar. Температуры плавления определены на столике Кофлера со скоростью нагрева 4 °С/мин.
Все исследования выполнены при комнатной температуре в воздушно-насыщенных растворах в этаноле с добавлением хлористого метилена в кварцевых кюветах с длиной оптического пути l = 1 см. Квантовые выходы флуоресценции измеряли, используя в качестве эталона разбавленный спиртовой раствор антрацена, квантовый выход флуоресценции которого составляет 0.3 [23], точность измерения 15%.
В качестве источника УФ света использовали светодиоды LED-316 (λmax = 316 нм, FWHM = 11 нм), LED-371 (λmax = 371 нм, FWHM = 8 нм), интенсивность действующего света (1–2) × 10–10 Эйнштейн см–2 с–1 для LED‑316 и (1.1–1.2) × 10–9 Эйнштейн см–2 с–1 для LED-371 (измерена ферриоксалатным актинометром). Ошибка измерения квантовых выходов реакций 20%. Все эксперименты проводили при красном свете.
Квантовохимические расчеты соединений в основном (S0) состоянии проводили методом функционала плотности с использованием гибридного функционала B3LYP в двух вариантах, без и с эмпирической дисперсионной поправкой (GD3), и гибридного функционала M06-2X, учитывающего дисперсионные взаимодействия, с базисом 6-31G*, пакет программ GAUSSIAN-09 [24]. Структуры соединений рассчитаны с полной оптимизацией геометрии. Оптимизированные структуры соответствовали минимумам на поверхности потенциальной энергии (ППЭ), поскольку в колебательных спектрах отсутствовали мнимые частоты.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Квантовохимические расчеты
Для оценки возможности существования конформеров диады D2 с π-стэкинг взаимодействием между SBQ фотохромами, были проведены DFT расчеты с использованием разных функционалов. Известно, что производные SBQ, вследствие вращения вокруг (квази)простой С–С-связи винил-бензохинолил, имеют два s-конформера, из которых более стабилен s-цис-конформер [10]. Такое соотношение стабильностей конформеров наблюдается и для производных М1 и М2. Расчет на уровне M06-2X/6-31G* показал, что s‑цис-конформер энергетически выгоднее s-транс-конформера на 0.93 ккал/моль для М1 и 1.48 ккал/моль для М2, в обоих соединениях боковые заместители находятся в плоскости молекулы, рис. 1.
Рис. 1.
Структуры s-цис-конформеров модельных SBQ М1 и М2, оптимизированные на уровне M06-2X/6-31G*.

Стыковка оптимизированных структур модельных SBQ М1 и М2 по атому кислорода дала плоскую структуру диады, при оптимизации которой получен конформер D2-А, рис. 2. При оптимизации, в результате отталкивания электронных оболочек близко расположенных атомов водорода, SBQ фотохромы вышли из плоскости и конформер D2-А приобрел V-образную структуру. При оптимизации структуры диады с максимально удаленными друг от друга SBQ фотохромами получен развернутый конформер D2-В, рис. 2. При оптимизации структуры диады с максимально сближенными фотохромами, расположенными один над другим, получен U-образный конформер D2-С, рис. 2. На уровне B3LYP/6-31G* этот конформер нестабилен и при оптимизации трансформировался в конформер D2-А. Полные и относительные энергии конформеров, рассчитанные разными функционалами, приведены в табл. 1.
Рис. 2.
Структуры конформеров диады D2, оптимизированные на уровне M06-2X/6-31G* (вид сверху и сбоку).
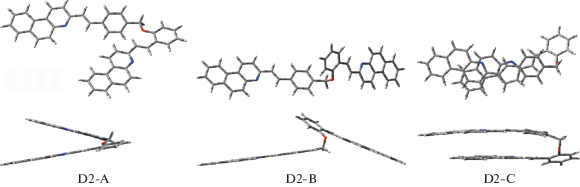
Таблица 1.
Полная энергия (Etot, а. е.) конформера D2-A и относительные энергии (ΔE, ккал/моль) конформеров диады D2, рассчитанные разными функционалами, во всех случаях использован базис 6-31G*
| Функционал | Etot | ΔE | ||
|---|---|---|---|---|
| D2-A | D2-A | D2-B | D2-С | |
| B3LYP | –1841.4110876 | 0 | 2.85 | – |
| B3LYP-GD3 | –1841.4831992 | 0 | 1.78 | –9.04 |
| M06-2X | –1840.6455476 | 0 | 1.73 | –6.97 |
На всех уровнях расчета конформер D2-B менее стабилен, чем D2-A, табл. 1, поскольку для достижения максимально развернутой конформации требуется выход боковых заместителей из плоскости соответствующего SBQ фотохрома, что энергетически невыгодно.
Гибридный функционал B3LYP хорошо зарекомендовал себя при расчете одиночных молекул, однако не подходит для расчета структур, в которых возможны нековалентные взаимодействия [25]. Такие π-стэкинг взаимодействия стабилизируют U-образный конформер D2-С, но на уровне B3LYP/6-31G* структура D2-С не является минимумом на ППЭ и при оптимизации трансформируется в структуру D2-A.
При добавлении к функционалу B3LYP эмпирической дисперсионной поправки GD3, а также при использовании гибридного функционала M06-2X, учитывающего дисперсионные взаимодействия, конформер D2-С оказывается самым стабильным, табл. 1, как и конформеры с π-стэкинг структурой ранее исследованных SBQ диад [15, 16]. Поскольку SBQ фотохромы в диаде D2 связаны очень коротким оксиметиленовым мостиком, нековалентное связывание в конформере D2-С приводит к нарушению планарной структуры фотохромов, в основном SBQ1, рис. 2.
В конформерах D2-А и D2-В реакция ФЦП невозможна вследствие удаленности SBQ фотохромов друг от друга: разные функционалы предсказывают расстояние между этиленовыми группами в пределах 7.94–8.14 Å для D2-А и 9.07–9.42 для D2-В.
В конформере D2-С фотохромы находятся один над другим и максимально сближены вследствие π-стэкинг взаимодействия, но сдвинуты относительно друг друга. Расстояние между этиленовыми группами равно 5.06 Å на уровне B3LYP--GD3 и 4.87 Å на уровне M06-2X, что больше максимально допустимого (4.2 Å, см. выше), поэтому реакция ФЦП в конформере D2-С также невозможна. При дизайне структуры диады D2 предполагалось наличие именно этого свойства.
На рис. 3 показаны энергия и структура граничных МО, высшей занятой (ВЗМО) и низшей вакантной (НВМО) и соседних МО для конформеров диады D2-А и D2-С и модельных стирилбензохинолинов М1 и М2. Замена метоксиметиленовой группы в стирильном фрагменте М1 на метокси группу в М2 приводит к незначительному повышению уровней граничных МО и уменьшению щели ВЗМО-НВМО на 0.03 эВ, что коррелирует с наблюдаемым небольшим батохромным сдвигом длинноволновой полосы поглощения (ДВПП) М2 по сравнению с М1 на 2 нм (0.02 эВ), см. ниже.
Рис. 3.
Энергия и структура граничных МО, высшей занятой (ВЗМО, HOMO, H) и низшей вакантной (НВМО, LU-MO, L) и соседних МО для конформеров диады D2-А и D2-С и модельных стирилбензохинолинов М1 и М2, расчет M06-2X/6-31G*.
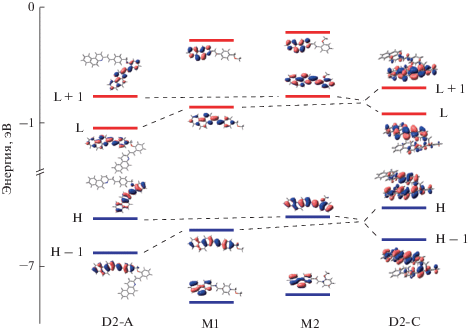
При объединении фотохромов в диаду в конформере D2-А уровни МО SBQ2 сохраняются, а МО SBQ1 уходят вниз по энергии, поэтому ВЗМО локализована на SBQ2, а НВМО – на SBQ1, рис. 3. Аналогичная картина наблюдается для конформера D2-В. В целом, в конформерах D2-А и D2-В МО попеременно локализованы на одном или другом SBQ фотохроме.
В конформере D2-С взаимодействие π-систем двух SBQ фотохромов приводит к делокализации МО по обоим фотохромам, но основной вклад в ВЗМО вносит π-система SBQ2, а в НВМО – SBQ1, рис. 3.
Важно отметить, что ВЗМО в моделях М1 и М2, а в диаде ВЗМО и ВЗМО-1 носят связывающий характер по двойной связи этиленовой группы, в то время как НВМО в моделях М1 и М2, а в диаде НВМО и НВМО+1 имеют разрыхляющий характер по двойной связи, что является предпосылкой протекания реакции ФИ при заполнении этих вакантных МО в возбужденном состоянии.
В табл. 2 приведены рассчитанные на уровне TD-M06-2X/6-31G* параметры низших синглетных возбужденных состояний модельных соединений и конформеров диады D2: энергии возбуждения, максимумы поглощения, силы осцилляторов и состав переходов. Сравнение с экспериментальными спектрами М1 и М2 (рис. 4), а также с данными метода TD-B3LYP [11] показывает, что метод TD-M06-2X завышает энергию переходов, но правильно передает соотношение между спектральными характеристиками соединений.
Таблица 2.
Вертикальные энергии возбуждения (Eex), максимумы поглощения (λmax), силы осцилляторов (f) и состав переходов (вклад > 15%) в низшие синглетные возбужденные состояния модельных стирилбензохинолинов М1 и М2 и диады D2 (см. структуры на рис. 1 и 2), рассчитанные методом TD-M06-2X/6-31G*
| Соединение | Сост.а | Составб | % | Eex (эВ) | λmax (нм) | f |
|---|---|---|---|---|---|---|
| М1 | S1 | H → L | 89 | 3.90 | 317.8 | 1.1461 |
| S2 | H-1 → L H → L + 1 |
45 33 |
4.27 | 290.5 | 0.2586 | |
| S3 | H-4 → L | 81 | 4.41 | 281.0 | 0.0018 | |
| S4 | H-1 → L + 1 H-2 → L |
66 20 |
4.81 | 257.7 | 0.4498 | |
| М2 | S1 | H → L | 89 | 3.88 | 319.4 | 1.0487 |
| S2 | H-1 → L H → L + 1 |
42 36 |
4.26 | 291.0 | 0.1980 | |
| S3 | H-4 → L | 81 | 4.41 | 281.3 | 0.0017 | |
| S4 | H-2 → L H-1 → L + 1 |
45 36 |
4.76 | 260.7 | 0.1202 | |
| D2-А | S1 | H → L + 1 H-1 → L |
57 35 |
3.85 | 322.4 | 0.5458 |
| S2 | H-1 → L H → L + 1 |
53 32 |
3.94 | 314.8 | 1.5463 | |
| S3 | H-3 → L H-2 → L + 1 H → L + 3 H-1 → L + 2 |
25 21 18 15 |
4.25 | 291.6 | 0.0820 | |
| S4 | H-3 → L H-2 → L + 1 H → L + 3 |
24 22 17 |
4.27 | 290.3 | 0.4030 | |
| D2-С | S1 | H → L | 69 | 3.65 | 339.3 | 0.0377 |
| S2 | H → L + 1 H-1 → L |
49 29 |
3.94 | 314.8 | 1.3203 | |
| S3 | H-1 → L H → L |
28 17 |
4.17 | 297.3 | 0.0034 | |
| S4 | H-2 → L + 1 H → L + 3 |
20 16 |
4.20 | 294.9 | 0.2285 |
Рис. 4.
Спектры поглощения (левая ось): модельных фотохромов (1) E-М1 и (2) E-М2, EE изомера диады D2 (3) экспериментальный и (4) рассчитанный как сумма спектров модельных соединений; нормированные спектры люминесценции (правая ось, возбуждение 356 нм): (5) E-М1, (6) E-М2, (7) EE-D2, (8) E-М2 в масштабе спектра (7).
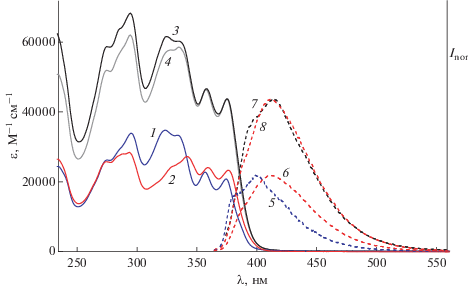
В модельных SBQ М1 и М2 основной вклад в ДВПП вносит интенсивный переход в S1-состояние, который обусловлен (на 89%) переносом электрона между граничными МО, делокализованными по всей π-системе SBQ. Рассчитанный небольшой батохромный сдвиг при переходе от М1 к М2 согласуется с экспериментом.
Анализ расчетных данных для диады показывает, что в конформере D2-А переход в низшее возбужденное S1-состояние представляет собой суперпозицию двух локализованных на разных SBQ фотохромах переходов H → L + 1 (57%) и H-1 → L (35%) с преимущественным вкладом SBQ2, табл. 2, рис. 3.
В конформере D2-С малоинтенсивный переход S0 → S1 обусловлен переносом электрона между граничными МО H → L, делокализованными по π-системам обоих фотохромов. По сравнению с конформером D2-А, для D2-С расчет предсказывает на 0.2 эВ более низко лежащее S1‑состояние, что соответствует батохромному сдвигу полосы поглощения на 17 нм.
В обоих конформерах диады изоэнергетические переходы S0 → S2 (3.94 эВ) обладают самой большой силой осциллятора. Для обоих конформеров эти переходы имеют качественно одинаковый состав, H-1 → L и H → L + 1, но в конформере D2-А переходы происходят между МО, локализованными на одном и том же фотохроме, т.е. это суперпозиция локальных переходов в SBQ1 и SBQ2 фотохромах, а в конформере D2-С те же МО делокализованы по обоим фотохромам, рис. 3.
Таким образом, квантовохимические расчеты показывают, что для диады D2 возможны конформеры, имеющие в основном S0 состоянии π-стэкинг структуру со сближенными SBQ фотохромами, которая может быть предшественником эксиплекса, образующегося в возбужденном S1 состоянии. Расчет предсказывает батохромно сдвинутый спектр поглощения для π-стэкинг структуры; при образовании эксиплекса следует ожидать батофлорно сдвинутый спектр флуоресценции. В то же время реакция ФЦП в эксиплексе не будет протекать, т.к. расстояние между этиленовыми группами двух SBQ фотохромов больше максимально допустимого для этой реакции.
Экспериментальные исследования подтвердили второй вывод – реакция ФЦП в диаде D2 не происходит, однако батофлорно сдвинутая флуоресценция также не наблюдается. Если эксиплекс и образуется, безызлучательные каналы дезактивации в нeм преобладают над излучательным.
Синтез диады D2
Исходя из структуры, существует несколько вариантов синтеза диады D2. Используя отработанную ранее методику синтеза производных SBQ конденсацией 3-метилбензо[f]хинолина и замещенных бензальдегидов [15], был протестирован вариант синтеза сначала двух SBQ-фотохромов с последующим соединением их между собой. Однако затем было найдено, что оптимальным является другая последовательность, состоящая в постепенном наращивании структуры диады, схема 2 . По этой схеме вначале был синтезирован фотохром SBQ1 с бромметильным заместителем – 3-((E)-2-(4-(бромметил)фенил)-винил)-бензо[f]хинолин, к которому затем присоединили салициловый альдегид в реакции нуклеофильного замещения, а на последней стадии достроили фрагмент фотохрома SBQ2 в реакции конденсации с 3-метилбензо[f]хинолином.
Схема 2 . Схема синтеза диады D2.
Спектрально-люминесцентные свойства
Модельные SBQ обладают колебательно-разрешенными ДВПП в УФ-А диапазоне спектра с максимумами 357 и 375 нм для М1 и 360 и 377 нм для М2 (рис. 4, спектры 1 и 2). Эти особенности сохраняются в спектре поглощения диады D2, максимумы ДВПП равны 358 и 376 нм, рис. 4. Экспериментальный спектр диады (рис. 4, спектр 3), практически, совпадает с рассчитанным как сумма спектров модельных SBQ (рис. 4, спектр 4); небольшие различия двух спектров свидетельствуют о незначительном взаимодействии двух фотохромов в S0-состоянии.
Исходя из молярных показателей поглощения (МПП) модельных SBQ, можно оценить соотношение между эффективностями поглощения света каждым фотохромом в зависимости от длины волны облучения. Например, на длине волны 316 нм М1 поглощает в 1.56 раз больше света, чем М2, а на длине волны 375 нм, наоборот, М2 поглощает в 1.11 раз больше света, чем М1.
Оба SBQ фотохрома являются люминофорами. Как и спектр поглощения, спектр излучения М2 (рис. 4, спектр 6) сдвинут в сторону длинных волн относительно спектра М1 (рис. 4, спектр 5). Максимумы (λfl) и квантовые выходы флуоресценции (φfl) равны 401 нм (с плечом 383 нм) и 0.54 для М1, 413 нм и 0.084 для М2 [11]. Энергии 0-0 переходов равны 26260 см–1 (3.26 эВ) для М1 и 25850 см–1 (3.20 эВ) для М2.
Поскольку S1-состояние М1 лежит на 0.06 эВ выше, чем М2, с учетом близкого расположения фотохромов в диаде (см. выше), можно ожидать эффективного синглет-синглетного ПЭ от SBQ1 к SBQ2, что будет приводить к тушению первого и сенсибилизации второго.
Согласно теории диполь-дипольного индуктивно-резонансного ПЭ, предложенной Фёрстером [26], константа скорости ПЭ определяется уравнением
Используя спектры поглощения и флуоресценции модельных SBQ, были рассчитаны интегралы перекрывания для разных донорно-акцепторных пар, которые приведены в табл. 3. Там же даны значения радиусов Фёрстера, которые оценены с использованием среднеквадратичной величины κ2 = 2/3 [26]; для разных конформеров диады D2 этот параметр имеет разное значение, зависящее от взаимной ориентации дипольных моментов переходов донора и акцептора энергии.
Таблица 3.
Интегралы перекрывания спектров (J) и радиусы Фёрстера (R0) для разных донорно-акцепторных пар модельных SBQ фотохромов
| Донор | Акцептор | J/1012 М–1 см–1 нм4 | R0/нм | |
|---|---|---|---|---|
| 1 | E-M1 | E-M2 | 86.8 | 3.04 |
| 2 | E-M2 | E-M1 | 27.3 | 1.84 |
| 3 | E-M1 | Z-M2 | 5.0 | 1.89 |
| 4 | E-M2 | Z-M1 | 2.6 | 1.24 |
Формально, ПЭ в направлении SBQ1 → SBQ2 возможен в изомерах диады EE и EZ, а в направлении SBQ2 → SBQ1 – в изомерах EE и ZE. Однако, исходя из рассчитанных параметров, преобладающими являются процессы с ПЭ, в которых донором является E-SBQ1: E-SBQ1 → E-SBQ2 и E-SBQ1 → Z-SBQ2. Для этих донорно-акцепторных пар получены максимальные значения R0 (табл. 3). Это вывод согласуется со сделанным выше на основании сравнения энергий 0-0 переходов.
Действительно, спектр излучения диады, λfl = = 414 нм (рис. 4, спектр 7), а также квантовый выход флуоресценции, φfl = 0.093, практически, совпадают с аналогичными параметрами для М2. При сравнении спектра флуоресценции диады со спектром М2 в том же масштабе (рис. 4, спектр 8) выявляется небольшое плечо в спектре диады при 400 нм, которое соответствует положению полосы излучения М1, поэтому его следует отнести к остаточному излучению SBQ1 в диаде. Исходя из соотношения площадей полос в шкале волновых чисел, доля SBQ1 в полосе излучении диады составляет 2.5%. На длине волны возбуждения (356 нм), как следует из соотношения МПП, SBQ1 поглощает 49.5% света, и поскольку для диады φfl = 0.093, получаем для квантового выхода флуоресценции SBQ1 в диаде $\varphi _{{{\text{fl}}}}^{'}$ = 0.0046.
Теперь можно рассчитать эффективность (квантовый выход) ПЭ в диаде: φET = 1 – $\varphi _{{\text{D}}}^{'}$/φD, где φD и $\varphi _{{\text{D}}}^{'}$ – это квантовые выходы флуоресценции донора (SBQ1) в свободном состоянии и в присутствии акцептора (SBQ2 в диаде.) Используя в качестве φD значение φfl для М1 (0.54), получаем для диады D2 φET = 0.99.
Таким образом, в диаде D2 наблюдается эффективный ПЭ от SBQ1 к SBQ2, который проявляется в люминесцентных и, как показано ниже, также в фотохимических свойствах диады. В то же время не наблюдается батофлорно сдвинутый спектр флуоресценции, который можно было бы отнести к излучению эксиплекса. По-видимому, квантовохимические расчеты переоценивают стабильность конформеров с π-стэкинг взаимодействием, в которых возможно образование эксиплексов.
Фотохимические свойства
Фотохимические свойства производных стирилбензохинолинов М1 и М2 изучены ранее [11]. Оба соединения подвергаются обратимой ФИ, схема 3 , с квантовыми выходами транс-цис (φtc) и цис-транс(φct) ФИ φtc = 0.20 и φct = 0.47 для М1 и φtc = 0.39 и φct = 0.44 для М2. Кроме того, для М2 обнаружена побочная реакция фотоциклизации (ФЦ) цис-изомера с образованием производных 12b-азониа-бензо[c]хризена.
Схема 3 . Фотоизомеризация производных 3-стирилбензо[f]хинолина.
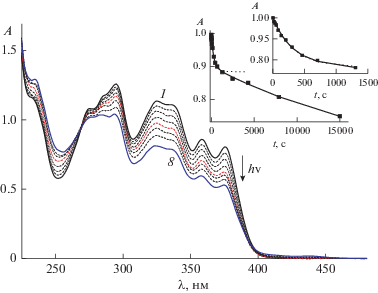
При облучении диады D2 светом 316 на начальной стадии (0–1300 с) наблюдались спектральные изменения, характерные для реакции транс-цис ФИ производных SBQ: уменьшение поглощения в области 270–390 нм с одновременным ростом в коротковолновой области, рис. 5. При этом наблюдалась изосбестическая точка (ИТ) 269.7 нм, а кинетическая кривая, практически, выходила на плато, что можно было рассматривать как достижение ФС реакции ФИ, рис. 5, вставка.
Рис. 5.
Спектральные изменения при облучении воздушно-насыщенного раствора диады D2 (2 × 10–5 М) светом с длиной волны 316 нм, интенсивность 1.2 × 10–10 Эйнштейн см–2 с–1, общее время фотолиза (1–8) 15 000 с; вставка: кинетика изменения оптической плотности на длине волны 316 нм, экспериментальные точки и аппроксимирующие кривые, рассчитанные по моделям “6 уравнений” (сплошная линия) и “2 уравнения” (пунктирная линия), см. текст.
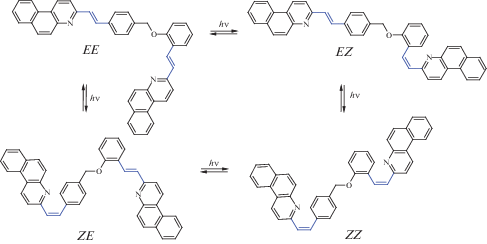
Для бифотохромной диады в цикле реакций ФИ участвуют четыре изомера – EE, EZ, ZE и ZZ, схема 4, соотношение концентраций которых в реакционной смеси по достижении ФС зависит от соотношения МПП и квантовых выходов ФИ.
Схема 4 . Цикл реакций фотоизомеризации бифотохромной диады D2 (с фрагментами SBQ в форме s-цис-конформеров).
Однако при облучении диады D2 достигалось не истинное, а квази-ФС, поскольку при увеличении времени облучения на порядок и более происходило дальнейшее уменьшение полосы поглощения и наблюдался сдвиг ИТ. На этой стадии наблюдался также рост полосы в области 430–440 нм. Поскольку эти спектральные изменения аналогичны таковым при облучении модельного М2, мы предположили, что они связаны с реакцией ФЦ цис-изомера фотохрома SBQ2, которая возможна в EZ и ZZ изомерах диады.
Применение метода главных компонент (МГК, principal component analysis) [27, 28] к анализу спектральных изменений при фотолизе диады D2 подтвердило наличие в реакционной смеси дополнительных хромофоров, связанных с протеканием реакций, побочных по отношению к ФИ. На начальных стадиях фотолиза анализ МГК показал наличие только трех независимых хромофоров. Это объясняется тем, что спектр любого из четырех изомеров диады (т.е. хромофоров) является алгебраической суммой спектров трех других изомеров, например, ZZ = (EZ + ZE – EE), т.е. независимы только три хромофора. Однако при анализе всего массива спектров, полученных при фотолизе диады, МГК показал появление в реакционной смеси дополнительных независимых хромофоров, которые, как указано выше, логично приписать продуктам реакции ФЦ.
Это наглядно видно, если при анализе к матрице экспериментальных спектров при фотолизе диады D2 добавить модельные спектры изомеров диады, рассчитанные исходя из спектров транс- и цис- изомеров модельных SBQ М1 и М2. На рис. 6 показан график счетов, на котором экспериментальные и модельные спектры представлены в общем базисе первых трех сингулярных векторов. Каждая точка на графике соответствует конкретному спектру, при анализе учитывался спектральный диапазон 255–480 нм с шагом 1 нм, т.е. исходная матрица включала 226 значений оптической плотности для каждого спектра. Звездочками отмечены точки, соответствующие модельным спектрам изомеров диады. Следует обратить внимание на разницу масштабов шкал по векторам p2 и p3 на рис. 6б.
Рис. 6.
График счетов – обработка методом главных компонент (principal component analysis) спектральных изменений, происходящих при фотолизе диады D2 светом 316 нм, экспериментальные спектры представлены в общем базисе первых сингулярных векторов (a) p1 и p2, (б) p2 и p3. Звездочками отмечены точки, соответствующие модельным спектрам изомеров диады (см. текст), стрелки показывают направление спектральных изменений при фотолизе.
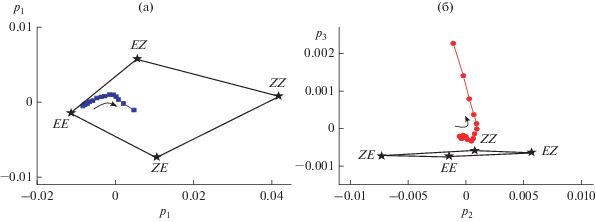
Все четыре изомера диады D2 спектрально различаются, поэтому точки EE, EZ, ZE и ZZ на рис. 6 образуют четырехугольник, который ограничивает область возможных спектральных изменений, связанных с реакциями ФИ двух SBQ фотохромов в диаде. Четырехугольник лежит в одной плоскости p1–p2, что обусловлено наличием только трех независимых хромофоров. Несовпадение начальной точки кривой на рис. 6 с точкой EE связано с небольшим различием экспериментального и модельного спектров диады, что обсуждалось выше, рис. 4.
Движение по вектору p1 связано со спектральными изменениями при реакции ФИ обоих фотохромов диады, в то время как по вектору p2 реакции ФИ SBQ1 и SBQ2 разнонаправлены и чeтко различаются. На рис. 6а, 6б хорошо видно, что вначале экспериментальная кривая движется по направлению EE−EZ, т.е. вначале спектрально проявляется, практически, только реакция ФИ SBQ2. Отсутствие спектральных проявлений реакции ФИ SBQ1 (движение вдоль стороны EE−ZE) согласуется с выводом о практически полном ПЭ от SBQ1 к SBQ2 в EE изомере диады D2, в результате чего фотохимическая активность SBQ1 потушена. Сопоставление с рис. 5, вставка, показывает, что начальный участок кривой до излома на графиках МГК, рис. 6, соответствует начальному участку быстрых спектральных изменений на кинетической кривой.
Точка излома на графиках МГК, рис. 6, характеризует достижение квази-ФС в реакции ФИ SBQ2. После прекращения быстрых спектральных изменений, связанных с этой реакцией, при длительном облучении начинают проявляться существенно более медленные изменения, связанные с другой реакцией. По вектору p2 эти спектральные изменения направлены в сторону ZE изомера диады и обусловлены реакцией транс-цис ФИ SBQ1, но включение в анализ вектора p3 показывает, что они связаны также с появлением новых хромофоров, поскольку график МГК выходит из плоскости p1–p2, рис. 6б. Поэтому можно сделать вывод, что в медленные спектральные изменения при длительном фотолизе диады D2 вносит вклад не только реакция транс-цис ФИ SBQ1, которая в EE изомере, практически, потушена в результате ПЭ на SBQ2, но и реакция ФЦ цис-изомера SBQ2 в EZ и ZZ изомерах диады.
Поскольку бифотохромная диада D2 содержит два разных фотохрома, кинетику ФИ диады по схеме 4 можно описать упрощенной системой дифференциальных уравнений (1)–(4) (см. подробнее [29, 30 ] ):
(1)
$\begin{gathered} {{d{{c}_{{EE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EE}}}} {dt = ({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}}{{c}_{{ZE}}} + }}} \right. \kern-0em} {dt = ({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}}{{c}_{{ZE}}} + }}{{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c2}}}}}{{c}_{{EZ}}} - \\ - \,\,({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}} + {{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}){{c}_{{EE}}}){{I}_{0}}F, \\ \end{gathered} $(2)
$\begin{gathered} {{d{{c}_{{ZE}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZE}}}} {dt = ({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}{{c}_{{EE}}} - }}} \right. \kern-0em} {dt = ({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}{{c}_{{EE}}} - }} \\ - \,\,({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}} + {{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}){{c}_{{ZE}}} + {{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{t2}}}}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(3)
$\begin{gathered} {{d{{c}_{{EZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{EZ}}}} {dt = ({{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}{{c}_{{EE}}} - }}} \right. \kern-0em} {dt = ({{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}{{c}_{{EE}}} - }}({{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c2}}}}} + \\ + \,\,{{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}){{c}_{{EZ}}} + {{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}}{{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $(4)
$\begin{gathered} {{d{{c}_{{ZZ}}}} \mathord{\left/ {\vphantom {{d{{c}_{{ZZ}}}} {dt = ({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}{{c}_{{EZ}}} + }}} \right. \kern-0em} {dt = ({{\varphi }_{{{\text{tc1}}}}}{{\varepsilon }_{{{\text{t1}}}}}{{c}_{{EZ}}} + }}{{\varphi }_{{{\text{tc2}}}}}{{\varepsilon }_{{{\text{t2}}}}}{{c}_{{ZE}}} - \\ - \,\,({{\varphi }_{{{\text{ct1}}}}}{{\varepsilon }_{{{\text{c1}}}}} + {{\varphi }_{{{\text{ct2}}}}}{{\varepsilon }_{{{\text{c2}}}}}){{c}_{{ZZ}}}){{I}_{0}}F, \\ \end{gathered} $Кроме того, для диады D2 следует учесть две реакции ФЦ, которые протекают в Z-SBQ2 фотохроме в EZ и ZZ изомерах диады с образованием фотоциклопродуктов PCP1 и PCP2. Для упрощения примем, что обе реакции имеют одинаковый квантовый выход φpc. Для описания этих реакций необходимо добавить уравнения (5) и (6), а также соответствующие члены добавить к уравнениям (3) и (4):
(5)
${{d{{c}_{{{\text{PCP1}}}}}} \mathord{\left/ {\vphantom {{d{{c}_{{{\text{PCP1}}}}}} {dt}}} \right. \kern-0em} {dt}} = {{\varphi }_{{{\text{pc}}}}}{{\varepsilon }_{{{\text{c2}}}}}{{c}_{{EZ}}}{{I}_{0}}F,$(6)
${{d{{c}_{{{\text{PCP2}}}}}} \mathord{\left/ {\vphantom {{d{{c}_{{{\text{PCP2}}}}}} {dt}}} \right. \kern-0em} {dt}} = {{\varphi }_{{{\text{pc}}}}}{{\varepsilon }_{{{\text{c2}}}}}{{c}_{{ZZ}}}{{I}_{0}}F.$Необходимо учесть еще один фактор. Все фотохимические превращения SBQ2 в EE и EZ изомерах диады D2 протекают как при прямом возбуждении SBQ2, что учтено в рассмотренной системе дифференциальных уравнений, так и при сенсибилизации вследствие ПЭ от SBQ1. Относительный вклад этих каналов возбуждения зависит от соотношения МПП SBQ1 и SBQ2 на длине волны облучения. По данным спектрально-люминесцентного анализа, в EE изомере диады эффективность ПЭ от E-SBQ1 к E-SBQ2 равна 0.99. ПЭ возможен также от E-SBQ1 к Z-SBQ2 в EZ изомере диады. Интеграл перекрывания спектров для акцептора Z-SBQ2 на порядок меньше по сравнению с акцептором E-SBQ2, табл. 3, поэтому для эффективности ПЭ от E-SBQ1 к Z-SBQ2 принято значение 0.5.
С учетом этих упрощений, систему дифференциальных уравнений (1)–(6) решали численно путем минимизации среднеквадратичной ошибки оптической плотности ΔA = (Σ(Acalc – Aexp)2/m)1/2, где Acalc – оптическая плотность, рассчитанная численным интегрированием уравнений (1)–(6), Aexp – измеренная оптическая плотность реакционной смеси, m – число экспериментальных точек на кинетической кривой. Получены следующие значения квантовых выходов: φtc1 = 0.015, φct1 = 0.002, φtc2 = = 0.51, φct2 = 0.61 и φpc= 0.006. Рассчитанная аппроксимирующая кривая показана на вставке на рис. 5 сплошной линией. Из полученных данных следует, что для Z-SBQ2 в диаде D2, как и для модельного М2, квантовый выход реакции ФЦ на два порядка меньше квантового выхода реакции ФИ.
Сравнение результатов расчета по системе уравнений (1)–(6) с результатами анализа МГК показывает адекватность предложенной кинетической схемы для описания спектральных изменений при фотолизе диады D2. На рис. 7 показана кинетика изменения относительных концентраций изомеров диады, включая продукты фотоциклизации. Видно, что в начальный период до 1300 с проявляется, практически, только реакция ФИ SBQ2, что соответствует наблюдению ИТ в этот период, рис. 5, а также ходу графика МГК вдоль отрезка EE-EZ в плоскости p1–p2, рис. 6.
Рис. 7.
Относительная концентрация изомеров диады D2 при облучении светом 316 нм: (1) EE, (2) ZE, (3) EZ, (4) ZZ, (5) PCP1 и (6) PCP2.
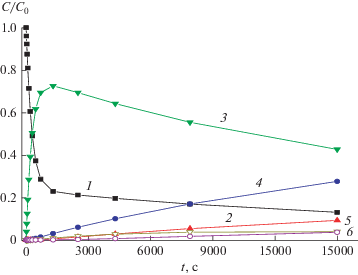
Точка достижения максимума концентрации EZ изомера (рис. 7, кривая 3) соответствует точке излома на графиках МГК (рис. 6) и характеризует достижение квази-ФС в реакции ФИ SBQ2. Расчет показывает, что в этот момент времени более 95% смеси составляют только EE (23.4%) и EZ (71.9%) изомеры диады, содержание ZZ изомера равно 2.9%, ZE изомера – 1%, а продуктов фотоциклизации – 0.8%.
После достижения квази-ФС начинается медленный спад кинетической кривой, рис. 5, вставка, в реакционной смеси начинают накапливаться продукты фотоциклизации (PCP1 и PCP2), этот период времени соответствует выходу графика МГК из плоскости p1–p2 и ходу кривой по третьему вектору p3, рис. 6б. Становится заметным также рост содержания других изомеров диады, ZZ (кривая 4) и, в последнюю очередь, ZE изомера (кривая 2), рис. 7. Очевидно, что основной канал образования ZE изомера – через EZ и ZZ изомеры, схема 5 , а не напрямую из EE изомера, т. к. этот канал, практически, потушен вследствие ПЭ. Появление изомеров диады, содержащих фотохром Z-SBQ1, соответствует повороту графика МГК после излома в отрицательную сторону по вектору p2, рис. 6.
Следует подчеркнуть сходство и различие между кинетическими кривыми на рис. 5 (вставка) и рис. 7, и кривой на графике МГК на рис. 6. В их основе лежат одни и те же спектральные изменения при облучении диады D2 светом, хотя график МГК не имеет шкалы времени. Принципиальное различие состоит в том, что при анализе МГК apriori не используется никакой гипотезы о структуре хромофоров и сути протекающих превращений. График МГК выявляет только тот факт, что в реакционной системе существует несколько разных хромофоров, между которыми происходят переходы, но МГК не может раскрыть химическую сущность этих хромофоров и характер происходящих реакций.
В отличие от этого, кинетические кривые рассчитываются на основе модели, в которую уже вложено представление о структуре соединений и механизме реакций. Однако даже в рамках одной модели кривые могут иметь разный вид, в зависимости от использованных параметров. И наоборот, иногда по другой модели также можно аппроксимировать экспериментальные данные. Например, исходя из полученных значений квантовых выходов, которые для реакции ФИ SBQ2 на порядок и более превосходят значения для других реакций, наблюдаемых в реакционной системе, в начальный период времени можно пренебречь этими другими реакциями. Максимально простая кинетическая модель “ФИ только SBQ2 фотохрома” с учетом только уравнений (1) и (2) и 100% ПЭ на начальном участке дает значения φtc2 = 0.48 и φct2 = = 0.09. Рассчитанная по этой модели кинетическая кривая показана на вставке на рис. 5 пунктирной линией. До 1300 с кривые, рассчитанные по моделям “6 уравнений” и “2 уравнения” неразличимы. Но затем кривая модели “2 уравнения” выходит на плато, т.е. простая модель “только одна реакция” неспособна описать дальнейшее уменьшение оптической плотности и появление в реакционной смеси новых независимых хромофоров при увеличении времени облучения до 15 000 с.
Полученные данные по спектрально-люминесцентным и фотохимическим свойствам диады D2 обобщены на рис. 8 в виде диаграммы термов. Диада представляет собой ковалентно связанную донорно-акцепторную пару, где донором энергии является фотохром SBQ1, акцептором – SBQ2. Отнесение термов произведено на основании спектров модельных фотохромов М1 и М2. Для термов низших синглетно-возбужденных состояний, локализованных на SBQ1 (S1_D) и SBQ2 (S1_A) фотохромах, показано положение уровней 0–0 переходов, рассчитанных по пересечению спектров поглощения и люминесценции, для термов S2-состояний приведены энергии вертикальных (франк-кондоновских) переходов, рассчитанные по положению максимумов полос поглощения.
Рис. 8.
Диаграмма термов для EE изомера бис-стирилбензохинолиновой диады D2; ЕТ (energy transfer) – перенос энергии, донором (D) энергии является фотохром SBQ1, акцептором (A) – SBQ2; для S1-термов указаны энергии 0-0 переходов, для S2-термов – энергии вертикальных (франк-кондоновских) переходов, рассчитанные по максимумам полос поглощения модельных фотохромов М1 и М2.
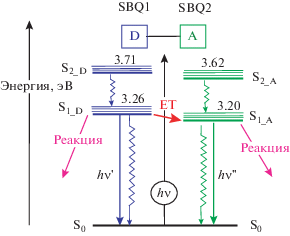
В диаде наблюдается несколько конкурентных фотофизических и фотохимических процессов. Под действием света возбуждаются оба фотохрома, поскольку их спектры поглощения перекрываются, а доля света, поглощенного каждым фотохромом, определяется соотношением МПП на длине волны облучения. Оба фотохрома флуоресцируют и подвергаются реакции ФИ, однако в SBQ1 эти процессы потушены, поскольку основной канал дезактивации возбужденного SBQ1 – это перенос энергии на SBQ2, приводящий к тушению первого и сенсибилизации второго фотохрома.
ЗАКЛЮЧЕНИЕ
Таким образом, с целью предотвращения реакции [2+2]-фотоциклоприсоединения (ФЦП), разработана структура несимметричной диады D2, в которой два разных стирилбензохинолиновых (SBQ) фотохрома с заместителями в орто- и пара- положениях стирильных фрагментов соединены оксиметиленовой мостиковой группой, что обеспечило продольный сдвиг фотохромов друг относительно друга.
Квантовохимические расчеты относительной стабильности конформеров диады по теории функционала плотности (DFT) с применением функционалов B3LYP-GD3 и M06-2X, учитывающих дисперсионные поправки, с базисом 6-31G*, предсказали возможность существования стабильных конформеров диады с π-стэкинг взаимодействием SBQ фотохромов, в которых невозможна реакция ФЦП, но которые могут быть предшественниками эксиплексов, обладающих длинноволновой флуоресценцией.
Диада D2 была синтезирована, ее спектрально-люминесцентные и фотохимические свойства исследованы в сравнении со свойствами модельных SBQ. Под действием света в диаде происходила реакция фотоизомеризации и перенос энергии между двумя SBQ фотохромами с эффективностью 99%, приводящий к тушению SBQ-донора и сенсибилизации SBQ-акцептора. Длинноволновая флуоресценция эксиплекса не наблюдалась. При длительном облучении диады обнаружена побочная реакция, предположительно, фотоциклизация SBQ-акцептора, поскольку в соответствующем модельном фотохроме М2 наблюдались аналогичные спектральные изменения.
В отличие от ранее исследованных SBQ диад, в случае диады D2 не получено ни химического (реакция ФЦП), ни физического (батофлорно сдвинутый спектр флуоресценции) свидетельства образования эксиплекса (эксимера для симметричных диад). На основании сравнения расчетных и экспериментальных данных сделан вывод, что функционалы B3LYP-GD3 и M06-2X, возможно, переоценивают стабильность конформеров диады с π-стэкинг взаимодействием SBQ фотохромов. Возможно также, что такие конформеры все же существуют и дают эксиплекс, но безызлучательные каналы дезактивации в нeм преобладают над излучательным.
Список литературы
Wysocki L.M., Grimm J.B., Tkachuk A.N., Brown T.A., Betzig E., Lavis L.D. // Angew. Chem. Int. Ed. 2011. V. 50. P. 11206.
Lavoie-Cardinal F., Jensen N.A., Westphal V., Stiel A.C., Chmyrov A., Bierwagen J., Testa I., Jakobs S., Hell S.W. // Chem. Phys. Chem. 2014. V. 15. P. 655.
Moerner W.E. // J. Microscopy. 2012. V. 246. P. 213.
Szacilowski K. // Chem. Rev. 2008. V. 108. P. 3481.
Будыка М.Ф. // Химия высоких энергий. 2010. Т. 44. С. 154.
Gust D., Andreasson J., Pischel U., Moore T.A., Moo-re A.L. // Chem. Commun. 2012. V. 48. P. 1947.
Budyka M.F., Potashova N.I., Gavrishova T.N., Li V.M. // Nanotechnol. Russ. 2012. V. 7. P. 280.
Будыка М.Ф. // Успехи химии. 2017. Т. 86. С. 181.
Будыка М.Ф., Ли В.М., Поташова Н.И. // Химия высоких энергий. 2013. Т. 47. С. 196.
Будыка М.Ф., Ли В.М., Гавришова Т.Н., Поташова Н.И. // Химия высоких энергий. 2015. Т. 49. С. 177.
Будыка М.Ф., Гавришова Т.Н., Ли В.М., Дозморов С.А. // Химия высоких энергий. 2021. Т. 55. № 1. С. 13.
Budyka M.F., Gavrishova T.N., Potashova N.I., Chernyak A.V. // Mendeleev Commun. 2015. V. 25. P. 106.
Budyka M.F., Gavrishova T.N., Potashova N.I. // ChemistrySelect. 2016. V. 1. P. 36.
Budyka M.F., Gavrishova T.N., Potashova N.I., Li V.M. // Chemistry Select. 2018. V. 3. P. 10651.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Федулова Ю.А. // Химия высоких энергий. 2019. Т. 53. С. 206.
Caldwell R.A., Creed D. // Acc. Chem. Res. 1980. V. 13. P. 45.
Matsubara C., Kojima M. // Tetrah. Lett. 1999. V. 40. P. 3439.
Gierschner J., Mack H.G., Oelkrug D., Waldner I., Rau H. // J. Phys. Chem. A. 2004. V. 108. P. 257.
Shu K., Zhao J., Yuan S., Dou Y., Lo G.V. // Internat. J. Photoenergy. 2014. 874102.
Chung J.W., You Y., Huh H.S., An B.K., Yoon S.J., Kim S.H., Lee S.W., Park S.Y. // J. Am. Chem. Soc. 2009. V. 131. P. 8163.
Krueger R.A., Blanquart G. // Phys. Chem. Chem. Phys. 2019. V. 21. P. 10325.
Becker H.D. // Chem. Rev. 1993. V. 93. P. 145.
Gaussian 09, Revision D.01 // Frisch M.J., Trucks G.W., Schlegel H.B., et al. Gaussian, Inc., Wallingford CT, 2013.
Riley K.E., Pitonak M., Jurecka P., Hobza P. // Chem. Rev. 2010. V. 110. P. 5023.
Braslavsky S.E., Fron E., Rodriguez H.B., Roman E.S., Scholes G.D., Schweitzer G., Valeur B., Wirz J. // Photochem. Photobiol. Sci. 2008. V. 7. P. 1444.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М. // Химия высоких энергий. 2010. Т. 44. С. 436.
Pomerantsev A.L., Chemometrics in Excel, John Wiley & Sons, Inc., Hoboken, 2014.
Будыка М.Ф., Поташова Н.И., Гавришова Т.Н., Ли В.М., Гак Ю.В., Гринева И.А. // Химия высоких энергий. 2018. Т. 52. С. 204.
Будыка М.Ф., Гавришова Т.Н., Ли В.М., Дозморов С.А. // Химия высоких энергий. 2019. Т. 53. С. 7.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий