Химия высоких энергий, 2021, T. 55, № 1, стр. 98-100
Взаимодействие триплетного состояния модифицированного порфиринового красителя с нитроксильным радикалом
А. Е. Егоров a, *, А. А. Костюков a, В. М. Алпатова b, В. А. Ольшевская b, В. А. Кузьмин a
a Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, ул. Косыгина, 4, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: ae.yegorov@gmail.com
Поступила в редакцию 25.08.2020
После доработки 26.08.2020
Принята к публикации 02.09.2020
Порфирины и родственные соединения находят широкое применения как наноматериалы [1], органические солнечные батареи [2], применяются для лечения различных кожных заболеваний [3], а также как фотосенсибилизаторы для фотодинамической терапии рака (ФДТ) [4, 5]. Ряд соединений уже одобрены для применения в клинической практике [6]. Одним из методов повышения эффективности действия молекул (фотосенсибилизаторов) применяемых при проведении ФДТ, является химическая модификация исходных молекул, направленная на улучшение фотодинамических свойств молекул, повышения биодоступности и понижения их системной (темновой) токсичности. В данной работе был исследован тетрафенилпорфирин, содержащий карборанилсукцинимидный заместитель в бета-положении порфиринового макроцикла. Ранее было показано, что карборановые производные порфиринов показывают более высокую противоопухолевую активность нежели их неборированные аналоги [7]. Взаимодействие молекул фотосенсибилизаторов со стабильными радикалами представляет интерес из-за усиления интеркомбинационной конверсии в результате действия парамагнитной частицы (нитроксильного радикала). В работе [8] был исследован конъюгат нафталиндиимидного производного с (2,2,6,6–тетраметилпиперидин-1-ил) оксилом (TEMPO). В результате ковалентной сшивки хромофора со стабильным радикалом, свойства полученного соединения демонстрируют эффект аналогичный эффекту тяжелого атома. Представляет интерес изучение взаимодействия молекул тетрапирролов и стабильных радикалов для возможного последующего создания новых перспективных молекул фотосенсибилизаторов.
В представленной работе было изучено взаимодействие триплетного состояния соединения 2-{3-[(o-карборан-1'-ил)тио]пирролидин-2,5-дион-1-ил}-5,10,15,20-тетрафенилпорфирина (P), синтезированного согласно [9], со стабильным нитроксильным радикалом (2R) 4-гидрокси-2,2,6,6-тетрапиперидин-1-оксилом (TEMPOL) (“Sigma-Aldrich”, США) методом импульсного фотолиза. Спектры поглощения регистрировались с помощью спектрофотометра Shimadzu UV-3101PC в кварцевых кюветах (1 × 1 см). Кинетика гибели триплетных состояний и триплет-триплетные спектры поглощения соединения P были получены на установке импульсного фотолиза с использованием кварцевой кюветы с длиной оптического пути 20 см и Xe лампы с энергией вспышки 80 Дж (15 мкс) [10]. Эксперименты проводили с использованием этанола и толуола как растворителей. Перед фотовозбуждением все растворы дегазировали вакуумированием. Фотовозбуждение проводилось через стеклянные оптические фильтры ЖС18 (пропускание > 500 нм). Регистрация поглощения проводилась с помощью фотоумножителя ФЭУ-38 (МЭЛЗ, СССР).
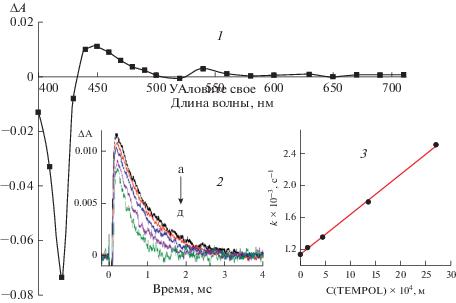
При прямом фотовозбуждении раствора соединения P (1 × 10–7 М) в этаноле наблюдается выцветание в области 420 нм, соответствующее выцветанию синглетного состояния в полосе Соре. Поглощение триплетного состояния 3P наблюдается в области 440–500 нм и 540 нм (рис. 1, 1). Гибель триплетного состояния происходит по реакции первого порядка kT = (1.15 ± 0.1) × 103 с–1. (рис. 1, 2а). Добавление 2R в концентрациях (1.5–27.0 × 10–4 М) приводит к тушению триплетного состояния 3P (рис. 1, 2б–д). Константа тушения kq = (5.0 ± 0.5) × 105 М–1 с–1 была рассчитана из графика зависимости константы псевдо-первого порядка скорости гибели триплетного состояния k = kT + kq [2R] от концентрации 2R (рис. 1, 3)
Рис. 1.
(1) Дифференциальный спектр триплетного состояния 3P в этаноле ([P] = 1 × 10–7 М), 300 мкс после вспышки. (2) Кинетика гибели триплетного состояния 3P (на 440 нм) при различных концентрациях 2R × 104 М: а – 0, б – 1.5, в – 4.5, г – 13.5, д – 27.0. (3) Зависимость константы скорости гибели триплетного состояния 3P от концентрации 2R.
Одним из способов деактивации триплетного состояния соединения P является перенос энергии на молекулу нитроксильного радикала. Ранее было показано, что для эффективного переноса энергии на радикал, необходимо чтобы энергия триплетного T1 уровня донора была больше 18 000 см–1 [12]. Для тетраарилпорфиринов энергия триплетного Т1 уровня как правило ниже Т1 уровня антрацена (ET < 14700 см–1) [13]. Ввиду большой разницы между энергетическими уровнями возбужденных состояний 3P и 2R, перенос энергии между ними представляется маловероятным. Вторым путем деактивации триплетного состояния является реакция переноса электрона с участием молекулы нитроксильного радикала как донора электрона. На примере взаимодействия нитроксильного радикала и триплетного состояния бискарбоцианинового красителя был доказан перенос электрона, который приводит к разрушению хромофорной системы последнего [11]. В процессах переноса электрона, константа тушения триплетного состояния определяется сродством к электрону молекулы красителя, энергией триплетного состояния и зависит от диэлектрической постоянной растворителя [14]. Для оценки роли данного механизма тушения триплетного состояния порфирина, была получена константа его тушения в низкополярном растворителе – толуоле kq = (2.8 ± 0.3) × 105 М–1 с–1. Значение экспериментально полученных констант тушения kq триплетных состояний молекул Р нитроксильным радикалом примерно на 4 порядка меньше диффузионной константы скорости в этаноле при комнатной температуре (kdiff = = 5.5 × 109 M–1 с–1). Сопоставимые значения констант тушения в этаноле (ε = 24.5) и толуоле (ε = 2.38) показывают, что процесс переноса электрона, как путь деактивации триплетного состояния молекулы порфирина, не играет заметной роли. Полученные результаты согласуются с работой [14], где было показано слабое влияние эффекта растворителя для молекул с низким положением Т1 уровня. Для ароматических углеводородов было показано [12], что до-минантным путем деактивации триплетных состояний при взаимодействии с нитроксильным радикалом в случае низких значений (ET < 14700 см–1) энергии триплетных уровней молекул донора является ускорение интеркомбинационного перехода в результате обменного взаимодействия.
Таким образом, в отличие от взаимодействия триплетного состояния бискарбоцианинового красителя с радикалом, механизм тушения триплетного состояния порфирина нитроксильным радикалом заключается в ускорении интеркомбинационной конверсии при взаимодействии электронных оболочек триплетного состояния 3P и радикала, которое приводит к образованию основного синглетного состояния молекулы порфирина.
Список литературы
Zhang W., Xing L., Wang H., Liu X., Feng Y., Gao C. // Langmuir. 2015. V. 31. P. 4330.
Mahmood A., Hu J.-Y., Xiao B., Tang A., Wang X., Zhou E. // J. Mater. Chem. A. 2018. V. 6. P. 16769.
Annunzio S., Costa N., Mezzina R., Graminha M., Fontana C. // Int. J. Mol. Sci. 2019. V. 20. P. 3861.
Agostinis P., et al. // CA Cancer J. Clin. 2011. V. 61. № 4. P. 250.
Allison R., Sibata C. // Photodiagnosis Photodyn Ther. 2010. V. 7. № 2. P. 61.
Abrahamse H., Hamblin M. // Biochemical Journal. 2016. V. 473. P. 347.
Moisenovich M., Ol’shevskaya V., Rokitskaya T. et al. // PLoS ONE. 2010. V. 5. № 9. P. 12717.
Wang Z., Gao Y., Hussain M. et al. // Chemistry − A Eu-ropean Journal. 2018. V. 24. № 70. P. 18663.
Ol'shevskaya V., Alpatova V., Radchenko A. et al. // Dyes and Pigments. 2019. V. 171. P. 107760.
Egorov A., Kostyukov A., Nekipelova T. et al. // High Energy Chem. 2020. V. 54. P. 142.
Kostyukov, A., Nekipelova, T., Borissevitch, I. et al. // High Energy Chem. 2019. V. 53. P. 87.
Kuzmin V., Tatikolov A. // Chemical Physics Letters. 1978. V. 53. № 3. P. 606.
Harriman A. // J. Chem. Soc. Faraday Trans. 1981. V. 77. P. 1281.
Gijzeman O., Kaufman F., Porter G. // J. Chem. Soc. Faraday Trans. 1973. V. 69. P. 727.
Дополнительные материалы отсутствуют.
Инструменты
Химия высоких энергий